Introducción
Los hongos micorrízicos arbusculares (HMA) son simbiontes obligados que se asocian con el 90 % de las plantas (Smith y Read, 2010), en las cuales incrementan el suministro de nutrientes al extender el volumen del suelo, además de provocar cambios favorables en las relaciones hídricas, en la asimilación de carbono y en la arquitectura de la raíz, contribuyendo a la estabilidad y diversidad de los ecosistemas (Abbott y Johnson, 2017). Las bacterias del género Rhizobium viven en el suelo y colonizan el sistema radical de leguminosas compatibles (Calazans et al., 2014), entre las que figuran las plantas coberteras (Solís et al., 2019). En esta asociación se forman nódulos, en donde se realiza la fijación de nitrógeno atmosférico (Calero Hurtado et al., 2019). De este modo, los HMA y Rhizobium proporcionan fósforo y nitrógeno a la planta, respectivamente, siendo la sinergia de estos simbiontes una combinación importante para la agricultura (Spagnoletti et al., 2013).
Los suelos con historial de uso agrícola intensivo tienden a beneficiarse de la adición de hongos micorrízicos nativos y abonos verdes (Lehman et al., 2012) que, junto con las bacterias simbióticas fijadoras de nitrógeno, mejoran la fertilidad del suelo (Souza et al., 2019). La efectividad de la interacción leguminosa-micorriza-Rhizobium depende de las especies hospederas, de las bacterias de Rhizobium, de los hongos micorrízicos y de las condiciones del suelo (Cué y Torres-García, 2019). Asimismo, la fijación simbiótica de nitrógeno está limitada por la disponibilidad de fósforo (Liu et al., 2016), por lo que la captación de nitrógeno se expresará en su máxima capacidad si las plantas tienen un suministro adecuado de fósforo (Bulgarelli et al., 2017). Las coberteras son abonos verdes que concentran nitrógeno, por lo que, al ser integradas al suelo mejoran sus propiedades físicas, químicas y biológicas (Martín Alonso et al., 2017; Benites, 2016). Además, controlan plantas arvenses (Ospitan et al., 2018) y son utilizadas como alimento para el ganado (Ojeda-Quintana et al., 2019). Estas leguminosas son una alternativa para la introducción de HMA en suelos de baja fertilidad o de alta densidad, durante los periodos de descanso.
De manera natural, las plantas establecen simbiosis micorrízica con todas las especies de HMA, no obstante, algunos hongos pueden ser más efectivos que otros, considerando distintos factores. Niwa et al. (2018) mencionan que algunas especies de HMA introducidas suelen ser más eficientes que las nativas, ya sea en suelos estériles o en suelos nativos sin esterilizar. Sin embargo, esta condición en plantas coberteras ha sido escasamente estudiada. Por lo anterior, en el presente estudio se plantea evaluar la respuesta de los hongos micorrízicos arbusculares introducidos y nativos en seis especies de leguminosas coberteras, así como su interacción con Rhizobium por inoculación natural y el efecto de la fracción biológica del suelo. Con nuestros hallazgos podemos contribuir a proponer alternativas para la incorporación de microorganismos en suelos que requieren una recuperación de nutrientes.
Materiales y métodos
Descripción del sitio donde se colectó el suelo
El suelo se colectó en la localidad de La Tinaja, municipio de Emiliano Zapata, Veracruz, ubicada en 19º 30´ 41.76´´ L N y 96º 46´ 46.94 L O, a 895 msnm; esta localidad presenta clima templado-húmedo con lluvias en verano y temperatura media anual de 25.2 ºC. Los antecedentes del uso del suelo, previo al establecimiento del experimento, indican que por seis años se utilizó para el cultivo de caña de azúcar, posteriormente, la parcela permaneció cinco años en descanso agrícola, y cuatro con pasto introducido (Brachiaria brizantha), sin aplicación de agroquímicos, pastoreo o labranza. La zona se caracteriza por su baja fertilidad y poca profundidad del suelo.
El muestreo se realizó en un área de 1 000 m2, dividida en 10 cuadrantes de 100 m2, dentro de estos se tomaron 10 muestras al azar, a 20 cm de profundidad. Para el experimento en invernadero, se colectaron 80 kg de suelo; para el análisis físico y químico, se elaboró una muestra compuesta a partir de las muestras simples, las cuales se colocaron en bolsas de plástico para su traslado. Antes de su análisis, el suelo se secó a la sombra por tres días y se envió al Laboratorio de Fertilidad y Nutrición Vegetal en el Campo Experimental Cotaxtla del Instituto Nacional de Investigaciones Forestales Agrícolas y Pecuarias.
El suelo presenta una textura franco-arenoso (63 % de arena, 12 % de arcilla y 23 % de limo), muy bajo contenido de materia orgánica (2.4 %), pH ácido (4.6), bajo contenido de N inorgánico (19 mg kg-1), alto contenido de P Bray (38 mg kg-1), de K (48 mg kg-1), de Ca (48 mg kg-1) y de Mg (19 mg kg-1); adecuado contenido de Fe (49 mg kg-1), de Zn (3.2 mg kg-1) y Mn (3.2 mg kg-1), Al intercambiable (0.54 M.e./100 g) y 1.88 M.e./100 g de % saturación de Al (Diario Oficial de la Federación, 2002).
Preparación del suelo, siembra, inoculación y transplante
El suelo trasportado del campo al laboratorio fue dividido en dos porciones de 35 kg, una parte fue esterilizada (a 121 °C, 15 lbs, 60 min) durante tres días continuos y se ventiló por 10 días, con el propósito de eliminar la fracción biológica de este y la otra parte del suelo colectado se reservó para el tratamiento con HMA nativos. El sustrato que fue colocado en macetas de 1 kg consistió en suelo estéril (SE) y suelo sin esterilizar (SSE), según correspondiera. Esta técnica se utiliza en estudios (Oruru et al., 2018; Xiao et al., 2020) cuyo objetivo es explorar la influencia de los HMA y las características químicas y biológicas de suelos esterilizados y sin esterilizar; objetivos similares a los que se plantearon en esta investigación.
Se seleccionaron seis especies de leguminosas coberteras, cuatro de hoja angosta: Clitoria ternatea L., Calopogonium mucunoides Desv., Crotalaria juncea L., Stylosanthes guianensis Abul.; y dos de hoja ancha: Canavalia ensiformis L. y Mucuna pruriens L. Los hongos micorrízicos introducidos corresponden al inóculo comercial Rizofermic®, compuesto por un consorcio de 12 especies: Acaulospora morrowiae Spain & N.C. Schenck, Acaulospora spinosa C. Walker & Trappe, Acaulospora scrobiculata Trappe, Funneliformis mosseae (T.H. Nicolson & Gerd.) C. Walker & A. Schüßler, Funneliformis geosporus (T.H. Nicolson & Gerd.) C. Walker & A. Schüßler, Gigaspora rosea T.H. Nicolson & N.C. Schenck, Gigaspora decipiens I.R. Hall & L.K. Abbott, Glomus macrocarpum Tul. & C. Tul., Glomus aggregatum N.C. Schenck & G.S. Sm., Rhizophagus intraradices (N.C. Schenck & G.S. Sm.) C. Walker & A. Schüßler, Scutellospora pellucida (T.H. Nicolson & N.C. Schenck) C. Walker & F.E. Sanders y Claroideoglomus etunicatum (W.N. Becker & Gerd.) C. Walker & A. Schüßler; propagados de acuerdo con la técnica de Sierverding modificada (Trejo-Aguilar y Bañuelos, 2020), con un promedio de 1200 esporas/100 g de suelo. Los hongos nativos corresponden a los que se encontraban de manera natural en el suelo sin esterilizar, con un promedio de 1650 esporas/100 g de suelo. Las semillas se inocularon al momento de su siembra con hongos introducidos y, de igual manera se colocaron semillas en suelo sin esterilizar para propiciar la inoculación micorrízica nativa. De acuerdo con el tamaño de la semilla, se colocaron 10 semillas por maceta de aquellas coberteras de hoja angosta y una semilla por maceta para las de hoja ancha.
El experimento se realizó bajo condiciones de invernadero en la Facultad de Ciencias Agrícolas de la Universidad Veracruzana, en la ciudad de Xalapa, Veracruz. Este experimento se mantuvo 60 días, durante los cuales las plantas se regaron cada tercer día con agua corriente a capacidad de campo.
Variables evaluadas
Sesenta días después de la siembra e inoculación, se evaluó el peso fresco y seco de raíces, tallos, hojas y nódulos de Rhizobium, tras el secado en estufa a 65 ºC, hasta alcanzar un peso constante. Para la determinación del porcentaje de colonización micorrízica, se utilizó la técnica de clareo y tinción de Phillips y Hayman (1970) y el método del gradiente de intersección de Giovannetti y Mosse (1980).
Una de las variables importantes en esta relación simbiótica es la de “capacidad de respuesta”, definida como un cambio en la biomasa de la planta, que resulta de la simbiosis; de ahí que hablemos de “respuesta de crecimiento micorrízíco” (MGR) propuesta por Smith y Smith (2011) o “Respuesta a la inoculación micorrízica” (RM).
En este estudio se calculó el índice de respuesta a la inoculación micorrízica (IRM) en función del peso fresco (IRMPF) y seco (IRMPS), de acuerdo con la fórmula de Plenchette et al. (1983).
Aunque no se inoculó con Rhizobium, se detectó la presencia de nódulos en las raíces. La semilla no fue desinfectada debido a que después de varios intentos se observó que el proceso de desinfección afectaba la germinación. Por lo que, se decidió sembrar la semilla de manera directa, explicando la razón de la presencia de nódulos con base en reportes que mencionan que las bacterias simbióticas permanecen en la testa de la semilla y la simbiosis se establece en el momento en que ésta germina (Pérez-Ramírez et al., 1998).
Diseño experimental
Se estableció un diseño factorial 2 x 2, donde cada factor incluyó dos niveles de micorriza [introducida (i) y nativa (n)] y dos niveles de suelo [estéril (SE) y sin esterilizar (SSE)]. Con base en esto, se establecieron cuatro tratamientos por especie de planta: 1) suelo estéril con hongos micorrízicos introducidos (SEi), 2) suelo sin esterilizar con hongos introducidos (SSEi), 3) suelo estéril sin hongos micorrízicos (SE), y 4) suelo sin esterilizar, es decir, el tratamiento que contenía los hongos nativos (SSEn). Cada tratamiento constó de tres replicas y se realizó un análisis para cada una de las seis especies de cobertera.
Análisis estadístico
Se realizó un análisis de varianza (ANOVA) de dos vías, en un diseño completamente al azar, para cada una de las variables de respuesta: peso fresco y seco de raíz, de tallo/hoja, de nódulos y para el porcentaje de colonización micorrízica. Se aplicaron las pruebas de diferencia mínima significativa de Tukey para las comparaciones múltiples post-hoc (con diferencia al nivel de P≤0.05). En todos los análisis se utilizó el software Minitab 2018 para Windows.
Resultados
El desarrollo de las plantas tuvo un visible efecto en los tratamientos, donde se muestra el beneficio de la introducción de HMA en SEi, en contraste con el SSEi. También es notorio que la micorriza nativa (SSEn) no promovió el incremento de la biomasa. Al comparar SSEn con SSEi se observó que los HMA introducidos incrementaron la biomasa en contraste con los HMA nativos (Figura 1).

Figura 1 Efecto de la inoculación micorrízica nativa (n) e introducida (i) y del suelo esterilizado (SE) y sin esterilizar (SSE) en Stylosanthes guianensis. Nótese que la inoculación de hongos micorrízicos arbusculares introducidos promueve mayor desarrollo de la biomasa que la micorriza nativa.
Efecto de la inoculación de HMA, y de la esterilización del suelo sobre la colonización de las raíces y los parámetros de crecimiento
Los datos del ANOVA de dos vías mostraron que los parámetros de crecimiento y colonización de la raíz fueron significativamente afectadas por la esterilización del suelo y la procedencia de los HMA. De este modo, se observaron variaciones en la promoción del crecimiento y eficiencia en la micorrización por influencia del hospedero, así como una tendencia por efecto del suelo. En los tratamientos SSE, la colonización de los HMA introducidos disminuyó, y como consecuencia, el efecto de la simbiosis micorrízica también fue reducido (Tabla 1).
Tabla 1 Efecto de la inoculación de HMA y de la esterilización del suelo sobre la colonización de las raíces y los parámetros de crecimiento
| Planta | Tratamiento | PSR | PSTH | PSN | % Col |
| Canavalia ensiformis | SEi | 3.06b | 10.63 | 0.98 | 63.33a |
| SSEi | 2.43b | 9.03 | 0.64 | 13.89bc | |
| SE | 5.96a | 9.3 | 0.01 | 0.00c | |
| SSEn | 3.30b | 9 | 0.97 | 32.31b | |
| ANOVA Mico*Sue | * | ns | * | *** | |
| Mucuna pruriens | SEi | 2.16 | 6.06a | 0.45 | 58.2a |
| SSEi | 2.23 | 3.70c | 0.24 | 51.67a | |
| SE | 2.36 | 5.00ab | 0.14 | 5.33b | |
| SSEn | 2.46 | 4.23bc | 0.18 | 24.82ab | |
| ANOVA Mico*Sue | ns | * | ns | ns | |
| Clitoria ternatea | SEi | 0.36 | 0.63a | 0.059a | 73.43a |
| SSEi | 0.37 | 0.56a | 0.0001b | 62.47a | |
| SE | 0.36 | 0.40a | 0.019b | 2.67b | |
| SSEn | 0.12 | 0.14b | 0.0003b | 58.99a | |
| ANOVA Mico*Suel | ns | ns | * | *** | |
| Calopogonium mucunoides | SEi | 4.26a | 2.16a | 0.066a | 44.39a |
| SSEi | 0.59b | 1.56a | 0.011ab | 15.76b | |
| SE | 0.43b | 0.80b | 0.003b | 1.30b | |
| SSEn | 0.50b | 0.09b | 0.002b | 17.50b | |
| ANOVA Mico*Suel | *** | ns | ns | ** | |
| Stylosanthes guianensis | SEi | 0.83a | 1.46a | 0.006a | 24.9 |
| SSEi | 0.36b | 0.60b | 0.001ab | 8.97 | |
| SE | 0.15b | 0.16b | 0.0004b | 3.67 | |
| SSEn | 0.12b | 0.14b | 0.001ab | 37.00 | |
| ANOVA Mico*Suel | ns | ** | ns | * | |
| Crotalaria juncea | SEi | 0.62 | 1.67a | 0.035 | 71.0a |
| SSEi | 0.54 | 0.95b | 0.016 | 35.54ab | |
| SE | 0.39 | 0.50b | 0.026 | 1.33b | |
| SSEn | 0.38 | 0.52b | 0.019 | 37.5ab | |
| ANOVA Mico*Suel | ns | * | ns | ** |
PSR: peso seco de raíz. PSTH: peso seco de tallo y hojas. PSN: peso seco de nódulos. % Col: porcentaje de raíz colonizada. *: <0.05. **: <0.01. ***: <0.001.
SE: suelo estéril. SSE: suelo sin esterilizar. i: micorriza introducida. n: micorriza nativa. Letras distintas indican diferencias significativas entre los tratamientos.
Interacción micorriza- suelos (Mico*Sue). Las columnas donde no hay letras de la prueba de comparación de medias, no presentan diferencias significativas.
En las variables de crecimiento se observaron diferencias significativas por efecto del suelo y la micorriza en las seis especies coberteras evaluadas. En esta variable se muestran los pesos frescos, considerando que las coberteras se incorporan en fresco (Figura 2). Las especies de hoja ancha no presentaron la misma tendencia en incremento de biomasa aérea y radicular. Canavalia ensiformis no tuvo diferencias en el incremento de biomasa aérea, pero sí en raíz, en contraste con Mucuna pruriens que sí mostró diferencias en biomasa aérea pero no tuvo cambios en el desarrollo de la raíz.
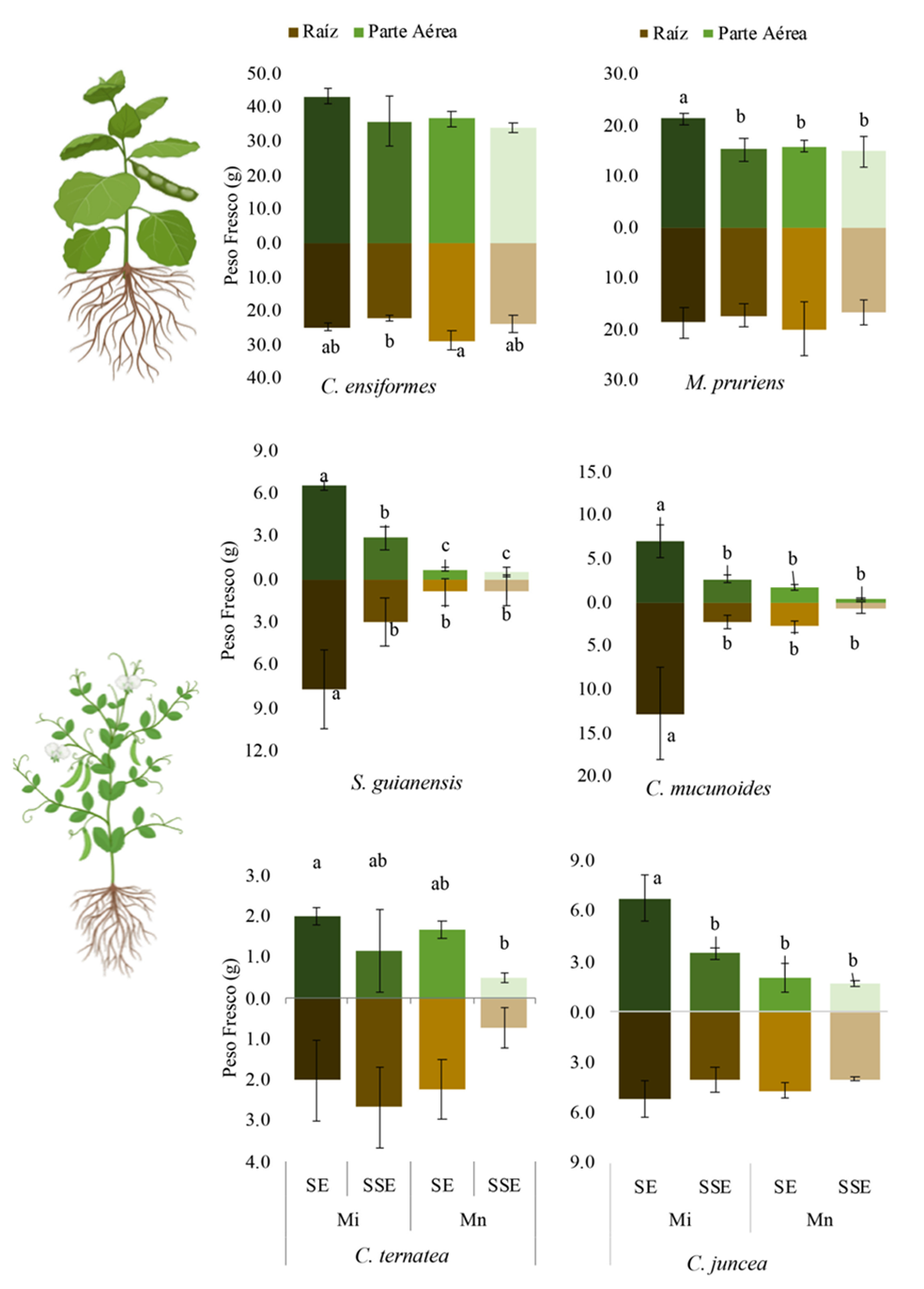
Figura 2 Efecto de los HMA introducido (i), nativo (n) y sin inocular (c) sobre la biomasa en los tratamientos de suelo esterilizado (SE) y sin esterilizar (SSE). Los datos están expresados en medias ± D.S. (n = 3). Letras distintas indican diferencias significativas entre estos tratamientos (Tukey P ≤ 0.05), la ausencia de estas no muestra diferencias.
El efecto por la esterilización del suelo e inoculación con hongos introducidos en coberteras de hoja angosta incrementó significativamente el peso de la parte aérea y de la raíz (P ≤0.05). En las mismas plantas con hongos nativos, también el suelo estéril tuvo un mayor peso, aunque no fue significativo (Figura 2).
Las especies C. ternatea y C. juncea mostraron diferencias significativas (P ≤0.05) en el peso fresco de la parte aérea pero no en raíz, en los cultivos en suelo estéril. Calopogonium mucunoides y S. guianensis mostraron el mayor incremento en el peso fresco en el tratamiento con micorriza introducida en suelo estéril, comparado con los otros tratamientos de cada cobertera (P ≤0.05). En ambas coberteras, el peso fresco de la parte aérea mostró diferencias significativas (P ≤0.05) pero no en la raíz (Figura 2).
Índice de Respuesta a la Inoculación Micorrízica
El tratamiento que presentó el valor más alto del IRM se notó en Stylosanthes guianensis, con un 88.9 % para el peso fresco y un 86.15 % para el seco, siendo el más alto por efecto de hongos introducidos en suelo estéril. En los suelos no esterilizados, donde se inoculó con hongos introducidos, se obtuvieron porcentajes menores, pero aún importantes del IRM en Calopogonium mucunoide (72.73 %) y Clitoria ternatea (71.24 %) (Tabla 2).
Tabla 2 Índice de respuesta a la inoculación con hongos micorrízicos nativos e introducidos en seis especies de leguminosas de cobertera en suelo estéril y sin esterilizar
| IRMPF (%) | |||
| Especie de Leguminosa | Tratamiento en suelo | ||
| SE i | SSE i | SSE n | |
| Clitoria ternatea | 66.90 | 67.30 | 18.80 |
| Calopogonium mucunoides | 75.58 | 76.40 | 74.77 |
| Stylosanthes guianensis | 89.54 | 75.70 | -60.48 |
| Crotalaria juncea | 42.31 | 23.11 | 13.10 |
| Canavalia ensiformis | 3.87 | -1.30 | 10.85 |
| Mucuna pruriens | 9.52 | 2.90 | 10.50 |
| IRMPS (%) | |||
| Clitoria ternatea | 63.00 | 71.90 | 23.10 |
| Calopogonium mucunoides | 80.72 | 73.67 | 52.26 |
| Stylosanthes guianensis | 86.11 | 67.17 | -34.02 |
| Crotalaria juncea | 59.79 | 38.73 | -4.99 |
| Canavalia ensiformis | -12.14 | -8.00 | 19.25 |
| Mucuna pruriens | 9.97 | -13.75 | 8.87 |
IRMPF: Índice de respuesta a la inoculación micorrízica en peso fresco; IRMPS: Índice de respuesta a la inoculación micorrízica en peso seco.
En las coberteras de hoja ancha, la especie con menor IRMPF fue C. ensiformis, tanto con hongos introducidos como con nativos (Tabla 2). Si bien no hubo incremento en peso fresco, se observó un IRMPS de 3.16 %. Los tratamientos con hongos nativos presentaron los valores más bajos en el peso fresco y seco de la parte aérea en todas las especies estudiadas. Los IRMPF e IRMPS en suelos no esterilizados fueron negativos. En el peso de la raíz no se observó diferencia en los tratamientos y se percibió un IRMPS con valores negativos en ambas especies (Tabla 2).
Peso fresco de nódulos
El peso de los nódulos fue estadísticamente diferente entre plantas inoculadas con hongos introducidos y nativos para todas las coberteras, excepto para Crotalaria juncea (Figura 3). Se observó un mayor peso fresco de los nódulos en interacción con hongos micorrízicos introducidos. En este caso fue notorio que, a mayor colonización mayor peso de los nódulos. Sin embargo, en la interacción con hongos nativos tuvo un efecto inverso, donde un menor peso de los nódulos se observó en suelos con hongos nativos, en todas las especies de plantas con excepción de C. juncea (Figura 3).

Figura 3 Peso fresco de nódulos y colonización micorrízica por especie de planta y por tipo de suelo (SE, suelo estéril; SSE, suelo sin esterili zar). Las barras del lado izquierdo indican inoculación con hongos micorrízicos introducidos (i), las barras del lado derecho indican inoculación con hongos micorrízicos nativos (n) y sin inocular (c). Las líneas rojas indican el porcentaje de colonización micorrízica. Letras distintas indican diferencias significativas (Tukey P ≤ 0.05) entre tratamientos sobre el peso de nódulos de cada especie cobertera. Las comparaciones son entre la misma especie indicado por letras mayúsculas o minúsculas. La ausencia de letras no muestra diferencias. Los datos están expresados en medias ±, D.S. (n = 3).
Colonización micorrízica
Se observó una nula o baja colonización micorrízica en las raíces de las plantas crecidas en suelo estéril sin inoculación externa (Figura 3). El porcentaje de colonización en las raíces de las plantas crecidas en suelo estéril con micorriza introducida fue mayor, en comparación con los valores reportados en raíces colonizadas con micorriza nativa (Figura 3). Esta tendencia se observó en todas las especies de coberteras estudiadas, excepto en Stylosanthes guianensis, donde los porcentajes de colonización fueron de 24 % en SEi y 32 % en SSEn (Figura 3).
Discusión
La eliminación de la fracción biológica del suelo mediante la esterilización permitió observar que los hongos nativos promovieron una baja o nula producción de biomasa fresca de las leguminosas estudiadas (Figura 2). Los datos obtenidos muestran que en un sustrato estéril los hongos introducidos fueron más eficientes al incrementar las variables de crecimiento, en comparación con el sustrato sin esterilizar. La baja efectividad de los hongos introducidos en suelos sin esterilizar puede indicar que la microbiota nativa tiene un efecto “supresivo” en la planta o en los HMA. Svenningsen et al. (2018) mencionan que el micelio extraradical (ME) de los HMA coexiste con comunidades microbianas, y estas pueden estimular o suprimir la actividad del ME. Dichos autores realizaron un experimento con suelo estéril y sin esterilizar, en donde el crecimiento del ME varió considerablemente y se suprimió en 4 de 21 suelos nativos estudiados. La pasteurización de estos suelos eliminó la supresión del ME, pues en el suelo existían acidobacterias y otros taxones bacterianos, que son supuestos antagonistas fúngicos identificados.
Aunque se encontró colonización micorrízica nativa en las raíces de todas las especies de las plantas estudiadas, no hubo un incremento en la biomasa de las plantas (Figuras 2a y 2b); en este punto es importante considerar que una alta colonización micorrízica no siempre se traduce en un mejor desarrollo del huésped (Faye et al., 2013).
El inoculante introducido ha sido consistente en su efecto promotor del crecimiento en trabajos anteriores (Bañuelos et al., 2017), y el inoculante nativo podría tener especies de HMA con efectividad limitada, sin descartar la posibilidad del efecto supresivo por la microbiota nativa. La pérdida de efectividad pudiera deberse a que el suelo estudiado fue cultivado previamente con caña de azúcar, lo que implica una alta aplicación de fertilizantes sintéticos (254-85-108 de N, P y K, Moreno-Seceña et al., 2016). Asimismo, el uso de herbicidas y la quema antes de cada ciclo son factores que afectan a la microbiota del suelo. Sin embargo, cabe destacar que el suelo tuvo un periodo de descanso de cinco años, lo que posiblemente propició la recuperación de la biomasa fúngica por lo que en este estudio se pudo detectar colonización en las raíces. No obstante, se ha reportado que muchas especies eficientes de HMA se pierden cuando el suelo pasa por un periodo de disturbio por prácticas agrícolas (Oehl et al., 2003). Considerando, al inicio del experimento, el muestreo de exploración sobre la cantidad de esporas nativas (1650 esporas/100 g de suelo), se podría suponer que los HMA nativos no fueron eficientes o que en el suelo hay una comunidad microbiana que podría considerarse antagónica.
Es un hecho que las semillas utilizadas transportaban rizobacterias simbiontes en su testa (Pérez-Ramírez et al., 1998), pues todas las especies de leguminosas sembradas para el presente estudio desarrollaron nódulos en las raíces, aún en condiciones estériles. El peso de los nódulos presentó un incremento en suelo esterilizado en combinación con HMA introducidos en todas las especies de leguminosas, excepto en C. juncea, mientras que el peso de los nódulos disminuyó en suelos estériles sin la fracción biológica. Las leguminosas son plantas muy susceptibles a la pérdida de biota del suelo (Prudent et al., 2019), lo que puede afectar su capacidad de establecerse y extenderse a nuevas regiones, debido a la dependencia de un mutualismo especializado con rizobios fijadores de nitrógeno (Rodríguez-Echeverría et al., 2012). Asai (1944) fue el primero en demostrar que algunas leguminosas tenían dificultad para crecer y no formar nódulos en suelos estériles, a menos que establecieran una simbiosis micorrízica. Se sabe que el número de nódulos, peso o actividad nitrogenasa, se incrementan por la adición de los HMA (Wang et al., 2011; Hashem et al., 2019). En este experimento se observó un incremento en el peso de los nódulos en presencia de HMA. Este efecto también se observa en la coinoculación de consorcios de HMA con Bradyrhizobium en Vigna radiata (Musyoka et al., 2020). Dicho incremento puede atribuirse a un mejor estado nutricional de la planta, principalmente por la suplementación de P (Püschel et al., 2017) y al hecho de que ambos simbiontes comparten rutas de infección similares en la planta (Ivanov et al., 2012; Lévy et al., 2004). Esto significa que la presencia de un simbionte facilita el establecimiento del otro simbionte (Hao et al., 2019).
La interacción entre organismos asociativos y simbiontes suele tener un efecto aditivo en el incremento del crecimiento vegetal. Biró et al. (2000) probaron que, en alfalfa, la inoculación tripartita con Sinorhizobium meliloti, Azospirillum brasilense y Glomus fasciculatum en suelo esterilizado, incrementó el crecimiento vegetal. Además, la adición de HMA a un suelo esterilizado aumentó el número de nódulos en raíces y la abundancia de A. brasilense. Este experimento concuerda con los resultados encontrados en el presente estudio realizado con seis leguminosas. Además, Biró et al. (2000) encontraron que en sustratos no estériles no había un incremento significativo en el número de nódulos, lo que también coincide con lo demostrado en este estudio. Tal efecto, puede atribuirse a que existe una competencia de los microorganismos nativos por los recursos en un suelo no estéril, de hecho, es una de las principales causas de inoculación fallida (Graham, 1992).
Se ha reportado que dependiendo de las comunidades microbianas, podrían presentarse cambios en las jerarquías competitivas de estos organismos (Hendriks et al., 2015). Sin embargo, nuestro entendimiento acerca de la interacción en las relaciones simbióticas de organismos benéficos y plantas es aún limitado, pero sabemos que en suelos naturales, los HMA se enfrentan a una competencia que puede disminuir su efecto en la planta como lo demostrado en este experimento.
La presencia de la comunidad microbiana puede ejercer un efecto de competencia o de supresión en los HMA introducidos. Cabe señalar que el término “supresivo” ha sido frecuentemente asociado a patógenos, y se define como “aquel en el cual el desarrollo de la enfermedad es suprimido aún cuando el patógeno sea introducido en presencia de un hospedero susceptible” (Baker y Cook, 1974). Estudios recientes han descrito este efecto para los HMA (Svenningsen et al., 2018; Cruz-Paredes et al., 2019).
Aunque generalmente se habla del efecto benéfico de la micorriza y se recomienda ampliamente en la agricultura, es importante enfatizar que las interacciones entre comunidad microbiana, en especial entre bacterias y los huéspedes, presentan diferentes efectos en la planta. Así que, dependiendo de la interacción, se ha especulado que existen suelos que pueden suprimir o favorecer la actividad del micelio extraradical de los HMA (Svenningsen et al., 2018).
En el presente estudio se observó que en Stylosanthes guianensis los hongos introducidos tuvieron un alto IRM positivo, en comparación con los hongos nativos, cuyo IRM fue negativo. En plantas de Etlingera elatior, da Silva et al. (2017) encontraron una respuesta positiva de crecimiento ante la inoculación micorrízíca con Gigaspora albida (9 %), expresada en IRM; mientras que la inoculación con Claroideoglomus etunicatum tuvo un IRM negativo (-47.97 %) y la combinación de ambos HMA también dieron una RM negativa (IRM de -25.2 %). Por otra parte, Smith y Smith (2011) señalan que los valores de RM dependen de diversos factores como los rasgos genómicos de la planta, la arquitectura de la raíz, la especie de hongos utilizada, las características del suelo, entre otros. Los valores de RM de dos especies relacionadas, Mucuna puriens y Canavalia ensiformis, muestran una respuesta similar en el IRM, pues ambos tienen valores negativos. En este sentido, es importante recordar que nuestro experimento fue establecido en macetas, lo cual pudo limitar el desarrollo natural de la raíz y por lo tanto, el acceso a nutrientes.
En la Figura 4 se representa un esquema de la interacción observada en los resultados de este estudio, en la cual se puede apreciar que el suelo estudiado bajo condiciones naturales tiene un efecto supresivo tanto en la colonización del hongo como en la producción de biomasa del huésped; sin embargo, el suelo natural no inhibe la producción de Rhizobium. El efecto de la simbiosis se evaluó por la producción de biomasa y, aunque en todos los tratamientos se detectó presencia de nódulos, no se evaluó la cantidad de nitrógeno fijado vía simbiótica, tampoco se identificó y analizó la población de bacterias presentes en el suelo. El único argumento con el que se cuenta para suponer que es un suelo supresivo, es la eliminación de la fracción biológica, por lo que es necesario que en el futuro se realicen estudios sobre la identidad de las poblaciones, principalmente de bacterias, así como el efecto de Rhizobium en la fijación de nitrógeno.
Conclusiones
Los resultados muestran que las poblaciones de hongos micorrízicos nativos fueron infectivos, pero no efectivos en la promoción del crecimiento de las leguminosas. Futuras investigaciones son necesarias para conocer con claridad la pérdida de la eficiencia de especies de hongos que se refleja en una nula capacidad mutualista y sus relaciones con la biota del suelo, que al parecer tuvo un efecto supresivo en hongos nativos e introducidos. La respuesta de la planta a la inoculación micorrízica es independiente del porcentaje de colonización y del inóculo aplicado. Esto sugiere que la respuesta pudiera deberse al tipo de planta o suelo donde se aplique el inóculo. La presencia de hongos micorrízicos promueve el desarrollo de especies de bacterias simbióticas fijadoras de nitrógeno, por lo que, desde el punto de vista práctico, la inoculación de leguminosas coberteras con hongos micorrízicos en suelos dispuestos a las actividades agrícolas, es una alternativa para la incorporación de microorganismos en suelos con baja fertilidad que requieren de una recuperación de nutrientes.











 nova página do texto(beta)
nova página do texto(beta)




