Introducción
Se ha documentado la reducción de la susceptibilidad de patógenos, tanto de raíz como de parte aérea, en plantas que se asocian con hongos micorrízicos arbusculares (HMA), fenómeno que se ha denominado como inducción de resistencia por micorrización (MIR) (Pozo y Azcón-Aguilar, 2007). Este fenómeno de resistencia aumentada, o disminución de la susceptibilidad, que se manifiesta en la planta ante la presencia del patógeno, está precedido por un estado fisiológico denominado preacondicionamiento o “priming”, el cual se induce por el establecimiento de la simbiosis, y permite que las plantas colonizadas por hongos micorrízicos arbusculares (HMAs) respondan de una manera más rápida e intensa al ataque posterior del patógeno (Pozo y Azcón-Aguilar, 2007; Jung et al., 2012).
El “priming” sensibiliza, local y sistémicamente, los tejidos vegetales para aumentar la respuesta de defensa basal y puede ser activado, no solamente por la interacción con microorganismos benéficos (Pozo et al., 2009; Jung et al., 2012), sino también por inductores sintéticos (Beckers et al., 2009; Martínez-Aguilar et al., 2016), y es acompañado por discretos cambios transcripcionales en genes involucrados con rutas de defensa en planta (Cervantes-Gámez et al., 2016), que comúnmente se hacen más evidentes durante el ataque de patógeno (Beckers et al., 2009).
Las rutas de señalización derivadas del ácido jasmónico (JA) se han relacionado con el establecimiento de la simbiosis (Hause et al., 2007), con el estado de “priming” y con la MIR. La colonización con Glomus fasciculatum en plantas de tomate indujo la tolerancia al patógeno vascular Fusarium oxysporum (Nair et al., 2015a) y también a Alternaria alternata (Nair et al., 2015b) de manera paralela a un aumento en la expresión de genes de la ruta de síntesis de JA, y a una notable acumulación de su derivado metil jasmónico (MeJA); también mutantes de tomate deficientes en la ruta de biosíntesis de JA, inoculadas con Funneliformis mosseae fueron más susceptibles a la infección por Alternaria solani, lo que indica que la vía de señalización de esta hormona es esencial para la MIR (Song et al., 2015).
Uno de los derivados biológicamente activos del JA es la fitohormona MeJA, el cual es un éster metílico con actividad antimicrobiana ampliamente distribuido en el reino vegetal (Alvarez et al., 2015). La aplicación exógena de MeJA en semillas y plántulas de tomate reduce la germinación de esporas y el crecimiento micelial del hongo necrotrófico Alternaria porri f. sp. solani (Kępczyńska y Król, 2012), y aumenta la resistencia contra herbívoros (Lu et al., 2015). Los perfiles de transcripción génica de hojas de plantas de tomate, micorrizadas y no micorrizadas, y tratadas con MeJA, revelaron la inducción de genes regulados por JA, incluyendo genes ya descritos como relacionados con defensa y sensibles a esta fitohormona (Pozo et al., 2009). Por lo tanto, estas evidencias indican que el MeJA participa en la inducción de defensa en planta contra patógenos y herbívoros, y sugieren que puede afectar el “priming” y la MIR.
El JA y sus derivados, colectivamente llamados jasmonatos (JAs), pertenecen a una clase de lípidos conocidos como oxilipinas. En la ruta biosintética de las oxilipinas participan enzimas claves, la primera de ellas es la lipoxigenasa (LOX; linoleato óxido reductasa) que cataliza la adición de oxígeno molecular a un ácido graso poliinsaturado tal como los ácidos linoleico o linolénico (Wasternack, 2007). Se han descrito seis isoformas de LOX en frijol, PvLOX1 a la PvLOX6, todas en la ruta 13-LOX; PvLOX1 a PvLOX5 son de tipo 1, y solo PvLOX6 es del tipo 2 y su participación es exclusiva en la biosíntesis de JAs (Porta y Rocha-Sosa, 2002; Porta et al., 1999, 2008) (Figura 1). Aunque la existencia de la ruta 9-LOX en frijol no se descarta, ésta aún no ha sido descrita.
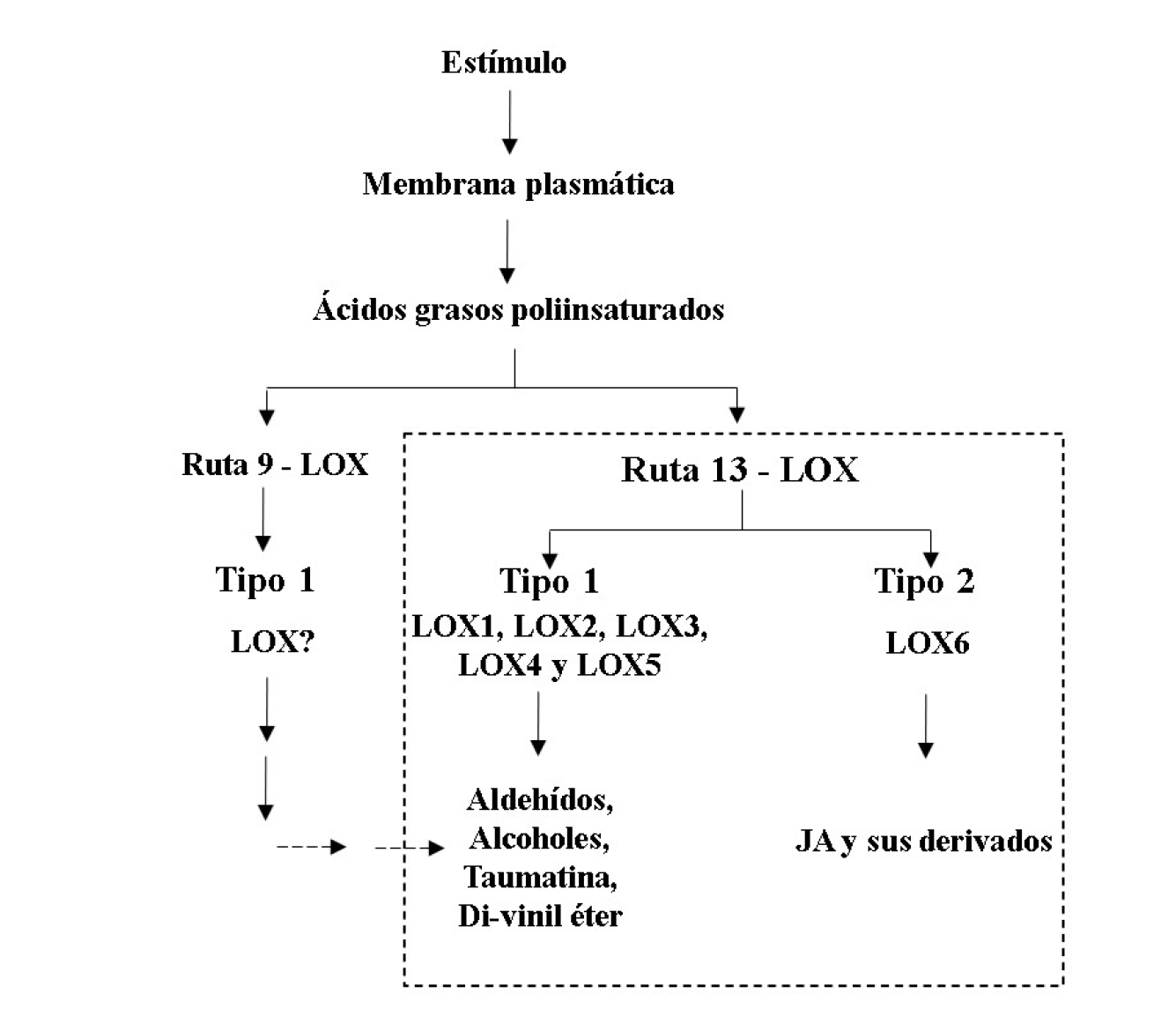
Figura 1 Representación esquemática de la ruta biosintética de oxilipinas en frijol. La oxidación de los ácidos grasos derivados de la membrana plasmática por oxigenación es mediada por lipoxigenasas (LOX; en posición 9 ó 13), de las cuales se han descrito seis en frijol.
Previamente, hemos reportado la reducción de susceptibilidad contra Sclerotinia sclerotiorum en diferentes variedades de frijol inoculadas con el HMA Rhizophagus irregularis (Mora-Romero et al., 2015a, b), así como la sobreexpresión de los genes PvLOX2 y PvLOX6, previo al ataque de patógenos (Mora-Romero et al., 2015b). La sobreexpresión de PvLOX2 es observable tanto en tejido de raíz como en hoja, mientras que PvLOX6 solo es detectable en tejido foliar, lo cual es consistente con el hecho de que el inicio de la síntesis de JAs se lleva a cabo en los cloroplastos (Bell et al., 1995). Esto llevó a concluir que dichos genes están involucrados en la MIR observable en frijol contra el patógeno S. sclerotiorum, y que probablemente el producto de la expresión de PvLOX2 esté involucrado en la ruta de síntesis de la molécula señal de defensa que se produce en la raíz, la cual es translocada al tejido foliar donde se efectúa la síntesis de JAs mediada por PvLOX6 para el acondicionamiento fisiológico de la planta y el subsecuente aumento de defensa contra patógenos (Mora-Romero et al., 2015b).
El presente trabajo reporta el efecto de la colonización del hongo micorrízico arbuscular R. irregularis y la aplicación exógena de MeJA en la reducción de la susceptibilidad de S. sclerotiorum en plantas de frijol de la variedad Azufrasin, así como la expresión de los genes PvLOX2 y PvLOX6 tras la invasión del patógeno.
Materiales y métodos
Inóculo de los HMA
El inóculo de HMA se obtuvo de cultivos axénicos de raíces transformadas de zanahoria colonizadas con Rhizophagus irregularis y mantenidas en medio de cultivo sintético en cajas Petri (Mora-Romero et al., 2015b). Por otra parte el hongo Sclerotinia sclerotiorum se obtuvo a partir de esclerocios colectados en campos de cultivo de frijol, los cuales se desinfectaron con hipoclorito de sodio al 0.5 % durante un minuto, se enjuagaron con agua destilada estéril por un minuto, se secaron perfectamente con papel absorbente y se inocularon en cajas Petri con medio de cultivo de papa-dextrosa-agar (PDA). Los esclerocios desinfectados se incubaron durante tres a cinco días a 19 °C para inducir su germinación en el medio de cultivo.
Condiciones de crecimiento de plantas
Semillas de frijol variedad Azufrasin, se desinfectaron sumergiéndolas en etanol (96 %) durante dos minutos, seguido por cinco minutos en hipoclorito de sodio 0.5 %, se enjuagaron cuatro veces con agua destilada estéril y se germinaron en sustrato vermiculita:arena (1:1 v/v) en macetas de 1 L. Cinco días posteriores a la germinación, cada planta se inoculó con 0.1 g de macerado de raíces de zanahoria colonizadas con R. irregularis. A las plantas del tratamiento control se les agregó 0.1 g de macerado de raíces de zanahoria sin colonizar con el hongo. Todas las plantas se mantuvieron bajo condiciones controladas de luz y temperatura (8 h luz a 25 ºC / 16 h oscuridad a 18 ºC) para permitir el crecimiento de plantas y el establecimiento de la simbiosis. Las plantas se regaron con agua corriente dos veces por semana y se fertilizaron semanalmente con 50 ml de solución nutritiva de Hoagland [Ca(NO3)2 •4H2O, 2.5 mM; KNO3, 2.5 mM; MgSO4 • 7H2O, 1 mM; NaFe EDTA, 0.05 mM; H3BO3, 10 μM; Na2MoO4 • 2H20, 0.2 μM; ZnSO4 • 7H2O, 1 μM; MnCl2 • 4H2O, 2.0 μM; CuSO4 • 5H2O,0.5 μM; CoCl2 • 6H2O, 0.2 μM; HCL, 25 μM; MES buffer 0.5 mM, 200 μM KH2PO4]. Cuatro semanas posteriores a la inoculación con el hongo micorrízico, cuatro plantas micorrizadas (M) y cuatro no micorrizadas (NM) se emplearon para los experimentos de infección. Cada una de estas plantas se consideró como una unidad experimental independiente.
Determinación del porcentaje de colonización
Las plantas se cosecharon a las cuatro semanas posteriores a la inoculación con R. irregularis. Las raíces se colectaron, se lavaron con agua corriente para remover restos de sustrato, y se fijaron en etanol al 50 % (v/v) durante un día, se enjuagaron en agua destilada e incubaron dos días con KOH al 20 % (p/v) a temperatura ambiente para clarificarlas. Posteriormente, las raíces se lavaron con agua destilada estéril e incubaron por 2 h en HCl al 1 % (v/v), nuevamente se lavaron con agua destilada estéril y tiñeron con solución de azul de tripano al 0.05 % durante 2 días (Phillips y Hayman, 1970). Las raíces se mantuvieron en lactoglicerol 1:1:1 (agua: ácido láctico: glicerol) a temperatura ambiente. El porcentaje de colonización se determinó por el método de intersección a la línea (Giovannetti y Mosse, 1980). Las plantas no inoculadas se inspeccionaron bajo el estereoscopio para descartar la existencia de estructuras de colonización micorrízica.
Tratamiento con MeJA e infección con el patógeno S. sclerotiorum
A las cuatro semanas después de la inoculación con R. irregularis, y justo antes de que las plantas se cosecharan para determinar el porcentaje de colonización, se colectó un foliolo de la hoja del tercer nodo de cada planta y se colocó en una cámara húmeda construida de la siguiente manera: en el fondo de una caja de Petri se colocó papel filtro estéril humedecido con agua destilada estéril, sobre el cual se ubicaron dos portaobjetos en cruz, para posicionar sobre éstos el foliolo sin que entrara en contacto con el papel filtro humedecido, cuya función, era mantener una alta humedad relativa dentro de la caja. Después de colocar el foliolo, se aplicó el tratamiento de MeJA. Foliolos provenientes de plantas M y NM se trataron con 1 mL de 50 μM de MeJA (López-Ráez et al., 2010) disuelto en 1 % etanol. A un número correspondiente de foliolos de plantas M y NM se les aplicó 1 mL de 1 % etanol. De esta manera, el experimento consistió en cuatro tratamientos: no micorrizado (NM), micorrizado (M), no micorrizado con MeJA (NM-MeJA) y micorrizado con MeJA (M-MeJA). Inmediatamente después de aplicar el MeJA (o el etanol al 1 %), los foliolos se infectaron en el haz con un disco de medio PDA conteniendo micelio de S. sclerotiorum en activo crecimiento. Posterior a esto, las cajas de Petri se sellaron con plástico flexible (Parafilm M ®) (Mora-Romero et al., 2015b). Las cajas se distribuyeron en un arreglo completamente al azar en un cuarto de crecimiento con un fotoperiodo de 8 h luz a 25 ºC / 16 h oscuridad a 18 ºC. El efecto del patógeno S. sclerotiorum se determinó mediante la medición del diámetro de tejido necrótico a las 24 h posterior a la infección, los foliolos se colectaron para la extracción de RNA total, síntesis de cDNA y posterior análisis de genes.
Aislamiento de RNA total y síntesis de cDNA
Cada una de las réplicas biológicas por tratamiento, por separado, se utilizaron para la extracción del RNA total con TRIzol reagent Ambion (cat. no. 15596-026) siguiendo las recomendaciones del fabricante. Posterior al aislamiento, el RNA total se visualizó por electroforesis y se cuantificó por espectrometría. Cada una de las muestras (1 mg) se trató con TURBO DNAse (Invitrogen cat. no. AM2238), y se empleó como molde para la transcripción reversa con la enzima SuperScript IIIRT kit (Invitrogen cat. no. 18080-044), de acuerdo con las instrucciones del fabricante.
Cuantificación relativa de genes por PCR en tiempo real
La mezcla de reacción para PCR contenía 200 nM de cada oligonucleótido, 10 μl de SsoAdvanced™ Universal SYBR® Green Supermix (BioRad cat. no. 1725271) y 100 ng de cDNA en un volumen total de 20 μl. Se emplearon placas de 96 pozos para el equipo CFX96 Touch™ Real-Time PCR Detection System (BioRad). El programa utilizado fue: 95 °C por 3 minutos para la activación de la enzima y 40 ciclos de 95 °C por 30 segundos, 60 °C por 30 segundos y 72 °C por 30 segundos. Para descartar la amplificación de productos inespecíficos, se realizó una curva de disociación posterior al programa de amplificación, utilizando los parámetros definidos en el equipo. Los datos generados se analizaron en función del ciclo umbral o Ct (cycle threshold), empleando la función 2-ΔCT. La expresión del gen constitutivo gliceraldehído-3-fosfato deshidrogenasa (GAPDH) se incluyó en cada corrida de PCR en tiempo real con la finalidad de normalizar los resultados de expresión de cada uno de los genes de interés. Los oligonucleótidos utilizados se describen en la Tabla 1.
Tabla 1 Oligonucleótidos utilizados en el presente trabajo
| Nombre | Secuencia 5’--3’ | Referencia | |
| Normalizador | GAPD-Pv-3’F | GGGGTTACTCCCAAAGGGTTGTGG | (Cervantes-Gámez, 2010) |
| GAPD- Pv-3’R | TGAGCTTTTGATCACTTCCATTTGTTTGGC | ||
| De interés | PvLOX2- 3’UTR F | CGTCTGTGGTTTAATGTCTGTCC | (Mora-Romero et al., 2015b) |
| PvLOX2-3’UTR R | CACCCGACAATTATGCAGAG | ||
| PvLOX6-F | TGGTTCAAATTCAGGTGCAA | ||
| PvLOX6-R | CATGGCTCACCCTTTTTAGC | ||
Análisis estadístico
Los datos obtenidos de las lesiones ocasionadas por el patógeno a las 24 h posteriores a la infección se sometieron a pruebas de homogeneidad y se sujetaron a la transformación de la raíz cuadrada del valor de la lesión, previo al análisis de varianza, para la posterior comparación de medias por Tukey (p < 0.05). En los análisis de la expresión relativa por PCR en tiempo real igualmente se aplicó ANOVA y la prueba post-hoc de Tukey (p <0.05). Los datos se analizaron en el paquete estadístico MINITABv18.
Resultados
La colonización con el HMA R. irregularis no incrementó la biomasa fresca en frijol variedad Azufrasin
El porcentaje de colonización micorrízica cuatro semanas posteriores a la inoculación con R. irregularis fue de 11.4 ± 0.6. En los tratamientos no inoculados no se observaron estructuras relacionadas a la colonización, tal como se esperaba. Se evaluaron los pesos frescos, tanto de raíz como parte aérea, y no se observó diferencia significativa entre los tratamienos NM y M (Figura 2).
Tanto la micorrización como la aplicación exógena de MeJA reducen la susceptibilidad a S. sclerotiorum, y dichos efectos son aditivos cuando ambas condiciones se combinan
La invasión del patógeno S. sclerotiorum en los foliolos bajo los diferentes tratamientos, se determinó a las 24 h posteriores a la inoculación con el patógeno, mediante la medición del halo necrótico. Los foliolos del tratamiento NM presentaron los mayores diámetros de lesión foliar (Figura 3), mientras que en los tratamientos M y NM-MeJA, los diámetros de lesión fueron aproximadamente 38 % menores comparados con el tratamiento NM, y no existieron diferencias estadísticas entre ellos (Figura 3). Por otro lado, la combinación de ambas condiciones, es decir el tratamiento M-MeJA, presentó los menores diámetros de lesión observados en el experimento, correspondiendo a menos del 10 % de diámetro de lesión del tratamiento NM (Figura 3).
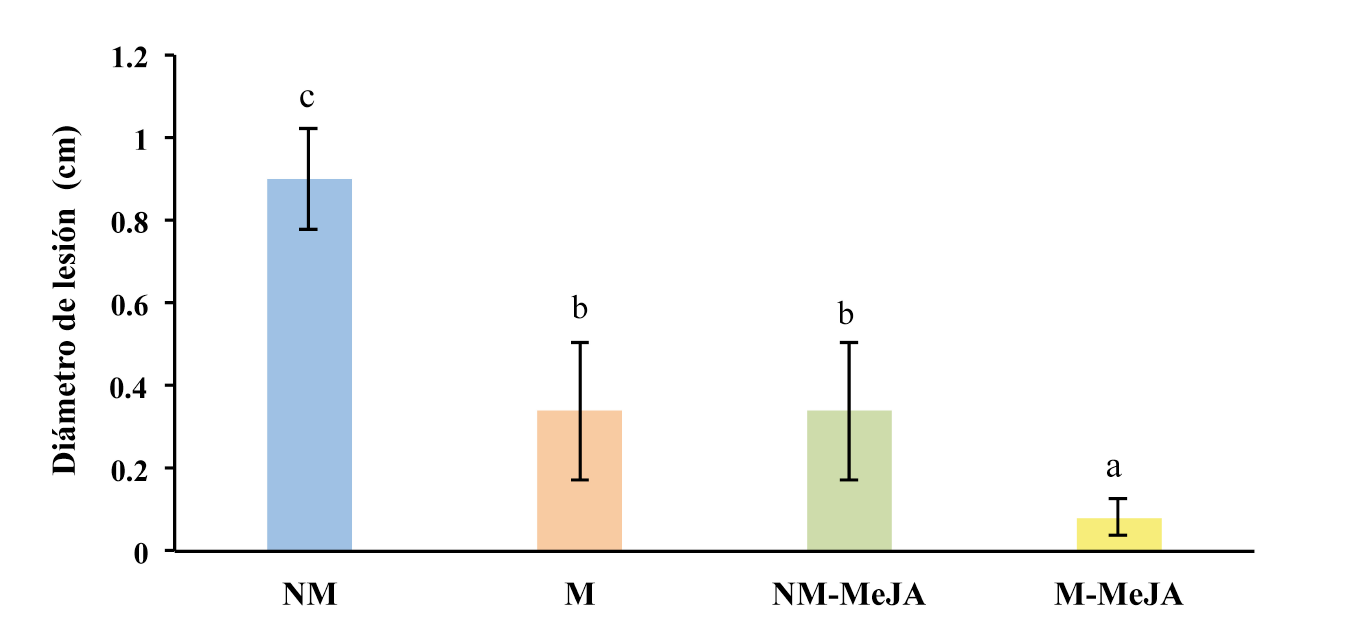
Figura 3 Diámetro de la lesión en foliolos de frijol variedad Azufrasin, 24 h post-inoculación con S. sclerotiorum. NM: foliolos provenientes de plantas no micorrizadas. M: micorrizadas. NM-MeJA: tratadas con 50 µM MeJA. M-MeJA: combinación de micorrización y 50 µM MeJA. Letras diferentes indican diferencias estadísticas significativas entre los tratamientos (ANOVA, Prueba de Tukey p < 0.05) n=4.
La expresión de los genes PvLOX2 y PvLOX6 aumentó significativamente en hojas de plantas de frijol en el tratamiento combinado de micorrización y MeJA exógeno
Con el objetivo de investigar el posible involucramiento de la ruta de las oxilipinas en la defensa inducida por micorrización en hojas de frijol infectadas con S. sclerotiorum, se analizó el perfil de expresión de los genes PvLOX2 y PvLOX6 en el tejido foliar de plantas M y NM, 24 h después de ponerlas en contacto con el hongo patógeno. De igual manera, se analizó la expresión de los genes en tejidos tratados con MeJA exógeno. Los resultados indicaron que la tendencia de la expresión del gen PvLOX2 en los foliolos infectados con S. sclerotiorum fue mayor en los tratamientos M y NM-MeJA, con respecto al tratamiento NM; sin embargo, las diferencias no fueron significativas entre estos tres tratamientos. Por otro lado, la infección con S. sclerotiorum en los foliolos de plantas con la combinación de condiciones, es decir, en el tratamiento de hojas de plantas micorrizadas y adicionadas con MeJA (M-MeJA), el aumento en la expresión de PvLOX2 fue casi dos órdenes de magnitud con respecto a la expresión relativa observada en el tratamiento NM (Figura 4a). En cuanto a PvLOX6, su perfil de expresión fue similar al de PvLOX2, particularmente en la intensa inducción observada en el tratamiento combinado de micorrización y adición exógena de MeJA (Figura 4b). Tampoco se observaron diferencias significativas entre los tratamientos NM, M y NM-MeJA para PvLOX6 (Figura 4b).

Figura 4 Expresión relativa de PvLOX2 (A) y PvLOX6 (B) en foliolos de frijol variedad Azufrasin 24 h post-inoculación con S. sclerotiorum. NM: foliolos de plantas no micorrizadas. M: micorrizadas. NM-MeJA: tratadas con 50 µM-MeJA. M-MeJA: combinación de micorrización y 50 µM MeJA. Letras diferentes indican diferencias estadísticas significativas entre los tratamientos (ANOVA, Prueba de Tukey, p < 0.05) n=3.
Discusión
Las plantas, al enfrentarse con un patógeno, son capaces de activar diversos mecanismos de defensa que le permiten contender al atacante. Estos mecanismos son diversos, y van desde el fortalecimiento de barreras físicas como las paredes celulares y cutículas, hasta la síntesis de compuestos, péptidos y proteinas antimicrobianas, entre otros (Freeman y Beattle, 2008). De manera interesante, la interacción de las plantas con microorganismos tales como rizobacterias benéficas y hongos micorrízicos arbusculares alteran la manera en que las plantas responden al ataque por un patógeno, dando como resultado la activación de un estado de alerta que hace a las plantas responder mas rápida e intensamente a un ataque subsecuente por un patógeno (Pieterse et al., 2001; Pozo et al., 2009; Jung et al., 2012). Estos mecanismos de “priming” o preacondicionamiento llevan a la inducción de la resistencia sistémica inducida, o ISR por sus siglas en inglés (induced systemic resistance) en el caso de bacterias benéficas (Van der Ent et al., 2008); o a la resistencia inducida por micorrización, o MIR, por sus siglas en inglés (mycorrhiza induced resistance) en el caso de hongos micorrízicos arbusculares (Jung et al., 2012). Ambos mecanismos suponen la inducción discreta de algunos genes o acumulación de proteínas que, una vez que el ataque se lleva a cabo, pueden influir en el rápido encendido de los mecanismos de defensa propiamente dichos. En el presente trabajo, se ha mostrado que hojas de plantas de frijol micorrizadas con R. irregularis son capaces de mostrar defensa inducida por micorrización contra el patógeno foliar S. sclerotiorum, corroborando observaciones previas (Mora-Romero et al., 2015a, b) en una nueva variedad de frijol.
De manera interesante, la adición de MeJA a tejidos foliares no micorrizados (NM-MeJA), mostró un nivel de infección por el patógeno similar al de tejidos de plantas micorrizadas (M) sin la adición de MeJA. Ya ha sido descrito que la adición exógena de MeJA induce la defensa contra patógenos en planta en diversos sistemas vegetales (Kępczyńska y Król, 2012; Vijayan et al., 1998). En particular, en Arabidopsis thaliana se demostró que el efecto protector de la aplicación exógena de MeJA contra Pythium mastophorum fue mediado por la inducción de mecanismos de defensa de la planta utilizando mutantes deficientes en la acumulación a ácido jasmónico o insensibles a dicho compuesto (Vijayan et al., 1998). Por lo tanto es tentador hipotetizar que quizás la respuesta de defensa por micorrización se deba a una producción endógena de MeJA como respuesta al establecimiento de la simbiosis, y que tal vez MeJA induce la defensa observada, la cual fue similar a las plantas NM y adicionadas con MeJA exógeno. Esta idea ha sido sugerida por otros autores (Pozo et al., 2009; Jung et al., 2012; Nair et al., 2015b; Song et al., 2015). Sin embargo, hay reportes en los que no se ha observado la producción de MeJA en hojas en plantas micorrizadas (Fiorilli et al., 2011), por lo tanto, es necesario realizar más investigación para explicar este mecanismo.
De manera interesante, en el presente trabajo, cuando ambas condiciones se aplicaron simultáneamente (tratamiento M-MeJA), se observó un efecto sinérgico en la magnitud de la respuesta de defensa contra S. sclerotiorum. Esto pudiera sugerir que el MeJA potencialmente producido por la micorrización en hojas, junto con el MeJA exógeno, simplemente se adicionan para amplificar la respuesta de defensa. Sin embargo, ya que en este trabajo no se cuantificó MeJA producido en hojas de plantas micorrizadas, esta explicación no puede ser concluyente.
Existe abundante evidencia de la regulación de genes relacionados con defensa en plantas micorrizadas (Liu et al., 2007; López-Ráez et al., 2010; Mora-Romero et al., 2015 b; Nair et al., 2015a, b; Pozo et al., 2009; Song et al., 2015). En este trabajo se cuantificó la expresión relativa de dos genes de lipoxigenasas relacionados con la síntesis de oxilipinas: el gen PvLOX2, el cual codifica para una lipoxigenasa tipo1 de la ruta 13-LOX y el gen PvLOX6, de una lipoxigenasa tipo 2 también de la ruta 13-LOX. La lipoxigenasa PvLOX6 ha sido reportada como involucrada exclusivamente en la síntesis de ácido jasmónico (Porta et al., 2008). En el presente trabajo, no se observaron diferencias significativas en la expresión de ninguno de los dos genes en las hojas de plantas de frijol NM, M y NM-MeJA e infectadas con S. sclerotiorum; sin embargo, ambos genes fueron fuertemente inducidos cuando ambas condiciones, micorrización y MeJA exógeno, se aplicaron simultáneamente. Para PvLOX6, esto es consistente con una retroalimentación positiva del MeJA en la propia biosíntesis de jasmonatos, misma que ya ha sido previamente reportada (López-Ráez et al., 2010), es decir, que la adición de jasmonatos, como el MeJA, induce la biosíntesis de más jasmonatos. Por otro lado, la sobreexpresión de PvLOX2 en el tratamiento combinado, sugiere que otras oxilipinas, además del MeJA pueden estar involucradas en la amplificación de la respuesta de defensa observada, ya sea a través de la inducción de su biosíntesis por el propio MeJA o por otros compuestos relacionados. Esta idea de que otras oxilipinas, tanto de la ruta 13-LOX como de la 9-LOX puedan estar involucradas en la regulación de la defensa inducida por micorrización, ha sido ya propuesta en la literatura (López-Ráez et al., 2010; Mora-Romero et al. 2015b), pero requiere de ser fundamentada con mas evidencia experimental.
En conclusión, en el presente trabajo se reporta que la inoculación con el HMA R. irregularis redujo la susceptibilidad al patógeno foliar S. sclerotiorum en una nueva variedad de frijol (Azufrasin). Dicha defensa por micorrización se incrementó con la aplicación exógena de MeJA y fue acompañada por un aumento significativo en los niveles de expresión de los genes PvLOX2 y PvLOX6. Esto sugiere que además de los jasmonatos, otras oxilipinas están involucradas en la defensa inducida por micorrización ante el ataque de patógenos en las plantas.











 nueva página del texto (beta)
nueva página del texto (beta)




