Introducción
México se caracteriza por presentar una amplia variedad de ambientes terrestres, dentro de los cuales se destacan los húmedos, áridos y semiáridos (Martínez et al., 2014). Gran diversidad de microorganismos habitan tales ambientes e interactúan con las comunidades de plantas presentes en ellos (Olalde y Aguilera, 1998). Entre los más estudiados se encuentran los hongos micorrízicos arbusculares (HMA), que desempeñan un papel clave al regular los ciclos de nutrientes y del carbono, además de que establecen asociaciones simbióticas mutualistas con la mayoría de las plantas.
En el estado de San Luis Potosí, predominan el bosque mesófilo de montaña, selvas altas y medianas, selvas bajas, zonas semiáridas, y zonas áridas (CONAFOR, 2014). Los ambientes húmedos se caracterizan por presentar suelos profundos o someros con altos niveles de precipitación, baja evapotranspiración, abundante materia orgánica y pH ácido (Gonzáles et al., 2012). Por otra parte, los ambientes semiáridos presentan baja disponibilidad de agua, suelos variables en profundidad, textura, pH, conductividad eléctrica y fertilidad, siendo frecuentes los suelos con perfil incipiente o poco desarrollados (Mazuela, 2013). Los HMA influyen en la estructura de los ambientes y en su multifuncionalidad (Van der Heijden et al., 2015). La asociación se basa en un intercambio mutuo entre la planta y el hongo, favoreciendo este último una mayor absorción de nutrientes hacia la planta y ésta a su vez obtiene productos derivados de la fotosíntesis para su mantenimiento (Bonfante y Genre, 2010).
Las asociaciones simbióticas pueden ser aprovechadas para favorecer el crecimiento y desarrollo de los cultivos (Smith y Smith, 2015), mejorar las propiedades físicas y nutricionales de los suelos (Smith y Smith 2012), y contrarrestar los efectos negativos de los estreses biótico y abiótico (Díaz et al., 2013; Chen et al., 2018). Ello permite la incorporación de prácticas agroecológicas en el manejo de los cultivos para mejorar la sostenibilidad de estos sistemas de producción (Benami et al., 2020). Algunos trabajos correlacionan el desarrollo de las plantas con los niveles de colonización, número de esporas y riqueza de especies en ambientes áridos y húmedos, donde se encuentran respuestas asociadas a las poblaciones de HMA presentes (Montaño et al., 2007; Méndez, 2013; Furrazola et al., 2017). Al respecto Berruti et al. (2016) plantean que el 75 % de la propagación de especies micorrízicas arbusculares, se ha realizado mediante el método de plantas trampa que permiten seleccionar especies micorrízicas eficientes para ser utilizadas como inoculantes micorrízicos. Entre los cultivos más comunes se encuentran el sorgo (Sorghum vulgare Pers.) y el maíz (Zea mays L.) cultivos con alta dependencia micorrízica y que cuentan con ciclos fenológicos cortos y un amplio sistema radicular (Fernandez, 2003).
Benami et al. (2020) manifiestan la necesidad de realizar investigaciones que permitan lograr un mayor desarrollo en la tecnología de producción de inoculantes micorrízicos. Ellos hacen referencia a retos por solucionar en la producción de inóculos comerciales de HMA, lo que permite identificar especies con alta eficiencia micorrízica. Rillig et al. (2016) plantean la necesidad de investigar con profundidad la tecnología micorrízica y proponen incluir en este estudio un monitoreo del manejo agrícola, aspectos de fitomejoramiento, ingeniería agroecológica y la microbiota asociada. Teniendo en cuenta estas consideraciones, el presente trabajo tuvo como objetivo identificar la diversidad de HMA de dos suelos de San Luis Potosí y su respuesta en el crecimiento de plantas de Sorghum vulgare y Zea mays.
Materiales y métodos
El experimento se desarrolló en la Facultad de Agronomía y Veterinaria de la Universidad Autónoma de San Luis Potosí. Se utilizó suelo franco areno arcilloso de dos ambientes (húmedo y semiárido) y las especies empleadas como cultivos trampa fueron Sorghum vulgare y Zea mays. El suelo del ambiente húmedo es de tipo luvisol (WRB, 2015), con un clima del tipo semicálido húmedo con lluvia todo el año (García, 2004), un bioma denominado bosque mesófilo de montaña (Rzedowski. 2006). El sitio se encuentra en el municipio de Xilitla, San Luis Potosí, México, en las siguientes coordenadas geográficas: 21° 23´ N y 98° 59´ O y a una altitud de 600 a 900 m. El suelo del ambiente semiárido es de tipo leptosol (WRB, 2015) con un clima del tipo seco o árido con regímenes de lluvias en verano (García, 2004), un bioma denominado de matorral xerófilo (Rzedowski. 2006) proveniente del municipio de Villa Hidalgo, S.L.P. México, en las siguientes coordenadas geográficas: 22° 27´ N y 100° 42´ O; con altitud de 1700 msnm. En cada sitio se obtuvieron tres submuestras aleatorias a una profundidad de 0-20 cm, las cuales se homogenizaron para formar dos muestras compuestas. Las características físico-químicas de las muestras de los suelos se muestran en la Tabla 1.
Tabla 1 Análisis físico y químico de suelos de dos ambientes del estado de San Luis Potosí
| Ambientes | pH (1:2) | MO | CaCO3 | N | P2O5 | K | Densidad aparente | Arena | Limo | Arcilla |
| (%) | (kg ha-1) | (%) | ||||||||
| Tropical húmedo | 5.9 | 3.8 | 28.5 | 4.9 | 13 | 1.35 | 1.47 | 46 | 22 | 32 |
| Semiárido | 7.6 | 3.2 | 1.6 | 3.48 | 29 | 2.78 | 1.45 | 44 | 30 | 26 |
Reproducción de especies de HMA
La reproducción de los HMA se realizó en un invernadero en condiciones semicontroladas durante los meses de abril a junio de 2017. El sustrato estuvo conformado por una mezcla del suelo proveniente de los ambientes antes mencionados y arena esterilizada (proporción 1:1). Se empleó la metodología del cultivo trampa descrita por Brundrett et al. (1996). Se sembraron cinco semillas por maceta de cada una de las especies de las plantas hospederas elegidas y se establecieron cinco macetas al azar por tratamiento. Previo a la siembra se realizó un conteo inicial de la cantidad de esporas presente en cada suelo: el proveniente del ambiente húmedo (H) contenía 124 esporas (100 g de suelo) y el que provenía del ambiente semiárido (SA) contenía 53 esporas (100 g de suelo). La fertilización se realizó con solución nutritiva Long Ashton (LANS) baja en fósforo (22 mg L-1) (Hewitt, 1966).
Identificación de las características morfológicas de las especies micorrízicas
Para la identificación de los HMA, se montaron las esporas en láminas semipermanentes con alcohol polivinilico-lacto-glicerol “PVLG” (Morton et al., 1993) y reactivo de Melzer (Koske y Tessier, 1983). Las observaciones de las estructuras microscópicas de estas esporas se realizaron en el microscopio compuesto (Nikon Model Eclipse. Japón); en estas observaciones se tomaron en cuenta las características morfológicas básicas propuestas por Walker (1983) y Morton (1988). Con lo anterior se determinó: la forma, tamaño, características de la pared externa, estructuras de germinación, hifa de sostén y reacción al reactivo de Melzer de las esporas extraídas. Posterior a ello, se identificaron las especies con base en la colección internacional de cultivos de hongos micorrizógenos arbusculares y vesiculares (http://invam.caf.wvu.edu), el manual para la identificación de hongos micorrizícos vesículo-arbusculares (Schenck y Perez, 1990), las descripciones de especies depositadas en el Departamento de Patología de Plantas de la Universidad de Agricultura en Szczecin, Polonia (http://www.agro.ar.szczecin.pl/~-jblaszkowski/), así como las publicaciones originales de las especies. Se empleó como referencia la clasificación del Phyllum Glomeromycota propuesto por Redecker et al. (2013) y Wijayawardene et al. (2018). Los especímenes identificados fueron depositados en el Laboratorio de Fitopatología de Facultad de Agronomía y Veterinaria de la UASLP.
Variables estudiadas
Las evaluaciones se realizaron a los 107 días después de la siembra. Se evaluó la biomasa seca total de la parte aérea y la biomasa seca total de raíz, las cuales fueron secadas en una estufa Riossa Nom a 70 °C hasta alcanzar peso constante. El peso se registró en una balanza analítica digital Ohaus®.
El flujo de CO2 del sustrato se midió con un sistema portátil de medición de intercambio de gases (LI-6400 Li-Cor) acoplado a la cámara de flujo de CO2 (6400-09). En cada maceta se eliminó el material vegetal y se insertó un anillo de 10.5 cm de diámetro. Se realizaron tres ciclos de lectura de los niveles de CO2 en cada maceta.
Para el número de esporas se siguió el procedimiento de Gerdemann y Nicholson (1963), las esporas extraídas se contabilizaron en una placa de conteo con círculos concéntricos donde se depositaban las esporas, lo que facilitaba su conteo; mientras para el porcentaje y eficiencia de colonización se utilizó el método de Phillips y Hayman (1970), Giovanetti y Mosseae (1980) y Trouvelot et al. (1986).
Análisis estadístico
Se realizó una prueba de t de student para dos muestras
independientes (p≤0.05). El número de esporas g-1 se transformó
mediante la raíz cuadrada, mientras que el porcentaje de colonización
micorrízica por la función arcsen
Resultados
Identificación de las especies micorrízicas
Se identificaron 11 especies de hongos micorrízicos que pertenecen a tres familias del Phyllum Glomeromycota. La familia Glomeraceae fue la más abundante con un 63% del total, mientras que la familia Acaulosporaceae tuvo el 27 % y la familia Claroideo-glomeraceae un 9 %. En el sustrato del ambiente húmedo con el cultivo trampa de Sorghum vulgare se identificó a Claroideoglomus etunicatum (W.N. Becker & Gerd.) C. Walker & A. Schüßler, Acaulospora morrowiae Spain & N.C. Schenck, Sclerocystis rubiformis Gerd. & Trappe, Glomus macrocarpum Tul. & C. Tul., Acaulospora denticulata Sieverd. & S. Toro, Acaulospora scrobiculata Trappe, Glomus sp.1 y Glomus sp.2. Con este mismo sustrato y el cultivo trampa de Zea mays se identificó a C. etunicatum, A. morrowiae, S. rubiformis, G. macrocarpum y Glomus sp.2. Por otro lado, el sustrato del ambiente semiárido con el cultivo trampa de Sorghum vulgare, se identificó a C. etunicatum, A. morrowiae, Rhizophagus intraradices (N.C. Schenck & G.S. Sm.) C. Walker & A. Schüßler, Funneliformis mosseae (T.H. Nicolson & Gerd.) C. Walker & A. Schüßler y Glomus sp.3. Mientras que en el sustrato del ambiente semiárido con el cultivo trampa de Zea mays se identificó a C. etunicatum y A. morrowiae (Figura 1). Por otra parte, en el sustrato del ambiente húmedo se encontró el 73 % del total de las especies micorrízicas identificadas en Sorghum vulgare y el 45 % en Zea mays; mientras que en el sustrato del ambiente semiárido se encontró el 45 % en Sorghum vulgare y el 18 % en Zea mays.
Biomasa seca total de parte aérea y de raíz
La prueba t de student para la biomasa seca total (Tabla 2), indica que la biomasa seca aérea de los cultivos trampa de Sorghum vulgare y Zea mays fue mayor en el sustrato semiárido, superando en un 17 y 28 % respectivamente a los cultivos trampa establecidos en el sustrato del ambiente húmedo (Figura 2A). Por otra parte, la biomasa seca de raíz no mostró diferencias en el cultivo trampa a base de Sorghum vulgare, mientras que los de Zea mays establecidos en sustrato de ambiente húmedo superaron en un 13 % a los establecidos en sustrato semiárido (Figura 2 B).
Tabla 2 Resultados de la prueba de t de student para los cultivos de Sorghum vulgare y Zea mays
| Variables | Cultivos trampa | |||
| Sorgo | Maíz | |||
| t | P value | t | P value | |
| Biomasa seca parte aérea total | 3.47 | 0.009** | 5.04 | 0.001** |
| Biomasa seca raíz total | -1.26 | 0.245 n.s. | -3.46 | 0.009** |
| Flujo de CO2 del sustrato | 9.91 | 0.000*** | 2.51 | 0.018* |
| No de esporas | 2.36 | 0.025* | 3.19 | 0.004** |
| Porcentaje de colonización | 1.08 | 0.294 n.s. | 4.62 | 0.000*** |
| Eficiencia de colonización | 2.07 | 0.053 n.s. | 4.14 | 0.001** |
Prueba t de student (P ≤ 0.05). *significativo, ** muy significativo, ***altamente significativo, n.s. no significativo.
Flujo de CO2 del sustrato de crecimiento
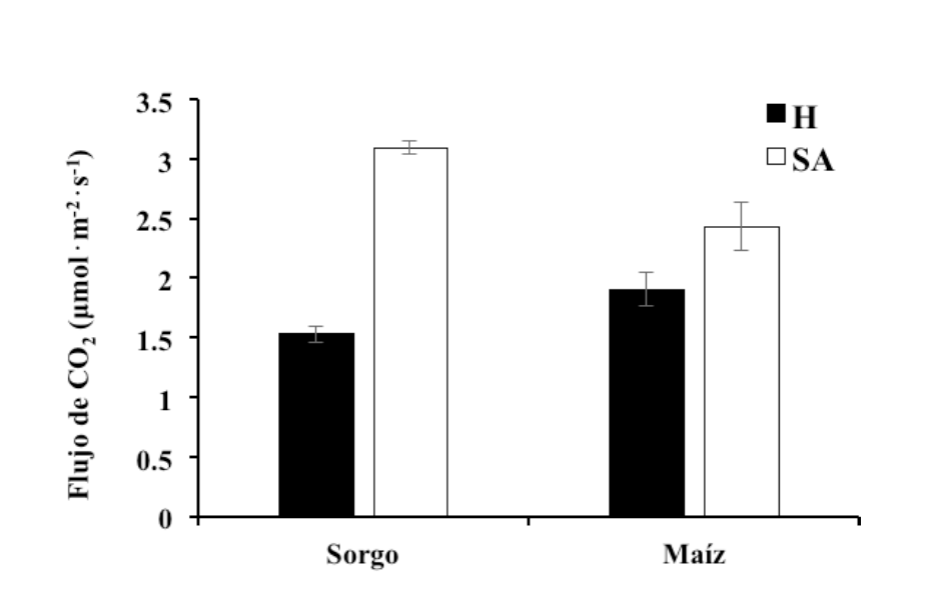
La prueba de t de student para el flujo de CO2 (Tabla 2), muestra que las plantas trampa de Sorghum vulgare y Zea mays en el sustrato semiárido superaron en un 50 y 22 % respectivamente a las del sustrato del ambiente húmedo (Figura 3).
Variables micorrízicas
La prueba de t de student para el número de esporas, porcentaje y eficiencia de colonización indica diferencia estadística entre los suelos. El número de esporas fue superior en las plantas trampa del ambiente semiárido. Las plantas de Sorghum vulgare y Zea mays superaron en un 18 y 28 % respectivamente a las establecidas en el sustrato del ambiente húmedo (Figura 4A). Por otra parte, el porcentaje de colonización refleja la presencia de estructuras de HMA en la raíz y mostró diferencias significativas en Zea mays, donde los mejores resultados correspondieron al sustrato del ambiente semiárido. El cultivo trampa Zea mays superó en un 27 % a los que crecieron en el sustrato del ambiente húmedo (Figura 4B). La eficiencia de colonización, cantidad de hifas, arbúsculos y vesículas de HMA que se forman dentro de la raíz colonizada mostró diferencias significativas en las plantas de Zea mays. De igual modo, las raíces del sustrato semiárido superaron en un 52 % con respecto al sustrato húmedo (Figura 4C).
Discusión
Identificación de las especies micorrízicas
El sustrato del ambiente húmedo tuvo mayor riqueza de HMA con respecto al sustrato del ambiente semiárido, lo cual puede estar asociado a la diversidad de plantas de estos ambientes y las características del suelo. Álvarez et al. (2017), han reportado hasta 49 morfo-especies de HMA en selvas tropicales, en comparación a las 19 morfo-especies de estos hongos en matorrales xerófilos del centro de México reportadas por Monroy y Ramírez (2018). Por otra parte, Sorghum vulgare fue el cultivo trampa que propagó una mayor diversidad de especies de HMA, lo que puede estar asociado a un mayor producción de biomasa radical en este cultivo.
Biomasa seca total parte aérea y de raíz
Las especies de HMA de ambiente semiárido promovieron una mayor biomasa en la parte aérea, lo que indica que estos hongos pueden desarrollar mecanismos de adaptación en este tipo de ambiente. Se ha documentado que el pH es un factor que influye en la absorción de nutrientes por la planta, tal y como lo refieren Andrade y Martínez (2014). En suelos con pH alcalino, la planta disminuye la capacidad de absorción de los nutrientes; en este sentido, los HMA juegan un papel importante en la eficiencia micorrízica, tal y como sucede en los ambientes semiáridos. Aunque la biomasa seca de la raíz fue superior en el sustrato húmedo (Figura 2B), esta variable no está relacionada a la biomasa seca aérea, lo cual sugiere que la respuesta de la biomasa aérea puede estar asociada al nivel de colonización intraradical más que al desarrollo radical.
Flujo de CO2 del sustrato de crecimiento
El sustrato semiárido promovió la mayor tasa de flujo de CO2. Este sustrato presentaba un 12.5 % menos de carbonatos totales que el sustrato húmedo (Tabla 1), esto indica que las especies micorrízicas del ambiente semiárido pueden aportar una mayor cantidad de CO2 al sustrato. Smith y Smith (2015) plantean que las hifas son las encargadas del transporte del carbono producto de la fotosíntesis hasta el hongo y a su vez de los nutrientes del suelo hacia la planta. Por otro lado, Herman et al. (2012) y Nottingham et al. (2013) plantean que la transferencia del carbono al suelo en zonas que son inaccesibles para las raíces puede realizarse a través de las hifas micorrízicas. Solaiman (2014) sugieren que las hifas extraradicales y la acción de glomalina en la formación de agregados del suelo pueden contribuir al secuestro del carbono en el suelo.
Comportamiento micorrízico
Las especies del ambiente semiárido replicaron el mayor número de esporas, lo que sugiere que la diversidad de especies de HMA no incrementó el número de esporas en el cultivo trampa, sino la capacidad que tienen las especies de replicarse. El porcentaje y eficiencia de la colonización fue mayor en Zea mays en el sustrato del ambiente semiárido; sin embargo, el Sorghum vulgare mostró un comportamiento similar en ambos sustratos. Esto puede sugerir que existe selectividad entre las especies de HMA hacia el hospedero y ésta puede estar dada por la dependencia micorrízica del cultivo, las especies de HMA involucradas y las características del sustrato. Helgason et al. (2002) sugieren que existe selectividad entre los HMA y plantas que colonizan, lo que favorece el crecimiento y desarrollo. Bainard et al. (2014) demostraron que existen factores que influyen en la abundancia y diversidad de especies de HMA, siendo el pH y las propiedades químicas del suelo los que impulsan variaciones de las comunidades de HMA en el suelo.
Conclusiones
Se identificaron 11 especies de HMA, siendo la familia Glomeraceae la más abundante. La mayor diversidad se replicó en el cultivo trampa de Sorghum vulgare. El sustrato del ambiente semiárido es más eficiente en la promoción del crecimiento aéreo, el flujo de CO2 del suelo y la producción de esporas (número de esporas), en cultivos trampa de Sorghum vulgare y Zea mays. El sustrato del ambiente húmedo favoreció el crecimiento radicular de Sorghum vulgare y Zea mays. La eficiencia en la simbiosis micorrízica se vió reflejada por un incremento en las estructuras fúngicas de los HMA dentro de la raíz y en el crecimiento de los cultivos trampa. La simbiosis micorrízica dependió del cultivo y las especies de HMA involucradas.











 nueva página del texto (beta)
nueva página del texto (beta)