Introducción
México es un país con alta diversidad vegetal, con un estimado entre 20,000 y 30,000 especies de plantas vasculares (Espejo-Serna et al., 2004). Su variedad de relieve y condiciones climáticas permiten observar diversos ecosistemas como el Bosque Mesófilo de Montaña (BMM) y la Selva Baja Caducifolia (SBC). El BMM alberga la mayor diversidad de especies de flora y fauna con relación a su área, cuya característica principal es la presencia de nubes a nivel de la vegetación. Se calcula que alrededor de 2,500 a 3,000 especies de plantas vasculares habitan en estos bosques, sin embargo, también abundan epífitas y helechos (CONABIO, 2010). Por otro lado, la SBC o Bosque Tropical Caducifolio, es el ecosistema tropical de mayor extensión a nivel mundial (42 %) y en México representa cerca del 60 % de la vegetación tropical (Trejo y Dirzo, 2000). La SBC está dominada por árboles de baja estatura (hasta 12 m), cuenta con cactáceas columnares y las briofitas y helechos son poco frecuentes (Rzedowski, 2006). A diferencia del BMM, la SBC presenta una época seca donde los árboles pierden sus hojas, lo cual puede prolongarse de cinco hasta ocho meses, generando un déficit hídrico y de nutrientes minerales disponibles (Bullock et al., 1995; Rzedowski, 2006).
Una gran parte de las especies vegetales que habitan en estos ecosistemas forman asociaciones simbióticas con los hongos micorrízicos arbusculares (HMA). Se ha reportado que cerca del 80 al 95 % de las plantas vasculares que existen actualmente son capaces de establecer esta interacción (Smith y Smith, 2008). Los beneficios de la asociación micorrízica arbuscular para la planta hospedera incluyen un mejor estado nutricional, en particular referente a fósforo y otros nutrientes minerales de baja disponibilidad. Del mismo modo, le confieren ventajas tales como una mayor resistencia al estrés biótico, esto es, un efecto potenciador de los mecanismos de defensa a enfermedades ocasionadas por diversos fitopatógenos (Jung et al., 2012); y al estrés abiótico, como una mayor resistencia al estrés de sequía y salinidad (Chen et al., 2017).
Mientras que la presencia de los HMA es común en todos los ecosistemas terrestres (Smith y Smith, 2008), existen diferencias en la efectividad de estos hongos de acuerdo a los antecedentes de manejo del sitio (Gillespie y Allen, 2006) y respecto a la eficiencia de uso del fósforo (Mensah et al., 2015). Diversas especies, o incluso aislados de la misma especie, pueden tener una funcionalidad distinta, tanto en la comunidad que conforman como en una especie vegetal determinada (Klironomos, 2000; Bittebiere et al., 2020). En cultivos de importancia agrícola, se ha encontrado que inóculos con alta riqueza de HMA, pueden ser más efectivos en su respuesta al crecimiento, que aquellos de baja riqueza (Trejo-Aguilar et al., 2013). En papaya, la simbiosis induce un incremento significativo tanto del peso de la planta como del número de las hojas (Mamatha et al., 2002). Incluso se ha observado que la simbiosis con HMA es importante para la supervivencia de las plantas, especialmente en época de secas (Vega-Frutis y Guevara 2017).
Otro aspecto importante a conocer además de la efectividad de los HMA sobre el hospedero, es la identidad y diversidad de las especies que conforman una comunidad. Aun cuando la diversidad global de los HMA es relativamente baja, si se analiza a nivel de comunidad, la diversidad local puede ser alta (Menzel et al., 2018). La diversidad vegetal, las diferencias en la composición del suelo, la topografía y el clima pudieran estar relacionados con la diversidad de HMA en la microbiota rizosférica, tal como ha sido reportada para otros grupos biológicos (Sarukhán et al., 2009). En México, los HMA no han sido ampliamente estudiados y a pesar de que existen algunos esfuerzos en conocer la diversidad asociada a nuestros ecosistemas, aún es necesario caracterizar muchas regiones de nuestro país (Montaño et al., 2012).
Los primeros reportes taxonómicos de este grupo de hongos en México fueron realizados por Trappe y Guzmán (1971). En el 2001, Varela y Trejo (2001) presentaron 44 especies de HMA reportadas en el país, mientras que Montaño et al. (2012), reportaron un total de 95 especies. El dato más reciente menciona que en México existen 143 especies de hongos pertenecientes a Glomeromycota (Varela et al., 2019).
Aunque los trabajos taxonómicos se incrementaron en los últimos 15 años, en México se han elaborado escasos reportes sobre la identificación molecular (Trejo-Aguilar et al., 2013; Trejo et al., 2015; Sangabriel-Conde et al., 2015; Santillán-Manjarrez et al., 2019; Chimal-Sánchez et al., 2020). Sin embargo, como ha sido señalado por diversos autores, la identificación de las especies a nivel molecular es necesaria, considerando la variación morfológica existente y que la producción de esporas es asincrónica entre los HMA (Walker y Vestberg, 1998; Souza, 2015).
Conocer la diversidad de HMA en comunidades nativas a partir del muestreo directo presenta algunos retos. Por ello, es común recurrir al uso de plantas con dependencia micorrízica para la propagación de inóculos efectivos aislados de los ecosistemas naturales. Existen muchas especies vegetales que muestran dependencia micorrízica (Ortaş, 2020), esto es, su crecimiento se ve favorecido cuando, bajo condiciones limitantes de fósforo, la planta produce más biomasa en comparación con una planta no colonizada con HMA. Tal es el caso de Carica papaya (Trindade et al., 2001), un cultivo de importancia para México, con una superficie cultivada de 19, 471.03 ha, una producción de 1, 039, 819.64 ton y un valor total de $ 6, 186, 186, 720.00 MN. El estado de Veracruz cultiva 3, 525 ha, produciendo 114, 173.33 ton y una derrama económica de $ 595, 874, 230 MN (SIAP, 2020). La estrategia en este trabajo se centró en comparar inóculos provenientes de ecosistemas naturales contrastantes, propagados en cultivo trampa, con el propósito de probar que los HMA establecen simbiosis y ésta puede ser efectiva, aun cuando estos hongos no provienen de ambientes edáficos similares a las condiciones de desarrollo del hospedero (planta modelo, Carica papaya), así como estudiar, mediante un análisis microbiómico, la diversidad de especies de HMA de estos inóculos que se asocian a la planta hospedera.
Materiales y métodos
Descripción de los sitios de muestreo
Se seleccionaron dos ecosistemas contrastantes: BMM y SBC. Los sitios de muestreo son catalogados como reservas ecológicas, en el estado de Veracruz. El sitio BMM se ubica en el municipio de Xalapa, Veracruz y cuenta con una extensión de 30 hectáreas, el sitio SBC se localiza en Actopan, Veracruz en un área de 2 hectáreas. Sus características y geolocalización se muestran en la Tabla 1.
Tabla 1 Características climáticas y edáficas típicas de los ecosistemas estudiados
| Variable | Bosque mesófilo de montaña (BMM) | Selva baja caducifolia (SBC) |
| Altitud | 1400 msnm | 253 msnm |
| Clima | Cf. húmedo sin estación seca | Aw. tropical húmedo seco |
| lluvias a lo largo del año | lluvias en verano | |
| temperatura 12 a 23 °C | temperatura 20 a 26 °C, | |
| precipitación 1500 a 2000 mm | precipitación 1100 a 1300 mm | |
| Distribución de | Lluvias constantes a lo largo de todo el año | Distribucion desigual a lo largo del ano, dos estaciones |
| humedad | marcadas: lluviosa y seca | |
| Materia orgánica | 13.9 % | 0.5 % |
| pH | 5.4 | 4.7 |
| Suelo | Andosol y acrisol órtico | Luvisol vértico |
| Textura | Franco arenosa | Migajón arcilloso |
| Ubicación | 19o 27 ́32 ́ ́ Latitud Norte | 19 o 27 ́ 30 ́ ́ Latitud Norte |
| 94o 34 ́26 ́ ́Longitud Oeste | 96 o 34 ́ 20 ́ ́ Longitud Oeste | |
| Vegetación | Dosel de árboles caducifolios de 15 a 30 m de altura | El estrato arbóreo oscila entre los 12 y 15 m de altura |
| Predominantemente de afinidad holártica | Predominancia de elementos neotropicales y escasez/ ausencia de los holarticos | |
| El sotobosque está conformado por especies perennifolias de afinidad neotropical | La característica sobresaliente es la pérdida de sus hojas por 5 a 8 meses |
Fuente: Hernández y Jacobo, 2018; Vázquez-Torres et al., 1992; Williams-Linera et al., 2002.
Muestreo de suelo
El muestreo se realizó según el método propuesto por Huising et al., (2012) para estudios de diversidad bajo el suelo, adaptándolo a la topografía de los sitios de estudio. Se seleccionaron tres puntos aleatorios (réplicas) con una distancia aproximada de 100 m entre ellos. En cada punto se trazaron dos círculos concéntricos de 3 y 6 m de radio, en un área total de 113 m2, dentro de estos se seleccionaron 12 puntos: cuatro en el radio de 3 m y ocho en el radio de 6 m. Se tomaron 12 submuestras de suelo con un nucleador de 5 cm de diámetro y 20 cm de altura, con capacidad de 200 g. El suelo de las 12 submuestras de cada punto se homogenizó y se tomaron cuatro réplicas de cada mezcla para su propagación en cultivos trampa.
Propagación de HMA en “cultivos trampa” y preparación del inóculo
Se utilizó la técnica reportada por Sieverding (1991) para obtener abundantes esporas sanas y con la mayor diversidad posible de especies. Como hospederos para la propagación se utilizaron primero un pasto (Brachiaria decumbens), seguido por una leguminosa (Canavalia ensiformis) y posteriormente un cereal (Zea mays). Para el paso inicial de propagación en pasto se utilizaron macetas de 500 mL con 100 g del suelo muestreado en cada punto mezclado con 200 g de arena esterilizada en autoclave por una hora a 121 °C y 15 libras de presión (este procedimiento se repitió tres veces con un espacio de 24 horas entre cada esterilización y el sustrato se empleó hasta después de 24 horas de esterilizado). Adicionalmente, esta mezcla fue cubierta con 150 g de arena estéril. Estas especies altamente micotróficas, se emplearon en este orden para evitar la pérdida de diversidad del inóculo (Trejo-Aguilar et al., 2013), cultivando cada una de ellas de manera consecutiva sobre arena estéril en macetas circulares con capacidad de 3.8 L (20 cm diámetro x 16 cm de altura). Cada maceta fue sembrada por periodos de tres meses consecutivos con cada especie, posteriormente se suspendió el riego durante los siguientes tres meses. Al final de este periodo, se colectaron raíces de maíz para determinar el porcentaje de colonización, se eliminó la parte aérea de las plantas, los fragmentos de raíces se homogenizaron con el sustrato y se realizó el conteo de esporas de cuatro alícuotas del homogenizado. Se obtuvieron 57.7 y 85.42 % de colonización en las raíces de maíz como cultivo trampa, para BMM y SBC respectivamente, y un promedio de 1,625 y 456 esporas por cada 100 g de suelo. En los subsecuentes experimentos se emplearon 10 g de inóculo (arena y fragmentos de raíces colonizadas) proveniente de la mezcla del cultivo trampa anterior.
Pruebas de eficiencia de los consorcios micorrízicos, en C. papaya como planta modelo
Se seleccionó C. papaya variedad Maradol, como planta modelo, debido a su alta dependencia micotrófica (Jaizme-Vega et al., 2006; Khade y Rodrigues, 2009), a su rápida respuesta a la colonización micorrízica (Quiñonez-Aguilar et al., 2015; Devi et al., 2019), así como a la facilidad de observar estructuras micorrízicas en sus raíces y a la escasa información sobre los ensambles de HMA asociados a esta especie de importancia agrícola. Se empleó un diseño experimental completamente al azar, con tres tratamientos: inóculo BMM, inóculo SBS y control (sin inocular), cada uno con cinco réplicas. Las semillas fueron sembradas directamente en la maceta, las plantas de papaya se mantuvieron en invernadero durante 45 días a partir del día de siembra en macetas con un volumen de 1 L de suelo estéril y conteniendo los 10 g de inóculo en el caso de los tratamientos. Se irrigó ad libitum con agua destilada estéril y cada 15 días se fertilizó con solución de Hoagland sin fósforo. El experimento tuvo una duración de 45 días, debido a que es el tiempo requerido para que las plantas sean colonizadas por los HMA. Las plantas se cultivaron en un invernadero a una temperatura de 25 - 30 °C, con un fotoperiodo de 18 h luz/6 h oscuridad. Se evaluó área foliar, porcentaje de colonización, biomasa y fósforo total en base seca empleando cinco repeticiones. Se emplearon tres de las cinco muestras de raíz para la extracción de ADN. A los 45 días después de la siembra e inoculación se determinó el área foliar mediante el paquete de R Leaf Area (Katabuchi, 2015). Para obtener la biomasa, se midió el peso seco; el tejido se mantuvo a 80 °C durante 3 días y se utilizó una balanza analítica. El porcentaje de colonización se determinó por el método de clareo y tinción de Phillips y Hayman (1970) y la cuantificación de estructuras internas se evaluó empleando un microscopio óptico, mediante la técnica de McGonigle et al. (1990). El control no-inoculado no mostró colonización por HMA. El contenido de fósforo en el tejido foliar se determinó mediante el método de Fósforo Bray P-1 de acuerdo a la NOM 021 RECNAT 2000 AS-11.
Diseño experimental y análisis estadístico
Se utilizó un diseño completamente aleatorizado con tres tratamientos (inóculo BMM, inóculo SBC y control sin inocular), cada uno con cinco repeticiones. Se consideró como hipótesis nula (H0) la similitud de respuesta de las variables evaluadas entre los tratamientos y como hipótesis alternativa (Hi) la existencia de diferencias significativas. Se comprobó el cumplimiento de los supuestos teóricos de homogeneidad (Komolgorov, 1933). Se realizó un análisis de varianza de clasificación simple basado en un modelo lineal de efectos fijos (Fisher, 1937). Cuando existieron diferencias significativas entre los tratamientos, se utilizó la prueba de comparación múltiple de medias de Tukey (1960) para p ≤ 0.001. Para verificar en qué porcentaje el modelo matemático empleado (lineal de efecto fijo) explicaba la variabilidad encontrada en los tratamientos, se calculó el coeficiente de determinación (R2) sin ajustar mediante el cociente entre la suma de cuadrados de los tratamientos y la suma de cuadrados total. Para comparar las medias de la variable porcentaje de colonización se utilizó la prueba de distribución teórica de probabilidades de “t de student” para p ≤ 0.001 (Gosset, 1917). El tamaño de muestra empleado fue n=5. Para estos análisis se utilizó el paquete estadístico profesional STATISTICA versión 12 para Windows.
Extracción de ADN de raíces y amplificación del ADN ribosomal de HMA
Se colectaron de 30 a 40 fragmentos de 1 cm de raíces de una planta de papaya (réplica biológica). Este procedimiento se realizó con cuatro réplicas biológicas (o plantas) de cada tratamiento (SBC y BMM). Los fragmentos de raíces se depositaron en DNAzol a temperatura ambiente y fueron mantenidos a -18 °C hasta su procesamiento. Se siguió el protocolo indicado en el kit para la extracción de ADN a partir de tejido vegetal (DNA Plant mini kit QIAgen). La cuantificación del ADN genómico extraído se realizó en un fluorómetro Qubit (Invitrogen) y la estimación de la relación de calidad (A260/280 y A260/230) fue estimada en un Nanodrop 2000C (ThermoFisher Scientific). Se llevó a cabo una PCR (reacción en cadena de la polimerasa) anidada para amplificar específicamente a especies de Glomeromycota. Las mezclas de oligonucleótidos SSUmAf y LSUmAr se utilizaron para amplificar un segmento de 1,800 bp dentro de la región de ADN ribosomal, seguido de un PCR anidado utilizando las mezclas de oligonucleótidos SSUmCf y LSUmBr para obtener un producto de 1,500 bp como se reportó en Krüger et al. (2009). Los productos de 1,500 bp se utilizaron como templado para una tercera reacción de PCR en la que se utilizaron oligonucleótidos ITS 1 e ITS 4 (White et al., 1990), reduciendo el tamaño del amplicón a ~600 bp. A cada oligonucleótido se le adicionaron los adaptadores correspondientes al sistema MySeq de Illumina (ITS1-MiSeq: TCG TCG GCA GCG GAT GTG TAT AAG AGA CAG TCC GTA GGT GAA CCT GCG G, e ITS4-MiSeq: GTC TCG TGG GCT CGG AGA TGT GTA TAA GAC AGT CCT CCG CTT ATT GAT ATG C). Los amplicones fueron purificados con el kit comercial QIAquick (Qiagen, Cat. no. 28106), cuantificados por fluorescencia en un Qubit y la calidad del material fue corroborada en un equipo Nanodrop, como se mencionó anteriormente.
Secuenciación masiva y análisis bioinformático
Los productos purificados de la tercer ronda de PCR (empleando el set de oligos ITS1-MiSeq e ITS4-MiSeq) fueron enviados para ser secuenciados al LAN-GEBIO-CINVESTAV Irapuato, donde las bibliotecas fueron etiquetadas de manera individual mediante la adición de índices (secuencias conocidas que permiten discernir entre las secuencias obtenidas para cada biblioteca) y posteriormente se realizó la secuenciación en ambas direcciones (paired-end) utilizando la plataforma MySeq de Illumina, en formato 2 x 300. Cada amplicón se analizó con la base de datos RDP (Ribosomal Database Project, https://rdp.cme.msu.edu/); utilizando herramientas bioinformáticas de clasificación jerárquica para cada muestra. El clasificador RDP y la base de datos de los dominios ITS se usaron para generar tablas de clasificación jerárquica (“phylum”, “clase”, “orden”, “familia”, “género” y “especie”) para ITS. Una vez obtenidos los datos de especie putativa, las taxa virtuales se clasificaron de acuerdo al Catalogue of Life (2020-04-16 Beta, http://www.catalogueoflife.org/ consultado en mayo 22 del 2020).
Resultados y discusión
Efecto de los consorcios en papaya
Una vez realizada la prueba de comparación múltiple de medias (Tabla 2), se constató la existencia de diferencias altamente significativas (p ≤ 0.001) para las variables evaluadas: biomasa (F= 50.2474; gl= 2; p= 0.0001); contenido de fósforo foliar (F= 228.993; gl= 2; p= 0.000) y área foliar (F= 297.59; gl= 2; p= 0.00000), por lo que se rechaza la hipótesis nula alegórica a cada variable.
Tabla 2 Valores promedio de los tratamientos en las variables bio-masa, área foliar y contenido de fósforo foliar en plantas de papaya a los 45 días post-inoculación con HMA
| Inóculo | Biomasa (g peso seco-1) |
Área foliar (cm2) |
Fósforo foliar (mg planta-1) |
| BMM | 0.13 ± 0.02a | 18.25 ± 1.86a | 0.30 ± 0.04b |
| SBC | 0.05 ± 0.02b | 9.28 ± 0.55b | 0.70 ± 0.06a |
| Control | 0.01 ± 0.01b | 0.86 ± 0.16c | 0.13 ± 0.01c |
Los valores indican la media ± el error estándar.
Las variables de respuesta fueron analizadas con un ANOVA y para las diferencias entre los niveles del factor inóculo se usó la prueba de contraste a posteriori de Tukey (P ≤ 0.05).
Letras distintas indican diferencias significativas.
Partiendo de la suma de cuadrados de las fuentes de variación involucradas en el modelo lineal empleado (tratamientos y error) en cada análisis de varianza, se obtuvo que por efecto de los tratamientos se explicó la variabilidad total existente en la variable biomasa en un 90 %, mientras que en las variables contenido de fósforo y área foliar, esta variabilidad fueron explicadas en un 97 y 98 % respectivamente, existiendo un mayor ajuste en estas dos variables. Estos valores confirman la factibilidad del modelo lineal empleado en el procesamiento estadístico para explicar la contribución de los tratamientos establecidos a la variabilidad total.
Las plantas que se inocularon con los HMA provenientes del BMM presentaron valores superiores de biomasa y área foliar, respecto al control (13 y 21 veces más, respectivamente) y al tratamiento SBC (2.6 y 2 veces más, respectivamente). Cabe destacar, que el contenido de fósforo foliar fue significativamente mayor en el tratamiento SBC, respecto al resto de los tratamientos (Tabla 2). Dichos resultados coinciden con los publicados por Quiñones-Aguilar et al. (2019) quienes evaluaron la efectividad de consorcios multiespecíficos de HMA provenientes de suelos de plantaciones de Agave cupreata del estado de Michoacán; dos de los consorcios evaluados incrementaron la biomasa total respecto al testigo sin HMA más de dos veces.
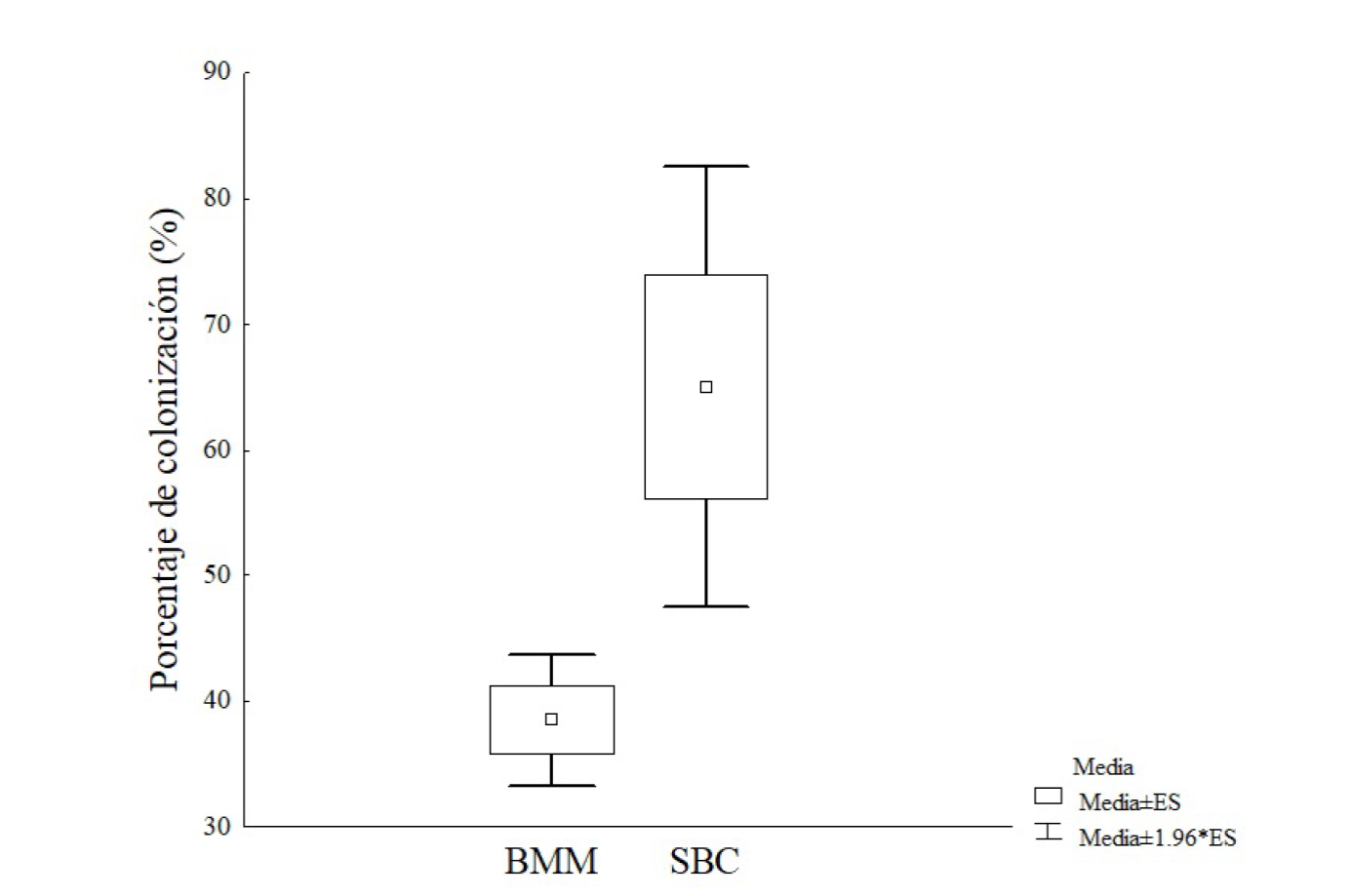
Los porcentajes de colonización micorrízica presentaron diferencias altamente significativas (Figura 1), obteniendo el mayor promedio el tratamiento SBC. En este mismo tratamiento la dispersión con respecto a la media fue más notable, lo que sugiere la necesidad de experimentar en futuros trabajos la respuesta de colonización en esta o en otras especies vegetales. Los porcentajes de colonización micorrízica alcanzados en este trabajo a los 45 días (SBC 65 % y BMM 38.46 %) son mayores a los reportados por Vega-Frutis y Guevara (2009) en plantas silvestres de papaya machos y hembras en edad reproductiva (Febrero 2007) en cuanto a estructuras internas (menor al 5 %). En papaya, variedad Cera, se reporta una colonización del 100 % del sistema radical 100 días después de la colonización (Quiñones-Aguilar et al., 2019) y, en papaya, variedad Maradol, 210 días después del trasplante a suelo inoculado con Glomus mosseae y Entrophospora colombiana, se reportan niveles de 91.5 % y 58.2 % respectivamente (Vázquez-Hernández et al., 2011).
Identificación molecular
Del total de lecturas obtenidas mediante secuenciación masiva, el 82 % cumplieron con los criterios de calidad y longitud mínimas (Tabla 3), de las cuales 134,143 lecturas se alinearon con alguna secuencia reportada para el Phyllum Glomeromycota (50.5 %).
Tabla 3 Conteo de lecturas (reads) obtenidas por sitios muestreados mediante secuenciación masiva y después de la limpieza y filtrado bioinformático
| Sitio muestreado | Lecturas iniciales | Filtradas por calidad | Dominios por nivel: | |||
| Fungi (ITS) | Phyllum | Género | Especie | |||
| SBC | 184,260 | 153,458 | 147,948 | 64,242 | 4,990 | 970 |
| BMM | 138,882 | 112,262 | 109,040 | 69,921 | 41,002 | 7,824 |
| Total | 323,142 | 265,720 | 256,988 | 134,143 | 45,992 | 8,794 |
Incidencia y riqueza de especies
Se identificaron 12 taxa virtuales de HMA asociadas a papaya, ocho provenientes del inóculo SBC y siete del BMM (Figura 2). Las réplicas biológicas en nuestro trabajo corresponden a una sola planta, esto nos permitió determinar que cada una se asoció con 4 a 9 especies distintas con un promedio de 6.4 especies de HMA por planta (datos no mostrados).

Figura 2 Frecuencia absoluta de las especies provenientes de dos ecosistemas presentes en cuatro muestras de raíz de plantas de papaya. Dos consorcios de HMA provenientes de los ecosistemas de selva baja caducifolia (SBC) y bosque mesófilo de montaña (BMM) fueron usados como inóculo en plantas de papaya, teniendo cuatro réplicas biológicas para cada tratamiento.
Se encontraron 11 especies del orden Glomerales todas pertenecientes a la familia Glomeraceae representada por los géneros Rhizophagus (R. custos (C. Cano & Dalpé) C. Walker & A. Schüßler, R. fasciculatus (Thaxt.) C. Walker & A. Schüßler, R. intraradices (N.C. Schenck & G.S. Sm.) C. Walker & A. Schüßler, R. irregularis (Błaszk., Wubet, Renker & Buscot) C. Walker & A. Schüßler y R. prolifer (Dalpé & Declerck) C. Walker & A. Schüßler) y Glomus (G. macrocarpum Tul. & C. Tul., Glomus sp3, sp7 y sp8); seguidos por especies del género Oehlia (O. diaphana [Syn. R. diaphanus] (J.B. Morton & C. Walker) Błaszk., Kozłowska, Niezgoda, B.T. Goto & Dalpé) y Funneliformis (F. dimorphicus (Boyetchko & J.P. Tewari) Oehl, G.A. Silva & Sieverd.). Se identificó también la especie Ambispora appendicula (Spain, Sieverd. & N.C. Schenck) C. Walker, miembro del orden Archaesporales y la familia Ambisporaceae.
La única especie presente en todas las muestras y réplicas biológicas analizadas fue R. irregularis (Figura 2). En plantas inoculadas con inóculos de SBC, se encontraron R. irregularis y Glomus sp3 SUN_2011 en las cuatro réplicas biológicas; mientras que en las de BMM fueron R. irregularis, R. custos, y O. diaphana. Tres especies (R. custos, R. irregularis y G. macrocarpum) fueron identificadas provenientes de ambos ecosistemas (Figura 2).
La diversidad alfa fue mayor en SBC en concordancia con un porcentaje de colonización micorrízica mayor que en BMM. Existen cinco especies únicas de SBC y cuatro de BMM, así como tres especies en ambos sitios (Figura 3) . Rhizophagus irregularis fue la especie dominante en los dos ecosistemas. Previamente se ha reportado que las características del ecosistema permiten observar una variabilidad en la composición de la comunidad de HMA (Öpik et al., 2006). Las plantas de papaya inoculadas con HMA originarios de SBC presentan un mayor número de especies, algunas aún no caracterizadas, tales como Glomus sp3, sp7 y sp8 SUN_2011 (Figura 2) , las cuales podrían ser nuevas especies. Entre las doce especies caracterizadas en este estudio F. dimorphicus (Oehl et al., 2011) corresponde a una especie que no ha sido reportada para México de acuerdo a los últimos registros que se tienen (Varela et al., 2019), aumentando a 144 el número de especies de Glomeromycota encontradas en nuestro país.

Figura 3 Distribución de las especies de HMA encontradas en raíces de papaya inoculadas con consorcios provenientes de SBC y BMM. Adicionalmente, se muestra el valor de la diversidad alfa para cada ecosistema.
En nuestro grupo de trabajo previamente se caracterizaron morfológicamente las esporas de las especies presentes en estos ecosistemas naturales. En SBC y BMM se encontraron 19 y 18 especies, respectivamente (datos no publicados). Del total de las ocho especies detectadas en SBC y siete en BMM en el presente trabajo, solo R. intraradices fue encontrada en ambos ecosistemas, mediante identificación morfológica. Sin embargo, la caracterización morfológica se basó en la identificación de las esporas colectadas del suelo en los dos ecosistemas naturales. En este tipo de trabajo muchas de las especies poco representadas no pueden ser descritas (Kruger et al., 2009), es posible que la diversidad en los ecosistemas naturales sea mayor. En el presente trabajo identificamos HMA que se encuentran asociadas a las raíces de papaya después de haber pasado por un proceso de selección y amplificación en tres cultivos trampas con especies diferentes, dicho proceso permitió identificar especies que no fueron descritas con los estudios morfológicos en esporas de suelo de los ecosistemas naturales.
Nuestros resultados también muestran tres especies tentativas como Glomus sp. puesto que la identificación molecular no permitió llegar hasta la especie. Esto sugiere la posibilidad de que estos Glomus sp. no correspondan a las especies descritas en el presente trabajo aumentando el número de especies reportado.
Las transferencias consecutivas por cultivos trampa y la propagación en papaya, pudo haber seleccionado de manera dirigida a las especies detectadas en el presente trabajo. Es posible que esto se deba a una asociación específica de los HMA presentes en los ecosistemas naturales con los cultivos trampa utilizados en el presente estudio. Esto puede haber favorecido la reproducción diferencial de especies de HMA, así como generar diferencias en las velocidades de producción de esporas, por ejemplo, debido a su ciclo reproductivo durante el año en condiciones naturales (Khade y Rodrigues, 2010; Thomsen y Hart, 2018).
Para conocer las comunidades de HMA de ecosistemas naturales se requiere tanto la caracterización de esporas de suelo a nivel morfológico como de complementar estos estudios con la identificación molecular. La estrategia de secuenciación masiva empleada en el presente trabajo ofrece una herramienta útil para este fin. Por otra parte, en este trabajo se encontraron especies no identificadas en análisis morfológicos de los ecosistemas naturales de donde provenía el inóculo, por lo que se sugiere que este tipo de estrategia empleando cultivos trampa pudieran ser complementarios para la caracterización de comunidades provenientes de ecosistemas naturales. Este procedimiento pudiera amplificar algunos de los HMA presentes en menor proporción en ecosistemas naturales, lo cual permitiría detectar a aquellos miembros más raros entre la comunidad de HMA de un ecosistema determinado. Adicionalmente, la completa caracterización de una comunidad de HMA en un ecosistema natural requiere la realización de estudios que integren muestreos en diferentes épocas del año, y de diferentes micrositios donde se localizan los principales representantes de la vegetación en el ecosistema.
El consorcio de especies encontrado en raíces de papaya inoculadas con HMA provenientes de BMM mostró una mayor producción de biomasa y área foliar en papaya, aun cuando la diversidad fue más baja que el consorcio de especies provenientes de SBC. Las diferencias en biomasa entre los tratamientos inoculados con HMA y el control que no recibió HMA confirman una fuerte dependencia micorrízica (Trindade et al., 2001) por parte del hospedero vegetal, C. papaya. Todas las especies encontradas en BMM pertenecen a la familia Glomeraceae y en SBC también, exceptuando una especie perteneciente a la familia Ambisporaceae. Rhizophagus irregularis fue la especie dominante en ambos ecosistemas (Figura 2). Como ha sido demostrado, esta es una especie generalista y promiscua (Oehl et al., 2010), se le ha descrito en todos los ambientes edáficos y se asocia con todo tipo de hospederos. Sin embargo, Ijdo et al. (2010) la ubican como una especie con estrategia R. Por otra parte, aunque se ha comprobado que esta especie promueve beneficios a las plantas debido a su alta tasa de colonización y esporulación, se corre el riesgo que la introducción de esta especie, principalmente en ecosistemas agrícolas, desplace especies nativas o más eficientes, como sucede con este tipo de especies “generalistas”.
Glomus macrocarpum, presente en las raíces de plantas de papaya inoculadas con HMA de ambos ecosistemas, es una especie también considerada como “generalista” (Carneiro et al., 2019) y ha sido encontrada en campos de cultivo de papaya, en varios sitios estudiados como Brasil e India (Trindade et al., 2006; Sharda y Rodrigues, 2008).
Aunque R. irregularis y G. macrocarpum, se caracterizan por ser cosmopolitas, es importante notar su compatibilidad con papaya, y no descartar su función en la simbiosis, ya que estas especies también han mostrado ser eficientes en el manejo de nutrientes y tienen efectos positivos sobre la biomasa vegetal en papaya (Manjunatha et al., 2002; Ley-Rivas et al., 2017) y en otros cultivos (Naik et al., 2018; Kumari et al., 2017; Kumar et al., 2017).
El análisis microbiómico empleado permitió la identificación de taxa virtuales aún no reportadas, que podrían corresponder a nuevas especies, así como el hallazgo de la especie Funneliformis dimorphicus, nuevo registro para México. También se logró conocer la distribución y asociación de los HMA identificados, que en un futuro podría ser la base para la selección de inoculantes micorrízicos.











 nova página do texto(beta)
nova página do texto(beta)