Introducción
En la actualidad, el cultivo de hongos comestibles y medicinales es una actividad importante en México, ya que se produce un alimento de gran demanda, con buen precio en el mercado y que genera miles de empleos. Esta actividad inició en los años 30’s del siglo pasado por migrantes europeos a través del cultivo de champiñones, específicamente Agaricus bisporus (J.E. Lange) Imbach, y se consolidó en décadas posteriores (Martínez-Carrera et al., 2016). Su desarrollo se robusteció a partir de los 70’s con la introducción de especies de Pleurotus, conocidas comercialmente como ”oyster mushrooms” en Europa y América del Norte, por su morfología que asemejan ostras y en México tomaron el nombre de “setas”, ya que los primeros cultivos provenían de España, donde así se denominan a las especies comestibles. Aunque con anterioridad a las especies silvestres de Pleurotus se les denominaban oreja blanca, oreja de palo, oreja de cazahuate, hongo de patancán u hongo de izote (Guzmán, 2000), el término de setas se popularizó rápidamente y se mantiene en el mercado nacional.
Las especies de Pleurotus presentan ventajas de crecimiento sobre otros hongos cultivados, debido a su eficiente capacidad enzimática de biodegradación de una gran variedad de materiales lignocelulósicos (Mata et al., 2017). Además, sus ciclos de cultivo son cortos y quizás lo más atractivo desde el punto de vista comercial, algunas cepas son altamente productivas de basidiomas con tamaño y morfología de interés al consumidor (Chang y Miles, 2004).
En México se comercializa mayoritariamente Pleurotus pulmonarius (Fr.) Quél., debido a las preferencias de consumo de ‘variedades claras’, aunque entre los cultivadores no existe completa certeza sobre la especie que cultivan, ya que frecuentemente se confunde con Pleurotus ostreatus (Jacq.) P. Kumm., debido a su alta similitud morfológica e incluso confundidas en la bibliografía (Guzmán, 2000; Pánek et al., 2019). En condiciones naturales, P. pulmonarius y P. ostreatus pueden coexistir, aunque la primera se reproduce más favorablemente en ambientes más cálidos, lo cual sugiere que las condiciones ambientales han favorecido una eventual especiación alopátrica (Lechner et al., 2005; Shnyreva y Shtaer, 2006). A nivel comercial, P. pulmonarius resulta de gran interés para algunas condiciones ambientales del país, por lo que es prioritario disponer de cepas con alta producción de basidiomas de tamaño y morfología adecuada para el mercado regional, de preferencia con baja producción de esporas y rendimiento estable bajo diferentes condiciones de cultivo en ciclos cortos (Mata et al., 2013).
A pesar del desarrollo que ha tenido esta agroindustria a nivel nacional, los avances logrados en programas de entrecruzamiento genético de cepas realizados en instituciones nacionales no han incidido significativamente en la disponibilidad y reproducción masiva de germoplasma adecuado para las condiciones ambientales regionales, por lo que la producción nacional continúa sustentada en un limitado número de cepas.
En el caso de Pleurotus, al presentar un patrón de sexualidad heterotálico tetrapolar (Shnyreva y Shtaer, 2006), es factible realizar cruzamientos de esporas entre los tipos de apareamiento compatibles. Este es un proceso complejo, azaroso y requiere partir de cepas parentales con capacidad de heredar a su descendencia características de interés al mercado, como la cantidad y el tamaño de basidiomas (Avin et al., 2016). En el presente estudio, se aislaron basidiosporas de cepas comerciales de Pleurotus pulmonarius, que se entrecruzaron para obtener los dicariones correspondientes, con el objetivo de determinar la variación en el crecimiento micelial, desarrollo de primordios, peso y tamaño de los basidiomas entre las cepas parentales y progenie, con la finalidad de seleccionar germoplasma con potencial comercial.
Materiales y métodos
Cepas
Se utilizaron las siguientes cepas de P. pulmonarius como germoplasma parental: IE-115 (Fungi Perfecti, K200, EUA), IE-739 fue donada por un productor comercial nacional y la IE-717 (=LGAM P57) fue proporcionada por el Dr. G. Zervakis de la Universidad de Agricultura de Atenas (Grecia). Las primeras dos cepas son cultivadas comercialmente en México. Todo el material genético está depositado en el Cepario de Hongos del Instituto de Ecología (Xalapa, Mex.) (WDCM 782).
Obtención de micelios monospóricos y cruzas
Se colocaron basidiomas maduros de las cepas parentales cultivadas en paja de cebada sobre papel estéril, con la finalidad de obtener las esporadas. Los cultivos monospóricos se aislaron de diluciones de basidiosporas en agua destilada estéril a una concentración de 1 x 106 esporas mL-1 (Gaitán-Hernández y Salmones, 2008). Se dispersaron alícuotas de 0.5 mL de las suspensiones de esporas en cajas de Petri con 20 mL de medio de agar con papa y dextrosa (PDA, Bioxon) e incubadas en la oscuridad a 26 °C. Después de 3 a 4 d de incubación, las esporas que germinaron fueron transferidas a otra caja de Petri con PDA para favorecer su desarrollo y corroborar su estado monocariótico, mediante la ausencia de fíbulas. Al menos 20 cultivos monospóricos se aislaron de cada cepa parental.
Se eligieron 12 cultivos monospóricos al azar de cada cepa parental para obtener sus tipos de compatibilidad (Eger, 1978). Estos cultivos fueron dispuestos en pares entre ellos, sin cruzas recíprocas. Paralelamente, se prepararon cinco réplicas de los monospóricos de cada cepa, 36 en total, para estimar su crecimiento micelial en PDA a 26 °C. La cuantificación del crecimiento se basó en las mediciones de los diámetros miceliales desarrollados, a partir de dos líneas marcadas perpendicularmente una de otra, cada tercer día de incubación (Salmones y Durán Barradas, 2001). De acuerdo con los resultados del análisis estadístico de los valores obtenidos, se eligió el cultivo monospórico más rápido de cada tipo de compatibilidad, cuatro en total por cada parental, para realizar las cruzas interespécimen.
Se estimó el crecimiento micelial en PDA tanto a las cepas parentales como a las cruzas interespécimen obtenidas, de manera similar al procedimiento seguido para los cultivos monospóricos. Estos resultados fueron analizados estadísticamente mediante un ANOVA y prueba de medias de Tukey para determinar diferencias significativas entre los diámetros miceliales desarrollados, con apoyo del paquete estadístico Statistica 7.1 (StatSoft, 2005).
Cultivo de las cepas en paja de cebada
El inóculo se preparó con semillas de sorgo (Sorghum vulgare L.), ajustadas una humedad de ca 30 %, colocadas en bolsas de polietileno y esterilizadas a 121 °C durante 1 h (Guzmán et al., 2013). Las semillas fueron inoculadas con porciones de micelio de cada una de las tres cepas parentales y de las 48 cruzas. Las muestras se incubaron a 26 °C en la oscuridad hasta el cubrimiento total de los granos por el micelio.
El sustrato utilizado para la producción de las fructificaciones fue paja de cebada (Hordeum vulgare L.), previamente procesada en una trilladora para obtener fragmentos de 5 a 8 cm de largo. El sustrato se hidrató y fermentó durante 5 d, con volteos periódicos (al menos 2 veces) para favorecer un proceso aeróbico. Posteriormente, el sustrato fue colocado en un túnel de pasteurización y tratado térmicamente con vapor a 65 °C por 6 h. La siembra consistió en mezclar la paja de cebada (humedad del 68 %) con el inóculo de cada cepa a un porcentaje de inoculación del 5 % (base húmeda), en bolsas de plástico de 40 × 60 cm. El peso final de las muestras fue de 4 kg con 10 réplicas por cepa. Las muestras fueron incubadas a 26 ± 1 ºC en la oscuridad hasta el cubrimiento total del sustrato por el micelio. Después se colocaron en un área con iluminación (12 h luz/12 h oscuridad), concentración de CO2 <1200 ppm, humedad de 85 ± 5 % y temperatura de 26±3°C.
La productividad se expresó como: i) eficiencia biológica (EB) (Tschierpe y Hartmann, 1977) y ii) tasa de producción (Salmones y Durán Barradas, 2001). Los hongos cosechados se agruparon por tamaño del píleo: (G1) hasta 5 cm, (G2) de 5.1 a 10 cm, (G3) 10.1 a 15 cm y grupo 4 (G4) >15 cm (Gaitán-Hernández y Salmones, 2008), al igual que la producción de basidiomas de cada cosecha expresado como porcentaje del volumen total de hongos obtenidos.
Resultados y discusión
Obtención de micelios monocarióticos y cruzas
En los procesos de hibridación y mejoramiento genético, la selección de parentales apropiados es un factor esencial. En el presente estudio se eligieron parentales de diferente origen geográfico con la finalidad de contar con mayor variabilidad genética de la especie, que evitara la repetición de alelos durante la recombinación genética.
Los 12 cultivos monospóricos de las tres cepas parentales se agruparon en cuatro tipos de compatibilidad, lo que concuerda con el patrón de sexualidad heterotálico tetrapolar de Pleurotus (Eger, 1978; Shnyreva y Shtaer, 2006). Cada tipo de compatibilidad fue conformado por uno a cuatro cultivos monospóricos. A los 10 d de incubación, los cultivos monospóricos de la cepa IE-717 presentaron diámetros de micelio de hasta 72.7 ± 2.3 mm, mientras que los monospóricos de IE-115 crecieron entre 59.3 ± 1.0 hasta 64.8 ± 2.5 mm y los cultivos de IE-739 de 53.5 ± 1.6 a 69.0 ± 2.0 mm (Tabla 1). Los diámetros miceliales más desarrollados correspondieron a los monospóricos 4 y 5 del parental IE-717 y al monospórico 9 del parental IE-739, por lo que fueron estadísticamente similares entre ellos y diferentes al resto de micelios evaluados.
Tabla 1. Crecimiento micelial de los cultivos monospóricos de Pleurotus pulmonarius a los 10 días de incubación y origen de las cruzas evaluadas en el estudio
| Cepa parental |
Tipos de compatibilidad |
No. de monospórico |
Ø micelial (mm) |
Parentales | Código asignado y combinación de monospóricos |
|||
| IE-115 | I (A1B1) | 3 | 59.8±1.6c1 | IE-115 | C1 = 4-4 | C2 = 11-4 | C3 = 10-5 | C4 = 10-11 |
| II (A1B2) | 4 | 64.8±2.5b | X | C5 = 4-5 | C6 = 11-5 | C7 = 10-4 | C8 = 3-11 | |
| III (A2B1) | 11 | 59.3±1.0c | IE-717 | C9 = 3-9 | C10 = 4-11 | C11 = 10-9 | C12 = 11-9 | |
| II (A2B2) | 10 | 64.3±1.2b | C13 = 4-9 | C14 = 11-11 | C15 = 3-5 | C16 = 3-4 | ||
| IE-717 | I (A3B3) | 4 | 69.2±2.1a | IE-115 | C17 = 11-7 | C18 = 3-7 | C19 = 4-7 | C20 = 11-9 |
| II (A3B4) | 5 | 72.7±2.3a | X | C21 = 10-9 | C22 = 4-9 | C23 = 3-9 | C24 = 3-4 | |
| III (A4B3) | 9 | 57.3±0.5cd | IE-739 | C25 = 11-1 | C26 = 10-7 | C28 = 4-1 | C28 = 3-1 | |
| II (A4B4) | 11 | 63.2±3.8b | C29 = 10-4 | C30 = 10-1 | C31 = 4-4 | C32 = 11-4 | ||
| IE-739 | I (A5B5) | 1 | 59.3±1.2c | IE-717 | C33 = 5-9 | C34 = 5-7 | C35 = 4-4 | C36 = 9-9 |
| II (A5B6) | 4 | 53.5±1.6e | X | C37 = 4-7 | C38 = 9-1 | C39 = 11-1 | C40 = 5-1 | |
| III (A6B5) | 9 | 69.0±2.0a | IE-739 | C41 = 11-4 | C42 = 4-1 | C43 = 11-9 | C44 = 9-7 | |
| II (A6B6) | 7 | 54.8±0.8de | C45 = 4-9 | C46 = 5-4 | C47 = 11-7 | C48 = 9-4 | ||
1 Diámetro micelial desarrollado a los 10 días de incubación. Letras diferentes en la misma columna, para todas las cepas, indican diferencias significativas (α= 0.05), de acuerdo a la prueba de intervalos múltiples de Tukey.
En promedio, los cultivos monospóricos requirieron de 14 a 20 d para cubrir el diámetro total de la caja de Petri (90 mm Ø). De acuerdo con los resultados del análisis estadístico aplicado a los diámetros desarrollados por los 36 micelios monospóricos a los 10 d de incubación, se eligió un cultivo de cada tipo de compatibilidad para las cruzas interespécimen. Como resultado del entrecruzamiento de los cuatro tipos de apareamiento de las tres cepas parentales se obtuvieron 48 micelios dicarióticos, a los cuáles se les asignó un código de identificación (Tabla 1). Estos cultivos cubrieron el diámetro total de la caja de Petri en 10-14 d de incubación. Los resultados de crecimiento micelial de parentales y cruzas a los 8 d de incubación se muestran en la Figura 1.
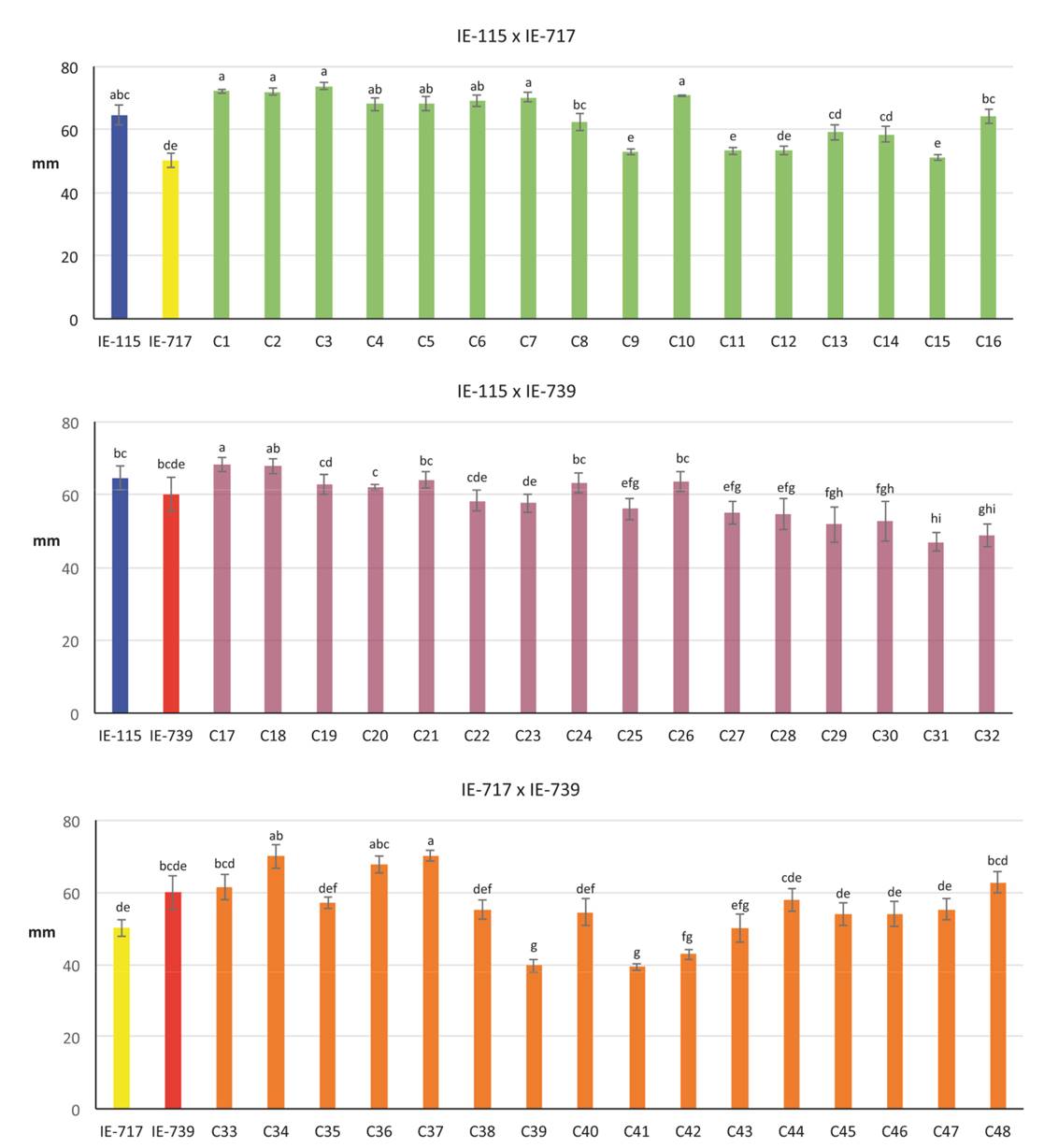
Figura 1. Diámetro micelial promedio (mm) de los parentales y cruzas obtenidas a los 10 días de incubación. En cada combinación de parentales, columnas que no comparten al menos una letra en común, indican diferencias estadísticas, de acuerdo con la prueba de intervalos múltiples de Tukey (p=0.05).
El germoplasma obtenido de la combinación de los parentales IE-115 e IE-717 alcanzó diámetros miceliales promedio de 51.0 ± 0.9 (C9) a 73.8 ± 1.2 mm (C3), mientras que las combinaciones de IE-115 x IE-739 variaron entre 47.0 ± 1.1 (C31) hasta 68.1 ± 1.9 mm (C17) y las de IE-717 x IE-739 desde 39.3 ± 0.9 (C39) hasta 70.2 ±1.5 mm (C37). Las cepas parentales presentaron diámetros promedio de 64.5 ± 3.2 mm (IE-115), 50.2 ± 2.4 mm (IE-717) y 60.1 ± 4.72 mm (IE-739), siendo disímil entre algunas cepas y sus parentales (p<0.05) (Figura 1). Once de los dicariones (C1-C7, C10, C16-C18) obtenidos a partir de IE-115 presentaron un crecimiento micelial mayor o similar a su parental, con diferencias significativas con algunos de los dicariones restantes. De manera similar, 11 dicariones (C17-C19, C21, C24, C26, C33, C34, C36, C37 y C48) de la progenie obtenida con IE-739 presentaron diámetros miceliales mayores a similares de su parental. IE-717 mostró menor desarrollo micelial que los otros parentales, por lo que gran parte de su progenie (25 cruzas) logró superar el tamaño del micelio desarrollado por su parental, de éstas 13 correspondieron a las combinaciones con IE-115 y los 12 restantes con IE-739.
En general se observó que la combinación entre IE-115 e IE-717 generó un mayor número de cruzas con mejor tasa de crecimiento micelial que sus parentales, que superaron los 70 mm de diámetro micelial a los 8 d de incubación. Si bien se ha reportado que la capacidad de una cepa para colonizar de manera rápida y eficiente el sustrato en que crece es una característica independiente de su capacidad para la formación y desarrollo de fructificaciones (Royse, 2002; Gaitán-Hernández y Salmones, 2008), es recomendable para fines de cultivo comercial cultivar germoplasma con rápido crecimiento micelial, porque provee ventajas sobre la expresión de enzimas lignocelulolíticas como lacasas, relacionadas no sólo con el proceso de colonización y descomposición del sustrato, sino también con la capacidad de defensa ante organismos contaminantes y consecuentemente, en la disponibilidad de nutrientes requeridos para la formación y desarrollo de fructificaciones (Mata et al., 2005, 2017).
El crecimiento rápido de basidiomicetos se debe a factores poligénicos, predominantemente controlado por uno o dos genes, demostrado a través de la identificación del loci de caracteres cuantitativos (QTL, Quantitative Trait Loci) en P. ostreatus (Larraya et al., 2002). En este estudio es interesante destacar que la mayoría de la progenie del monospórico 7 y 4 del parental IE-739 e IE-115 respectivamente, mantuvieron un rápido crecimiento micelial y altos valores de productividad en los dicariones obtenidos. Lo anterior podría deberse a la presencia de los genes involucrados en el proceso. En P. ostreatus se ha observado que los monocariones de rápido crecimiento pertenecen a tipos de compatibilidad específicos (Larraya et al., 2002). Una posible explicación a la asociación entre el crecimiento micelial y los loci de reconocimiento sería que las fuerzas evolutivas de estos sistemas difieren del resto del genoma, ya que la selección equilibrada y la recombinación suprimida parecen jugar un papel importante en su evolución (van der Nest et al., 2009).
Producción de las fructificaciones
En las 48 cruzas obtenidas, el micelio invadió adecuadamente el sustrato, con dos a tres semanas de incubación para cubrirlo totalmente. Sin embargo, dos dicariones no lograron presentar primordios, por lo que los resultados de productividad corresponden a las 46 cepas restantes. En gran parte de las muestras cultivadas se observó que el micelio desarrollado sobre la paja mostraba zonas más densas con aspecto aterciopelado, que con el paso de los días se convirtió en una cubierta tipo costra, aunque sin alcanzar la compactación observada en otras especies cultivadas como Lentinula edodes (Berk.) Pegler. El desarrollo cespitoso de los primordios y la morfología de los basidiomas cosechados fue característico de la especie, flabeliformes e infundibuliformes, de color blanquecino a crema, algunos con tonalidades marrón-grisáceas.
En la Figura 2 A y B se presenta la distribución de las cruzas de acuerdo con los valores de EB y TP registrados. La eficiencia biológica de las cepas progenie fluctuó entre 16.4 (C36) hasta 147.5 % (C37) y la TP entre 0.14 (C43) a 2.59 % (C35). Del total de cruzas, 12, 21, y 13 alcanzaron EBs <50, 50-80 y >80 % respectivamente. Las cepas parentales presentaron EBs desde 91.9 (IE-739) hasta 114.8 % (IE-115). En cuanto a las TPs, 17, 13, 12 y 4 cruzas presentaron <1, 1-1.5, 1.5-2 y >2 % respecti-vamente; mientras que en las cepas parentales los porcentajes fluctuaron entre 1.45 (IE-739) a 2.07% (IE-115). Las cepas produjeron entre 1 a 4 cosechas durante ciclos de cultivo que fluctuaron entre 40 y 98 d. El patrón de distribución de hongos obtenidos por cosecha fue variable, aunque en general la mayor cantidad se desarrolló en las primeras dos cosechas, con un porcentaje acumulado de <70 a 99 % de la producción total. En la Figura 2 C se muestra la distribución de las cruzas de acuerdo con los porcentajes alcanzados. En cuanto a las cepas parentales, estos porcentajes correspondieron al 76.7 (IE-717), 79.4 (IE-739) y 96.9 % (IE-115). Esta característica es altamente deseable en la producción comercial, ya que representa la factibilidad de lograr un mayor número de ciclos de cultivo durante el año.
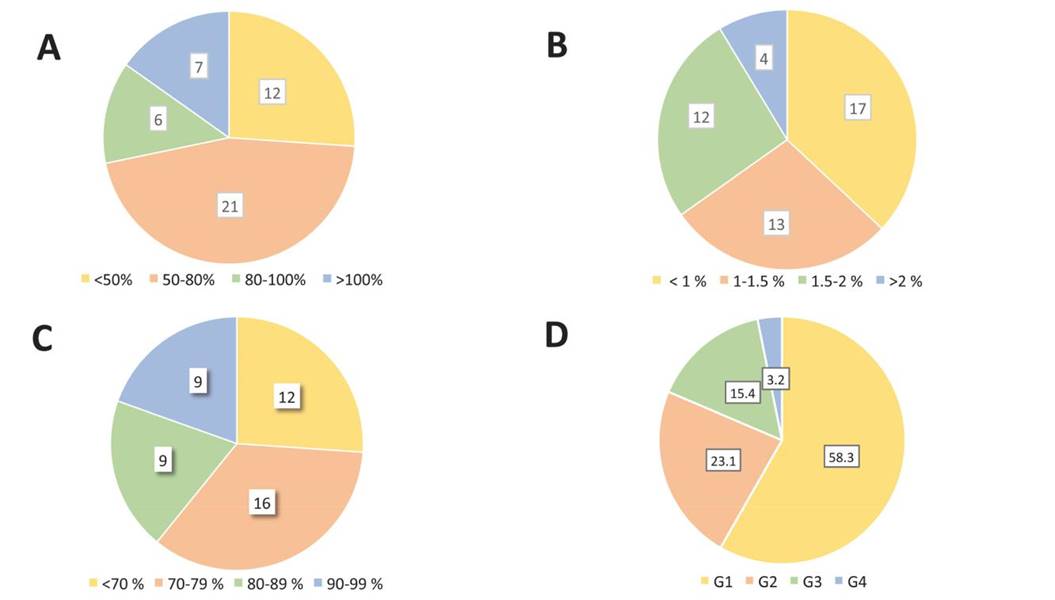
Figura 2. Características de producción de las 46 cepas progenie cultivadas en paja de cebada. A: eficiencia biológica, B: tasa de producción, C: relación de las primeras dos cosechas con respecto al total de la producción obtenida y D: Tamaño de los basidiomas desarrollados. Los valores corresponden a la sumatoria (A-C) y porcentaje promedio (D) de todas las cepas.
Con respecto al tamaño de los hongos, se desarrollaron especímenes de los 4 grupos considerados, correspondiendo a los grupos 1 y 2 los mayores porcentajes (Figura 2 D); mientras que en las cepas parentales los valores promedio de los grupos fueron de 62.5 (G1), 22.6 (G2), 9.9 (G3) y 5 % (G4).
En la Tabla 2 se presentan los datos de productividad de las 13 cepas progenie que registraron EBs >80 %, así como de sus cepas parentales. Dos de las cepas provienen del entrecruzamiento entre los parentales IE-115 e IE-717 (C1 y C2), cuatro de la combinación entre IE-115 y IE-739 (C17-C19 y C21); y las 6 cepas restantes del entrecruzamiento entre IE 717 y IE-739 (Tabla 1). La mayoría de las cruzas presentaron valores de productividad superiores al menos de uno de sus parentales, con excepción de la cruza C37 que alcanzó una EB de 147.5 %, el valor promedio más alto en este estudio. Las cruzas C34 y C35 también resultaron altamente productivas, con 139 % de EBs.
Tabla 2. Productividad de las cepas parentales y las cruzas que alcanzaron las eficiencias biológicas más altas en el estudio (>80 %)
| Cepa | Primordios (días) | 1a. cosecha (días) | Cosechas | Ciclo de cultivo (días) |
EB % |
TP % |
| IE-115 | 17-201 | 21-26 | 3-4 | 48-62 | 114.8a-d2 | 2.07a-d |
| IE-717 | 24-26 | 28-32 | 1-4 | 40-68 | 102.9bcd | 1.97b-e |
| IE-739 | 26-29 | 33-35 | 3-4 | 55-68 | 91.9d | 1.65c-f |
| C1 | 26-28 | 32-34 | 2-4 | 49-69 | 98cd | 1.51def |
| C2 | 23-27 | 30-34 | 3-4 | 54-69 | 117.7a-d | 1.81cde |
| C17 | 25-26 | 30-32 | 3-4 | 50-66 | 92.7d | 1.50def |
| C18 | 23-28 | 30-34 | 3-4 | 58-66 | 100.3cd | 1.56def |
| C19 | 20-22 | 24-28 | 3-4 | 64-93 | 96.5bcd | 1.40ef |
| C21 | 20-21 | 26-27 | 3-4 | 61-83 | 131.4abc | 2.03a-d |
| C22 | 25-28 | 33-34 | 1-4 | 43-70 | 81.4d | 1.55def |
| C34 | 28-37 | 35-44 | 1-4 | 44-62 | 139.6ab | 2.46ab |
| C35 | 24-30 | 30-35 | 3-4 | 49-51 | 139.5ab | 2.59a |
| C37 | 38-39 | 42-43 | 2-4 | 57-76 | 147.5 a | 2.19abc |
| C40 | 41-56 | 47-66 | 3 | 63-81 | 82.9d | 1.12f |
| C42 | 30-32 | 35-37 | 3-4 | 56-79 | 85.8d | 1.15f |
| C46 | 41-47 | 47-54 | 3 | 63-75 | 83.8d | 1.13f |
1Promedio de 10 réplicas.
2Resultados en una columna con al menos una misma letra indica que no hubo diferencias significativas entre los valores, de acuerdo con la prueba de intervalos múltiples de Tukey (p=0.05).
Los tiempos requeridos por los parentales para presentar los primordios variaron entre 17 (IE-115) hasta 26 d (IE-739) y la primera cosecha a partir del día 21 (IE-115) y hasta el día 33 (IE-739). Se evaluó entre 1 (IE-717) a 4 cosechas en ciclos de cultivo de 40 hasta 68 d (Tabla 2). En cuanto a las cepas progenie, los primeros primordios se observaron a partir del día 20 (C19 y C20) y hasta el día 41 (C40 y C46). En las cepas progenie se evaluaron de 1 a 4 cosechas, en ciclos de cultivo entre 43 y 93 d (Tabla 2). Aunque existió una variabilidad alta en los parámetros de cultivo evaluados, los resultados son similares y/o superiores a los reportados en trabajos previos de P. pulmonarius cultivado en diferentes sustratos (Salmones y Durán Barradas, 2001; Philippoussis et al., 2001; Gaitán-Hernández et al., 2009; Nyochembeng et al., 2008; Gupta et al., 2011; Adebayo et al., 2013; Abdulgani et al., 2017).
La mayoría de los especímenes cosechados correspondieron por su tamaño al grupo G1, con excepción de las cruzas C40 y C46 que presentaron una mayor producción de fructificaciones de G2 y G3 (Figura 3). Entre los parentales se distinguió el porcentaje de basidiomas desarrollados por IE-717 e IE-739, que correspondieron al 13.5 y 15.5 % (G3), y 9.8 y 5.1 % (G4) respectivamente de la producción total.
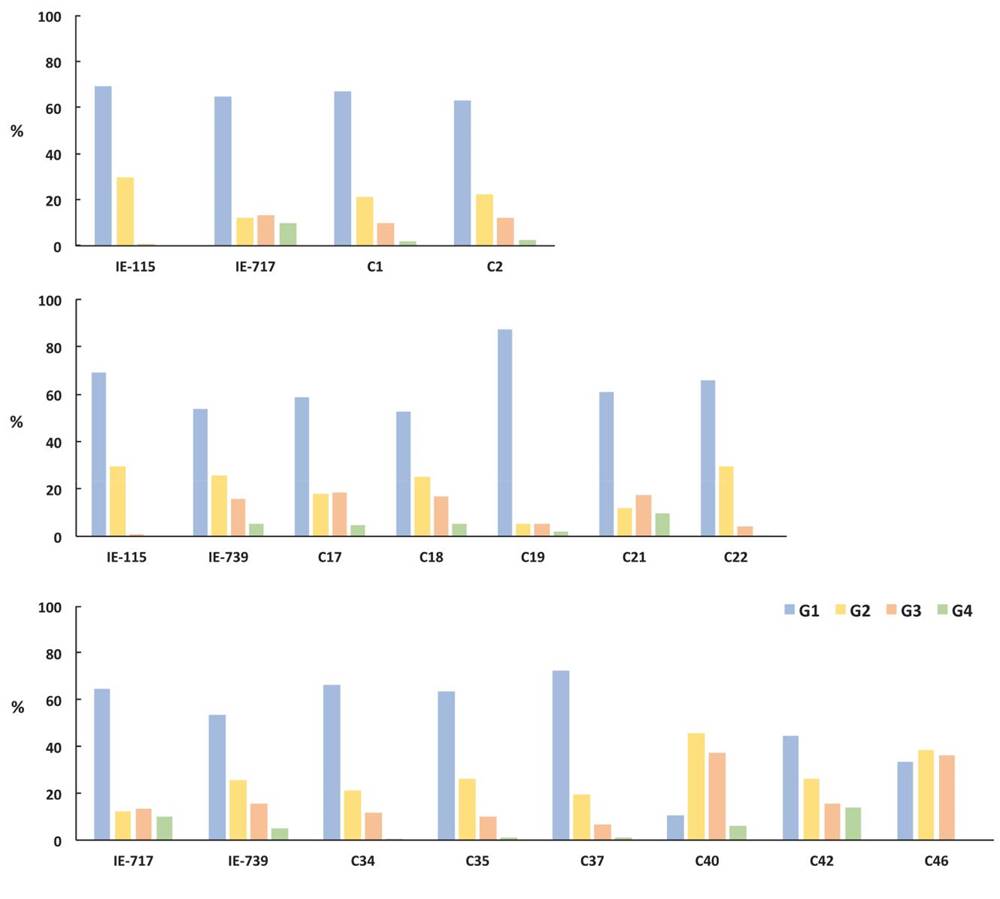
Figura 3. Porcentaje de basidiomas desarrollados por las cepas parentales y sus cruzas cultivadas en paja de cebada, agrupadas de acuerdo con el tamaño del píleo, (G1) hasta 5 cm, (G2) de 5.1 a 10 cm, (G3) 10.1 a 15 cm y grupo 4 (G4) <15 cm.
En cuanto a la progenie, las dos cepas resultantes de las combinaciones entre IE-115 e IE-717 no mostraron incremento en el tamaño de las fructificaciones con relación a sus parentales, ya que mantuvieron un alto porcentaje de G1 e incluso menor del G4 que IE-717. En cuanto a la descendencia de IE-115 e IE-739, destaca la producción de las cruzas C17, C18 y C21 que, con porcentajes promedio de 18.4, 17.1 y 17.2 % para el grupo 3, superaron los valores de sus parentales de 0.9 % (IE-115) y 15.5 % (IE-739). En cuanto a G4, sólo las cepas C18 (5.4 %), C21 (9.7 %) e IE-739 (5.1 %) lograron desarrollar basidiomas con píleos mayores a 15 cm de diámetro.
Con respecto a las combinaciones de la progenie de IE-717 e IE-739, destacan las cepas C40, C42 y C46 que presentaron un equilibrio entre los porcentajes de los grupos, especialmente la C42 logró un alto porcentaje de G4, se asume heredada de su parental IE-717. Con excepción de IE-115 que no produjo fructificaciones con píleo mayor a 15 cm de Ø, las otras dos cepas parentales fueron altamente productivas con basidiomas G3 y G4, que correspondieron al 23.3 (IE-717) y 20.6 % (IE-739) de la producción total. Estos valores son equiparables (Salmones y Durán Barradas, 2001) y superiores a estudios previos (Gaitán-Hernández et al., 2009).
En la Figura 4 se observa la distribución de las fructificaciones durante las cosechas, una característica de interés para los productores porque está relacionada con la factibilidad de incrementar el número de ciclos de cultivo por área de producción. Para las cruzas C1 y C2, las primeras dos cosechas correspondieron al 88.1 y 85.1 % de la producción total, valor similar al 89.2 % de su parental IE-115, aunque más bajo al 99.2 % registrado por IE-717. En cuanto a la progenie de la combinación IE-115 × IE-739, sólo las cruzas C19 (83.6 %) y C22 (95.2 %) lograron porcentajes mayores al promedio de 79.9 % registrado por IE-739, aunque ninguna cruza superó el 89.2 % del parental IE-115. De las cruzas resultantes de IE-717 × IE-739, sólo tres cepas, C34 (87.5 %), C35 (89.3 %) y C37 (92.1 %), superaron los porcentajes de uno de sus parentales (IE-739), sin que ninguna lograra superar el 99.2 % registrado por IE-717.
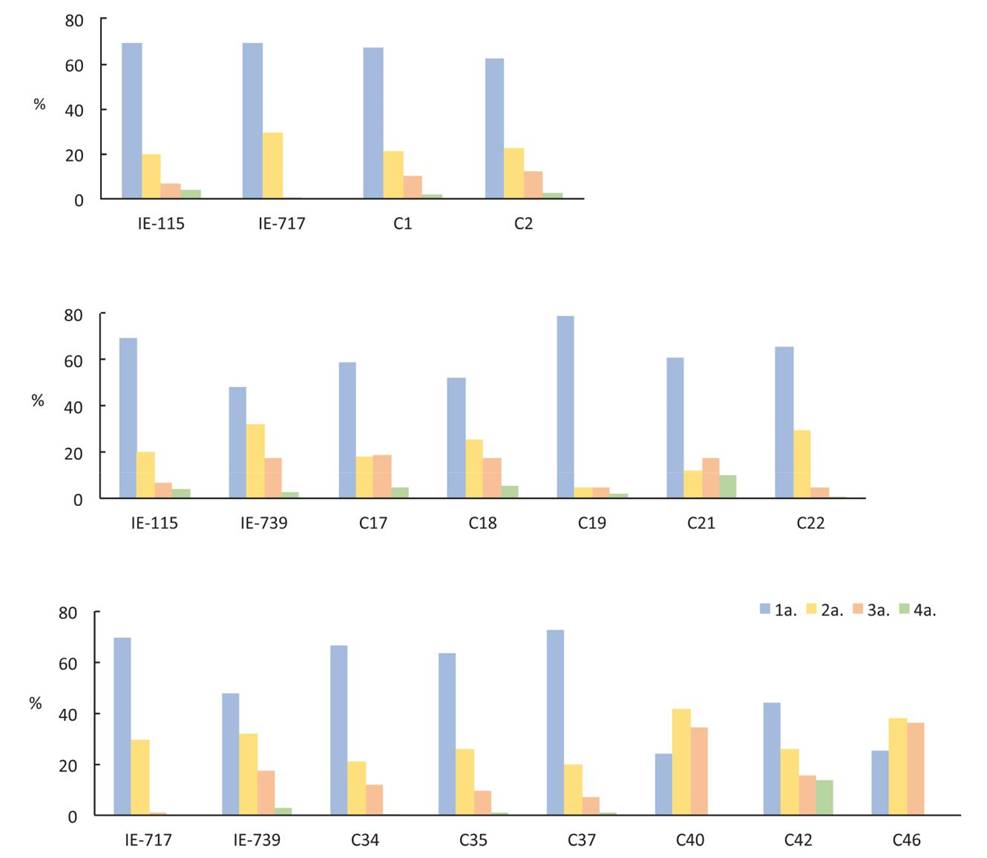
Figura 4. Distribución de la producción de basidiomas desarrollados por las cepas parentales y sus cruzas en las diferentes cosechas evaluadas.
Es importante destacar que las condiciones ambientales pudieron influir en el desarrollo y productividad de las cepas. Por el número de cruzas obtenidas y las limitaciones de espacio para la experimentación, el proceso de cultivo duró aproximadamente dos años, durante este periodo se trató de mantener estable la temperatura ambiental en el área de producción, lo que resultó complicado especialmente durante los meses calurosos, parámetro que influyó negativamente en el comportamiento de las cepas, al retrasar la inducción de los primordios y consecuentemente, en los ciclos de cultivo.
En cuanto a las características productivas de las cepas progenie y a pesar de lo azaroso del proceso, se lograron resultados satisfactorios, ya que el 25 % del germoplasma obtenido alcanzó altos valores de eficiencia biológica y tasa de producción, que superó el 100 % de EB y el 2 % de TP, características de interés para el sector productivo, ya que representa incrementar sus ingresos al tener la factibilidad de aumentar el número de ciclos de cultivo en una misma área de producción.











 nova página do texto(beta)
nova página do texto(beta)



