Introducción
El control de insectos plaga en la agricultura se ha basado principalmente en el uso de plaguicidas (Ferron y Deguine, 2005), los cuales han mostrado un favorable impacto en reducir pérdidas en cosechas; sin embargo, en forma paralela también han causado efectos adversos en la calidad del ambiente, la biodiversidad, la salud humana, costos de producción, desarrollo de resistencia en las plagas y surgimiento de plagas secundarias, entre otros (Kibria, 2016; Bale et al., 2007). Por lo anterior, el control biológico se considera un componente importante en la sustentabilidad de la agricultura para el control de plagas, ya que minimiza el uso y los efectos desfavorables de plaguicidas (Tracy, 2014); además tiene la capacidad de darle sostenibilidad a la agricultura a largo plazo al reducir insumos no renovables y ser amigable con el ambiente (Pretty, 2007).
En el control biológico se utilizan enemigos naturales para reducir las poblaciones de las plagas; entre estos organismos benéficos se encuentran los hongos entomopatógenos de los cuales se han registrado cerca de 750 especies que atacan a artrópodos, siendo los más comúnmente utilizados Beauveria bassiana (Bals.-Criv.) Vuill., Metarhizium anisopliae (Metschn.) Sorokin y Cordyceps fumosorosea (Wize) Kepler, B. Shesthra & Spatafora (como Isaria fumosorosea) (Maina et al., 2018). Para considerar a los hongos entomopatógenos como agentes potenciales de uso, éstos deben de presentar características importantes adicionales al nivel de patogenicidad como crecimiento rápido, producción abundante de conidios para utilizarse como inóculo y germinar rápidamente para iniciar el proceso de infección en el hospedero (Hassan et al., 1989; Jackson et al., 2010).
El hongo entomopatógeno Hirsutella citriformis Speare ha sido considerado como un agente potencial de biocontrol de Diaphorina citri Kuwayama (Hemiptera: Liviidae) debido a la capacidad mostrada en campo de causar epizootias naturales (Aubert 1987; Subandiyah et al., 2000; López-Arroyo et al., 2009). Sin embargo, este hongo cuenta con características como crecimiento micelial lento, producción reducida de conidios con germinación lenta. Lo anterior coloca a H. citriformis en desventaja respecto a otros hongos entomopatógenos para realizar estudios dirigidos al control biológico de D. citri (Subandiyah et al., 2000), que transmite especies de la bacteria Candidatus Liberibacter, asociadas a la enfermedad letal de los cítricos conocida comúnmente como Huanglongbing (Bové, 2006).
Meyer et al. (2007) sugirieron que es necesario investigar nuevos medios de cultivo para mejorar la esporulación de este entomopatógeno debido a la escasa producción de conidios en el medio rico en carbohidratos SDA, enriquecido con extracto de levadura como fuente de proteína, así como en granos de arroz. Medios líquidos (Romero-Rangel et al., 2012) y sólidos (Leal-López et al., 2010) a base de vegetales han mostrado resultados promisorios con producción elevada de blastosporas o conidios. Pérez-González et al. (2015a) y Orduño-Cruz et al. (2015 a) observaron que diferentes medios de cultivo sintéticos y condiciones de cultivo afectan el crecimiento y la esporulación de H. citriformis. Sin embargo, la cantidad de conidios producidos por este entomopatógeno aún se mantiene baja con un tiempo de esporulación prolongado.
Diversos sustratos a base de productos y desechos vegetales consistentes de granos, paja, bagazo, jugos e infusiones han sido evaluados para la producción en masa de hongos entomopatógenos (Ramanuj, 2015; Sahayaraj y Namasivayam, 2008); no obstante, se desconoce la capacidad de producción de conidios de H. citriformis sobre la mayoría de estos sustratos o en combinación con medios sintéticos. Factores como surfactantes (Mwamburi et al., 2015) y fuentes de carbón y nitrógeno (Mustafa y Kaur, 2009) pueden influir en la germinación de conidios de hongos entomopatógenos. Se ha documentado que suspensiones líquidas en agua o agua más Tween 80 reducen significativamente la germinación de conidios de H. citriformis depositados en SDA y que esta respuesta posiblemente se debe a la disolución de la capa mucilaginosa que rodea los conidios de este entomopatógeno (Casique-Valdez et al., 2011; Orduño-Cruz et al., 2015b).
En esta investigación se evaluó el crecimiento y la capacidad de producción de conidios de H. citriformis en distintas fuentes de proteína vegetal o animal y medios sintéticos, solas o en combinación, y la capacidad de germinación de conidios de este hongo en agua o en combinación con fuentes de proteína, NaNO3 y surfactantes.
Materiales y Métodos
Cepa
Se evaluó la cepa INIFAP-Hir-2 aislada de Yucatán, México, con la cual se han realizado diversas investigaciones (Pérez-González et al., 2015a,b; Romero-Rangel et al., 2012) y la secuencia de sus regiones ITS (accesión KC911855) y gen 28S (KC911848) se encuentran depositadas en el National Center for Biotechnology Information (NCBI; www.ncbi.nlm.nih.gov; Pérez-González et al., 2015b). Esta cepa ha demostrado elevados porcentajes de mortalidad en un estudio de semicampo (Pérez-González et al., 2016) y se conserva en el Campo Experimental General Terán del Instituto Nacional de Investigaciones Forestales, Agrícolas y Pecuarias (INIFAP).
Crecimiento y esporulación en granos con agar y medios sintéticos
Se utilizaron dos medios a base de granos ricos en proteína, soya y quínoa, y se comparó el crecimiento y la capacidad de producción de conidios con los medios comerciales PDA (DIFCO) y SDA (DIFCO). El medio a base de soya se elaboró con la cocción de 20 g de grano en agua por seis horas, se conservó en refrigeración hasta el día siguiente y se licuó; enseguida se aforó a 1 L de agua y se le agregó 20 g de agar. El medio de quínoa se elaboró mediante cocción de 20 g de granos en agua por 1 h, se conservó en refrigeración hasta el día siguiente y se licuó; posteriormente se aforó a 1 L de agua y se le agregó 20 g de agar.
Los medios PDA y SDA se elaboraron conforme a las instrucciones de cada producto. Los medios se esterilizaron, se vertieron en cajas Petri de 90 × 15 mm y se inocularon con un disco de 0.8 cm de diámetro de colonia de H. citriformis de 30 d de edad crecidas en PDA. Cuatro cajas Petri (repeticiones) se establecieron por cada medio de cultivo (tratamientos) y se mantuvieron a 25 °C. A los 22 d se determinó el diámetro de los micelios y se extrajeron de la periferia de los mismos dos discos de 0.8 cm de diámetro (1 cm2; Figura 1), se colocaron en un tubo con 2 mL de agua estéril y se agitaron cuidadosamente para estimar el número de conidios con un hematocitómetro.

Figura 1 Crecimiento de Hirsutella citriformis en Sabouraud dextrosa agar (A), papa dextrosa agar (B), a base de soya (C) y a base de quínoa (D) a los 22 días postinoculación. Las perforaciones en las colonias corresponden a los discos de 0.8 cm de diámetro extraídos para el conteo de conidios. Observe el diámetro del micelio en cada medio de cultivo.
Esporulación en infusiones y combinación con medios sintéticos
Se determinó la producción de conidios de H. citriformis en seis medios de cultivo: 1) a base de lenteja (Lens culinaris Medik.), 2) a base de atún comercial enlatado (Tuny®; atún aleta amarilla en agua), 3) PDA en infusión de quínoa, 4) PDA al 50 % en infusión de quínoa, 5) SDA en infusión de quínoa y 6) SDA (testigo). El medio a base de lenteja se elaboró cociendo 100 g de grano en agua por 1 h, se licuó, filtró por doble tela, aforó a 1 L y se agregó 17 g de agar. El medio de atún se elaboró con una lata de 140 g, se hirvió en agua por 10 min, se filtró, aforó a 1 L y se le agregó 17 g de agar. El PDA se elaboró con 39 g del producto con 1 L de infusión de quínoa preparada el mismo día, hirviendo 20 g por 20 min y filtrada por doble capa de tela.
El medio de 50 % de PDA se elaboró con 19.5 g del producto y 1 L de infusión de quínoa filtrada, adicionado con 9 g de agar. El medio de SDA con quínoa se elaboró con 65 g del producto en un litro de infusión de quínoa filtrada. El medio de SDA se preparó conforme a las instrucciones del producto. Tres series de tres cajas Petri (repeticiones) de cada medio de cultivo se inocularon con 50 µL de una suspensión de 106 conidios mL-1 y se incubaron a 26 °C. Se determinó la producción de conidios a los 18, 25 y 32 d de incubación (una serie de cajas inoculadas para cada tiempo) de manera similar como se describió previamente (Pérez-González et al., 2015a, Chan-Cupul et al., 2010). Se agregaron 5 mL de agua estéril a cada caja Petri, se raspó la superficie con un asa de vidrio y se colectó y determinó el volumen obtenido. A partir de las suspensiones se realizó un conteo en el hematocitómetro y se estimó la cantidad de conidios por caja Petri.
Germinación de conidios en agua
Se determinó la capacidad de germinación de conidios de H. citriformis en agua común (pozo del municipio de General Terán, Nuevo León, México) y agua purificada (adquirida en Montemorelos, Nuevo León, México). Ambos tipos de agua (tratamientos) se esterilizaron por filtración (filtros de 0.2 µm) y a 2 mL de cada uno se le incorporaron dos discos de 0.8 cm de un micelio esporulado de H. citriformis de 30 d de edad crecido en PDA. Cada tratamiento consistió de cuatro repeticiones de una alícuota de 20 µL con conidios y se realizó la prueba de germinación en portaobjeto (Wood y Fisher, 2017; Chou, 1981).
Dos alícuotas (repeticiones) fueron depositadas sobre un portaobjeto estéril colocado en una caja Petri con PDA (dos cajas por tratamiento). A las 24 h se abrieron las cajas Petri para permitir el secado de las alícuotas, los portaobjetos fueron retirados de las cajas, se agregaron 40 µL de lactofenol azul de algodón sobre el sitio de las alícuotas y se cubrió con un cubreobjetos. Se registró el número de conidios germinados en los primeros 100 conidios observados al microscopio compuesto a 600 aumentos (40 × 15). Se consideró que los conidios germinaron cuando el largo del tubo germinativo fue al menos 1.5 el tamaño del ancho de los conidios.
Germinación en fuentes de proteína, nitrógeno y surfactantes
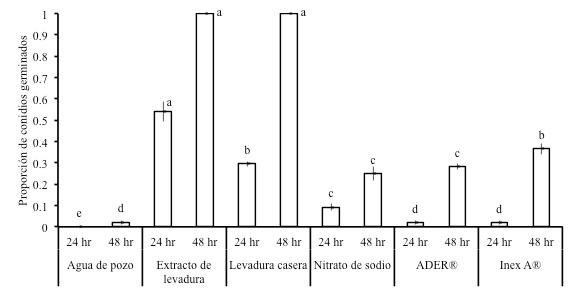
Los tratamientos para determinar el efecto sobre la germinación de conidios fueron agua (testigo), extracto de levadura (DIFCO) al 0.5 %, levadura (marca Tradi-Pan) al 0.5 % de proteína, nitrato de sodio (0.2 %) y los surfactantes ADER® (Nonil Fenol Polioxietilenico; equivalente a 318 g de i.a. L-1) (0.1 % del producto) e Inex-A® (Alcohol Graso Etoxilado y Polidimetilsiloxano; equivalentes a 20.2 y 1.0 g de i.a. L-1) (0.1 % del producto). Los tratamientos se elaboraron con agua de pozo y una vez preparados se esterilizaron por filtración como se mencionó anteriormente. A 2 mL de cada tratamiento se le incorporaron cuatro discos de 0.8 cm de diámetro de una colonia esporulada de H. citriformis de 30 d de edad crecida en PDA. Se elaboraron dos series de cada tratamiento, cada uno consistiendo de cuatro repeticiones de una alícuota de 20 µL con conidios de H. citriformis. La deposición de las alícuotas y las condiciones del experimento se mantuvieron como en el estudio anterior, usando la prueba de germinación en portaobjeto. Una serie de tratamientos se evaluó a las 24 h y el otro a las 48 h de establecidos. Se registró el número de conidios germinados como se describió anteriormente; excepto que en los tratamientos a base de levadura en el registro a las 48 h, el porcentaje de germinación fue considerado de 100 % debido al abundante crecimiento micelial que impidió contabilizar.
Germinación en concentraciones de extracto de levadura
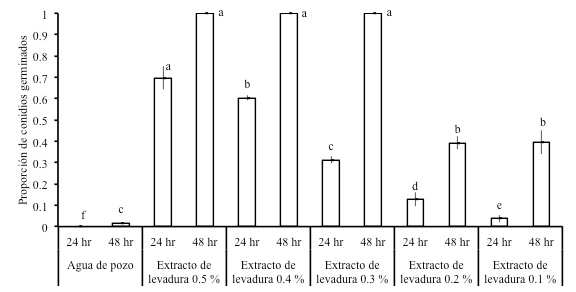
En este experimento se evaluaron seis concentraciones de extracto de levadura sobre la germinación de conidios de H. citriformis. Las concentraciones evaluadas fueron 0.5, 0.4, 0.3, 0.2, 0.1 y 0.0 (testigo) % de extracto de levadura preparadas con agua de pozo y se esterilizaron por filtración. Se elaboraron dos series de cada tratamiento, cada uno consistió de cuatro alícuotas (repeticiones). En este experimento se elaboró una suspensión de conidios de 7.62 × 106 mL-1, a partir de la cual se colocaron dos alícuotas de 2 µL sobre portaobjetos como se describió anteriormente. Sobre cada alícuota de conidios se depositaron 20 µL de cada concentración de levadura a evaluar. Una serie de tratamientos se evaluó a las 24 h y la otra a las 48 h de establecidos; se determinó el número de conidios germinados a partir de los primeros 100 conidios observados. A las 48 h los conidios germinados a las concentraciones de 100, 80 y 60 % de extracto de levadura, para fines de análisis se consideraron con 100 % de germinación, debido al abundante crecimiento micelial que impidió contabilizar.
Análisis de datos
Los experimentos se establecieron en un diseño completamente al azar considerando que los tratamientos fue la única fuente de variación y las repeticiones se distribuyeron al azar. Se realizaron pruebas de normalidad para cada experimento, con excepción del experimento de germinación en agua, en el programa SPSS (versión 24). Para el análisis de producción de conidios los datos fueron transformados a logaritmos base 10. Con los datos de conidios germinados se obtuvo la proporción de éstos y se transformaron al arcoseno de la raíz cuadrada de cada valor. Los valores transformados se sometieron a análisis estadísticos con el Programa de Diseños Experimentales (versión 1.6), de la Facultad de Agronomía de la Universidad Autónoma de Nuevo León (Olivares, 2015). Se realizaron pruebas de Tukey (p = 0.05) entre las medias de los tratamientos cuando fue pertinente.
RESULTADOS
Crecimiento y esporulación en granos con agar y medios sintéticos
El crecimiento micelial y la producción de conidios de H. citriformis varió significativamente entre los medios de cultivo (Tukey, p = 0.05), con un coeficiente de variación (CV) de 7.96 y 4.11 respectivamente. El mayor crecimiento ocurrió en PDA (5.9 cm) y SDA (5.4 cm) respecto a quínoa (3.3 cm) y soya (2.1 cm) (Figura 2); mientras que, en los discos de colonia (1 cm2) extraídos de colonias de 22 d de edad, la mayor producción de conidios (Figura 3) fue notable en quínoa (1,095,000), seguido de PDA (315,000), SDA (50,000) y soya (40,000).
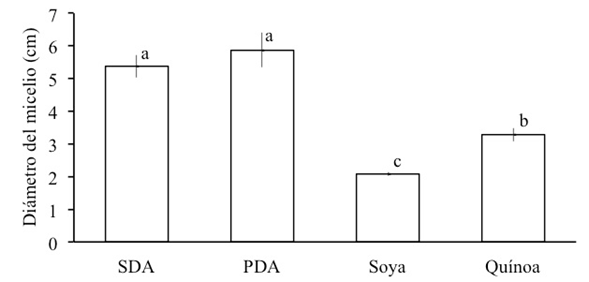
Figura 2 Diámetro promedio de los micelios de Hirsutella citriformis en cuatro medios de cultivo a los 22 días de edad, inoculados con un disco de micelio. Tratamientos con misma letra no difieren estadísticamente (Tukey, p = 0.05). SDA = Sabouraud dextrosa agar, PDA = papa dextrosa agar.
Esporulación en infusiones y en combinación con medios sintéticos
La producción de conidios varió significativamente entre los seis medios de cultivo en los tres tiempos de incubación (Tukey, p = 0.05). El medio 50 % de PDA con infusión de quínoa sobresalió en la producción de conidios en los tres tiempos de incubación y el medio de atún produjo la menor cantidad (Tabla 1).
Tabla 1 Producción de conidios (× 108; ±DS) de Hirsutella citriformis en cajas Petri con medios de cultivo en tres fechas de evaluación.
| Tratamiento | Días de incubación | ||
|---|---|---|---|
| 18 | 25 | 32 | |
| Papa dextrosa agar 50 % +quínoa | 0.7535 ± 0.20 a* | 0.5894 ± 0.23 a | 1.15 ± 0.208 a |
| Papa dextrosa agar 100 % + quínoa | 0.0420 ± 0.03 b | 0.0123 ± 0.00 b | 0.5898 ± 0.10 b |
| Sabouraud dextrosa agar + quínoa | 0.0074 ± 0.00 b c | 0.2601 ± 0.05 a | 0.2591 ± 0.02 c |
| Sabouraud dextrosa agar | 0.0119 ± 0.00 b c | 0.0051 ± 0.00 c | 0.0082 ± 0.00 d |
| Lenteja | 0.0095 ± 0.00 b c | 0.0086 ± 0.00 b c | 0.0134 ± 0.00 d |
| Atún | 0.0006 ± 0.00 c | 0.0002 ± 0.00 d | 0.0004 ± 0.00 e |
| C.V. | 3.98 | 2.17 | 1.5 |
* Promedios de tratamientos con misma letra en cada columna, no difieren estadísticamente (Tukey, p = 0.05).
Germinación en agua
El promedio de la germinación de conidios en agua purificada y en agua de pozo a las 24 h fue del orden del 0.0 y 0.5 % respectivamente y se omitió el análisis estadístico.
Germinación en fuentes de nitrógeno y surfactantes
El promedio de la germinación de conidios a las 24 y 48 h de evaluación varió entre tratamientos (p = 0.05; Figura 4), con un CV = 8.61 y 2.97 respectivamente. Los tratamientos a base de extracto de levadura sobresalieron desde las 24 h, mientras que los conidios en agua mostraron la más baja germinación en ambos tiempos de manera similar al experimento anterior. Tanto los surfactantes como el nitrato de sodio mostraron valores intermedios de germinación.
Germinación en concentraciones de extracto de levadura
Las concentraciones de extracto de levadura mostraron diferencias en el promedio de germinación de conidios (p = 0.05) a las 24 (CV = 7.43) y 48 h (CV = 2.76) de evaluación (Figura 5). El testigo en agua (0.0 % de extracto de levadura) mostró las menores proporciones de conidios germinados en ambos tiempos. A las 24 h es notoria una disminución de la germinación en la medida en que la concentración de extracto de levadura disminuye, mientras que a las 48 h el crecimiento micelial de los conidios germinados fue abundante en las tres concentraciones mayores de extracto de levadura.
DISCUSIÓN
En el control biológico de plagas por hongos entomopatógenos, estos tienen la ventaja de ser altamente específicos contra plagas blanco, no dañan el ambiente, son inocuos a animales y el hombre, y pueden persistir en los cultivos, entre otras (Sharma et al., 2013; Khan et al., 2012); sin embargo, cualquier avance en las estrategias de producción e infección que se puedan lograr, debe favorecer su utilización contra las plagas. Los resultados de esta investigación demuestran que la producción de conidios de H. citriformis se incrementa de manera abundante en un tiempo corto, mediante el uso de granos de quínoa con agar (22 d) y de la infusión en combinación con el medio PDA (32 d), respecto al resto de tratamientos.
En el medio de PDA enriquecido con extracto de levadura (0.5 %), la cepa INIFAP-Hir-2 de H. citriformis utilizada en esta investigación, alcanzó una producción de conidios cercana a 1.63 × 108 por caja Petri en 34 d (Pérez-González et al., 2015a), mientras que en nuestro estudio en PDA al 50 % enriquecido con quínoa se produjo 1.15 × 108 por caja Petri en 32 d (Tabla 1). Se ha reportado hasta una producción cercana a los 70 millones de conidios por cm2 de caja Petri (39.72 × 108 por caja Petri de 90 mm de diámetro) en el medio SDA enriquecido con 3 % de extracto de levadura (Orduño-Cruz et al., 2015a), después de 40 d de incubación a 25 °C, lo cual se considera sobrestimado.
El uso de extracto de levadura en medios de cultivo debe incrementar el costo para enriquecer 1 L de medio de cultivo en comparación con el uso de 20 g de grano de quínoa con PDA al 50 %. Los medios de cultivo PDA y SDA son una fuente rica de carbohidratos, que por sí solos son incapaces de incrementar la producción de conidios respecto al enriquecimiento de éstos con quínoa. Los granos de esta especie de Amaranthaceae sobresalen por su porcentaje de proteína, balance de aminoácidos, minerales, vitaminas y aceite respecto a granos como arroz, sorgo y otros (Abugoch, 2009), y contienen lisina, como también hierro, potasio y vitaminas B2, B5 y E (Padrón et al., 2014). Por lo que es necesario determinar el o los compuestos específicos que puedan explicar la sobresaliente producción de conidios de H. citriformis en el medio a base de esta semilla.
La germinación de conidios de hongos entomopatógenos es un evento importante en el proceso de infección durante la interacción con sus hospederos (Castrillo et al., 2005), por lo que es necesario identificar factores que la favorezcan. En esta investigación se utilizó agua de pozo, comúnmente utilizada en la agricultura para la aplicación de diversos productos, incluyendo micoplaguicidas, con el propósito de determinar su efecto sobre la germinación de conidios de H. citriformis y se contrastó con agua purificada adquirida de la misma región. Ambos tipos de agua fueron incapaces de lograr una germinación mayor al 1 % a las 24 h, lo que está acorde con resultados obtenidos previamente (Orduño-Cruz et al., 2015a) y posiblemente explica la escasa mortalidad de insectos y su micosamiento en bioensayos diversos (no publicados) al aplicar conidios por aspersión en agua.
Al utilizar dos fuentes naturales de proteína, NaNO3 y dos surfactantes con el agua de pozo, la germinación de conidios con extracto de levadura alcanzó el 54 % a las 24 h, un valor por encima de lo observado previamente (Orduño-Cruz et al., 2015b). En la medida en que se disminuyó la concentración de extracto de levadura, los valores de germinación mostraron una reducción gradual a las 24 h, lo que demuestra su importancia en la función en este proceso. Además, este producto también favoreció el abundante crecimiento micelial a las 48 h. Es conocido que distintos nutrientes influyen diferencialmente sobre la germinación de conidios de hongos entomopatógenos (Francisco et al., 2006), así como el estado de hidratación de los conidios (Dillon y Charnley, 1990; Lopes et al., 2013). En esta investigación se demostró que el extracto de levadura en solución, fuente rica en proteína, incrementa la germinación de conidios de H. citriformis y favorece el crecimiento micelial de conidios germinados respecto al uso de agua solamente, lo cual podría incrementar la capacidad de infectar al huésped y causar mayor mortalidad, y convertir a esta especie de hongo en un agente de control biológico de D. citri más efectivo.
Tanto la combinación de quínoa con otros medios de cultivo u otros nutrientes en la producción temprana y abundante de conidios, así como la función del extracto de levadura en la germinación de otros hongos entomopatógenos, deben evaluarse. Además, es importante considerar otras fuentes de nitrógeno sobre la germinación de conidios de entomopatógenos y su función en el desarrollo de infecciones en sus hospederos. En esta investigación se demostró que la capacidad de producción de conidios por H. citriformis y la germinación de sus conidios puede incrementarse con el uso de quínoa y extracto de levadura respectivamente, y favorecer el uso de este entomopatógeno en nuevas investigaciones dirigidas al control biológico de D. citri.











 nueva página del texto (beta)
nueva página del texto (beta)