Introducción
En la actualidad, una de las alternativas más utilizadas para el control de insectos plaga es el uso de insecticidas químicos, que si bien suelen ser bastante eficaces para controlar las poblaciones de plagas, también generan múltiples problemas debido a que son contaminantes de suelos y aguas, además de ser tóxicos para muchos organismos, incluyendo al hombre. Aunado a ello, los organismos plaga que controlan llegan a generar resistencia fisiológica. También es importante considerar que no son específicos, por lo que pueden afectar a los insectos benéficos y alterar el equilibrio químico del subsuelo, provocando cambios en las poblaciones de microorganismos que lo habitan y que muchas veces tienen relación directa con el bienestar de los cultivos, por lo que se ha llegado a la prohibición de varios de estos productos (Bale et al., 2008; Lu et al., 2014).
Por lo anterior, se han buscado nuevos métodos que ayuden a controlar las poblaciones de plagas y atenúen la contaminación por compuestos químicos, siendo en la actualidad el control biológico una de las soluciones más exitosas; este método consiste en el uso de uno o más enemigos naturales, o sus metabolitos, para reducir la densidad poblacional de un organismo que causa daño al hombre y/o sus productos, es decir, el combate en contra de un organismo mediante el uso de otro (Bale et al., 2008; Degenkolb y Vilcinskas, 2016).
Para implementar buenas prácticas de control biológico, es necesario la búsqueda de cepas de entomopatógenos nativos de la región donde se requiere aplicar un programa de biocontrol, con la finalidad de asegurar su éxito, ya que estos organismos están adaptados a las condiciones climáticas locales y mantienen una interacción constante con las plagas de los cultivos, por lo que es de esperar una mayor eficacia en su actividad biocontroladora; además, no alteran la microbiota del subsuelo ni la red de interacciones bióticas (Bardin et al., 2015). Para identificar los agentes de control biológico es necesario analizar cadáveres de insectos plaga para aislar e identificar los hongos entomopatógenos asociados, siendo las especies del orden Enthomophthorales, y de los géneros Metarhizium y Beauveria los de mayor relevancia (Shah y Pell, 2003).
Existen diferentes interacciones entre los insectos y los hongos; en el caso de algunas especies de los géneros Ophiostoma, Grosmannia y Ceratocystis por parte de Dendroctonus (Adams y Six, 2007; Six et al., 2011; Addison, 2014), el insecto puede aprovechar el micelio de los hongos como alimento en cierta etapa de su ciclo de vida, mientras que el hongo causa un daño significativo en los árboles a donde es transportado por el insecto, de tal manera que éste último funciona también como un vector. En otras interacciones, los hongos fungen como comensales, ayudando al huésped en la digestión, el ejemplo más estudiado de este tipo de relación se presenta en la división Neocallimastigomycota, los cuales son micromicetos anaerobios que se encuentran en el tracto digestivo de herbívoros (Griffith et al., 2010).
Recientemente, se ha descrito que algunos hongos fitopatógenos presentes en el intestino de los insectos, usan a éste como un vector (Willsey et al., 2017). En el caso de las especies del género Fusarium, como F. oxysporum y F. avenaceum, tienen como vectores a diversos dípteros (Gillespie y Menzies, 1993; El-Hamalawi y Stanghellini, 2005; Scarlett et al., 2014).
El objetivo de este trabajo fue aislar e identificar cepas nativas de hongos asociados a cadáveres de insectos plaga, con la finalidad de conocer organismos que pueden estar actuando de forma natural en los cultivos agrícolas y, por lo tanto, puedan tener mayor potencial para implementar estrategias futuras de control biológico que permitan reducir el uso de insecticidas químicos. Además de generar información que permita comprender otras implicaciones ecológicas de los insectos plaga, más que su potencial destructivo en los cultivos.
Materiales y Métodos
Colecta de muestras
Se colectaron cadáveres de insectos plaga en los municipios Jalpan de Serra, Pedro Escobedo y Colón del estado de Querétaro, principalmente en cultivos de maíz que mostraban síntomas de infección por hongos entomopatógenos. Cada individuo colectado se colocó en un contenedor individual de vidrio con tapa, registrándose la localidad, fecha de colecta, especie o grupo taxonómico y coordenadas (Tabla 1).
Tabla 1 Relación de muestras, hospederos y procedencia de los hongos colectados en el estudio
| Muestra | Aislado | Hospedero | Localidad | Coordenadas |
|---|---|---|---|---|
| 002A | F. verticillioides | S. frugiperda | Pedro Escobedo | lat. 20.47599 lon. -100. 08846 |
| 002R | F. verticillioides | S. frugiperda | Pedro Escobedo | lat. 20.47599 lon. -100. 08846 |
| 15 | F. oxysporum | S. frugiperda | Pedro Escobedo | lat. 20.47599 lon. -100. 08846 |
| 0015/A | F. oxysporum | S. frugiperda | Pedro Escobedo | lat. 20.47599 lon. -100. 08846 |
| 0019 fm | F. verticillioides | S. frugiperda | Pedro Escobedo | lat. 20.47599 lon. -100. 08846 |
| 0020 D | F. verticillioides | Melanoplus spp. | El Gallo, Colón | lat. 20. 65959 lon. -100. 05398 |
| 0020 F | F. verticillioides | Melanoplus spp. | El Gallo, Colón | lat. 20. 65959 lon. -100. 05398 |
| 253-1d | F. verticillioides | Toxoptera citricida | El Lindero, Jalpan | lat. 21. 27266 lon. -99. 49452 |
| 253-3D | F. verticillioides | Toxoptera citricida | El Lindero, Jalpan | lat. 21. 27266 lon. -99. 49452 |
| CEq3 | Fusarium spp. | Melanoplus spp. | Soriano, Colón | lat. 20.779253 lon. -100.05352 |
| Eq3 | Fusarium spp. | Melanoplus spp. | Soriano, Colón | lat. 20.779253 lon. -100.05352 |
| Mg02A | F. verticillioides | S. frugiperda | Pedro Escobedo | lat. 20.47599 lon. -100. 08846 |
| 0014 f/m | P. lilacinum | Melanoplus spp. | El Gallo, Colón | lat. 20. 65959 lon. -100. 05398 |
| CB2 | B. bassiana | Melanoplus spp. | Soriano, Colón | lat. 20.779253 lon. -100.05352 |
| Chap B5 | B. bassiana | Melanoplus spp. | Soriano, Colón | lat. 20.779253 lon. -100.05352 |
| M-3 | F. incarnatum | Melanoplus spp. | El Gallo, Colón | lat. 20. 65959 lon. -100. 05398 |
| M-4 | F. verticillioides | Melanoplus spp. | El Gallo, Colón | lat. 20. 65959 lon. -100. 05398 |
| M-5 | F. verticillioides | Melanoplus spp. | El Gallo, Colón | lat. 20. 65959 lon. -100. 05398 |
Aislamiento de hongos de cadáveres de insectos plaga
Los insectos colectados se colocaron en una solución al 0.5 % de hipoclorito de sodio por 5 min, posteriormente fueron transferidos a una solución al 70 % de etanol y finalmente se lavaron tres veces con agua destilada estéril, esto con la finalidad de inactivar cualquier hongo o microorganismo que se encontrase en el tegumento del insecto, así como favorecer el crecimiento o la recuperación de los hongos que se encontraran dentro del cuerpo del insecto muerto. Los cadáveres de los insectos desinfectados se colocaron en cámaras húmedas, cuya elaboración consistió en colocar en una caja de Petri un disco de papel filtro Whatman No. 1 humedecido con una solución de agua destilada estéril y cloranfenicol (34 µg/mL). Los insectos desinfectados se incubaron a 27 °C hasta la formación de estructuras reproductivas. Los conidios se colectaron por fricción con un asa en una solución al 0.1 % de Tritón X-100. Se prepararon diluciones seriadas de 10-2, 10-4 y 10-6 conidios por mL, que se cultivaron por dispersión en medio de cultivo PDA (Bioxon) con 0.5 % de Tritón X-100 y se incubaron a 27 °C durante 3 días. Los micelios aislados se recuperaron e inocularon en medios de cultivo PDA y se incubaron a 27 °C durante diez días para producir conidios de cultivos axénicos.
Identificación taxonómica
La determinación de género y especie se realizó mediante el uso de taxonomía clásica observando la morfología de las estructuras características para cada género, como son: conidióforos, conidios, micelio y estructuras especializadas, basándonos en la clave taxonómica propuesta por Barnett y Hunter (2003). Para determinar las especies de Fusarium se usaron las claves taxononómicas propuestas por Nelson et al. (1994) y Leslie y Summerell (2006), mientras que para Beauveria se usaron las obras de Rehner et al. (2011) y Humber (1997).
Extracción y manipulación de ácidos nucleicos
Los cultivos puros de cepas aisladas se inocularon en 50 mL de medio de cultivo líquido de papa dextrosa (PDB, Bioxon), a concentración de 1x106 esporas por mL, incubándose a 27 °C en agitación orbital, durante 4-6 días. El micelio se colectó por filtración y el ADN se extrajo con el método descrito por Reader y Broda (1985). La calidad del ADN se analizó por electroforesis en gel de agarosa al 1% y cuantificó con un Nanodrop Thermo Scientific®.
Amplificación del marcador molecular
Para el análisis molecular de los hongos aislados se usaron los oligonucleótidos ITS1 (5′-TCCGTAGGTGAACCTGCGG-3′) e ITS4 (5′-TCCTCCGCTTATTGATATGC-3′), específicos para amplificar la secuencia ITS1, 5.8S e ITS2 del gen ribosomal. Las reacciones de PCR se realizaron usando 100 ng de ADN genómico y la enzima Taq DNA Polimerasa recombinante (INVITROGEN), siguiendo las indicaciones del fabricante. Las condiciones de reacción fueron: un paso inicial de desnaturalización a 95ºC por 3 min, siguiendo 40 ciclos con tres pasos de 95 ºC por 30 s, 56 ºC por 30 s y 72 ºC por 1 min. Las reacciones terminaron con una extensión final 72 ºC por 5 min. Para la secuenciación de los productos de PCR se purificaron usando columnas “QIAquick PCR purification de QIAGEN”, siguiendo las especificaciones del fabricante.
Análisis filogenético
La matriz se generó a partir de descargas de secuencias depositadas en GenBank de trabajos previos con especies de los géneros obtenidos en el presente estudio, con el propósito de construir árboles filogenéticos y determinar la posición de las muestras respecto a especies secuenciadas por otros autores. La alineación de las secuencias se llevó a cabo en el programa McClade (versión 4.08) (Maddison y Maddison, 2005). Se hizo una matriz independiente para cada uno de los géneros y, para el caso de Fusarium, sólo se usaron las secuencias que eran diferentes en al menos una base, con el propósito de evitar redundancia. Las matrices fueron analizadas en los programas PAUP 4.0b10 (Altivec) (Swofford, 2002) para el método de parsimonia, RAxML 7.2.6 (Stamatakis, 2006) para el método de máxima verosimilitud y Mr. Bayes 3.2.2 (Huelsenbeck et al., 2013) para el método bayesiano. En el programa PAUP se realizó una búsqueda heurística de 1000 réplicas para obtener el árbol más parsimonioso, usando el criterio TBR (tree-bisection-reconnection) y que las ramas colapsaran cuando el máximo de su longitud fuera cero; el soporte de las ramas se hizo mediante un análisis de bootstrap de 1000 réplicas. En el programa RAxML, para obtener el árbol con los mayores valores de verosimilitud, se corrió un análisis de 1000 réplicas, usando el modelo evolutivo GTRGAMMA, y para el soporte de las ramas se corrió un análisis de boostrap de 1000 réplicas. Finalmente, en el programa MrBayes se usó el modelo evolutivo GTR+I para obtener el árbol con las mejores probabilidades posteriores, corriendo un análisis 10,000,000 de generaciones con 4 corridas y frecuencias de muestreo de 100 generaciones, asegurando que la desviación estándar fuera inferior de 0.01, quemando el 25% de las réplicas. La revisión y edición de los árboles se realizó con los programas TreeView versión 1.6.6 (Page, 2001) y Dendroscope versión 3.4.4 (Huson y Scornavaca, 2012).
Análisis de crecimiento de los hongos
La velocidad de crecimiento se determinó cultivando los hongos en medio de cultivo PDA. Para esto, se inocularon 2 µL de esporas sobre placas de PDA que se incubaron a 27 °C en la oscuridad, durante 2 días para Fusarium y 4 días para Beauveria, generando un precultivo. Del frente de crecimiento, se cortaron discos de micelio de 0.5 cm de diámetro y se inocularon en la parte central de cajas de Petri con PDA. Los cultivos se incubaron a 27 °C hasta que las colonias alcanzaron el borde de la caja Petri y se fotografiaron usando una referencia métrica para determinar los diámetros de las colonias y el crecimiento. Los datos se analizaron estadísticamente usando las pruebas de ANOVA y la comparación de medias de Tukey.
Resultados
Diversidad de hongos asociados a insectos plaga en el estado de Querétaro
Se procesaron alrededor de 40 cadáveres de insectos plaga, la mayoría fueron colectados en la parte alta de las plantas, momificados y sujetos a los tallos (Tabla 1, Figura 1). Con pocas excepciones, los cadáveres de los insectos no mostraron crecimiento de hongos en la superficie y se tuvieron que desinfectar e incubar en cámaras húmedas para promover el desarrollo de los micelios, aislando un total de 18 cepas. Mediante claves taxonómicas se estableció que 15 aislamientos correspondían al género Fusarium, en los hospederos Melanoplus sp., Toxoptera citricida y Spodoptera frugiperda; dos aislados se adscribieron al género Beauveria y un aislado al género Purpureocillium, ambos del hospedero Melanoplus sp. (Tabla 1). Los hospederos de donde se aislaron Fusarium y Purpureocillium es un dato novedoso, ya que no suelen ser los organismos en los que comúnmente se encuentran. Debido a que los resultados indican una prevalencia alta de Fusarium (83% de incidencia) con respecto a Beauveria y Purpureocillium, sería recomendable continuar los estudios que permitan determinar si las cepas de Fusarium obtenidas en este trabajo están actuando como entomopatógenos, saprobio y/o patógeno oportunista (Tabla 1).

Figura 1 Análisis filogenético y morfológico de las cepas de Fusarium. A: Relación filogenética de los aislados de Fusarium. Los agrupamientos de las cepas se generaron por el método bayesiano donde se muestran las cepas de Fusarium formando clados con Fusarium aff. verticillioides, F. oxysporum y F. incarnatum con soporte de bootstrap de 65 o mayor. Los valores arriba de las ramas representan BP/BMV/PP donde BP, Bootstrap; BMV, Bootstrap Máxima Verosimilitud; PP, Probabilidades Posteriores. B-J: Morfología colonial (C, G y J) y las estructuras reproductivas teñidas con azul de algodón (B, D, F, H y J) se obtuvieron de cultivos crecidos en PDA durante siete días a 27°C. Las observaciones microscópicas se realizaron en un microscopio de campo claro usando el objetivo 100X.
Análisis morfológico y filogenético de las especies de Fusarium
La morfología micelial y microscópica mostró variabilidad fenotípica entre los aislados de Fusarium, como fue velocidad de crecimiento, en las tonalidades de pigmentación del micelio y en la morfología de las estructuras reproductivas y esporas, sugiriendo la presencia de más de una especie.
Para definir la identidad de las especies pertenecientes al género Fusarium se obtuvieron las secuencias del gen ribosomal ITS1, 5.8S e ITS2 y mediante el alineamiento de las secuencias se encontraron cuatro grupos con secuencias idénticas, sugiriendo la presencia de 4 especies diferentes. Las cepas Mue4, Mue5, 2A, Mg02A, 19FM, 2R, 20D, 20F, 253-3D y 253-1D conformaron el grupo 1; las cepas 15 y 15A el grupo 2; las cepas CEq3 y Eq3 el grupo 3 y la cepa Mue3 formó el grupo 4. Por lo anterior, en el análisis filogenético se usó solo una cepa de Fusarium representando cada grupo, encontrando la formación de tres clados. La cepa Mue4 del grupo 4 no se asoció a ningún clado, sin embargo, microscópicamente tiene características de F. verticillioides, motivo por el cual la referenciamos como Fusarium aff. verticillioides, debido a que no se agrupa con las secuencias descargadas de “GenBank” que corresponden a dicha especie; mientras que la cepa 15A se agrupa con F. oxysporum y la cepa Mue3 forma clado con F. incarnatum (Figura 1A). Este agrupamiento tiene soportes de bootstrap aceptables, por lo que se confirmó la identidad de las cepas. Las cepas CEq3 y Eq3 no se muestran en el árbol debido a que no se obtuvieron secuencias de buena calidad, lo que dificultó determinar su identidad mediante el análisis filogenético, sin embargo, de acuerdo a sus características morfológicas, podría tratarse de F. oxysporum. Las características morfológicas para cada especie de Fusarium identificada se describen enseguida.
Fusarium incarnatum
El micelio fue en un principio blanco y flocoso, aunque con el tiempo presentó una tonalidad color café amarillenta. Las microconidias son obovadas con ningún o un septo máximo que nacen en conidióforos ramificados que pueden ser monofialides o polifialides. Midieron entre 2-3 µm x 6-12 µm. No se observaron clamidosporas (Figura 1 B-C).
Fusarium oxysporum
Los cultivos desarrollaron micelio aéreo abundante, con consistencia parecida al fieltro y coloración blanquecina que con el tiempo adquirió una tonalidad violeta. Las macronidias se forman en conidióforos muy ramificados mientras que las microconidias son elipsoidales y unicelulares, abundantes en el micelio aéreo donde puede llegar a formar falsas cabezuelas, miden entre 6-9 µm x 2-3 µm. Se originan sobre conidióforos cortos, simples o poco ramificados y con monofiálides. Se observó la presencia de clamidosporas de pared lisa, solitarias y de crecimiento lento (Figura 1 D-G).
Fusarium aff. verticilloides
En medio de cultivo PDA los aislados presentaron tres morfologías diferentes, el primero de color crema ligeramente obscuro, con desarrollo de poco micelio aéreo, de tono blanquecino y tomentoso. El segundo fue el más frecuente, con micelio de color durazno y abundantes estructuras aéreas. El último también mostró un tono durazno y abundante micelio aéreo, desarrollando un anillo color violeta, a los 4 o 5 días de cultivado.
Los macroconidios se observaron de pared celular gruesa, en estructuras rectas o ligeramente en forma de hoz, con una curvatura característica bien marcada en la célula apical, mientras que la célula basal fue pedicelada y llegando a presentar entre 3 y 7 septos. Los macroconidióforos fueron no ramificados o monofialides ramificadas (Figura 1 H-J). Las microconidias fueron ovoides con base aplanada (si crecen en cadenas) y pueden formarse en cadenas (si las condiciones son favorables), o presentar falsas cabezuelas sobre monofiálides largas y subuladas que pueden ser simples o ramificadas. No se encontraron clamidosporas.
Las tres especies de Fusarium encontradas ya habían sido reportadas previamente como agentes de control biológico con acción entomopatógena (Kuruvilla y Jacob, 1980; Nagalingam y Jayaraj, 1986; Gopalakrishnan y Narayanan, 1989; Prakash et al., 2010; Oliveira et al., 2012; Liu et. al., 2014); aunque para el caso de F. oxysporum y F. incarnatum es el primer reporte que se tiene de asociación con cadáveres de ortópteros. La prevalencia con la que se aislaron las especies de Fusarium también es interesante, pues representan un 83% del total de cepas obtenidas (Tabla 1) y tomando en cuenta que tanto Beauveria como Purpureocillium son géneros entomopatógenos comúnmente reportados, más que Fusarium, es un dato interesante que los relaciona como agentes entomopatógenos, aunque también pueden representar una relación simbiótica vector-hospedero, sin embargo, también se los reporta como fitopatógenos e inclusive, en algunos casos como patógenos de humanos o productores de micotoxinas, por lo que también es importante considerar el impacto que pueden tener en la producción de cereales y en el sector salud si los chapulines están actuando como vectores de estos fitopatógenos (Tamburic-Ilincic y Schaafsma, 2008).
Análisis morfológico y filogenético de Purpureocillium lilacinum
La cepa obtenida de Purpureocillium presentó un micelio de color blanco y flocoso, que con el tiempo se tornó a color violeta vináceo. Los conidióforos fueron muy parecidos a los de Penicillium, verticilados, con tallos anchos de pared celular gruesa rugosa muy ramificados, con 2 a 4 fiálides simples las cuales son anchas en su base para terminar en un característico cuello muy delgado que origina conidios elipsoidales a fusiformes (a veces con apariencia de limón), hidrofóbicos, hialinos y formados en cadenas que se rompen con facilidad, aunque a veces pueden enredarse. No se observaron clamidosporas (Figura 2 A). En la Figura 2 B se muestra la filogenia obtenida para esta especie, agrupándose con cepas de P. lilacinum con soporte de bootstrap de 88 para máxima verosimilitud y 57 para probabilidades posteriores.
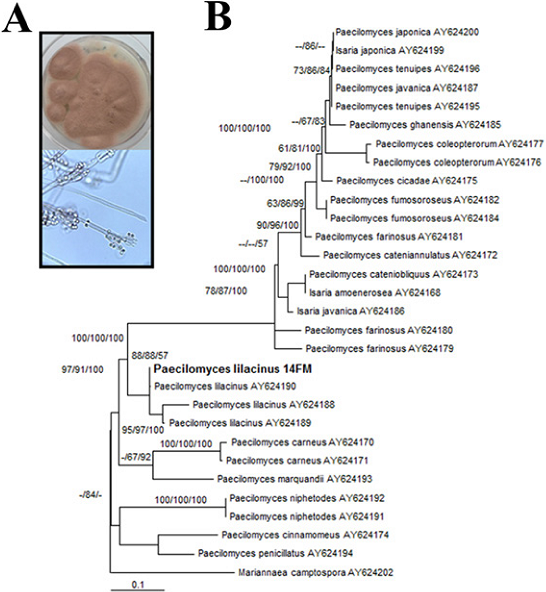
Figura 2 Identificación taxonómica y filogenética de la cepa 14 FM. A: Morfología colonial y estructuras reproductivas desarrolladas en medio de cultivo PDA incubada durante 7 días a 27°C. Las observaciones microscópicas se realizaron en un microscopio de campo claro usando el objetivo 40X. B: Filogenia molecular. Las relaciones filogenéticas que se observan mediante agrupamiento de cepas fueron generadas por el método bayesiano, donde la cepa 14 FM se agrupa con Paecilomyces lilacinus, con soporte de bootstrap de 65. Los valores arriba de las ramas representan BP/BMV/PP donde BP, Bootstrap; BMV, Bootstrap Máxima Verosimilitud; PP, Probabilidades Posteriores.
Purpureocillium lilacinum, anteriormente llamado Paecilomyces lilacinus, es también un importante agente biocontrolador, sin embargo, es más conocido como nematófago y aunque su acción como bioinsecticida ya ha sido reportada (Fiedler y Sosnowska, 2007; Martí et al., 2006), es poco usual encontrarlo actuando sobre insectos de manera natural y más aún sobre especies de ortópteros, por lo que éste es el primer reporte al respecto.
Análisis morfológico y filogenético de las especies de Beauveria bassiana
Las dos cepas aisladas presentaron diferente morfología, la cepa CB2 desarrolló un micelio de color blanco a crema, inicialmente algodonoso, que se tornó pulverulento con el tiempo debido al desarrollo de esporas y con lento crecimiento, mientras que en la cepa Chap B5 mantuvo el micelio de color blanco y algodonoso, con poca capacidad de desarrollar la textura pulverulenta, pero con un crecimiento más rápido que le permitió cubrir la superficie de la caja de Petri en pocos días (Figura 3 A-B). En ambos casos los conidios fueron unicelulares, globosos a subglobosos, hialinos y lisos, observándose su crecimiento sobre conidióforos globosos en su base que se van estrechando hacia el ápice en forma de raquis denticulado y en sucesión simpodial (Figura 3 C-D). El crecimiento en PDA mostró una marcada diferencia en el diámetro de la colonia entre ambas cepas, mientras que en la Figura 3E se muestra la filogenia para este género donde las cepas aparecen agrupadas en el clado de B. bassiana con un soporte de bootstrap de 68 para máxima verosimilitud y 96 para probabilidades posteriores por lo que coinciden la morfología y filogenia, por lo que se confirma el parentesco con la especie.

Figura 3 Análisis filogenético y morfológico de las cepas Chap B5 y CB2 de Beauveria. A-D: Morfología colonial y estructuras reproductivas. Las cepas se crecieron en PDA durante 10 días a 27 °C y las estructuras reproductivas se tiñeron con azul de algodón y se observaron usando el objetivo 4X. E: Filogenia molecular. Las relaciones filogenéticas que se observan mediante agrupamiento de cepas, fueron generadas por el método bayesiano, donde las cepas Chap B5 y CB2 formaron un clado con Beauveria bassiana, con soporte de bootstrap de 96. Los valores arriba de las ramas representan BP/BMV/PP donde BP, Bootstrap; BMV, Bootstrap Máxima Verosimilitud; PP, Probabilidades Posteriores.
Esta especie es de las más importantes a nivel mundial como agente de control biológico y su acción endófita al establecerse en la rizósfera de las plantas promueve el crecimiento al facilitar la adquisición de nutrientes (Scott y Bidochka, 2014), por lo que su presencia en el estado abre la posibilidad de su posterior uso como agente de control biológico en los campos de cultivo.
Discusión
En un estudio previo realizado en la entidad se habían identificado algunos entomopatógenos (Uribe-González y Santiago-Basilio, 2012); con este trabajo se generan importantes aportaciones sobre la presencia fúngica de P. lilacinum, F. incarnatum, F. verticilloides y F. oxysporum asociados a estos insectos plaga, constituyendo nuevos registros para el estado de Querétaro.
Con respecto a Fusarium, varias especies de este género forman complejos, por ejemplo F. verticilloides pertenece al complejo de F. fujikuroi, F. incarnatum a F. iarnatum-equiseti y F. oxysporum al complejo que lleva su nombre, por lo que la determinación de estos organismos se hace complicada usando sólo datos morfológicos, ya que la presencia de algunas estructuras, como son clamidosporas o esclerosios, dependen de las condiciones ambientales y nutricionales en que se cultivan.
El uso de la región ITS1, 5.8S e ITS2 del gen ribosomal como marcador molecular ayudó a corroborar la identidad de las especies obtenidas, acercándonos al complejo al que pertenecen, sin embargo, es necesario complementar el estudio con una filogenia elaborada a partir de diferentes regiones del ADN que son más comúnmente usadas para especies de Fusarium, como el factor de elongación alpha-1 o el gen que codifica la de β-tubulina (Watanabe et al., 2011).
Fusarium es un género cosmopolita altamente versátil que tiene la capacidad de desarrollar estructuras de resistencia para sobrevivir en ambientes adversos, así también puede sintetizar una amplia variedad de enzimas y micotoxinas que le permiten infectar una gran cantidad de organismos, por lo que puede presentarse en el ambiente como entomopatógeno, fitopatógeno, saprobio e incluso, en ocasiones especiales, como patógeno de humanos (Leslie y Summerell, 2006; Nelson et al., 1994). Esto nos hace cuestionarnos sobre el papel biológico que desempeñan estas tres especies en el ambiente, ya que varios autores han reportado que Fusarium puede controlar una amplia variedad de plagas de importancia agronómica, por ejemplo F. verticilloides se ha encontrado en ortópteros (Pelizza et al., 2011), F. incarnatum en cóccidos, áfidos, ácaros y trips (Liu et al., 2014; Nagalingam y Jayaraj, 1986) y F. oxysporum en dípteros, cóccidos y lepidópteros (Kuruvilla y Jacob, 1980; Prakash et al., 2010; Oliveira et al., 2012; Gopalakrishnan y Narayanan, 1989). Los resultados obtenidos en este trabajo, con mayor abundancia se aislaron las especies de Fusarium en comparación con otros géneros ampliamente reportados como entomopatógenos, como lo son Purpureocillium y Beauveria, apoya la existencia de un gran potencial y eficiencia como biocontrolador natural. Apoyando estos resultados recientemente se ha descrito que F. oxysporum produce beauvericina, un hexadepsipétido cíclico, con actividad insecticida que fue inicialmente identificado en B. bassiana (Zhang et al., 2016). Por otro lado, ya se ha comprobado que algunas especies de hongos de Fusarium y otros géneros pueden utilizar insectos como vectores hasta llegar a su hospedero principal (Goldberg y Stanghellini, 1990), y se sabe que estas tres especies de Fusarium identificadas en este trabajo son fitopatógenos que afectan cultivos de importancia agrícola (Tamburic-Ilincic y Schaafsma, 2008) e inclusive llegan a afectar a humanos con enfermedades inmunosupresoras (Nucci y Anaissie, 2007), por lo que la presencia del hongo en el insecto, podría ser una consecuencia de la frecuencia con que los insectos visitan los cultivos infectados.
La presencia y abundancia de las especies de Fusarium encontradas en las zonas estudiadas, coincide con las observaciones de otros autores, indicando que algunas de las especies de dicho género usan insectos como vectores para su propagación en cultivos (Gillespie y Menzies, 1993; El-Hamalawi y Stanghellini, 2005; Scarlett et al., 2014).
El caso de P. lilacinum es muy similar al de Fusarium, aunque se ha reportado principalmente como nematófago (Sharma et al., 2014) y en casos especiales infectando humanos (Gutiérrez et al., 1999; Carey et al., 2003), también se ha comprobado su gran eficiencia como entomopatógeno (Martí et al., 2006). Sin embargo, para nuestro conocimiento, es la primera vez que se aísla sobre cadáveres de Melanoplus sp., por lo que resultaría interesante demostrar si la especie es entomopatógena de este ortóptero.
Finalmente, se obtuvieron dos aislados de B. bassiana que presentaron diferencias morfológicas en su crecimiento micelial (Figura 3 A-B), mientras que la cepa CB2 presenta un crecimiento más reducido y esporas muy volátiles (se liberan con facilidad de los conidióforos), la cepa Chap B5 presenta un crecimiento acelerado y esporulación poco aparente, por lo que es importante realizar bioensayos con ambas micelios para determinar la eficiencia de ambas y comprobar si las diferencias fenotípicas tienen algún efecto en su actividad como agentes de control biológico.
Otro dato observado fue que los insectos infectados presentaron un comportamiento parecido al provocado por Ophiocordyceps spp. sobre algunas hormigas, haciéndolas apartarse de los cultivos donde se alimentan para llegar a las hierbas aledañas, donde suben a lo más alto de las ramas para finalmente morir quedando “momificadas”. La mayoría de las muestras que se analizaron en este trabajo corresponden a insectos momificados en las partes altas de hierbas, especialmente en las muestras con Fusarium spp., por lo consideramos que es un hallazgo interesante con potencial para ser tratado en estudios futuros, ya que no está reportado que Fusarium ni Purpureocillium provoquen este cambio de conducta en sus hospederos; aunque no se descarta la posibilidad de la participación de otros entomopatógenos en este comportamiento.
Conclusión
Los resultados indican que existe predominancia de especies del género Fusarium asociados a insectos plaga de importancia económica en los municipios muestreados del estado de Querétaro, con mayor prevalencia de Fusarium aff. verticillioides, sugiriendo que los insectos podrían estar actuando como vectores para distribuir estos fitopatógenos en los cultivos o como entomopatógenos en el control biológico de plagas. Por lo anterior, estos organismos deberán considerarse en futuros estudios, al igual que P. lilacinum. En cuanto a las dos especies de B. bassiana identificadas en este trabajo, se recomienda su incorporación como hongos entompatógenos en los paquetes tecnológicos del manejo integrado de plagas agrícolas para el estado de Querétaro.











 nova página do texto(beta)
nova página do texto(beta)


