Introducción
La Sigatoka Negra (SN) es la enfermedad causada por el hongo Mycosphaerella fijiensis Morelet [Ascomycota: Mycosphaerellaceae, anamorfo Pseudocercospora fijiensis (M. Morelet) Deighton], y es el principal problema fitosanitario del cultivo del banano y el plátano en América, Asia y África (Hidalgo et al., 2006). Desde su primer reporte al sur de Chiapas, en la década de los 80, M. fijiensis se ha diseminado rápidamente en casi todas las zonas productoras de banano en los últimos 15 años (Aguilar-Barragán et al., 2014). El hongo causa lesiones foliares necróticas que se expanden y destruyen los tejidos, reduciendo la capacidad fotosintética, afectando la maduración temprana del fruto y el volumen de producción (Martínez-Bolaños et al., 2012).
El manejo de la SN constituye uno de los principales rubros para la industria bananera, ya que puede alcanzar entre 27 y 50% del costo total de la producción (Sagratzki-Cavero et al., 2015). De forma tradicional, el control de la SN se apoya en un programa de manejo integrado del cultivo que considera mejorar el drenaje del suelo, una baja densidad de plantación (2000 plantas/ha), balance nutricional de N, P y K (inducción de resistencia fisiológica), control de malezas, eliminación de tejido enfermo (reducción de inóculo) y control químico. Siendo este último el más usado a pesar de ser costoso y comprometer el agroecosistema.
Algunos de los fungicidas más empleados contra M. fijiensis son mancozeb y clorotalonil (que actúan de forma preventiva), además de ingredientes sistémicos de los grupos bencimidazoles, triazoles, estrobilurinas y anilopirimidinas (Martínez-Bolaños et al., 2012).
La resistencia a fungicidas es un factor crítico que limita la eficiencia de los programas de manejo integrado de M. fijiensis, debido al incremento de dosis o frecuencias de aspersiones, principalmente a fungicidas sistémicos de los grupos bencimidazoles, triazoles y estrobilurinas (Martínez-Bolaños et al., 2012). Aunado a lo anterior, el uso de productos químicos para el manejo de SN ha ocasionado diversos problemas ecológicos. Ante esta situación, una alternativa podría consistir en el uso de propóleo como antifúngico, ya que este puede actuar de forma equilibrada y eficaz con el ambiente, debido a su origen natural (Pineda et al., 2010).
El propóleo es un conjunto de sustancias gomosas y resinosas que varía de acuerdo con su origen, y el cual se compone de resinas y bálsamos (50-55%), cera de abeja (30 a 40%), aceites esenciales o volátiles (5 a 10%), polen (5%) y otros materiales orgánicos (5%). En este producto natural se han identificado más de 240 sustancias, de las cuales 50% son compuestos fenólicos (flavonoides, ácidos aromáticos y sus ésteres, aldehídos aromáticos, cumarinas y triglicéridos fenólicos) con acción farmacológica (Shuai et al., 2014).
El propóleo, en forma de extractos etanólicos (EEP), se ha empleado de manera exitosa en estudios de inhibición in vitro de diversos hongos fitopatógenos, tales como Alternaria alternata, Fusarium oxysporium f. sp. melonis (Özcan et al., 2004), Colletotrichum gloeosporioides (Pineda et al., 2010), Didymella bryoniae, Rhizoctonia solani (Gallez et al., 2014) y Alternaria solani (Vargas-Toledo et al., 2016). Sin embargo, aún no se han explorado los extractos etanólicos de propóleo como posible alternativa de control de M. fijiensis. Por lo tanto, la hipótesis de investigación planteada fue que la concentración efectiva media (CE50) difiere entre los extractos etanólicos de propóleo. El objetivo del presente estudio fue evaluar la actividad antifúngica de tres extractos etanólicos de propóleo sobre el crecimiento in vitro de M. fijiensis aislada de una huerta de banano orgánico del estado de Colima.
Materiales y métodos
Aislamiento de Mycosphaerella fijiensis
Se tomaron muestras de tejido foliar con presencia de SN entre los grados de infección 2-5 (Rodríguez-Gaviria y Cayón, 2008), de una huerta orgánica en producción ubicado en la localidad de Armería, Colima, México (19°06'39.32" N y 103°86'46.95" O). Se cortaron fragmentos de tejido foliar de 4 × 4 cm y se desinfectaron con una solución acuosa de hipoclorito de sodio (20% v/v) y Tween 80 (500 µL/L) durante 10 min; después, el tejido se secó en papel filtro estéril (Whatman No. 1). El tejido desinfectado se depositó en cámaras húmedas (caja de Petri con papel filtro estéril húmedo) durante cinco días para inducir la conidiogénesis. Después, con una pinza estéril y en campana de flujo laminar, la superficie abaxial de los fragmentos de tejido foliar se presionaron directamente sobre agar-agua (3%) contenido en cajas de Petri, para la liberación de conidias, con una aguja subdermal en estereoscopio se tomaron las conidias y se depositaron en agar papa dextrosa (APD) suplementado con cloranfenicol (100 mg/L). Los aislados monospóricos de M. fijiensis se cultivaron a 25±2 °C con luz constante (Conde-Ferráez et al., 2008). Para los bioensayos se emplearon micelios monospóricos de 3 semanas de edad, con la finalidad de poseer colonias con características homogéneas, tales como velocidad de crecimiento e infectividad (Cortez-Madrigal et al., 2003).
Origen del propóleo
El propóleo crudo provino de dos apiarios; el primero se localizó al suroeste de Tecomán (18°51'17.45" N y 103°54'58.34" O), Colima, México (PTeco1), y el segundo (PTeco2) al noroeste del mismo municipio (18°57'36.88" N y 103°53'47.51" O). El tercero fue un extracto etanólico comercial (Casa del Apicultor®, San Juan, Valladolid, Yucatán, México) adquirido en el estado de Yucatán. Los criterios de selección de los propóleos fueron la disponibilidad y el tipo de vegetación. Los propóleos PTeco1 y PTeco2 provienen de una selva mediana caducifolia y selva baja caducifolia, respectivamente, según el inventario estatal forestal y de suelos del estado de Colima (CONAFOR, 2013a). Mientras que el PYuc proviene de una selva baja caducifolia. Todas estas vegetaciones poseen el mismo tipo de clima Aw0 (cálido subhúmedo, CONAFOR, 2013a; 2013b).
Obtención de los extractos etanólicos de propóleo
El propóleo se enfrió hasta 5 °C para desmenuzarlo con facilidad (partículas<0.25 cm), posteriormente, se preparó una mezcla al 50% (p/v) en etanol 96° GL (Eyng et al., 2015; Cerqueira-Sales et al., 2016). La mezcla se incubó en oscuridad, dentro de un agitador orbital (Felisa®, México), a 150 rpm a 20 °C durante siete días. Después, el extracto se filtró en papel Whatman No. 1 con una bomba de vacío. La concentración obtenida se consideró 100%, a partir de este último se obtuvieron las diluciones a evaluar en los ensayos con M. fijiensis.
Determinación de compuestos fenólicos totales
El contenido de fenoles totales de los tres extractos etanólicos de propóleo se determinó a través del método Folin-Ciocalteu (Sigma-Aldrich®, EE.UU., Sánchez-Rangel et al., 2013). Para ello, se desarrolló una curva estándar de ácido gálico (0, 10, 20, 40, 60, 90 y 120 µg/mL) (Sigma-Aldrich®, EE.UU.), con tres repeticiones por concentración. Las lecturas de absorbancia se realizaron a una longitud de onda de 725 nm en un espectrofotómetro (Luzeren L6S, México). El contenido de fenoles se expresó como microgramos de equivalentes de ácido gálico (EAG) por mililitro de EEP.
Bioensayos dosis-respuesta
La adición del EEP a diferentes concentraciones al APD se efectuó una vez que este último, previamente esterilizado, alcanzó 40 °C. Posteriormente, el medio se agitó manualmente y se vació en cajas de Petri de 90 x 15 mm. Como control negativo se usó APD sin EEP y como control positivo se empleó APD con 10% (v/v) de etanol 96 °GL. El etanol posee actividad inhibitoria en organismos fúngicos (Paschos et al., 2015), por lo tanto, se estableció el control positivo para conocer este efecto en M. fijiensis, a pesar de que las inhibiciones fueron calculadas en función del control negativo. Las concentraciones de EEP evaluadas fueron: 0, 1.25, 2.5, 5 y 10% (v/v), las cuales fueron seleccionadas con base a estudios previos de actividad antifúngica (Pineda et al., 2010; Guginski-Piva et al., 2015). Se emplearon cinco repeticiones por concentración y control evaluado.
Preparación del inóculo
A partir de los cultivos de M. fijiensis, de 21 días de edad, se tomaron dos discos de micelio con un sacabocados estéril de 6 mm de diámetro, los cuales se depositaron en el centro de la caja de Petri con APD + EEP. Posteriormente, las cajas de Petri se incubaron a temperatura ambiente (25±2 °C, 75±5% de humedad relativa, con 12 h luz/oscuridad). A los 5, 15, 22, 34 y 54 días, al reverso de las placas se tomaron fotografías a las colonias con una cámara digital Kodak® (Easyshare M350, New York, EE.UU.) a una distancia de 20 cm entre la caja de Petri y la cámara. A partir de las imágenes digitales se calculó el área de crecimiento del micelio con el programa ImageJ® 1.44 (Rasband, 2011). Los periodos de evaluación mencionados, fueron establecidos debido a la particularidad de las colonias de M. fijiensis, los cuales poseen lento crecimiento (6.3 mm en 14 días aproximadamente, Manzo-Sánchez et al., 2001).
Variables de respuesta
Se evaluó la tasa de crecimiento diaria del micelio (TCD), determinada con el área de los micelios durante 54 días. La TCD se calculó con la fórmula:
Análisis de datos
La TCD, el %ICM y el contenido de fenoles se sometieron a un análisis de varianza y una comparación de medias empleando la diferencia mínima significativa (DMS) al 0.05 de probabilidad. Los datos del %ICM se transformaron con la ecuación
Resultados
Tasa de crecimiento diaria (TCD)
Extracto etanólico de propóleo PTeco1
A los 5, 15 y 22 días de cultivo, el EEP PTeco1 no mostró reducción en la TCD de M. fijiensis. Por el contrario, algunas concentraciones significativamente incrementaron su biomasa en comparación con el control positivo (PDA + etanol 10% v/v), p. e. 1.25 y 2.5% a los 5 (F=18.81, P=0.00001), 15 (F=43.21, P=0.0001) y 22 (F=42.56, P=0.0035) días. Por el contrario, la concentración de EEP PTeco1 al 10% significativamente redujo la TCD de M. fijiensis a los 34 (F=39.89, P=0.0035) y 54 (F=40.10, P=0.0153) días de evaluación (Tabla 1). Las reducciones fueron de 0.104 (control positivo) a 0.009 cm2/día y de 0.198 (control positivo) a 0.044 cm2/día a los 34 y 54 días, respectivamente.
Tabla 1 Tasa de crecimiento diaria (cm2/día) in vitro de Mycosphaerella fijiensis en medio de cultivo APD con concentraciones de extractos etanólicos de propóleo
| Propóleo | Concentración (%) | Días de crecimiento | ||||
| 5 | 15 | 22 | 34 | 54 | ||
| PTeco1 | PDA+OH | 0.014 ± 0.002 b | 0.050 ± 0.025 b | 0.033 ± 0.019 b | 0.104 ± 0.037 b | 0.198 ± 0.069 ab |
| 1.25 | 0.060 ± 0.009 a | 0.179 ± 0.014 a | 0.083 ± 0.130 a | 0.192 ± 0.027 a | 0.304 ± 0.039 a | |
| 2.50 | 0.015 ± 0.002 b | 0.142 ± 0.033 a | 0.083 ± 0.014 a | 0.147 ± 0.039 ab | 0.210 ± 0.066 ab | |
| 5.00 | 0.013 ± 0.003 b | 0.048 ± 0.022 b | 0.038 ± 0.018 b | 0.084 ± 0.022 bc | 0.098 ± 0.025 bc | |
| 10.00 | 0.007 ± 0.002 b | 0.003 ± 0.002 b | 0.003 ± 0.003 b | 0.009 ± 0.009 c | 0.044 ± 0.042 c | |
| CV (%) | 18.81 | 43.21 | 42.56 | 39.89 | 40.10 | |
| P | 0.00001 | 0.0001 | 0.0035 | 0.0035 | 0.0153 | |
| F | 22.51 | 11.22 | 5.56 | 5.58 | 4.00 | |
| PTeco2 | Concentración (%) | Días de crecimiento | ||||
| 5 | 15 | 22 | 34 | 54 | ||
| PDA+OH | 0.014 ± 0.002 b | 0.050 ± 0.025 b | 0.033 ± 0.019 b | 0.104 ± 0.037 b | 0.198 ± 0.069 a | |
| 1.25 | 0.052 ± 0.008 a | 0.143 ± 0.022 a | 0.098 ± 0.022 a | 0.199 ± 0.029 a | 0.196 ± 0.067 a | |
| 2.50 | 0.013 ± 0.001 b | 0.008 ± 0.001 bc | 0.000 ± 0.000 b | 0.042 ± 0.014 bc | 0.126 ± 0.044 ab | |
| 5.00 | 0.004 ± 0.002 b | 0.001 ± 0.000 c | 0.000 ± 0.000 b | 0.001 ± 0.000 c | 0.025 ± 0.024 b | |
| 10.00 | 0.005 ± 0.001 b | 0.002 ± 0.001 c | 0.000 ± 0.000 b | 0.000 ± 0.000 c | 0.001 ± 0.000 b | |
| CV (%) | 18.73 | 30.63 | 75.82 | 40.83 | 43.65 | |
| P | 0.00001 | 0.00001 | 0.0001 | 0.00001 | 0.0215 | |
| F | 25.19 | 16.76 | 10.96 | 14.27 | 3.66 | |
| PYuc | Concentración (%) | Días de crecimiento | ||||
| 5 | 15 | 22 | 34 | 54 | ||
| PDA+OH | 0.014 ± 0.002 a | 0.050 ± 0.025 a | 0.033 ± 0.019 a | 0.104 ± 0.037 a | 0.198 ± 0.069 a | |
| 1.25 | 0.010 ± 0.001 ab | 0.004 ± 0.000 b | 0.000 ± 0.000 b | 0.014 ± 0.003 b | 0.039 ± 0.022 b | |
| 2.50 | 0.009 ± 0.002 b | 0.003 ± 0.001 b | 0.000 ± 0.000 b | 0.002 ± 0.001 b | 0.020 ± 0.016 b | |
| 5.00 | 0.008 ± 0.002 b | 0.003 ± 0.000 b | 0.000 ± 0.000 b | 0.000 ± 0.000 b | 0.004 ± 0.003 b | |
| 10.00 | 0.009 ± 0.001 b | 0.003 ± 0.000 b | 0.000 ± 0.000 b | 0.000 ± 0.000 b | 0.002 ± 0.000 b | |
| CV (%) | 14.60 | 22.51 | 50.56 | 38.76 | 53.62 | |
| P | 0.0945 | 0.0255 | 0.0414 | 0.0009 | 0.0021 | |
| F | 2.30 | 3.50 | 3.04 | 7.20 | 6.18 | |
Medias con literales diferentes entre columnas son significantemente diferentes entre sí (n=5, DMS, P=0.05), CV=coeficiente de variación. Las cajas de Petri se incubaron a 25±2 °C, 75±5% de humedad relativa, con 12 h luz/oscuridad.
Extracto etanólico de propóleo PTeco2
La concentración de 1.25% no mostró efecto en la reducción del crecimiento de M. fijiensis; por el contrario, incrementó significativamente (P<0.05) la biomasa del patógeno en todos los días evaluados. Las reducciones significativamente notables en la TCD de M. fijiensis se encontraron a los 34 y 54 días de evaluación en las concentraciones de 5 (F=14,27, P=0.00001) y 10% (F=3.66, P=0.0215), respectivamente (Tabla 1).
Extracto etanólico de propóleo PYuc
A partir de la segunda (15 días) y hasta la última evaluación (54 días), las cuatro concentraciones del extracto PYuc redujeron significativamente la TCD del fitopatógeno. En el último muestreo la TCD en el control positivo (PDA+OH) se redujo significativamente (F=6.18, P=0.0021) de 0.198 a 0.039, 0.020, 0.004 y 0.002 cm2/día, en las concentraciones de 1.25, 2.5, 5.0 y 10.0% (v/v), respectivamente.
Inhibición del crecimiento micelial
Extracto etanólico de propóleo PTeco1
En el día 5, la concentración de 1.25% inhibió el crecimiento micelial de M. fijiensis significativamente (F=32.22, P=0.00001) en menor proporción (27.6%) que las otras concentraciones evaluadas (44.2-44.8%). Por otra parte, al 10% significativamente inhibió en mayor medida el crecimiento micelial del patógeno a los 15 (45.1%, F=10.35, P=0.0001), 22 (49.9%, F=9.23, P=0.0002), 34 (59.2%, F=11.48, P=0.0001) y 54 (57.8%, F=6.23, P=0.0020) días (Tabla 2, Figura 1). Sin embargo, en esas mismas evaluaciones, las concentraciones de 1.25 y 2.5% (v/v) no fueron capaces de inhibir el crecimiento del hongo. Asimismo, se encontró que el etanol a 96 °GL, empleado para los extractos etanólicos, también inhibió (24.3 - 41.8%) la cepa estudiada de M. fijiensis.
Tabla 2 Inhibición (%) del crecimiento micelial in vitro de Mycosphaerella fijiensis en medio de cultivo APD con concentraciones de extractos etanólicos de propóleo
| Propóleos | Concentración (%) | Días de crecimiento | ||||
| 5 | 15 | 22 | 34 | 54 | ||
| PTeco1 | PDA+OH | 41.8 ± 0.5 a | 21.1 ± 8.9 b | 25.4 ± 10.5 b | 25.6 ± 11.2 b | 24.3 ± 11.3 b |
| 1.25 | 27.6 ± 2.1 b | 0.0 ± 0.0 c | 0.0 ± 0.0 c | 0.0 ± 0.0 c | 0.0 ± 0.0 b | |
| 2.50 | 41.4 ± 0.7 a | 0.0 ± 0.0 c | 0.0 ± 0.0 c | 0.0 ±0.0 c | 0.0 ± 0.0 b | |
| 5.00 | 41.8 ± 1.0 a | 18.5 ± 9.2 b | 20.6 ± 10.8 b | 22.7 ± 10.6 b | 24.9 ± 10.8 b | |
| 10.00 | 44.2 ± 0.7 a | 45.1 ± 1.7 a | 49.9 ± 2.2 a | 59.2 ± 4.2 a | 57.8 ± 14.4 a | |
| CV (%) | 2.9 | 19.1 | 19.6 | 19.5 | 22.9 | |
| P | 0.00001 | 0.0001 | 0.0002 | 0.0001 | 0.0020 | |
| F | 32.22 | 10.35 | 9.23 | 11.48 | 6.23 | |
| PTeco2 | Concentración (%) | Días de crecimiento | ||||
| 5 | 15 | 22 | 34 | 54 | ||
| PDA+OH | 41.8 ± 0.5 a | 21.1 ± 8.9 b | 25.4 ± 10.5 b | 25.6 ± 11.2 c | 24.3 ± 11.3 b | |
| 1.25 | 27.4 ± 3.7 b | 0.0 ± 0.0 c | 0.0 ± 0.0 c | 0.0 ± 0.0 d | 0.0 ± 0.0 c | |
| 2.50 | 41.9 ± 0.4 a | 39.7 ± 0.5 a | 47.4 ± 0.6 a | 46.6 ± 4.8 b | 34.0 ± 10.6 b | |
| 5.00 | 44.9 ± 0.5 a | 46.7 ± 0.6 a | 53.0 ± 0.4 a | 63.7 ± 0.2 a | 66.8 ± 6.2 a | |
| 10.00 | 44.7 ± 0.2 a | 46.2 ± 0.4 a | 53.4 ± 0.1 a | 64.2 ± 0.0 a | 72.9 ± 0.0 a | |
| CV (%) | 3.5 | 9.2 | 8.7 | 10.9 | 17.4 | |
| P | 0.00001 | 0.00001 | 0.00001 | 0.00001 | 0.00001 | |
| F | 17.47 | 25.04 | 23.75 | 24.96 | 16.42 | |
| PYuc | Concentración (%) | Días de crecimiento | ||||
| 5 | 15 | 22 | 34 | 54 | ||
| PDA+OH | 41.8 ± 0.5 a | 21.1 ± 8.9 b | 25.4 ± 10.5 b | 25.6 ± 11.2 b | 24.3 ± 11.3 b | |
| 1.25 | 2.1 ± 2.1 b | 43.3 ± 0.4 a | 50.0 ± 0.4 a | 57.0 ± 0.7 a | 59.1 ± 5.5 a | |
| 2.50 | 5.7 ± 2.8 b | 44.0 ± 0.6 a | 51.0 ± 0.3 a | 61.8 ± 0.3 a | 66.4 ± 4.1 a | |
| 5.00 | 7.5 ± 2.6 b | 44.4 ± 0.4 a | 52.9 ± 0.4 a | 63.8 ± 0.2 a | 71.6 ± 1.0 a | |
| 10.00 | 3.6 ± 2.3 b | 43.9 ± 0.3 a | 52.7 ± 0.3 a | 64.0 ± 0.3 a | 72.7 ± 0.2 a | |
| CV (%) | 49.8 | 9.3 | 8.9 | 9.3 | 12.7 | |
| P | 0.00001 | 0.0017 | 0.0021 | 0.0001 | 0.0001 | |
| F | 54.46 | 6.45 | 6.18 | 10.52 | 11.28 | |
Medias con literales diferentes entre columnas son significantemente diferentes entre sí (n=5, DMS, P=0.05), CV=coeficiente de variación. Las cajas de Petri se incubaron a 25±2 °C, 75±5% de humedad relativa, con 12 h luz/oscuridad.

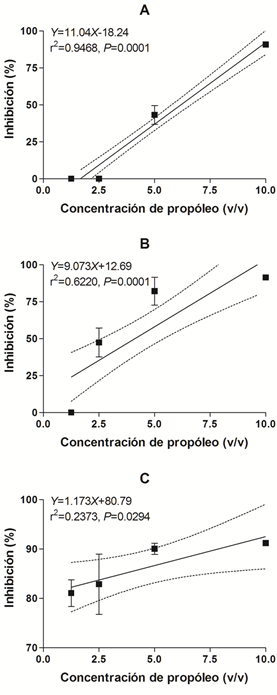
Figura 1 Crecimiento de las colonias de Mycosphaerella fijiensis en medio de cultivo APD con cuatro concentraciones (1.25, 2.5, 5.0 y 10.0%) de tres extractos de propóleos (PTeco1, PTeco1 y PYuc).
La regresión lineal entre la inhibición del crecimiento micelial y las concentraciones del PTeco1 mostró un coeficiente de determinación (r2) alto con un valor de r2=0.9468, sugiriendo que existe una fuerte relación entre la concentración de propóleo y la inhibición del patógeno. El modelo lineal resultó significativo (P=0.0001, Y=11.04X-18.27), el cual describe un 94.68% el pronóstico de la inhibición del M. fijiensis, si conocemos la concentración de propóleo (Figura 2A).
Extracto etanólico de propóleo PTeco2
Existió menor inhibición con la concentración al 1.25% al quinto día (27.4%) de evaluación, sin embargo, en los siguientes muestreos no se observó efecto inhibitorio para esa misma concentración. Por otra parte, las concentraciones 2.5, 5 y 10% inhibieron el crecimiento in vitro de M. fijiensis a los 15, 22, 34 y 54 días. Las inhibiciones más altas se observaron en el penúltimo (34 días, F=24.96, P=0.00001) y último muestreo (54 días, F=16.42, P=0.00001) (Tabla 2, Figura 1) en las concentraciones de 5 y 10% v/v, con inhibiciones de 63.7 (34 días) ‒ 64.2 (54 días) y 66.8 (34 días) ‒ 72.9% (54 días), respectivamente.
En análisis de regresión lineal para el extracto PTeco2 mostró un modelo significativo (P=0.00001, Y=9.073X+12.69) y una r2=0.6220, sugiriendo que no existe una fuerte relación lineal entre el incremento de la concentración de propóleo y el incremento en la inhibición del M. fijiensis. Tanto los porcentajes de inhibición (Tabla 2) y la regresión lineal (Figura 2B) sugieren que se obtiene el mismo porcentaje de inhibición al emplear las concentraciones de 5.0 y 10% v/v del extracto PTeco2.
Extracto etanólico de propóleo Pyuc
Todas las concentraciones inhibieron significativamente el crecimiento micelial in vitro de M. fijiensis, en comparación con el control positivo (APD+OH), a los 15 (F=6.45, P=0.00001), 22 (F=6.18, P=0.0021), 34 (F=10.52, P=0.0001) y 54 (F=11.28, P=0.0001) días de evaluación. Las cuatro concentraciones estudiadas inhibieron más de 50% al día 22 de evaluación, finalizando con valores mayores al 70% en las dos concentraciones mayores y una mínima diferencia de 9% con las dos concentraciones menores. En contraste, en la primera evaluación (5 días) no se observó inhibición en el crecimiento micelial del patógeno (Tabla 2, Figura 1).
En cuanto al análisis de regresión, se encontró una baja relación entre la concentración de propóleo y la inhibición del fitopatógeno (r2=0.2373). El modelo lineal resultó significativo (P=0.0294, Y=1.173X+80.79). Tanto la Tabla 2 como la Figura 2C, sugieren que las cuatro concentraciones de propóleo estudiadas, permiten estadísticamente el mismo porcentaje inhibición.
Concentración efectiva media (CE50)
La CE50 para PTeco1, PTeco2 y PYuc fue de 0.86, 3.34 y 0.24%, respectivamente (Tabla 3). De acuerdo al traslape de los intervalos de confianza, la menor CE50 (0.24%) correspondió al EEP PYuc. Por el contrario, la mayor CE50 (3.34%) correspondió al EEP PTeco2. La CE50 representa la dosis de propóleo que se requiere para inhibir el 50% del crecimiento del patógeno bajo las condiciones de estudio. Tomando este valor como parámetro para establecer una dosis en campo, se requiere 0.480 L/ha del EEP PYuc para un efecto significativo (visual). Por el contrario, para el EEP PTeco2 se requiere una dosis de 6.68 L/ha para ver un efecto significativo (Chi-X 2=788.23, P<0.0001) en la reducción del patógeno.
Tabla 3 Concentración efectiva media (CE50) y noventa (CE90) de tres extractos etanólicos de propóleo sobre Mycosphaerella fijiensis
| EEP | CE50 (%) | IC (%) | Pendiente | Ecuación Probit | Chi-X2 | P>Chi-X2 |
| PTeco1 | 0.86 b | 0.842 - 0.88 | 4.75 | y=4.75x - 4.08 | 463.79 | < 0.0001 |
| PTeco2 | 3.34 c | 3.20 - 3.49 | 3.82 | y=3.82x - 2.00 | 788.23 | < 0.0001 |
| PYuc | 0.24 a | 0.11 - 0.40 | 0.89 | y=0.89x + 0.55 | 73.13 | < 0.0001 |
| EEP | CE90 (%) | IC (%) | Pendiente | Ecuación Probit | Chi-X2 | P>Chi-X2 |
| PTeco1 | 1.13 b | 1.10 - 1.175 | 4.75 | y=4.75x - 4.08 | 463.79 | < 0.0001 |
| PTeco2 | 7.24 c | 6.81 - 7.77 | 3.82 | y=3.82x - 2.00 | 788.23 | < 0.0001 |
| PYuc | 0.81 a | 0.72 - 0.94 | 0.89 | y=0.89x + 0.55 | 73.13 | < 0.0001 |
IC= Intervalo de confianza. Literales diferentes son estadísticamente diferentes entre sí, de acuerdo al traslape de los intervalos de confianza (P≤0.05).
La CE90 para PTeco1, PTeco2 y PYuc fue de 1.13, 7.24 y 0.81% respectivamente (Tabla 3). Conforme al traslape de los intervalos de confianza, la menor CE90 (0.81%) correspondió al EEP PYuc, mientras que la mayor (7.24%) correspondió al EEP PTeco2. La CE90 corresponde a la dosis de propóleo requerida para inhibir el 90% del crecimiento del patógeno bajo las condiciones de estudio. Al tomar este valor como parámetro en campo para establecer una dosis, se requiere 1.62 L/ha del EEP PYuc para obtener un efecto significativo comparado con 14.48 L/ha del EEP PTeco2 para observar el mismo efecto.
Contenido de fenoles totales
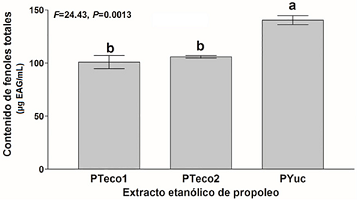
La concentración de fenoles más alta se encontró en el EEP PYuc con 140.47 µg EAG/mL, el cual fue estadísticamente mayor a los propóleos locales PTeco1 y PTeco2 con 100.94 y 105.82 µg EAG/mL, respectivamente (Figura 3).
Discusión
Mycosphaerella fijiensis posee un lento crecimiento in vitro, de acuerdo con Manzo-Sánchez et al. (2001) el diámetro promedio de las colonias de 14 días de edad es de 6.3 mm. Esta medida no se puede comparar con el presente estudio, debido a que el crecimiento de los micelios de M. fijiensis fueron calculados en área (cm2), el cual posee valores más bajos; sin embargo, son de mayor precisión, ya que los micelios del fitopatógeno no crecen de manera circular.
El presente estudio representa el primer reporte sobre la habilidad de extractos etanólicos de propóleo para inhibir el crecimiento in vitro de M. fijiensis. Estudios previos de sensibilidad in vitro sobre M. fijiensis, únicamente se han enfocado en la evaluación de fungicidas químicos (Pelaéz-Montoya et al., 2006), botánicos (Abiala et al., 2011; Kumakech et al., 2017) y biológicos (Sagratzki-Cavero et al., 2015).
Sin embargo, en la presente década se ha prestado bastante interés en la exploración del propóleo como antimicrobiano, principalmente se ha estudiado su actividad antibacteriana y fungicida (Hashemi, 2016).
Para micopatógenos agrícolas, algunos estudios in vitro e in vivo han sido realizados. Los extractos etanólicos de propóleo han sido efectivos para reducir el crecimiento in vitro de C. gloeosporioides (Pineda et al., 2010), D. bryoniae, R. solani (Gallez et al., 2014), Aspergillus niger, Fusarium sp. cepa 21, Fusarium sp. cepa 22, Macrophomina sp., Penicillium notatum, Phomitopsis sp. (Quiroga et al., 2006), Aspergillus versicolor, Penicillium aurantiogriseum (Temiz et al., 2013), Penicillium digitatum (Matny, 2015), entre otros.
Sin embargo, no existen estudios similares in vitro con M. fijiensis para contrastar los resultados obtenidos. Es destacable que los propóleos PTeco2 y PYuc ocasionaron inhibiciones en el crecimiento micelial por arriba del 50% a la concentración de 5% v/v. En otros hongos fitopatógenos como C. gloeosporioides se requiere un extracto de propóleo más concentrado (15-30 v/v) para ocasionar una inhibición in vitro entre 27 y 30% (Pineda et al., 2010). Esta situación parece ser similar en A. solani, ya que se requiere un extracto de propóleo al 17% (p/v) para ocasionarle una inhibición micelial in vitro de 25% (Cortés-Rubira, 2008). Por el contrario, D. bryoniae es más sensible al extracto etanólico de propóleo, de acuerdo con Gallez et al. (2014) el fitopatógeno inhibe su crecimiento micelial in vitro entre 69 y 77%, al crecer en PDA con propóleo a una concentración de 10% v/v.
Particularmente, en este estudio se observó que los extractos de PTeco1 y PTeco2 a la concentración de 1.25% (v/v) estimularon una mayor TCD respecto al control positivo (APD+OH), en ciertos periodos de evaluación. Este comportamiento fúngico depende de la especie en estudio, los organismos fúngicos poseen una versatilidad fisiológica y bioquímica ante la presencia de un estresor, que en este caso fueron los extractos etanólicos de propóleo. Un mecanismo fisiológico para contrarrestar a los estresores es el aumento en la velocidad de crecimiento (Álvarez et al., 1990; Chan-Cupul et al., 2014), otro mecanismo reportado es el incremento de su actividad bioquímica traducida en la producción de enzimas líticas y especies reactivas de oxígeno (ROS, por sus siglas en inglés), como mecanismo de defensa contra el estresor (Maciel et al., 2013). Por ello, es importante que en estudios de efectividad de moléculas químicas y/o biológicas sobre fitopatógenos sea abordado a través de un bioensayo dosis-respuesta, calculando la CE50. Parámetro idóneo para definir las concentraciones de las moléculas (o extractos) a emplear en estudios in vivo o in situ (Molina-Vargas y Melo-Martinez, 2010).
Por otra parte, son limitados los estudios in vivo e in situ (campo o invernadero) para el control de fitopatologías causadas por hongos a través de extractos etanólicos de propóleo, en este tenor, Guginski-Piva et al. (2014) reportaron la habilidad de un extracto etanólico de propóleo nativo de Brasil para la reducción del área bajo la curva del progreso de la enfermedad (ABCPE) de Mildiu (Podosphaera fuliginea) en pepino (Cucumber sativus). Los autores evaluaron cinco concentraciones (0.5, 1.0, 2.0, 4.0 y 8.0% v/v) del extracto etanólico de propóleo. Los resultados indicaron que la aplicación del extracto de propóleo al 8% (v/v) redujo el ABCPE entre 31.33 y 43.68%.
Actualmente, en México no existe información sobre la CE50 de extractos etanólicos de propóleo sobre patógenos fúngicos, por lo que este trabajo es de suma relevancia. Sin embargo, en este estudio se observó que la CE50 fue completamente diferente entre los tres extractos etanólicos de propóleo, con alta diferencia significativa entre ellos (P<0.0001). Por lo tanto, se acepta la hipótesis de investigación planteada. El extracto PYuc obtuvo la menor CE50 (0.24%) seguido de PTeco1 (0.86%) y PTeco2 (3.34%), esto significa que si extrapolamos la información a un tratamiento por hectárea necesitaríamos 0.48, 1.72 y 6.68 L del extracto etanólico de propóleo, respectivamente, para tener una inhibición aproximada de 50% en M. fijiensis. Este estudio sugiere futuros trabajos in vivo e in situ (campo o invernadero) para evaluar la efectividad de estas dosis de propóleo por hectárea.
En cuanto al contenido de fenoles totales, el extracto PYuc fue superior a los de Tecomán, Colima; sin embargo, no se determinó el perfil de compuestos fenólicos presentes en la muestra, estudios que podría abordarse en un futuro. Sin embargo, Ramanauskiene et al. (2013) reportaron un contenido de fenoles totales de 167.5, 175.6 y 115.4 mg equivalentes de ácido Felúrico (mg AFE)/g de propóleo a concentraciones de 2.5, 5.0 y 10% (p/v), respectivamente. Estos valores son altos en comparación a los del presente estudio (PYuc=140.47, PTeco1=100.94, PTeco2=105.82 µg EAG/mL), si comparamos la cantidad de propóleo (50% p/v) empleada para realizar los extractos etanólicos. El propóleo es un material heterogéneo y es dependiente de la composición vegetal de donde proviene (Shuai et al., 2014), razón por la cual denota una heterogeneidad en el contenido de fenoles totales.
Por tal motivo sería importante conocer la naturaleza química de los extractos, al respecto Burdock (1998) menciona que la presencia de flavonoides y ácidos fenólicos en el propóleo son constituyentes importantes y responsables de la bioactividad contra numerosos microorganismos patógenos. Asimismo, la naturaleza química de los extractos de propóleo varía de una ubicación a otra, debido a la composición florística de las especies botánicas existentes en cada región. Al respecto, Eguaras et al. (1999) reportaron diversos tipos de fenoles, principalmente ácidos fenólicos (benzoico, cafeico, ferúlico y cinámico) y flavonoides. Recientemente, empleando técnicas cromatográficas analíticas y de preparación, se han descrito al menos 241 compuestos químicos en el propóleo (Shuai et al., 2014).
Asimismo, es importante evaluar la diversidad vegetativa donde se ubican los distintos apiarios en el estado de Colima y determinar si algún propóleo crudo presenta mayor calidad (Gallez et al. 2014), ya que ésta depende de la composición de las especies vegetativas, estudio que se puede abordar en el futuro y que puede incidir sobre la efectividad de los extractos contra patógenos fúngicos agrícolas.
En conclusión, únicamente el propóleo PTeco1 mostró una relación positiva entre la concentración y el porcentaje de inhibición en el crecimiento de M. fijiensis, es decir a mayor concentración del EEP, mayor inhibición en el crecimiento micelial del fitopatógeno. Mientras que los extractos PTeco2 y PYuc, no mostraron este comportamiento. El extracto PYuc redujo la TCD in vitro de M. fijiensis en todas las concentraciones evaluadas, registró el mayor contenido de fenoles totales y presentó los valores menores de CE50 y CE90.











 nueva página del texto (beta)
nueva página del texto (beta)