Introducción
Los Ascomycota de agua dulce son un grupo diverso que incluye poco más de 300 especies cuya función ecológica es degradar material vegetal en ambientes lóticos. Estos hongos producen conidiosporas con morfología característica y forma muy variada (sigmoide, tetra-radiada, fusiforme, esférica, etc.) facilitando su dispersión por corrientes de agua y su adhesión a los restos vegetales sobre los que se desarrollan (Bärlocher, 1992; Shearer et al., 2006). Desde los primeros trabajos de Ingold (1942, 1943a), se han estudiado en otras regiones del mundo (Suberkropp y Klug, 1976; Ranzoni, 1979; Marvanová y Müller-Haeckel, 1980; Betancourt et al., 1986; Thomas et al., 1989; Iqbal, 1994; Rajashekhar y Kaveriappa, 2003; Fernández y Smits, 2009; Patil et al., 2014). En México, no hay antecedentes sobre este grupo de hongos en la espuma de ambientes lóticos, por lo que se desconoce su diversidad. Este estudio tuvo como objetivo describir la diversidad de los hifomicetes acuáticos en las cascadas del Parque Estatal Agua Blanca, localizado en el municipio de Macuspana, estado de Tabasco, México.
Materiales y métodos
El Parque Estatal Agua Blanca (PEAB) es un Área Natural Protegida (ANP) ubicada en la región Sierra de Tabasco, en el Municipio de Macuspana (17° 35’ y 17° 38’ N, 92° 25’ y 92° 29’ O) (Figura 1). Cuenta con una superficie de 2,025 ha, dominada por selva alta perennifolia y con una elevación entre 100 y 200 m.s.n.m. Las corrientes de agua presentes en el Parque, se forman producto de los escurrimientos de la serrania (Zarco-Espinoza et al., 2010). Se realizaron dos visitas (22 de mayo y 25 de junio de 2011) al PEAB y se tomaron ocho muestras (Tabla 1) en cada visita de, aproximadamente, 100 mL de espuma en puntos de las cascadas donde se formaba espuma gruesa y a los cuales se tenía acceso. Las muestras se colocaron en frascos de vidrio esterilizados, se fijaron con alcohol al 70% y se transportaron en una nevera (Descals, 1997) al Laboratorio de Micología en la División Académica de Ciencias Biológicas de la Universidad Juárez Autónoma de Tabasco, el tiempo transcurrido entre la toma y el procesamiento de las muestras varió entre 2 y 3 horas. Se elaboraron 10 preparaciones de cada muestra. Con una pipeta estéril se extrajeron 10 mL de cada frasco con muestra y se colocaron 5 gotas en un portaobjetos. Los portaobjetos se colocaron en una parrilla hasta que se evaporó el líquido. Posteriormente, se agregaron dos gotas de alcohol absoluto para deshidratar la muestra. Las preparaciones se tiñeron con azul de algodón y se montaron con alcohol polivinílico, antes de observar al microscopio (Descals, 1997). Para identificar las especies se utilizaron bibliografía y claves especializadas (Ingold, 1975; Chan et al., 2000; Gulis et al., 2005). Debido a que la técnica utilizada no permite el aislamiento de estos hongos, sólo se conservaron las laminillas que se elaboraron y, a partir de las cuales, se identificaron las especies; dichas laminillas, fueron depositadas en el Cepario UJAT como parte de la colección anexa de preparaciones, y se les asignó un número de colección con la clave CAPP-UJAT-00X.
Resultados
Se identificaron 9 especies de Ascomycota acuáticos. Campylospora chaetocladia, Diplocladiella taurina, Heliscus tentaculus, Jaculispora submersa, Lunulospora curvula, Miladina lecithina, Triscelophorus acuminatus, Triscelophorus monosporus y Trisulcosporium acerinum, se registran por primera vez en el estado de Tabasco y en México.
Descripciones taxonómicas
Campylospora chaetocladia Ranzoni, Farlowia 4 (3): 373 (1953)
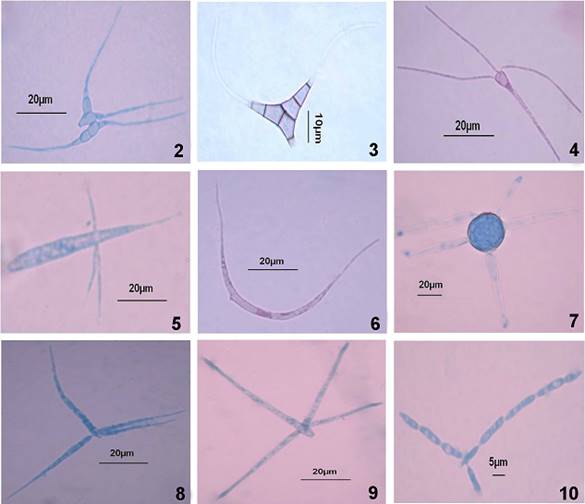
Figuras 2-10 Conidios de las especies identificadas. 2. Campylospora chaetocladia. 3. Diplocladiella taurina. 4. Heliscus tentaculus. 5. Jaculispora submersa. 6. Lunulospora curvula. 7. Miladina lecitina. 8. Triscelophorus acuminatus. 9. Triscelophorus monosporus. 10. Trisulcosporium acerinum.
Conidiosporas hialinas tetra-radiadas. Cuerpo conidial de hasta 70 µm de longitud, con forma triangular dividido en dos partes, con cuatro extensiones filiformes mayores a 30 µm de largo.
Material estudiado: Espuma. CAPP-UJAT-005. Col. Córdova-Córdova. Junio 25, 2011.
Observaciones: La forma y dimensiones de la conidiospora estudiada coinciden con las de la especie tipo.
Distribución: Argentina (Schoenlein-Crusius y Piccolo, 2003), Brasil (Schoenlein-Crusius y Piccolo, 2003; Fiuza y Gusmao, 2013), Canadá (Bärlocher y Marvanová, 2010), Colombia (Ruiz-Chala y Peláez-Rodríguez, 2013), Egipto (Abdel-Raheem, 1997), España (Descals et al., 1977; Casas y Descals, 1997), India (Sridhar y Kaveriappa, 1992; Rajashektar y Kaveriappa, 2003; Sudheep y Sridhar, 2011), Jamaica (Hudson e Ingold, 1960), Nigeria (Ingold, 1956; Alasoadura, 1968), Panamá (Amilcar et al., 2015), República Dominicana (Betancourt et al., 1986), Sierra Leona (Le'-Jhon, 1965), Rodesia (Ingold, 1958) y Venezuela (Cressa y Smits, 2007; Fernández y Smits, 2009; Pinto et al., 2009; Pinto y Smits, 2012; Fernández y Smits, 2013). Este es su primer registro en el estado de Tabasco y en México.
Diplocladiella taurina Cazau, Aramb & Cabello, Mycotaxon 46: 237 (1993)
Conidiosporas de forma triangular de color marrón a negro, con 8 células distoseptadas. Consiste en un eje principal con dos ramificaciones divergentes. El eje principal consiste en dos células (10-13 µm de longitud, desde la base hasta la curvatura de los brazos). Los brazos pueden medir 10.6 Χ 4-5 µm de ancho en la base hasta estrecharse a 1-1.5 µm. el color apical es más claro, terminando en apéndices hialinos, delgados, sin septos, de 20-23 µm de largo, por 1-1.5µm de ancho en la base y 1µm en el ápice.
Material estudiado: Espuma. CAPP-UJAT-001. Col. Córdova-Córdova. Mayo 22, 2011.
Observaciones: La forma y dimensiones de la conidiospora estudiada coinciden con las de la especie tipo.
Distribución: Es la segunda vez que se reporta esta especie después de ser descrita. Este es su primer registro en el estado de Tabasco y en México.
Heliscus tentaculus Umphlett, Virg. J. Sci., N.S. 10 (1): 27 (1959)
Conidiosporas hialinas tetra-radiadas, claviformes, con 3 ramas coronarias filiformes; cuerpo conidial de 3-5 µm de ancho por 45-70 µm de largo.
Material estudiado: Espuma. CAPP-UJAT-006. Córdova-Córdova. Junio 25, 2011.
Observaciones: La forma y dimensiones de la conidiospora estudiada coinciden con las de la especie tipo.
Distribución: Jamaica (Hudson e Ingold, 1960) y Francia (Chauvet, 1991). Este es su primer registro en el estado de Tabasco y en México.
Jaculispora submersa H.J. Huds. & Ingold, Trans. Br. Mycol. Soc. 43 (3): 475 (1960)
Conidiosporas hialinas unicelulares, eje principal de 37-55 µm de largo por 3-3.5 µm de ancho en la base a 5-7 µm en la parte media del conidio, con 3 apéndices laterales de 10-24 µm de largo por 0.5 µm de ancho.
Material estudiado: Espuma. CAPP-UJAT-009. Col. Córdova-Córdova. Junio 25, 2011.
Observaciones: La forma y dimensiones de la conidiospora estudiada coinciden con las de la especie tipo.
Distribución: Brasil (Fiuza y Gusmao, 2013), Canadá (Bärlocher, 1987; Bärlocher y Marvanová, 2010), Escocia (Ingold, 1973a), India (Rajashektar y Kaveriappa, 2003), República Dominicana (Betancourt et al., 1986) y Venezuela (Smits et al., 2007; Fernández et al., 2010; Fernández y Smits, 2013). Este es su primer registro en el estado de Tabasco y en México.
Lunulospora curvula Ingold, Trans. Br. Mycol. Soc. 25 (4): 409 (1942)
Conidiosporas hialinas sigmoides aseptadas con cicatriz de desprendimiento lateral o dorsal. Longitud del radio mayor a 10µm.
Material estudiado: Espuma. CAPP-UJAT-002. Col. Córdova-Córdova. Mayo 22, 2011.
Observaciones: La forma y dimensiones de la conidiospora estudiada coinciden con las de la especie tipo.
Distribución: Argentina (Schoenlein-Crusius y Piccolo, 2003), Australia (Swart, 1986), Brasil (Schoenlein-Crusius y Piccolo, 2003; Schoenlein-Crusius et al., 2009; Fiuza y Gusmao, 2013), Canadá (Bärlocher, 1987; Bärlocher y Marvanová, 2010), Chile (Schoenlein-Crusius y Piccolo, 2003), Estados Unidos (Woelkerling y Baxter, 1966), Egipto (Abdel-Raheem, 1997 y 2004), España (Descals et al., 1977; Roldán et al., 1987, 1988; Casas y Descals, 1997; Pérez et al., 2012), Francia (Chauvet, 1991), Hungría (Gönczöl y Révay, 2011), India (Sridhar y Kaveriappa, 1984 y 1987; Chandrashekar et al., 1991; Sridhar y Kaveriappa, 1992; Rajashektar y Kaveriappa, 1996; Sati y Belwal, 2005; Sudheep y Sridhar, 2011; Suresha et al., 2013a y 2013b; Ghate y Sridhar, 2015), Inglaterra (Ingold, 1942; Iqbal y Webster, 1973; Lindsey y Glover, 1976; Shearer y Webster, 1985), Jamaica (Hudson e Ingold, 1960), Nigeria (Alasoadura, 1968), Panamá (Amilcar et al., 2015), Paquistán (Iqbal, 1994; Arshad y Bareen, 2007), Portugal (Canhoto y Graça, 1996; Pascoal et al., 2005), Puerto Rico (Justiniano y Betancourt, 1989), República Dominicana (Betancourt et al., 1986), Sierra Leona (Le'-Jhon, 1965), Rodesia (Ingold, 1958) y Venezuela (Cressa y Smits, 2007; Fernández y Smits, 2009; Fernández y Smits, 2013 y 2015). Este es su primer registro en el estado de Tabasco y en México.
Miladina lecithina (Cooke) Svrček, Česká Mykol. 26 (4): 214 (1972)
Conidiosporas tetra-radiadas con una parte central subesférica de color marrón de 35-50 µm de diám. de la cual irradian de 4-8 ramificaciones hialinas con 1-4 septos, rectos de 100-180 Χ 8 µm de ancho.
Material estudiado: Espuma. CAPP-UJAT-004. Col. Córdova-Córdova. Mayo 22, 2011.
Observaciones: La forma y dimensiones de la conidiospora estudiada coinciden con las de la especie tipo.
Distribución: Argentina (Schoenlein-Crusius y Piccolo, 2003), Austria (Voglmayr, 1996), Canadá (Bärlocher, 1987), Egipto (Abdel-Raheem, 1997), Francia (Chauvet, 1991), Hungría (Gönczöl y Révay, 2011), India (Sridhar y Kaveriappa, 1992; Suresha et al., 2013a), Jamaica (Hudson e Ingold, 1960), Nigeria (Ingold, 1956; Alasoadura, 1968), República Dominicana (Betancourt et al., 1986), Uganda (Ingold, 1958) y Venezuela (Smits et al., 2007; Fernández et al., 2010; Fernández y Smits, 2015). Este es su primer registro en el estado de Tabasco y en México.
Triscelophorus acuminatus Nawawi, Trans. Br. Mycol. Soc. 64 (2): 346 (1975)
Conidiosporas tetra-radiadas de 44-66 µm de largo por 3.5-5 µm en el punto más ancho, eje principal con hasta 8 septos constreñidos; célula basal de 3-4 µm de ancho, célula apical hasta 0.5 µm en el ápice. Ramificaciones de hasta 54 µm de largo por 4.5 µm de ancho.
Material estudiado: Espuma. CAPP-UJAT-003. Col. Córdova-Córdova. Mayo 22, 2011.
Observaciones: La forma y dimensiones de la conidiospora estudiada coinciden con las de la especie tipo.
Distribución: Australia (Swart, 1986), Brasil (Fiuza y Gusmao, 2013; Fiuza et al., 2015), Canadá (Bärlocher y Marvanová, 2010), España (Pérez et al., 2012), Hong Kong (Chan et al., 2000), Hungría (Gönczöl y Révay, 2011), India (Sridhar y Kaveriappa, 1987; Chandrashekar et al., 1991; Sridhar y Kaveriappa, 1992; Rajashektar y Kaveriappa, 1996 y 2003; Sudheep y Sridhar, 2011; Ghate y Sridhar, 2015), Portugal (Pascoal et al., 2005), República Dominicana (Betancourt et al., 1986) y Venezuela (Smits et al., 2007; Fernández y Smits, 2009, 2013, 2015; Fernández et al., 2010, Pinto et al., 2009; Pinto y Smits, 2012). Este es su primer registro en el estado de Tabasco y en México.
Triscelophorus monosporus Ingold, Trans.Br. Mycol. Soc. 26 (3-4): 152 (1943)
Conidiosporas hialinas formadas por un eje principal de 50-70 µm de largo por 3-4 µm en la parte más ancha del eje, cerca de la base; con tres ramificaciones laterales divergentes de 40-50 µm de largo por 2-2.5 µm de ancho, cerca de la base, 1.5 µm en el ápice y hasta 1µm en la unión al eje principal.
Material estudiado: Espuma. CAPP-UJAT-007. Col. Córdova-Córdova. Junio 25, 2011.
Observaciones: La forma y dimensiones de la conidiospora estudiada coinciden con las de la especie tipo.
Distribución: Australia (Swart, 1986), Brasil (Schoenlein-Crusius et al., 2009), Canadá (Bárlocher, 1987; Bärlocher y Marvanová, 2010), Colombia (Ruiz-Chala y Peláez-Rodríguez, 2013), Egipto (Abdel-Raheem, 2004), España (Casas y Descals, 1997; Pérez et al., 2012), Estados Unidos (Woelkerling y Baxter, 1966), Francia (Chauvet, 1991), Hong Kong (Chan et al., 2000), India (Sridhar y Kaveriappa, 1984, 1987 y 1992; Chandrashekar et al., 1991; Rajashektar y Kaveriappa, 1996 y 2003; Sudheep y Sridhar, 2011; Suresha et al., 2013a y 2013b; Ghate y Sridhar, 2015), Inglaterra (Lindsey y Glover, 1976), Jamaica (Hudson e Ingold, 1960), Nigeria (Ingold, 1956; Alasoadura, 1968); Panamá (Amilcar et al., 2015); Paquistán (Iqbal, 1994; Arshad y Bareen, 2007), Portugal (Pascoal et al., 2005), Suiza (Bärlocher y Rosset, 1981), Swazilandia (Ingold, 1973b); Rhodesia (Ingold, 1958) y Venezuela (Smits et al., 2007; Fernández y Smits, 2009, 2013 y 2015; Pinto et al., 2009; Fernández et al., 2010; Pinto y Smits, 2012). Este es su primer registro en el estado de Tabasco y en México.
Trisulcosporium acerinum Hudson & Sutton, H.J. Huds. & B. Sutton, Trans. Br. Mycol. Soc. 47 (2): 200 (1964)
Conidiosporas hialinas tri-radiadas; eje principal de 54-90 µm de largo por 2-3.5 µm de ancho, con hasta 6 células constreñidas en los septos; células de hasta 20 µm de longitud.
Material estudiado: Espuma. CAPP-UJAT-008. Col. Córdova-Córdova. Junio 25, 2011.
Observaciones: La forma y dimensiones de la conidiospora estudiada coinciden con las de la especie tipo.
Distribución: Brasil (Schoenlein-Crusius y Piccolo, 2003; Fiuza y Gusmão, 2013), Canadá (Bärlocher y Marvanová, 2010), Hungría (Gönczöl y Révay, 2006), Japón (Hoyosa y Tanaka, 2007) y Venezuela (Pinto et al., 2009; Fernández et al., 2010; Fernández y Smits, 2015). Este es su primer registro en el estado de Tabasco y en México.
Discusión
Este es el primer estudio específico de hifomicetes acuáticos en México, utilizando la técnica de observación de conidios en muestras de espuma. Nueve especies se registran por primera vez en el estado de Tabasco y México. Además, se encontraron dos especies previamente identificadas tanto en ambientes dulceacuícolas como asociadas a restos vegetales: Phalangispora nawawi, encontrada en ambientes dulceacuícolas en Venezuela (Smits et al., 2007; Fernández et al., 2010; Fernández y Smits, 2015), y que en México fue registrada en restos vegetales en el estado de Veracruz (Heredia et al., 2000); mientras que Wiesneriomyces laurinus se ha reportado en ambientes dulceacuícolas de Brasil (Schoenlein-Crusius y Piccolo, 2003), Cuba (Delgado-Rodríguez y Mena-Portales, 2004), India (Rajashektar y Kaveriappa, 1996 y 2003; Sudheep y Sridhar, 2011), Japón (Hoyosa y Tanaka, 2007), y en México, en restos vegetales en Veracruz (Heredia et al., 2000)y Tabasco (Becerra et al., 2007; Martínez-Rivera et al., 2014).











 nova página do texto(beta)
nova página do texto(beta)