Introducción
Los tumores neuroendocrinos son neoplasias poco frecuentes, cuya incidencia ha ido en aumento (6.98 casos por 100,000 habitantes). La localización más frecuente del tumor primario es en tracto gastrointestinal, seguido del tracto bronquioalveolar1,2.
De los tumores carcinoides, solo el 40% presenta síntomas clásicos de síndrome carcinoide como rubor (84%), diarrea (70%), disnea (33%), dolor abdominal (7%), miopatía (6%), broncoespasmo y dermatopatías (6%)3.
En cambio, el síndrome carcinoide cardiaco (SCC), o síndrome de Hedinger, ocurre cuando se forma una lesión tipo «placa» con fibrosis endocárdica, afectando principalmente las válvulas cardiacas, asociado a niveles altos de 5-hidroxitriptamina (5-HT). Esta es una complicación de mal pronóstico, ya que los pacientes terminan desarrollando insuficiencia cardiaca4.
Presentación del caso
Mujer de 54 años, asintomática, sin antecedentes familiares, cirugías ni consumo de tabaco o alcohol, trabaja como psicoterapeuta familiar y lleva hábitos saludables. Durante una revisión ginecológica ordinaria en abril de 2016 se encontraron, como hallazgo incidental, múltiples masas heterogéneas en hígado al momento de realizar ultrasonido abdominal.
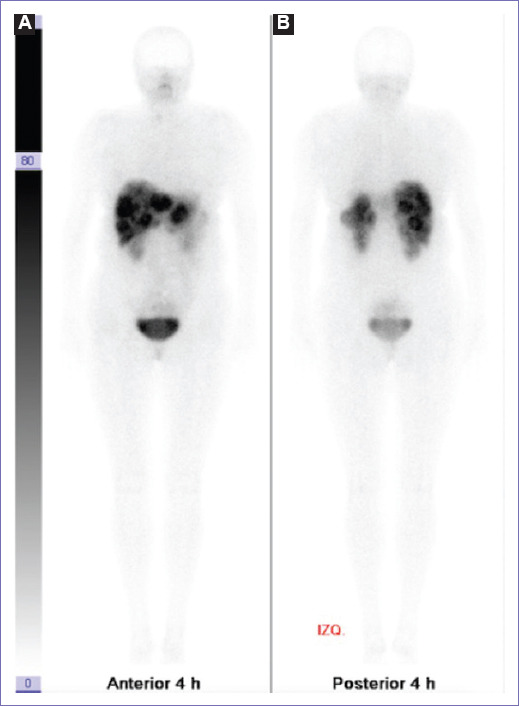
En estudios subsecuentes (tomografía toracoabdominal y panendoscopia) no se pudo localizar el sitio de tumor primario (mayo de 2016). Se realizó una biopsia percutánea de las lesiones hepáticas, resultando en un carcinoma neuroendocrino bien diferenciado (G2) con presencia de cromogranina (+++), sinaptofisina (+) y Ki67 del 5%. Se presentaron niveles de cromogranina en 353 ng/ml y octreoscan (Fig. 1) con reforzamiento de lesiones hepáticas (Fig. 1B). Se integra diagnóstico de tumor neuroendocrino grado 2 (bien diferenciado) con primario desconocido.
En septiembre de 2016 se inicia tratamiento con octreótida LAR (30 mg cada 28 días) y everolimús (10 mg/día), sin embargo se suspende al mes por neumonitis G2. Para un mejor control local se planeó realizar quimioembolización de lesiones hepáticas, pero la paciente presenta disnea, ortopnea progresiva y disnea paroxística nocturna. A la exploración física demuestra ingurgitación yugular y hepatomegalia (4 cm debajo del borde costal), sin evidencia de edema ni hallazgos adicionales.
Estudios diagnósticos
Biometría hemática normal, enzimas hepáticas elevadas alanina aminotransferasa 345 U/l, lactato deshidrogenasa 1,743, aspartato amino transferasa 345 U/l con valores normales de bilirrubina y amonio 4.1 g/dl. Dímero D en 387 ng/ml, valores ligeramente elevados de péptido natriurético de tipo B 150 pg/ml. Niveles urinarios de ácido 5-hidroxiindolacético (5-HIAA) 137 mg/24 h. El ecocardiograma transtorácico reportó válvula tricuspídea con ausencia de las cúspides de la válvula tricúspide posterior y septal con movimiento limitado de la válvula posterior e insuficiencia severa. La válvula pulmonar con insuficiencia severa presentando fracción de eyección del ventrículo izquierdo conservada (65%), sin disfunción diastólica y adecuada expansión del ventrículo derecho. El cateterismo cardiaco prequirúrgico reveló una onda V prominente debido a insuficiencia cardiaca derecha.
Se concluyó síndrome carcinoide cardiaco (SCC) asociado a tumor neuroendocrino metastásico. Se realizó un abordaje multidisciplinario para discutir el manejo adecuado y ético (cirujano cardiotorácico, cardiólogo, oncólogo, fisioterapeuta cardiopulmonar, psicooncólogo). El riesgo de mortalidad quirúrgica según EUROSCORE-II para este paciente fue del 0.87%. Con consentimiento del paciente se realizó cirugía en junio de 2017, se infundió octreótida 12 horas antes y durante la cirugía, y bajo anestesia general se realizó cirugía cardiaca mínimamente invasiva con reemplazo total de válvula tricúspide (Biológico #29) en tiempo anestésico de 5 horas, y 108 minutos de tiempo de circulación extracorpórea. Sin complicaciones transoperatorias, la paciente fue trasladada a una unidad de cuidados intermedios con soporte de oxígeno, tubo endopleural y rehabilitación pulmonar. A las 72 horas es dada de alta a domicilio con notable mejoría clínica.
Posteriormente continuó con octreótida LAR 30 mg IM cada 14 días (doble dosis) durante tres meses, sometida después a quimioembolización de metástasis hepáticas con lipiodol sin complicaciones. Luego se cambió a octreótida LAR 30 mg a cada 28 días y se reinició dosis baja de everolimús 2.5 mg/día, que se aumentó a 5 mg/día dos meses después. Se obtuvo respuesta parcial por imagen y marcadores séricos (cromogranina A sérica [CgA] y 5-HIAA). A los cinco años de la cirugía, la paciente se encuentra viva, con excelente calidad de vida, continúa en tratamiento con octreótida LAR 30 mg IM cada 28 días y everolimús 5 mg/día hasta abril de 2022, cuando se documenta progresión hepática y ósea; se inicia lutecio en agosto de 2022, se han aplicado tres dosis hasta la fecha, con lo que ha respondido favorablemente. Su última visita fue en noviembre de 2022.
Epidemiología
El SCC se ha descrito en el 50 a 60% de todos los pacientes con síndrome carcinoide. aunque recientemente su prevalencia ha disminuido al 20% debido a la disponibilidad y uso de análogos de somatostatina. El tracto gastrointestinal y broncoalveolar son los tumores primarios más frecuentes relacionados con el SCC (51 y 21% específicamente), sin embargo, en aproximadamente el 12% de los casos, el sitio primario permanece desconocido (Tabla 1). La relación hombre: mujer es de 1.6:1. Con una edad media de 59 años (± 11)5.
Tabla 1 Localización primaria de los tumores neuroendocrinos
| Localización del tumor | Incidencia |
|---|---|
| Gastropancreática | 51.00% |
| – Intestino delgado | 15.04% |
| – Recto | 14.89% |
| – Páncreas | 6.87% |
| Pulmones | 21.34% |
| Origen indeterminado | 12.03% |
Sin tratamiento, el SCC tiene un mal pronóstico, con una supervivencia global a los tres años del 31%. Sin embargo, su pronóstico ha mejorado debido a tecnologías de imagen para la detección y también a opciones terapéuticas más nuevas6.
Fisiopatología
La fisiopatología de la enfermedad se da primordialmente debido a la interacción de 5-HT2, en la formación de lesiones en forma de placa sobre las válvulas cardiacas y se describe de forma más específica en la figura 2.

Figura 2 Fisiopatología del síndrome carcinoide cardiaco (SCC). El daño típico del SCC es causado por péptidos vasoactivos secretados por el tumor, cuyo metabolismo hepático alcanza la circulación cardiaca derecha. La 5-hidroxitriptamina (5-HT) en combinación con prostaglandinas, bradicinina e histamina participan en la proliferación de fibroblastos, activando a receptores 5-HT 1B, 1D, 2A y 2B (dentro de las válvulas cardiacas), produciendo efectos vasoconstrictores, desarrollando la lesión tipo placa del SCC. Esto produce estenosis y/o insuficiencia de las válvulas tricúspide y pulmonar. La afectación del lado izquierdo es rara (15%), ya que la circulación pulmonar inactiva estos péptidos vasoactivos, pero sucede cuando un cortocircuito auricular de derecha a izquierda (como en el foramen oval permeable o los defectos del septum) permite que estos péptidos vasoactivos lleguen a las estructuras izquierdas, evitando su inactivación desde la circulación pulmonar2,4,7.5-HIAA: ácido-5-hidroxiindolacético, serotonina.
Manifestaciones clínicas
La mayoría de los tumores carcinoides son de crecimiento lento y pueden tardar alrededor de 20 años o más en desarrollar síntomas, por lo tanto, se estima que aproximadamente 1/3 de los pacientes (37%) podrían no ser diagnosticados. Sin embargo, cuando el corazón está involucrado en SCC, podría tomar de dos a cinco años desarrollar los síntomas. Las principales manifestaciones del SCC se enlistan en la tabla 25-8.
Tabla 2 Manifestaciones clínicas
| Síntoma o afectación | Frecuencia |
|---|---|
| Soplo sistólico de insuficiencia tricuspídea | 57% |
| Regurgitación tricuspídea | 97% |
| Insuficiencia pulmonar | 81% |
| Estenosis pulmonar | 53% |
| Estenosis mitral | 7% |
| Pelagra o dermatitis en zonas expuestas al sol (alto recambio de ac. nicotínico) | Presentación rara |
| Arritmias supraventriculares | Presentación rara |
| Síndrome coronario no oclusivo | Presentación rara |
| Metástasis a cavidades cardiacas | Presentación rara |
Diagnóstico
La identificación temprana de marcadores bioquímicos puede predecir la presencia y el grado de compromiso cardiaco en el SCC. En la tabla 3 se describen los principales métodos diagnósticos actualmente utilizados para identificar el SCC y para evaluar el estado actual de la enfermedad5,7-9.
Tabla 3 Diagnóstico
| Estudio diagnóstico | Utilidad |
|---|---|
| NT-proBNP* > 260 pg/ml o 31 pmol/l | Sensibilidad 92% Especificidad 91% |
| CgA* | Sensibilidad 100% Especificidad 30% |
| 5-HIAA* en orina 24 h | Sensibilidad 70% Especificidad 85% |
| Ecocardiograma transtorácico | Estándar de oro |
| TC tórax o RM cardiaca | Complementos |
| TC toraco-abdominal, PET-CT con FDG-18 o con octreótida (preferible), PET con DOTA-TOC, DOTANOC, DOTATATE10 | Para evaluar la actividad tumoral a distancia, importante en la toma de decisiones |
*El NT-proBNP en combinación con CgA tiene un importante valor pronóstico en el SCC asociado a una menor supervivencia global a los cinco años (16%)8. Es importante tomar en cuenta que los niveles de ácido-5-hidroxiindolacético (5-HIAA) y cromogranina A sérica (CgA) se alteran fácilmente con el uso de ciertos medicamentos y alimentos, ya que están enriquecidos con triptófano. Para aumentar el valor predictivo de este marcador, se requiere una muestra de orina de 24 horas en ácido acético o clorhídrico. FDG-18: 18 fluorodesoxiglucosa; NT-proBNP: propéptido natriurético de tipo B N-terminal; PET-CT: tomografía por emisión de positrones-tomografía computarizada; RM: resonancia magnética; TC: tomografía computarizada.
Tratamiento
Prevención
La resección quirúrgica del tumor primario puede prevenir el desarrollo del SCC en pacientes con enfermedad temprana. En el entorno metastásico, la mejoría de los síntomas del síndrome carcinoide también se puede lograr con cirugía (metastasectomía, cirugía citorreductora), embolización o ligadura de la arteria hepática (tratamiento locorregional), que también puede prevenir el desarrollo de SCC6,10. El manejo sistémico con análogos de somatostatina mejora la sintomatología reduciendo los niveles séricos de 5-HIAA y/o CgA. Estas opciones pueden usarse en combinación con otros agentes antineoplásicos. La terapia antineoplásica en tumores irresecables o metastásicos puede no funcionar para todos los pacientes, necesitando una evaluación especial, que depende básicamente del grado tumoral y/o la carga tumoral. La observación en situaciones de carga tumoral leve o de bajo grado podría ser suficiente. Actualmente, no hay datos para respaldar una secuencia especial de terapia regional o sistémica, y no hay datos para guiar la secuenciación de los tratamientos. Los tumores de grado intermedio-bajo suelen tratarse con everolimús, y en los tumores de alto grado con agentes citotóxicos con esquemas basados en platino (carboplatino/cisplatino) y etopósido, o combinaciones recientes con capecitabina y temozolomida11. El control adecuado de la enfermedad previene el del SCC (Fig. 3).
Manejo inicial, transoperatorio y postoperatorio
El manejo adecuado del SCC comienza con un enfoque multidisciplinario, que involucra a cardiólogos para el manejo de la insuficiencia cardiaca y la evaluación prequirúrgica, oncólogos para reducir los niveles de péptidos neuroendocrinos con la medicación adecuada y, por supuesto, cirujanos cardiotorácicos4,6. Así como médicos y enfermeros intensivistas para el manejo del cuidado transoperatorio y postoperatorio (Tabla 4).
Tabla 4 Objetivos a lograr durante todas las etapas quirúrgicas en el manejo del paciente con síndrome carcinoide
| Prequirúrgico | Transoperatorio | Postoperatorio |
|---|---|---|
| Calcular riesgo cardiaco (EUROSCORE, STS) | Monitoreo del tiempo quirúrgico, presión arterial principalmente | Vigilancia cercana, buscar signos/síntomas agregados |
| Realizar ECG y evaluar la función cardiaca total. | Evitar hipotensión o hipovolemia | Adecuado manejo del dolor |
| Evaluación y tratamiento del desequilibrio hidroelectrolítico, hipovolemia e hiper/hipoglucemia | Monitoreo de presión pulmonar y evitar broncoespasmo | Continuar infusión de análogos de somatostatina (octreótida) por al menos 24-48 h |
| Medición sérica y urinaria de los niveles de 5-HIAA y de la cromogranina-A en suero | Administrar 50-100 mcg de análogos de octreótida en la inducción anestésica | Manejo sistémico del cáncer, mantener como meta niveles normales de 5-HIAA en orina de 24 h, para evitar recurrencia del daño valvular |
| Uso de benzodiazepinas para manejar el estado de estrés del paciente. Evitar uso de opioides, dopamina y epinefrina (excretan metabolitos del tumor) | En caso de crisis carcinoide: administrar 500 mcg de octreótida en bolus IV | Evitar uso de opioides, dopamina y epinefrina (excretan metabolitos del tumor) |
| Administración de octreótida (100-200 mg/h) 12 h antes de la cirugía | Mantener al paciente eutérmico durante todo el evento quirúrgico | Rehabilitación cardiopulmonar temprana |
| Ketanserina oral 7 días antes de la cirugía, vigilando el rango de QT y arritmias | Evitar uso de opioides, dopamina y epinefrina (excretan metabolitos del tumor) | |
| Administración de antihistamínicos y corticosteroides |
5-HIAA: ácido-5-hidroxiindolacético; ECG: electrocardiograma; QT: quimioterapia; STS: Society of Thoracic Surgeons.
El único tratamiento definitivo del SCC es la cirugía, ya que la principal causa de muerte en estos pacientes es la insuficiencia cardiaca. El reemplazo valvular mecánico o bioprotésico es el estándar. La bioprótesis puede desarrollar una degeneración temprana por falla del injerto y fibrosis guiada por sustancias carcinoides, pero esto puede evitarse mediante el control postoperatorio de los niveles de péptidos neuroendocrinos. A pesar del riesgo de trombosis causado por las válvulas bioprotésicas, la terapia anticoagulante rara vez está indicada. Las válvulas mecánicas, por el contrario, son más duraderas pero requieren terapia anticoagulante a largo plazo, lo que aumenta el riesgo de sangrado y la reintervención quirúrgica por disfunción valvular5,7,12.
Anteriormente, las afecciones de la válvula pulmonar se trataban con valvulectomía y agrandamiento del tracto de salida, ya que la mayoría de los pacientes toleran algún grado de regurgitación pulmonar. Sin embargo, la regurgitación pulmonar, provocada por la valvulectomía, produce remodelación del ventrículo derecho. Así, el reemplazo valvular también es preferible en la valvulopatía pulmonar por SCC. Otros procedimientos quirúrgicos que pueden incluirse son el cierre del foramen oval y la resección de metástasis intracardiacas. La cirugía cardiaca mínimamente invasiva permite lograr esto con un abordaje paraesternal12-14.
Los pacientes con SCC mejorarán drásticamente después de la cirugía, porque el reemplazo valvular restaura completamente el flujo de sangre. Se necesitan algunos días o semanas para que se restablezca la remodelación ventricular13. La mortalidad postoperatoria (5-10%, sin importar el número de válvulas intervenidas) se debe principalmente a la gravedad de la enfermedad de base12.
Los análogos de somatostatina (octreótida, lanreótida) se deben continuar después de la cirugía, a dosis más altas inmediatamente después (octreótida LAR 30 mg cada 14 días) por unas pocas semanas, para reducir el 5-HIAA de manera más eficiente. Su uso está enfocado al control sintomático y estabilización de crisis carcinoide, ya que no detienen la progresión de la enfermedad ni prolongan la supervivencia5,8. La terapia sistémica antineoplásica (descrita anteriormente) y/o la intervención locorregional (embolización o ligadura de la arteria hepática) también serían necesarias después de la cirugía. El objetivo de estos tratamientos, además de mejorar el control de la enfermedad, es mantener niveles bajos de 5-HIAA y/o CgA, ya que su elevación se relaciona con el desarrollo de SCC15.
Para aquellos pacientes que desarrollan síntomas refractarios, hay pocas opciones para tratarlos, como etil-telotristat (diarrea refractaria del síndrome carcinoide, podría usarse junto con análogos de somatostatina, que reducen significativamente la diarrea y 5-HIAA), interferón alfa (en la enfermedad refractaria a los análogos de la somatostatina, para reducir la carga tumoral, aunque la toxicidad es limitante) y la terapia con radionúclidos de receptores peptídicos con 177 Lu-dotatato (lutecio), que hoy en día se considera como parte del manejo sistémico y ha demostrado buen control de la enfermedad, con toxicidad manejable2,12,16.
Discusión
El SCC es un escenario complejo, que merece un amplio reconocimiento en la práctica clínica y un abordaje multidisciplinario objetivo. Este caso describe la importancia de identificarlo. La paciente fue detectada con SCC y tratada oportunamente, lo que ha permitido que siga en tratamiento y con buena calidad de vida.
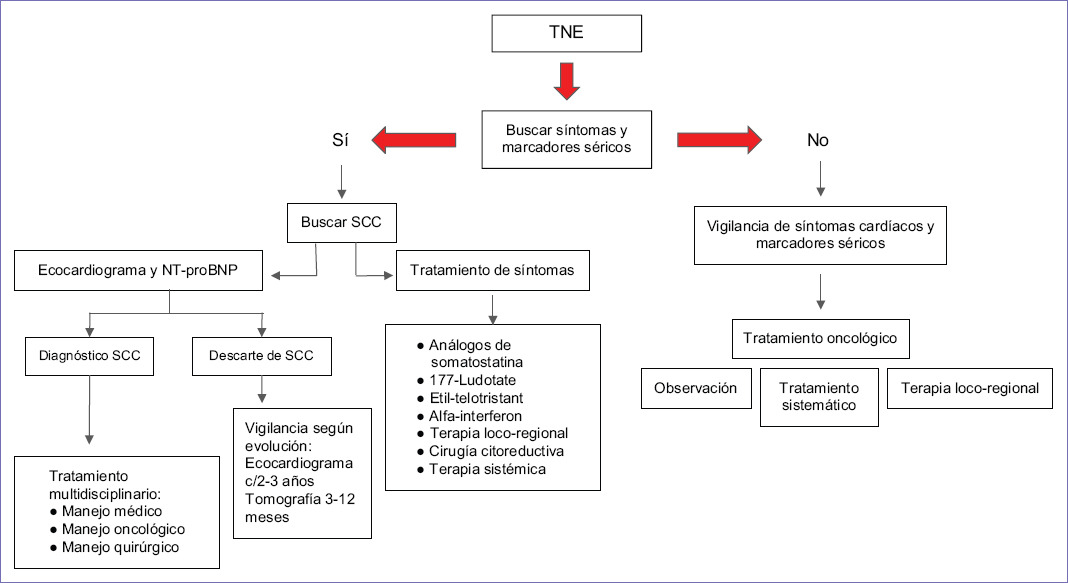
La prevención del SCC podría ser nuestro próximo objetivo en pacientes con este tipo de tumores, reduciendo oportunamente los metabolitos de la serotonina en estos pacientes. Además, se debe identificar temprano durante la evolución de la enfermedad metastásica. Recientes guías de 20172 recomiendan la detección temprana del SCC, por medio de su algoritmo de tamizaje, el cual solo está enfocado a la detección y manejo cardiaco. Aquí sugerimos un algoritmo de detección temprana de SCC para pacientes ya diagnosticados con tumor neuroendocrino (TNE) metastásico, que incluye seguimiento, manejo cardiaco y oncológico. También sugerimos objetivos preoperatorios, transoperatorios y postoperatorios.
Posteriormente, los pacientes deben continuar con el tratamiento sistémico y/o locorregional del TNE metastásico para lograr una mejor supervivencia global, como describimos en nuestro caso, que ha sido tratada con éxito y aún se encuentra con buena calidad de vida a cinco años de la cirugía cardiaca.
El comportamiento de crecimiento lento de estos tumores, así como los recientes agentes sistémicos y procedimientos locorregionales, hace que el SCC sea digno de abordar de manera temprana y factible de tratar con procedimientos mínimamente invasivos con excelentes resultados, para mejorar la calidad de vida de los pacientes.











 nueva página del texto (beta)
nueva página del texto (beta)