Introducción
Las lesiones subepiteliales en el estómago son hallazgos relativamente comunes en endoscopias digestivas altas. A menudo descritas como submucosas, estas lesiones se denominan más correctamente subepiteliales porque pueden surgir de capas de la pared gástrica distintas de la submucosa histológica o de la compresión extrínseca del estómago por varias estructuras intraabdominales normales o anormales. En la práctica, la evaluación diagnóstica y el manejo posterior de las masas subepiteliales varía considerablemente debido a que los abordajes de estas lesiones están actualmente en evolución1,2.
Los tumores subepiteliales gástricos (TGSE) se pueden dividir en lesiones benignas, lesiones potencialmente malignas y lesiones malignas. Las lesiones benignas incluyen leiomioma, schwannoma, lipoma y páncreas ectópico. Los TGSE malignos o potencialmente malignos incluyen tumores del estroma gastrointestinal (GIST), linfomas, tumores carcinoides y tumores glómicos. Las diferentes características del tumor, la prevalencia y la planificación del tratamiento dependen del diagnóstico anatomopatológico. Los GIST son los TGSE más comunes en el estómago, seguidos de los leiomiomas y los schwannomas. Estos tres TGSE generalmente se identifican mediante ultrasonido endoscópico (USE) en la capa muscularis propria. A pesar de los equipos y estudios de diagnóstico avanzados, los TGSE aún son difíciles de diagnosticar con métodos no invasivos antes de la operación, como esofagogastroduodenoscopia, USE y tomografía computarizada (TC)3,4.
Se considera que los TGSE que se diagnostican preoperatoriamente como GIST deben ser extirpados quirúrgicamente como lesión potencialmente maligna, aunque existe una ligera discordancia a nivel mundial según el tamaño tumoral, la existencia de síntomas, etc. Por lo tanto, diagnosticar si los TGSE son GIST es clave para llevar a los pacientes a una estrategia de tratamiento precisa5.
Las guías de tratamiento más recientes recomiendan vigilancia endoscópica una o dos veces al año en tumores gástricos mesenquimales < 2 cm de tamaño hasta volverse sintomáticos o aumentar de tamaño. Por el contrario, la resección quirúrgica se recomienda para tumores > 5 cm. En caso de TGSE de 2 a 5 cm, se recomiendan procedimientos invasivos como la toma de biopsia guiada por USE para obtener confirmación histológica. Por tanto, la medición exacta del tamaño del TGSE es importante para decidir el tratamiento. Cuando el tamaño de un TGSE es similar o decrece en la endoscopia de seguimiento 6 a 12 meses después, el tumor puede ser benigno. Por el contrario, cuando el tamaño de un TGSE aumenta rápidamente en la endoscopia de seguimiento, aumenta el potencial maligno. Si bien a la imagen por TC y la resonancia magnética nos pueden mostrar las ciertas características, el diagnóstico definitivo se basa únicamente en el estudio histológico e inmunohistoquímica, por lo que la resección quirúrgica completa representa el tratamiento de elección6,7.
El objetivo de este artículo es describir un caso clínico de TGSE con presentación clínica sintomática, que se manejó con resección sin diagnóstico preoperatorio, con evolución satisfactoria y pronóstico excelente tras la resolución quirúrgica.
Caso clínico
Se trata de una paciente de 43 años. Antecedentes de importancia para padecimiento actual: la madre falleció por leucemia mieloide aguda, la tía materna falleció por cáncer renal metastásico. En enero de 2021 cursa con sangrado de tubo digestivo alto, con hematemesis y melena, que requirió hemotransfusión sin reacciones, con hemoglobina que alcanza 7.0 g/dl. Protocolo diagnóstico: se realiza panendoscopia con evidencia de tumor en antro gástrico con úlcera central no activa, Forrest IIB. Biopsia de la úlcera reportada negativa para neoplasia maligna. Tomografia axial abdominopélvica simple y contrastada con estómago distendido por contenido homogéneo dependiente de la pared posterior de la curvatura menor, se identifica tumor sólido, lobulado de contornos definidos que disminuye el calibre del estómago en este sitio. Al contraste tiene reforzamiento heterogéneo y medidas de 7.3 x 5.5 x 6.7 cm. En región pélvica se identifica ovario izquierdo que muestra dos imágenes quísticas, la de mayor tamaño con eje máximo de 3.8 cm y la otra de 1.8 cm. Se observa líquido libre en fondo de saco.
TC de tórax con hallazgo de nódulo sólido irregular subpleural con eje máximo de 12 mm con atenuación de 15 UH en fase simple y posterior al contraste con reforzamiento heterogéneo de hasta 53 UH.
Se lleva a sala de operaciones el día 9 de febrero de 2021, se realiza laparotomía exploratoria, resección de tumor en la cara posterior del estomago (Fig. 1), realizándose una gastrectomía parcial (Fig. 2) con reconstrucción gastro-yeyuno-anastomosis en Y de Roux + ooforectomía izquierda. Posteriormente se coloca en posición de decúbito lateral izquierdo y bajo vídeo-toracoscopia se reseca lesión sospechosa en lóbulo inferior del pulmón izquierdo. No hay accidentes ni incidentes, sangrado mínimo, la enferma cursa el posquirúrgico sin complicaciones, tolera la vía oral al 5.o día de postoperatorio.
Reporte histopatológico
Producto de gastrectomía parcial: por la curvatura mayor mide 14.2 cm y por la menor 5.8 cm, presenta un diámetro máximo de 6.2 cm, la serosa es de color café, lisa con zonas lobuladas de color café rojizo, superficie opaca; con zonas despulidas y serosas. A la apertura, previo entintado de márgenes se identifica un tumor que mide 7.2 x 6.1 cm, se encuentra situado en la pared gástrica, es submucoso, en los cortes seriados es de color blanco amarillo con áreas de consistencia disminuida presenta márgenes bien definidos, sobreelevados, en la región central se observa zona ulcerada y en los cortes seriados se encuentra a 0.1 cm de la serosa; está a 0.6 cm del margen proximal y 4.3 cm del margen distal. La mucosa cercana al tumor preserva los pliegues, es de color café rojizo y en el antro y píloro muestra zonas finamente granulares. Del tejido adiposo de la curvatura mayor y menor se obtienen nódulos ovoides de color café claro, además se observan zonas de congestión vascular moderada. Por separado se recibe ovario izquierdo, es un fragmento de tejido que pesa 28 gramos y mide 5.7 x 3.6 cm, presenta serosa de color gris claro, opaca al corte se observa lesión quística y regular que mide 5.2 cm de eje mayor, con superficie interna lisa de color amarillo claro y escaso, con salida de líquido de aspecto citrino. Finalmente, en tercer contenedor se recibe un fragmento de biopsia de lesión pulmonar basal izquierda, pesa 7 gramos y mide 6.8 x 2.3 x 1.1 cm, presenta superficie pleural de color café claro, con áreas despulidas, el márgen se encuentra ocluido con grapas. Al corte existen áreas de color gris de aspecto irregularmente nodular rodeados por escaso parénquima pulmonar de aspecto esponjoso.
En las preparaciones histológicas del tumor gástrico se identifica neoplasia mesenquimatosa situada en la pared, se encuentra bien delimitada, está conformada por haces cortos de células ahusadas de tamaño intermedio con moderado citoplasma eosinófilo claro, núcleos alargados, puntiformes con una mitosis en 50 campos de alto poder, presenta áreas en rehilete y se identifica de manera focal áreas hipercelulares que alternan con áreas hipocelulares. Muestra zonas de aspecto fibroso y de manera focal se identifican zonas de leve atipia e hipercromasia, se encuentra muy cercano a la serosa, en la que se observa extraluminización eritrocitaria. La mucosa exhibe foveolas regulares levemente elongadas revestidas por epitelio de tipo antral con escasos bacilos Helicobacter pylori, con moderado infiltrado inflamatorio linfocitario disperso y leve edema estromal, no se observa atrofia, metaplasia o H. pylori. La neoplasia no contacta los márgenes de resección, posee necrosis ni muestra invasión linfovascular. Los ganglios linfáticos muestran leve congestión vascular moderada y dilatación sinusoidal (Fig. 3). Las preparaciones histológicas del ovario izquierdo presentan lesión quística rodeada parcialmente por células cuboides con núcleos pequeños, ovales, sin atipia. La pared es fibrosa. De manera focal se observan glándulas de aspecto endometrial; además se observan cuerpos amarillos y cuerpos blancos. No se observan datos morfológicos de malignidad. La biopsia de lesión pulmonar basal izquierda exhibe arquitectura parcialmente preservada con alvéolos que muestran septos alveolares, con ruptura focal y formación de clavas, en otras zonas se observa colapso focal con engrosamiento extenso de las paredes alveolares, formación de cuerpos de Masson, además de zonas de fibrosis hialinizado, existen zonas de macrófagos con pigmento negro. En la mucosa bronquial, con adecuada maduración, existe fibrosis mínima en la membrana basal; en la lámina propia se observa moderado infiltrado inflamatorio linfocitario (Tabla 1).
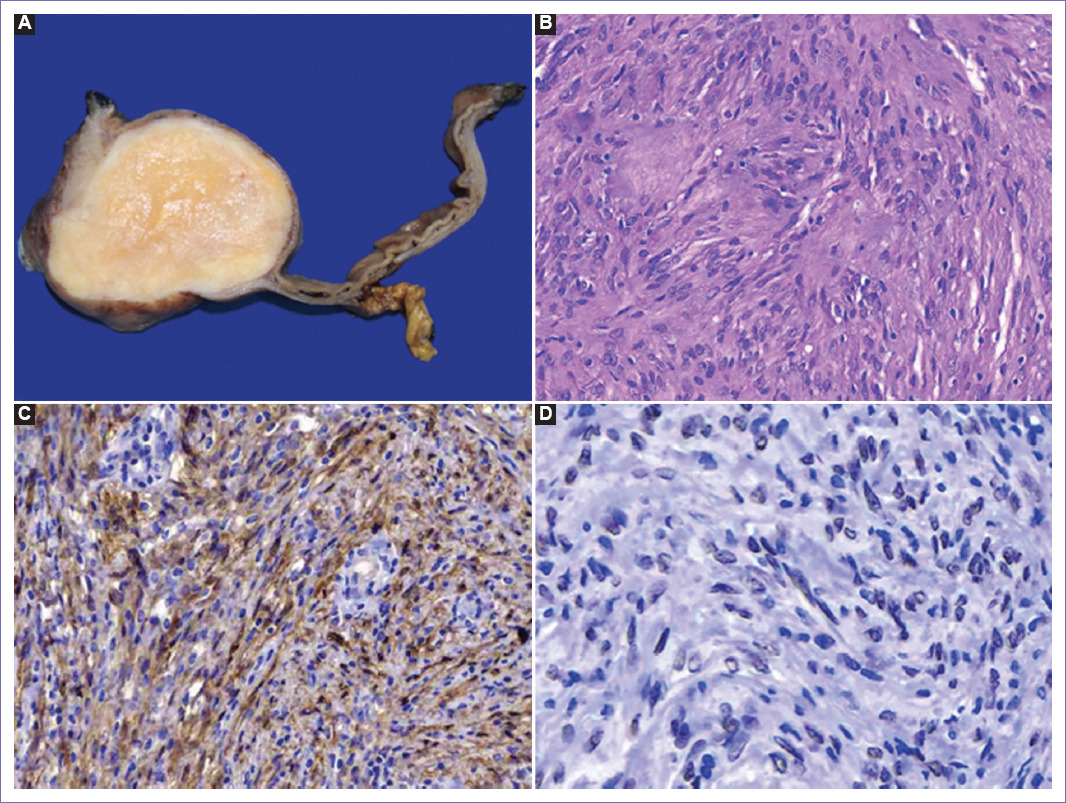
Figura 3 Reporte histopatológico. A: aspecto macroscópico. B: aspecto microscópico de la lesión. C: reacción a la tinción S100. D: reacción a la tinción SOX10.
Tabla 1 Informe anatomopatológico
| Tipo de procedimiento | Gastrectomía distal, ooforectomía izquierda y biopsia de lesión pulmonar basal izquierda |
| Sitio del tumor | Curvatura mayor |
| Tamaño del tumor | 7.2 x 6.1 cm |
| Focalidad | Unifocal |
| Tipo histológico | Schwannoma con áreas senescentes |
| Índice mitósico | 1 mitosis en 5 mm2 |
| Necrosis | Ausente |
| Márgenes de resección | Negativos, proximal a 0.4 cm |
| Número de ganglios examinados | 11 ganglios perigástricos |
| Número de ganglios involucrados | 0 (cero) |
Resultado de inmunohistoquímica
Se realiza estudio de inmunohistoquímica con los siguientes marcadores: S100, SOX10, CD117, DOG-1, actina, CD34 y ALK1; utilizando controles conocidos que resultaron positivos y suero control que resultó negativo, en una corrida validada (Tabla 2).
Discusión
De acuerdo con la literatura revisada, los TGSE representan un reto clínico tanto para el diagnóstico como para el manejo. La mayoría de los TGSE son benignos en el momento del diagnóstico y < 15% resultan ser malignos. Sin embargo, si un TGSE es benigno o maligno no se puede establecer sobre la base de los hallazgos de la biopsia endoscópica ordinaria6,7.
Ante tal escenario, Nishida et al.8 describen las siguientes interrogantes: ¿Existen características de malignidad? ¿Cuál se considera la histología o el origen más probable? ¿Requiere intervención terapéutica o es posible una conducta expectante? ¿Cuál es el mejor enfoque terapéutico? En el presente caso, por el tamaño y por la manifestación clínica de sangrado con repercusión en el hemograma se optó por un manejo quirúrgico en primera instancia, tomando en consideración las lesiones ovárica y pulmonar descritas en los estudios de extensión.
Cruz-Centeno et al.9 describen que la mayoría de los pacientes son asintomáticos, sin embargo los síntomas pueden incluir dolor abdominal, sangrado gastrointestinal superior, disminución del apetito, dispepsia, náuseas o vómitos. Los schwannomas gástricos pueden confundirse con otras neoplasias según los hallazgos endoscópicos y de imágenes. Por lo general, se diagnostican erróneamente como tumores GIST. Es importante diferenciar los schwannomas de otros tumores gástricos con mayor potencial maligno, ya que esto determinará el abordaje quirúrgico y la extensión de la resección. En este caso, así como en el descrito por Cruz-Centeno et al., tanto la TC como los estudios endoscópicos sugirieron un GIST a pesar de que la patología, apoyada en los estudios de inmunohistoquímica, reveló finalmente un schwannoma gástrico9.
Si bien dentro de la búsqueda intencionada no se encontraron guías oncológicas de manejo que describan cuál debe ser la conducta ante un TGSE, es el cirujano oncólogo quien de acuerdo con su conocimiento y experiencia debe estar preparado para una correcta toma de decisiones, por lo que, aunque no es lo habitual en nuestro ejercicio, se decide la intervención quirúrgica sin estudio anatomopatológico preoperatorio, considerándose como principio universal el muestreo ganglionar y la obtención de márgenes de resección negativos, considerando que algunos TGSE tienen potencial de metastatizar a los ganglios, por lo cual la linfadenectomía es básica, ya que es pronóstica y necesaria para poder definir la adyuvancia10,11.
En el schwannoma gástrico, la transformación maligna y recurrencia es infrecuente. La cirugía suele ser el tratamiento de elección, aunque en aquellos con un tamaño menor de 30 mm o con invasión superficial de la muscular propia, la resección endoscópica puede ser una alternativa. La terapia quirúrgica es la cura en la mayoría de los casos sin ninguna otra terapia adyuvante. El abordaje depende del tamaño del tumor, la localización, la experiencia y la preferencia del cirujano. Debido a la naturaleza y frecuencia de este tumor, la literatura disponible consiste en informes de casos, series de casos, estudios de casos y controles y revisiones. Después de la cirugía de margen libre el pronóstico es excelente, algunos argumentan que el riesgo de transformación maligna es teórico y que los hallazgos histológicos, como el tamaño del tumor y la tasa mitósica no tienen importancia pronóstica, pero desde que se han descrito schwanomas malignos y el seguimiento en tumores mayores de 10 cm o con una tasa mitótica > 10/50 HPF es limitada, se debe considerar una vigilancia clínica, endoscópica y tomográfica de acuerdo con cada paciente10-12.
Conclusión
En el presente artículo se expone el caso de una paciente con TGSE con presentación clínica sintomática, que se manejó con resección sin diagnóstico preoperatorio, con evolución satisfactoria, pronóstico excelente tras la resolución quirúrgica, cuyo diagnóstico final fue schwannoma gástrico.











 nueva página del texto (beta)
nueva página del texto (beta)




