Introducción
El rabdomiosarcoma es el sarcoma de tejidos blandos más frecuente en edades tempranas (infancia y adolescencia), los subtipos incluyen el alveolar, de células fusiformes/esclerosante, embrionario, de tipo mixto, pleomórfico y rabdomiosarcoma con diferenciación ganglionar1,2. Los rabdomiosarcomas son neoplasias asociadas con un fenotipo rabdomioblástico proveniente de células mesenquimales que dan origen al musculo esquelético3.
El rabdomiosarcoma alveolar (RMSa) se presenta en un 30% de todos los rabdomiosarcomas3. Se puede presentar en cualquier parte del cuerpo4, sin embargo la localización anatómica más frecuente son las extremidades, antebrazos y brazos, regiones perirrectal y perineal5,6. La mayoría de los RMSa son de aparición esporádica, de alto grado y pueden presentarse en un estadio diseminado avanzado afectando los pulmones, ganglios linfáticos y médula ósea2. El compromiso de los ganglios linfáticos periféricos es una de las primeras manifestaciones del RMSa en los casos avanzados, por lo que se clasifican dentro de los rabdomiosarcomas de peor pronóstico junto con el pleomórfico y los rabdomiosarcomas asociados al gen de fusión TFCP2 (Factor de transcripción alfa-globina CP2) y con MyoD1 mutada6,7.
Morfológicamente el RMSa se compone de una proliferación de células pequeñas de núcleos redondos con características nucleares de alto grado y con escaso citoplasma. El tumor presenta un patrón de nidos separados por tabiques fibrosos. Las células se disponen en láminas discohesivas que forman espacios alveolares o de forma menos llamativa en espacios en forma de hendidura2. Se han descrito dos subtipos histológicos del RMSa. El subtipo clásico conformado por células neoplásicas con espacios alveolares en donde se pueden observar células gigantes multinucleadas y fibras musculares normales. El subtipo sólido conformado por nidos separados por tabiques fibrovasculares delgados sin formación de alvéolos. Con frecuencia hay focos de necrosis de células tumorales y anaplasia8,9.
El diagnóstico se realiza por medio del estudio morfológico asociado con la positividad de marcadores musculares esqueléticos evaluados por inmunohistoquímica10. En ocasiones su morfología puede asemejar a carcinomas epiteliales o carcinomas neuroendocrinos, lo cual puede generar un inadecuado diagnóstico debido a que en ocasiones el RMSa puede tener expresión aberrante de estos marcadores, como en el caso que presentamos a continuación.
Descripción del caso
Mujer de 78 años de edad con dolor y sensación de masa con crecimiento rápido y progresivo en región inguinal izquierda de ocho meses de evolución. En la tomografía de abdomen y pelvis se observa masa de tejidos blandos de 88 x 118 mm de forma heterogénea con áreas sugestivas de necrobiosis, dicha formación engloba la arteria femoral común izquierda y el tercio proximal de las femorales superficiales.
Se realizó biopsia incisional de lesión en la cual se observó: tejidos blandos infiltrados por neoplasia maligna conformada por células de pequeño a mediano tamaño redondas y ovaladas, hipercromáticas con figuras mitóticas frecuentes, de citoplasma escaso, en patrón de nidos que conforman un aspecto alveolar separado por tractos fibrosos. En la figura 1 se observa la morfología con tinción de hematoxilina y eosina a menor y mayor aumento.
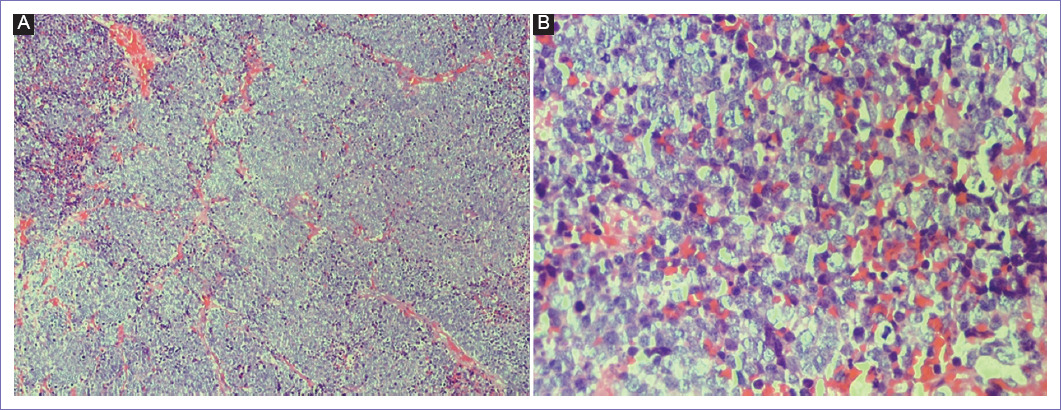
Figura 1 A: vista en 4x. Obsérvese en la fotografía del lado izquierdo el patrón alveolar, separado por tabiques fibrosos. B: en 40x se observa con mayor detalle la célula neoplásica con escaso citoplasma y núcleo redondo con cromatina abierta.
En los estudios de inmunohistoquímica se observó positividad para marcadores musculares esqueléticos (MyoD1, desmina y miogenina), marcadores epiteliales (CKAE1/AE3 y CAM5.2), marcadores neuroendocrinos (sinaptofisina, cromogranina, CD56), PAX5 positivo focal y negatividad para CK20, S100 HMB45, CD20, CD3, CD34, AML, FLI-1, P63 y Ki67 del 90%. En la figura 2 se observa el patrón de tinción de la MyoD1, CKA1/AE3 y CAM 5.2. En la figura 3 se muestra la expresión de los marcadores neuroendocrinos, con un patrón de tinción similar. Con los hallazgos morfológicos y los estudios de inmunohistoquímica el diagnóstico definitivo fue un rabdomiosarcoma alveolar de subtipo clásico con expresión aberrante de marcadores epiteliales y neuroendocrinos.
Discusión
La expresión aberrante se define como «expresión de un antígeno inesperado en una línea celular en cuestión, pero que no altera la asignación de linaje». La explicación molecular en la aberrancia de marcadores de inmunohistoquímica se fundamenta en el fenómeno en el que las células tumorales pierden o adquieren estructuras proteínicas de unión de membrana u otras proteínas de diferenciación mesenquimal, remodelando la matriz extracelular, facilitando la migración o diferenciación9,10; se ha documentado que la transición epitelio-mesénquima aberrante coadyuva a darle propiedades invasoras y metastásicas de las células neoplásicas10.
El presente caso en particular es interesante en varios aspectos, por la edad de presentación, en paciente anciano, adicionalmente la expresión aberrante de marcadores epiteliales y neuroendocrinos, que puede desencadenar diagnósticos y tratamientos inadecuados en los RMSa10,11. La expresión de marcadores epiteliales se ha reportado hasta en la mitad de los RMSa en cabeza y cuello2, seguido de las extremidades, región perirrectal/perianal. Mientras que la expresión de marcadores neuroendocrinos se ha reportado en muy pocos casos en la literatura. Bahrami et al.9 en un estudio de 44 RMSa de pacientes con una edad media de 18 años, encontraron que el 50% de los casos expresaron citoqueratina, el 43% expresó uno de los marcadores neuroendocrinos específicos, el 32% expresó sinaptofisina, el 22% expresó cromogranina A y el 11% manifestó ambos. La expresión de CD56 fue positivo en el 97% de los casos. La revelación de estos marcadores neuroendocrinos se limitaba principalmente en las células atípicas. Leroy et al.12, en su reporte de caso de un joven de 19 años con tumor polipoide maxilar con extensión orbital, evidenciaron un rabdomiosarcoma pobremente diferenciado con fenotipo inmunohistoquímico poco común, con reactividad para desmina, miogenina, y expresión aberrante de cromogranina y sinaptofisina con tinción paranuclear. En la tabla 1 se muestra el resumen de hallazgos de los autores descritos.
Tabla 1 Muestra diferentes casos con asociación de marcadores por inmunohistoquímica epiteliales y neuroendocrinos
| Autores | N.º casos RMSa | Grupo etario | Ubicación del tumor | CKAE1/AE3 | Syn | Crom | PAX5 | CD56 |
|---|---|---|---|---|---|---|---|---|
| Bahrami et al., 20089 | 44 | Adolescentes y adultos jóvenes | Varios sitios | 50% (22/44 casos) | 32% (12/37 casos) | 22% (8/36 casos) | NA | 97% (30/31 casos) |
| Leroy et al., 200712 | 1 | 19 años | Nasosinusal | No reactivo | (+) en células tumorales | (+) en células tumorales | NA | |
| Coindre et al., 199823 | 3 | Rango de 1 mes a 32 años | Cabeza y cuello | (+) | (–) | (–) | (–) | (–) |
| Palencia et al. (caso que se presenta) | 1 | 78 años | Miembro inferior | (+) en células tumorales | (+) en células tumorales | (+) en células tumorales | (+) focal en células tumorales | (+) en células tumorales |
RMSa: rabdomiosarcoma alveolar; Syn: sinaptofisina; Crom: cromogranina; PAX5: factor de transcripción miembro de la familia (paired box) PAX; CD56: molécula de adhesión celular de utilidad para definir estirpe neuroectodérmica tumoral; NA: sin información o no aplica para el estudio en particular.
Es importante destacar que para el diagnóstico es fundamental documentar la diferenciación miogénica por inmunohistoquímica y pruebas moleculares por hibridación fluorescente in situ que puede ayudar a distinguir entre el patrón denso del rabdomiosarcoma embrionario y el RMSa, analizando el producto del gen de fusión que ocurre en el 80% de los rabdomiosarcomas alveolares PAX3-FOXO1 y PAX7-FOXO113. El rabdomiosarcoma esclerosante molecularmente con ausencia de fusión de FOXO1, con mutaciones recurrentes de MyoD1, amplificación de MDM2/HMGA2, pérdida del 10q22, pérdida del cromosoma Y y amplificación de la región del cromosoma 12q13,15. Botiralieva et al. y Sullivan et al. evaluaron PAX como marcador diagnóstico en tumores de células pequeñas redondas y azules, con siete casos de RMSa, de los cuales cinco tenían translocaciones que involucraron genes PAX16. Morgenstern et al. identificaron un total de 42 casos, 15 correspondieron a RMSa con traslocaciones que involucraban el PAX7 o PAX3 en el 47% de los casos, también la expresión de PAX5 en RMSa por inmunohistoquímica en el 60% de los casos, con algún grado de tinción nuclear17.
Los diagnósticos diferenciales que se deben considerar en el presente caso incluyen la evaluación morfológica inicial y otros tipos de rabdomiosarcoma como, el embrionario y el esclerosante. Estos suelen ser conformados por células tumorales pequeñas y fusiformes, algunos con patrones morfológicos raros que incluyen el rabdomiosarcoma con características rabdoides5,18. Los otros diagnósticos diferenciales del presente caso son:
- Carcinoma de células pequeñas con diferenciación músculo-esquelética. Eusebi et al. presentaron tres casos (piel y tejido subcutáneo, vejiga urinaria y cavidad nasal), compuestos por dos tipos celulares: uno de características neuroendocrinas de célula pequeña convencional, de núcleos redondos con cromatina granular fina, escaso citoplasma, con reactividad para enolasa, cromogranina y citoqueratinas; el segundo tipo de célula era plasmocitoide alargada y con forma de filete, con abundante citoplasma eosinófilo y núcleos irregulares con nucléolos prominentes, con positividad para desmina, AML (actina de músculo liso), mioglobina y miogenina; todos los casos con particular evidencia ultraestructural de diferenciación rabdomioblástica19.
- Melanoma primario con expresión aberrante de marcadores neuroendocrinos. Lee et al. estudiaron casos de melanoma nasosinusal primario, con cuatro casos de población de células pequeñas, desprovistas de pigmento, algunos completamente negativos o solo focales para S100, tres de los cuales fueron positivos para marcadores neuroendocrinos y proteína de neurofilamento, con diagnósticos diferenciales que tener en cuenta con esta expresión: el neuroblastoma olfativo y el carcinoma neuroendocrino de células pequeñas20. Al igual que Cham et al. que describen un caso de melanoma maligno con diferenciación neuroendocrina de un hombre de 74 años con masa pulmonar con marcado pigmento, el cual reveló positividad para SO100, SOX10, MITF, sinaptofisina y CD5621.
- Linfoma linfoblástico con expresión aberrante de sinaptofisina, descrito por Nazım Emrah et al., en una paciente de sexo femenino de 9 años de edad con masa en mediastino anterior, derrame pleural y linfadenopatías. En biopsia se evidenció inmunofenotipo positivo para ALC, CD2, CD3, CD10, CD1a, TDT, sinaptofisina, con Ki67 del 90%, y negatividad para CD20, pancitoqueratina, CK19, cromogranina y CD5622.
Conclusión
En conclusión, el rabdomiosarcoma alveolar en una edad de presentación inusual, con expresión aberrante de marcadores epiteliales (citoqueratina) y marcadores neuroendocrinos (cromogranina, sinaptofisina y CD56), es un reto diagnóstico. Este hallazgo es poco frecuente y puede conllevar dificultades en el análisis o diagnósticos conclusivos erróneos, es por esto que se deben considerar como diferenciales otros tipos de rabdomiosarcoma, un carcinoma neuroendocrino con diferenciación muscular esquelética, el melanoma maligno primario con diferenciación neuroendocrina y por último un linfoma con expresión aberrante de marcadores neuroendocrinos.











 nueva página del texto (beta)
nueva página del texto (beta)




