Introducción
La glándula submandibular está involucrada en solo el 5-10% de los tumores de las glándulas salivales, el adenoma pleomórfico (AP) es el tumor que afecta más comúnmente esta glándula1. El tratamiento estándar para el tratamiento inicial es la resección quirúrgica completa y la tasa de recurrencia después de la resección inicial es inferior al 5% si el tumor se extirpa por completo con la cápsula intacta2. La ruptura capsular o el derrame del tumor pueden provocar recurrencias multifocales a pesar de la naturaleza benigna de la enfermedad. Después de que el tumor recurre una vez, la tasa de recurrencia posterior es de aproximadamente el 50%3. Si el AP no se trata, cerca del 25% sufre transformación maligna con el tiempo4.
En menos del 1% de los casos los AP sufren transformación maligna, especialmente los que han presentado múltiples recidivas. Estos tumores se denominan ex-adenoma pleomorfo (ex-AP)5.
Las metástasis de AP representan el 1%6 y la transformación de adenoma a carcinoma es más común en la glándula submaxilar y es menor en las glándulas accesorias7.
Objetivo
Presentar un caso de adenoma pleomorfo recurrente metastásico y realizar una comparación con la literatura existente.
Presentación de caso
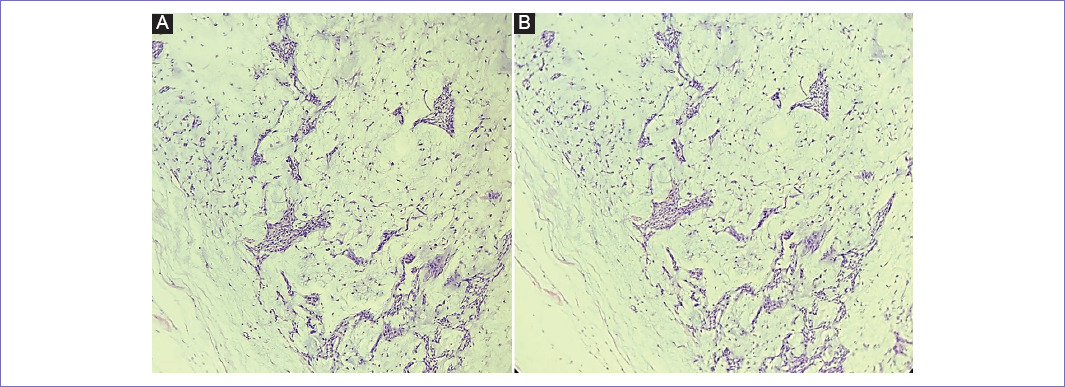
Mujer de 43 años de edad sin antecedentes de importancia con aumento de volumen de la región submandibular derecha con posterior toma de biopsia que reportaba AP. Se realizó una enucleación fuera de nuestro centro y tres años posterior a dicho procedimiento presentó recurrencia en la misma glándula. Se realizó un ultrasonido que reveló tumoración en nivel 1 y 2 del cuello. Se decidió realizar resección de la recurrencia retirando los niveles I-III del cuello, con hallazgos de múltiples tumoraciones sólidas de hasta 2 cm, con estudio transoperatorio con márgenes quirúrgicos negativos, con resultado histopatológico final de AP de 7 cm de eje mayor, multinodular, con lesión en bordes quirúrgicos de sección y ocho ganglios linfáticos con hiperplasia linforreticular (Fig. 1). Al presentar márgenes quirúrgicos positivos se decidió dar radioterapia adyuvante en dos fases, la primera con fotones 45 grays en 25 fracciones y la segunda con electrones de 60 grays en 35 fracciones. Un año después se observó recurrencia en cicatriz quirúrgica con nódulo de 1 cm, por lo que se solicitó un ultrasonido que reporta dos nódulos en sitio quirúrgico nivel IIB de 1.5 cm y 0.8 cm, por lo que se llevó a resección de sitio de recurrencia con resultado de AP en tejido celular subcutáneo de 1.2 cm sin tumor en bordes quirúrgicos. Se dejó en vigilancia. Tres años después (siete años posterior a la resección primaria) se detecta recurrencia por tomografía en zona pretraqueal, prelaríngea y en nivel I ganglionar y fosa amigdalina, por lo que fue llevada a resección de dicha lesión, posteriormente con resultado histopatológico final de AP en ganglios linfáticos cervicales y en fosa palatina con márgenes negativos (Fig. 2). Actualmente continua en vigilancia sin datos de nueva recurrencia, ya a 12 años del procedimiento inicial.
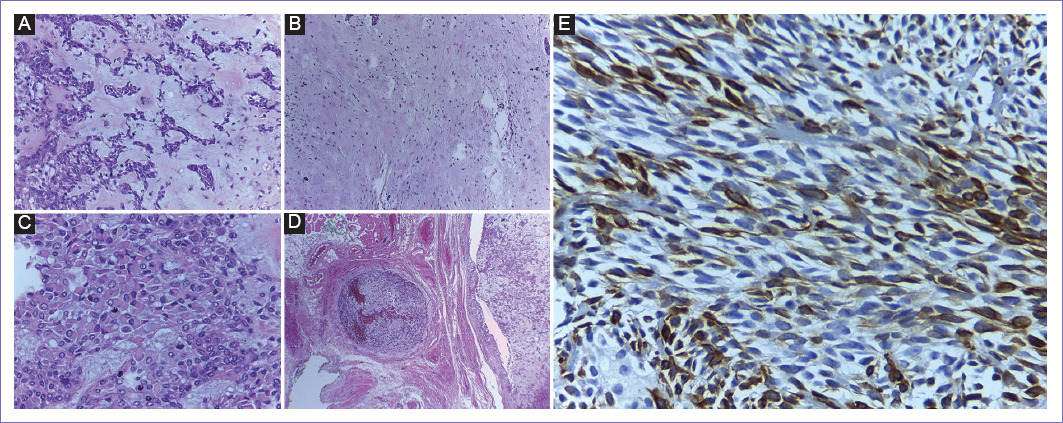
Figura 1 Resultado histopatológico con adenoma pleomorfo recurrente. Lesión trifásica: epitelial (ductal y mioepitelial) (A) y estromal (B). Componente estromal condromixoide: células mioepiteliales plasmocitoides (C), pseudópodo de adenoma pleomorfo con aspecto de pseudoinvasión al tejido conectivo adyacente (D), inmunohistoquímica (E). Componente epitelial bifásico: proteína ácido glial fibrilar positiva en células mioepiteliales (tinción café) y negativas en células ductales (tinción azul claro).
Discusión
Dentro de los factores de riesgo para recurrencia de nuestra paciente, el sexo femenino y la edad de presentación del tumor inicial son factores bien estudiados. El realizar de manera inicial enucleación se asocia con una recurrencia de hasta el 45%, en contraste con las bajas tasas de recurrencia (1-4%) informadas después de la parotidectomía superficial, además, debido a la cirugía podemos observar dos patrones de recurrencia local. El primero unifocal debido a la ausencia focal de una cápsula en AP y este puede tener de manera microscópica pseudópodos de células fuera de las enucleaciones realizadas y predispone al crecimiento desde las células residuales (residual), o multifocal debido a la ruptura capsular de la lesión con siembra del campo quirúrgico, por lo que se aumenta la tasa de recurrencia en un 5% en comparación con la parotidectomía sin derrame tumoral8. Además, de existir un aumento en el riesgo de malignidad en pacientes previamente tratados con resección o radioterapia9.
El tiempo de evolución desde la recurrencia, como en nuestra paciente, conlleva un riesgo de malignidad del 1.5% en los cinco primeros años y tiende a recurrir en un promedio de 7-10 años10, con un aumento al 9.5% una vez que el tumor supera los 15 años de evolución11, y un riesgo mayor con cada recaída a transformación en carcinoma ex-AP9,12,13.
Al momento de realizar la cirugía, el estudio transoperatorio reveló márgenes negativos, que en el estudio final fueron positivos, creemos que esto es en parte por la multifocalidad del tumor que está presente hasta en el 73% de los AP recurrentes (APR)14, además muchos nódulos miden menos de 1 mm y están en el tejido celular subcutáneo, por lo que tienen una alta incidencia de segunda recurrencia10.
El AP es un tumor de componente epitelial y mesenquimatoso condromixoide; se sabe que el APR ocurre con mayor frecuencia en tumores que son de naturaleza hipocelular y condromixoide15.
Existen algunos predictores biológicos de recurrencia la sobreexpresión de cadherina 11 (proteína de adhesión) y la proteína de agrupación de fascina/actina 2 (proteína de motilidad celular y el desprendimiento de las células tumorales)16, además en los análisis inmunohistoquímicos para investigar la expresión de proteínas del ciclo celular en AP, APR y carcinoma ex-AP. En contraste con el AP y el APR, el ex-AP demostró una fuerte tinción para p16, ciclina D1, CDK4, E2F y proteína de retinoblastoma. Se observó una distribución similar en AP, en contraste con APR y ex-AP, para polipéptidos pertenecientes a la familia de factores de crecimiento derivados de plaquetas y factores de crecimiento de fibroblastos, lo que sugiere su papel potencial en la recurrencia y transformación maligna de AP17,18. Por otro lado Glas et al. estudiaron de manera retrospectiva la expresión de progestágenos, estrógenos, el Ki-67 y el receptor de crecimiento derivado de insulina 1 (IGFR-1) en 52 pacientes con AP recurrentes tomando un grupo de control de adenoma primario de 18 pacientes dividiéndolo en recurrentes y primarios, encontrando una diferencia (p < 0.05) en el tipo de tumor entre el grupo recurrente (más variantes pobres en células) y el grupo control. La expresión de estrógenos fue baja en ambos grupos (19 y 17%, respectivamente), pero la inmunorreactividad para receptor de estrógenos fue mayor (48%) en el tejido normal de la glándula parótida. La expresión de progesterona en el grupo recurrente (96%) fue mayor en comparación con la expresión de progesterona en el grupo de control (61%; p < 0.001). La expresión de progestágenos y la expresión de IGFR-1 se correlacionaron débilmente en el grupo de AP recurrente (coeficiente de correlación: 0.660; p = 0.053). La expresión de la fracción de crecimiento (puntuación Ki-67) e IGFR-1 fue similar en ambos grupos, pero fue más extensa en comparación con el tejido normal de la glándula parótida. Se concluye que los receptores de estrógenos parecen ser un factor pronóstico y pueden considerarse un objetivo de tratamiento hormonal en pacientes con APR19.
En una revisión sistemática de la literatura de los AP metastásicos reportados en la literatura hasta el 2015 en donde se incluyeron 81 reportes de caso, se encontró una edad media al diagnóstico del AP metastásico (APM) de 49.5 años. El tiempo medio entre AP y APM fue de 14.9 años. Solamente tres casos tuvieron una presentación simultánea y el 72.8% tenía una recidiva local de AP previa al APM. Los sitios metastásicos fueron: hueso 36.6%, pulmón 33.8% y ganglios linfáticos del cuello 20.1%20. En un metaanálisis la supervivencia global de los pacientes con APM fue del 50% a cinco años. Los factores de mal pronóstico identificados fueron el encontrar enfermedad metastásica en múltiples sitios y el intervalo mayor a 10 años entre la presentación inicial de un APR y la detección de una metástasis a distancia21.
Hasta la fecha, ni en el análisis histológico ni el de ADN en los casos reportados de APM, se han podido reconocer parámetros específicos de malignidad (p. ej., tasas mitósicas, crecimiento infiltrativo, invasión vascular o linfática, áreas de necrosis, atipia celular)6. Además, la clasificación de la Organización Mundial de la Salud (OMS) en ediciones previas del libro WHO Classification of head and neck tumours, lo incluía como una entidad diferente dentro del capítulo de tumores malignos de glándulas salivales. Sin embargo, en su última edición (año 2017) lo clasifica como una subcategoría de AP dentro de la sección de tumores benignos22. Sin embargo, el comportamiento clínico de estos raros tumores debe evaluarse, esto debido a que no es posible determinar cuál de los adenomas de las glándulas salivales pleomórficas localmente recurrentes tiene el potencial de dar lugar a APM6. Coincidimos con Gosh et al. en que las transformaciones malignas del AP son el carcinoma ex-AP, carcinosarcoma y APM6 y no como lo sugiere en su última actualización de la OMS22, lo anterior por el comportamiento clínico de estas histologías.
El mecanismo del APM es poco conocido. Se ha planteado la hipótesis de que se produce iatrogénicamente durante la resección quirúrgica con siembra de células tumorales rotas en el torrente sanguíneo23, esto respaldado por una revisión sistemática en donde se encontraron 18 casos con metástasis múltiples a distancia en hígado o pulmón, de acuerdo con la hipótesis de diseminación hematógena (22.2%), 17 casos con diseminación de los ganglios linfáticos que respaldan las teorías de siembra linfática (20.1%)24. Por el momento pocos son los estudios que informan APM sin tratamiento quirúrgico previo del AP primario, sin embargo lo anterior sugiere que la siembra de células tumorales en la cirugía puede no ser el único mecanismo de metástasis25,26.
Dentro del tratamiento, la resección quirúrgica total es el tratamiento de elección del APM27-29. El tratamiento con radioterapia es controvertido: algunos estudios sugieren que puede llegar a ser una herramienta valiosa30. Además, los receptores de estrógenos parecen ser un factor pronóstico y pueden considerarse un objetivo de tratamiento hormonal en pacientes con APR22.
Los pacientes que presentan una lesión metastásica dentro de los 10 años posteriores al tratamiento inicial tienen un pronóstico significativamente peor en comparación con los que la presentan 10 años después de la aparición del tumor primario. La enfermedad una vez establecida en un sitio distante se asocia con una morbilidad y mortalidad significativas, con una supervivencia libre de enfermedad y específica de la enfermedad a cinco años del 58 y el 50%, respectivamente31.
Conclusión
El AP recurrente metastásico sigue siendo una entidad poco estudiada. El principal factor de riesgo de recurrencia es una cirugía incompleta de manera inicial, y el sexo femenino8,32. Dentro del análisis inmunohistoquímico, el p16, la ciclina D1, CDK4, E2F y la proteína de retinoblastoma pueden ayudar a evaluar el riesgo de recurrencia17,33, además los receptores de estrógenos parecen ser un factor pronóstico y pueden considerarse un objetivo de tratamiento hormonal en pacientes con APR19. Dentro de las opciones terapéuticas la cirugía es el pilar, dentro de las terapias complementarias para disminuir la recurrencia la radioterapia puede llegar a ser una herramienta valiosa30. Al igual que Knight et al., consideramos que es importante seguir documentado los casos de esta entidad en la literatura, para poder realizar una evaluación de los factores de riesgo de los pacientes24.











 nueva página del texto (beta)
nueva página del texto (beta)