Introducción
Las tecnologías de diagnóstico molecular han permitido la identificación de un número creciente de aberraciones genéticas en una gran variedad de cánceres. Esto ha llevado al aumento de las opciones terapéuticas y la mejora de la medicina de precisión1.
Entre estas aberraciones se encuentran los genes de fusión del receptor de la tirosina cinasa neurotrófico (NTRK), que recientemente han ganado importancia por su potencial en el diagnóstico de numerosos tipos de cáncer y como dianas terapéuticas2. Los genes NTRK (NTRK1, NTRK2 y NTRK3) se encuentran localizados en los cromosomas 1q21-p22, 9q22.1 y 15q25 y codifican la familia de receptores cinasa de la tropomiosina (TRK) TRKA, TRKB y TRKC, respectivamente3. Los tres receptores TRK son proteínas transmembranales formadas por una región intracelular que contiene el dominio tirosina cinasa unida, con un dominio extracelular formado por un clúster rico en cisteína, tres repeticiones de 24 residuos ricos en leucina (LRR1-3) que son específicas de la familia TRK, otro clúster rico en cisteína y dos dominios similares a la inmunoglobulina1,2.
Los ligandos principales de las proteínas TRK son las neurotrofinas, un grupo de factores de crecimiento implicados en el desarrollo y el funcionamiento del sistema nervioso, que son específicas para cada receptor. El factor de crecimiento nervioso (NGF) se une preferentemente con el TRKA, tanto el factor de crecimiento neurotrófico derivado del cerebro (BDNF) como la neurotrofina 4 (NT-4) pueden activar el TRKB, lo que implica que este receptor tiene una especificidad menor, y la neurotrofina 3 (NT-3) activa el receptor TRKC. Además, todas las neurotrofinas pueden ligarse al receptor de membrana p75NTR, un miembro de la familia de receptores del factor de necrosis tumoral, implicado en equilibrar la supervivencia y muerte celular durante el desarrollo del sistema nervioso central2,4.
La unión del NGF con el TRKA activa la vía RAS/MAPK (proteína cinasa activada por mitógeno), que lleva al aumento de la proliferación y el crecimiento celular mediante la señalización cinasa relacionada con la señal extracelular (ERK). La unión del BDNF con el TRKB activa las vías RAS-ERK, fosfoinositol-3-cinasa (PI3K) y fosfolipasa C-γ (PLC-γ), que llevan a la diferenciación y supervivencia neuronal, mientras que la unión de la NT-3 y el TRKC activa preferentemente la vía PI3K/AKT, que previene la apoptosis y aumenta la supervivencia celular. Para un funcionamiento normal de las células es importante la regulación adecuada de los niveles de los receptores TRK y su activación5.
Los genes de fusión NTRK se producen por reordenamientos intracromosómicos o intercromosómicos que yuxtaponen la región 3’ del gen NTRK con la secuencia 5’ de un gen de fusión asociado. Como resultado, las proteínas quimeras oncogénicas dan lugar a proteínas de fusión TRK que se encuentran activadas de forma constitutiva, con independencia del ligando. Esto lleva a una cascada de señalización ininterrumpida que actúa como impulsor oncogénico5.
De momento se han encontrado proteínas de fusión TRK en más de 20 tipos diferentes de cáncer. En conjunto pueden presentarse genes NTRK hasta en el 1% de los tumores sólidos, aunque la frecuencia puede ser muy variable en función de la histología del tumor. La frecuencia suele ser muy baja (< 5%) en tumores comunes como: adenocarcinoma pulmonar, tejidos blandos, leucemia mieloide aguda, carcinoma ductal de mama o cáncer colorrectal, mientras que puede ser elevada (> 80%) en algunos tumores raros o infrecuentes. En pacientes adultos se han identificado genes de fusión NTRK en el 90-100% de los carcinomas secretores de mama y carcinomas análogos secretores de mama, y en pacientes pediátricos el 91-100% de los fibrosarcomas infantiles congénitos y el 83% de los nefromas mesoblásticos congénitos han presentado genes de fusión NTRK5,6.
Aunque la incidencia sea baja para cada tipo específico de tumor con genes de fusión NTRK, en conjunto se encuentran en un número considerable de casos, los cuales se pueden beneficiar de las terapias dirigidas a las proteínas de fusión TRK7,8.
Tener un buen conocimiento de la frecuencia que presentan los genes de fusión NTRK en los distintos tipos de tumores puede ayudar a definir estrategias de diagnóstico clínico y de tratamiento. Este estudio tuvo como objetivo evaluar la prevalencia de las fusiones TRK en pacientes con cáncer en México.
Material y métodos
Se realizó un estudio retrospectivo y transversal de tipo canasta con el objetivo de buscar el mismo tipo de alteración genética en pacientes con neoplasias de diferentes tejidos. Se obtuvieron laminillas y bloques de parafina de pacientes de todo el país para determinar la presencia de genes de fusión NTRK, sin limitación por edad, género, tipo de neoplasia o región geográfica. Para detectar la presencia de genes de fusión de NTRK inicialmente se realizó inmunohistoquímica (IHQ) utilizando el ensayo VENTANA pan-TRK (EPR17341). Posteriormente, en los casos que resultaron positivos por IHQ (sobreexpresión de proteínas TRK), se determinó el tipo de fusión del gen NTRK mediante secuenciación de nueva generación (SNG) utilizando TruSight Oncology Comprehensive test en instrumento Illumina.
Se calcularon las frecuencias de los distintos tipos de cáncer por género y grupo etario, así como la proporción de neoplasias con genes de fusión NTRK y la frecuencia de las diferentes fusiones. Para reportar los resultados se ha utilizado estadística descriptiva.
Resultados
En total se evaluaron 677 casos de pacientes oncológicos de 30 hospitales pertenecientes a diferentes regiones de México y a cuatro instituciones de salud del país. El 51.3% de los pacientes fue atendidoen instituciones privadas, el 31.5% en hospitales de la Secretaría de Salud (SSA), el 14.9% en centros del Instituto Mexicano del Seguro Social (IMSS) y el 2.5% en el Instituto de Seguridad y Servicios Sociales de los Trabajadores del Estado (ISSSTE). Los pacientes fueron diagnosticados entre julio de 2019 y marzo de 2021, con el 73% de los casos observados durante el año 2020.
El 73% de los casos eran de la zona centro del país, siendo el 59.5% de ellos de la Ciudad de México y el 10% del Estado de México, mientras que solo el 0.6% fueron de la zona sur. Otros Estados con el mayor número de casos fueron: Jalisco, con 14.6%, Nuevo León, con 5.3% y Veracruz, con 0.4%, que corresponden a las zonas centro-norte, norte y sur, respectivamente.
El 52.4% de los casos observados (n = 355) correspondió al género femenino frente al 47.6% de hombres (n = 322). En total había 472 tumores con edad especificada, con una edad promedio de 45 ± 21 años (rango: 1 mes-88 años), de los cuales el 14% (66 pacientes) eran niños y el 86% (406 pacientes) eran adultos.
Incidencia de los distintos tipos de cáncer
De los 677 tumores evaluados, el tipo de cáncer más frecuente fue el de sistema nervioso central (SNC), presente en 102 (15.1%) pacientes (49% mujeres y 51% hombres), la mayoría de los cuales (48.2%) eran adultos (14.7% niños y 37.1% sin especificar). El segundo tipo de cáncer en frecuencia fue el de pulmón, presente en 100 (14.8%) pacientes (53.9% mujeres y 46.1% hombres), de los cuales solo el 1% fueron niños, mientras que el 41.0% fueron adultos y el 58.0% sin especificar. Hubo 99 pacientes (14.6%) con tumores de tejidos blandos (48.4% mujeres y 51.4% hombres), principalmente adultos (9.1% niños, 70.5% adultos, 20.4% sin especificar), y 82 pacientes (12.1%) presentaron cáncer de tubo digestivo con una mayor incidencia en hombres (62.1%) que en mujeres (37.6%) y en adultos (66.8%) que en niños (3.6%). El 25.4% de los pacientes (n = 172) presentó otros tipos de cáncer.
A lo largo del estudio se observó un ligero incremento en las frecuencias de cáncer de SNC y de otros tipos de cáncer, que en 2019 representaron el 10.7 y 20.5% de los casos, en 2020 fueron el 15.0 y 25.1% y en 2021 correspondieron al 22.5 y 35.2% de los casos, respectivamente. En cambio, no se observó ninguna tendencia en las frecuencias del resto de tipos de cáncer detectados.
El análisis por género mostró que en las 355 pacientes femeninas el 15.2% presentaba cáncer de pulmón, seguido por el 14.1% que presentó cáncer de SNC, el 13.5% presentó tumores de tejidos blandos y el 4.5% presentó cáncer de mama. Entre los pacientes de género masculino, el 16.1% tuvo cáncer del SNC, el 15.8% presentó tumores de tejidos blandos, otro 15.8% presentó cáncer del tubo digestivo y un 14.3% tenía diagnosticado cáncer de pulmón.
Al determinar el tipo de diagnóstico por grupo etario se observó que en los pacientes pediátricos el cáncer predominante fue el de tiroides (27.3%), seguido por el de SNC (22.7%) y el tumor de tejidos blandos (13.6%), mientras que los pacientes adultos presentaron con mayor frecuencia otros tipos de cáncer (29.6%), tumor de tejidos blandos (17.2%), cáncer del tubo digestivo (13.5%) y cáncer de SNC (12.1%).
Presencia de genes de fusión NTRK
Por medio de IHQ (pan-TRK) se detectó sobreexpresión de proteínas TRK en 47 de 677 (7%), en neoplasias de SNC, tejidos blandos, cáncer de glándula salival, fibrosarcoma infantil, cáncer de tubo digestivo y otros (Tabla 1).
Tabla 1 Resultados positivos en las pruebas de detección pan-TRK y SNG
| Diagnóstico | Prueba SNG n (%) | Prueba pan-TRK n (%) |
|---|---|---|
| G. salival | 0 (0%) | 1 (2.1%) |
| Fibrosarcoma infantil | 1 (3.7%) | 1 (2.1%) |
| Tumor de tejidos blandos | 2 (7.4%) | 5 (10.6%) |
| SNC | 21 (77.8%) | 31 (66.0%) |
| T. digestivo | 0 (0%) | 1 (2.1%) |
| Otros | 3 (11.1%) | 8 (17%) |
| Mama | 0 (0%) | 0 (0%) |
| Pediátrico | 0 (0%) | 0 (0%) |
| Tiroides | 0 (0%) | 0 (0%) |
| Colon | 0 (0%) | 0 (0%) |
| Pulmón | 0 (0%) | 0 (0%) |
| No valorable | 0 (0%) | 0 (0%) |
| Total | 27 (100%) | 47 (100%) |
SNC: sistema nervioso central; SNG: secuenciación de nueva generación.
La SNG detectó genes de fusión NTRK en 27 de los casos de cáncer valorados, lo que representa una prevalencia del 4%. Se observó que la prevalencia aumentó a lo largo del estudio, con un 1.8% en 2019, un 4.0% en 2020 y un 7.0% en 2021. Un poco más de la mitad de los casos con genes de fusión NTRK fueron mujeres (55.6%), proporción muy similar al de la población de estudio. En cambio, el 44% de los casos con genes de fusión NTRK con edad conocida perteneció a niños, una proporción mayor al 14% del total (Fig. 1). La prevalencia según etapa etaria fue del 12.12% en los pacientes pediátricos y del 2.46% en los pacientes adultos.
El 48.1% de los casos de cáncer con genes de fusión NTRK se detectó en hospitales privados, el 37% en el IMSS, el 11.1% en el SSA y el 3.7% restante se detectó en el ISSSTE.
Al determinar por tipo de cáncer se observó que había genes de fusión en el cáncer de SNC, los tumores de tejidos blandos, el fibrosarcoma infantil y otros tipos de cáncer, y que el 77.8% de ellos eran cáncer del SNC (Tabla 1).
Del total de pacientes con cáncer de SNC, el 20.8% presentaba genes de fusión NTRK, de los cuales seis eran niños y seis eran adultos, mientras que nueve pacientes eran de edad no especificada. Al analizar por etapa etaria se observó que entre los niños con cáncer de SNC el 43% presentaba genes de fusión, mientras que estos estaban presentes en el 12% de los adultos (Fig. 2). Igual que las frecuencias observadas de cáncer de SNC a lo largo del estudio, también se observó una tendencia al incremento en la presencia de genes de fusión NTRK, con un 16.7% de los casos positivos en 2019, un 20.3% en 2020 y un 26.7% en 2021 (Fig. 3).
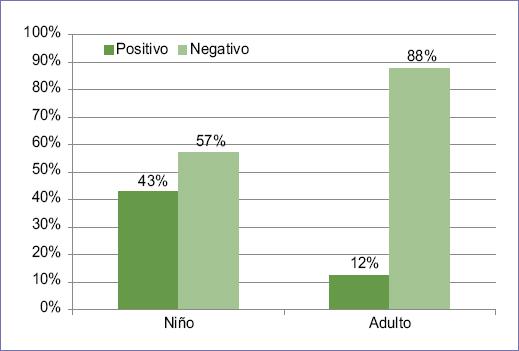
Figura 2 Distribución con base en la presentación del gen por etapa etaria de los pacientes con cáncer de sistema nervioso central.
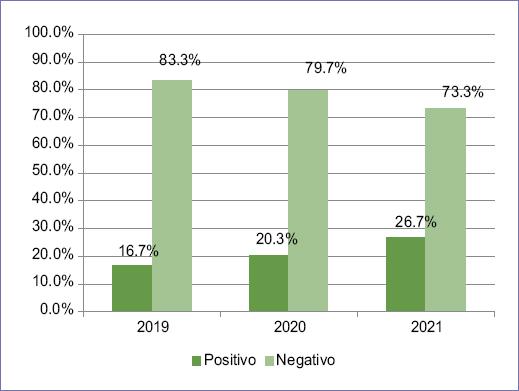
Figura 3 Porcentaje de presentación de genes de fusión NTRK por año en los pacientes con cáncer de sistema nervioso central.
Debido a la baja prevalencia de genes de fusión NTRK en los otros tipos de cáncer no se pudieron analizar con más detalle.
Tipos de fusión
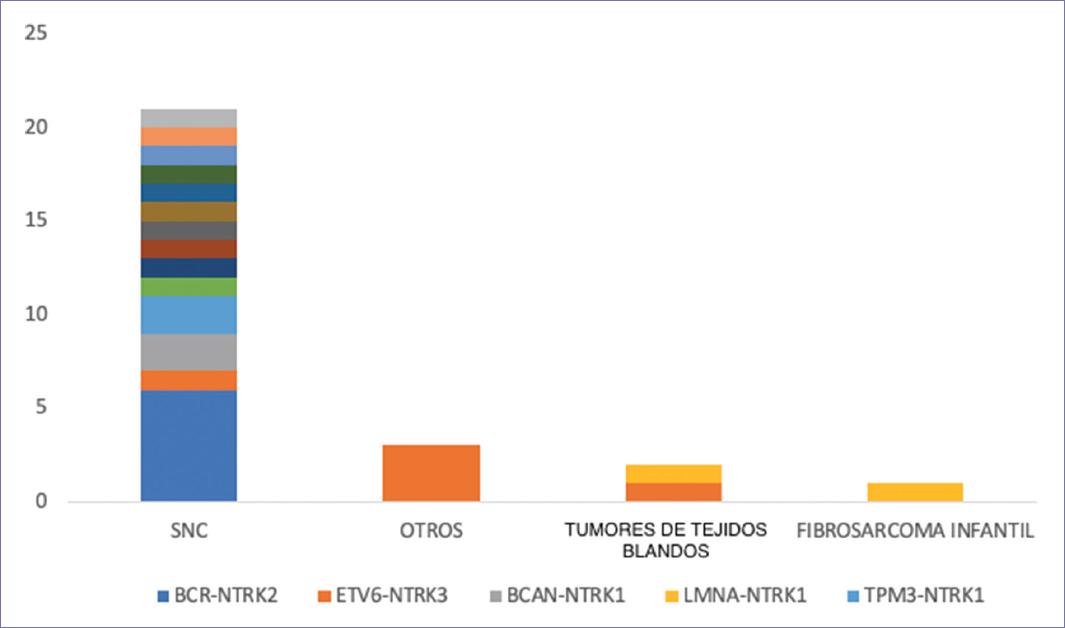
Se identificaron 15 tipos de fusión diferentes, y de ellas las que se encontraron con mayor frecuencia fueron: fusión BTCR-NTRK2, que se presentó en el 22.2% de los casos, ETV6-NTRK, que se detectó en el 18.5% y con una frecuencia del 7.4% se detectaron fusiones BCAN-NTRK-1, LMNA-NTRK1, TPM3-NTRK1 y 1AP-NTRK2.
La fusión BTCR-NTRK2 se observó solo en el cáncer de SNC, y representó el 28.6% de las fusiones detectadas en este tipo de cáncer, mientras que la fusión ETV6-NTRK se detectó en el cáncer de SNC, el tumor de tejidos blandos y otros tipos de cáncer. Por el contrario, la fusión LMNA-NTRK1 fue la única que no se encontró en el cáncer de SNC, en cambio sí se detectó en tumores de tejidos blandos y el fibrosarcoma infantil (Fig. 4).
Discusión
Este es el primer estudio en determinar la prevalencia de los genes de fusión NTRK en diferentes tipos de cáncer en una población de pacientes de México. Se decidió realizar un estudio de tipo canasta para incluir a un gran número de pacientes, con diversos tipos de cáncer y distintas topografías independientemente del tipo histológico, lo que permitió identificar alteraciones moleculares poco frecuentes que no suelen representarse en estudios tradicionales9.
Los principales tipos de cáncer que presentaban los pacientes evaluados fueron de SNC, de pulmón, tumores de tejidos blandos y de tubo digestivo, entre otros. El 7% de las muestras presentó proteínas de fusión TRK, demostrado por inmunohistoquímica, y posteriormente la SNG confirmó la presencia de genes de fusión NTRK en el 4% de los tumores evaluados. El 14% de los pacientes eran pediátricos, aunque estos presentaron el 44.4% de los genes de fusión NTRK. Esto fue debido a que la prevalencia de genes de fusión NTRK en los pacientes pediátricos fue mayor que en los adultos, con el 12.12 y 2.46% de las muestras con genes de fusión, respectivamente. Según varios estudios, cerca del 1% de los tumores sólidos puede presentar fusiones NTRK, y por lo tanto la muestra evaluada en este estudio presentaría una frecuencia mayor a la documentada para series de tumores no seleccionados2,5. La mayor frecuencia de genes de fusión detectada en los pacientes pediátricos concuerda con los datos disponibles en la literatura, donde se documenta su mayor frecuencia en tipos de cáncer raros y en algunos cánceres pediátricos10.
Se observó que entre 2019 y 2021 había un aumento en el número de casos positivos para los genes de fusión NTRK. Este aumento podría ser debido a un sesgo en la detección y no a un aumento de los casos durante este periodo, al hacer más pruebas de detección en tumores con una mayor susceptibilidad de presentar alteraciones genéticas como los de SNC2.
Las diferencias observadas en la prevalencia de los genes de fusión NTRK según el método de detección utilizado (inmunohistoquímica o SNG) confirman la importancia de utilizar la metodología adecuada. En la actualidad no existe un método estándar de dete-cción de las fusiones NTRK, lo que en ocasiones puede llevar a su falta de localización y dificultar la determinación de la prevalencia real de estas mutaciones11. La inmunohistoquímica mediante un anticuerpo pan-TRK ha mostrado ser un método con alta sensibilidad (95.2-97%) y especificidad (98-100%) que se puede implementar fácilmente a nivel local9. Aun así, la Sociedad Europea de Oncología Molecular recomienda realizar pruebas de detección a nivel molecular para confirmar la presencia de genes de fusión NTRK12.
Los genes de fusión NTRK solo se encontraron en cuatro tipos de cáncer, el de SNC, el sarcoma, el fibrosarcoma infantil y otros tipos de cáncer, con la mayoría de los casos (77.8%) pertenecientes al cáncer de SNC. Entre los pacientes con cáncer de SNC el 20.6% presentó genes de fusión NTRK. Esta frecuencia se encuentra dentro del rango de frecuencias descritas para los tumores de SNC, que oscila entre el 0.43-4.3% de los gliomas de bajo grado y el 10-40% de los gliomas no troncoencefálicos de alto grado2.
La SNG permitió identificar 15 fusiones diferentes, con la BTCR-NTRK2 y ETV6-NTRK como más frecuentes. La fusión ETV6-NTRK se detectó en el cáncer de SNC, tumores de tejidos blandos y otros tipos de cáncer. Esta fusión ETV6-NTRK es la que se ha asociado con la mayor cantidad de tipos de cáncer diferentes, tanto raros como los carcinomas secretores de mama, los análogos secretores de mama o los fibrosarcomas infantiles, como las histologías más frecuentes como cáncer de mama o el cáncer colorrectal1,5,13.
La fusión BCR-NTRK2 solo se encontró en el cáncer de SNC. Esta fusión solo se ha encontrado en gliomas de alto grado lo que indica que es una fusión específica de este tipo de cáncer1.
El mayor conocimiento de los genes de fusión NTRK y su potencial como diana terapéutica ha llevado a un creciente interés en el desarrollo de inhibidores de TRK14. Las fusiones TRK son oncogénicas y en ocasiones los pacientes que las presentan no han tenido éxito con el tratamiento estándar. Los nuevos inhibidores de TRK como larotrectinib y entrectinib han mostrado en ensayos clínicos que consiguen respuestas rápidas y duraderas con pocos y reversibles eventos adversos15. Estos inhibidores se pueden utilizar en todos aquellos tumores con genes de fusión NTRK, tanto en los tipos de cáncer más comunes con baja frecuencia de genes de fusión NTRK como en aquellos tumores raros con alta frecuencia de fusiones. En consecuencia, la identificación de estos genes de fusión permitirá seleccionar a los pacientes con tumores sólidos que se puedan beneficiar del tratamiento con inhibidores de TRK16.











 nueva página del texto (beta)
nueva página del texto (beta)