Introducción
El cáncer es una problemática mundial que afecta tanto a adultos como a niños. A nivel global, para el año 2020 se reportó una incidencia de 279,419 casos de cáncer infantil entre los 0 y 19 años, una prevalencia de 850,317 casos entre 2016 y 2020, además de una mortalidad para el último año de 107,833 casos1. Además, se destaca que en países de altos ingresos la supervivencia de los niños con cáncer es cercana al 80%, mientras que en países de ingresos bajos las estadísticas muestran otro panorama y a pesar de no conocerse con exactitud la supervivencia por la ausencia de registros basados en la población con cáncer y su economía local2,3, se sabe que el porcentaje de supervivencia es más bajo.
Aunque la incidencia del cáncer en niños puede calificarse como baja en comparación con los adultos, de acuerdo con datos registrados en GLOBOCAN en 20201 existe una tendencia al aumento de casos nuevos, evidenciado en que para el último año se presentaron 79,253 casos más que los reportados para 2018. Dentro de los tipos de cáncer con mayor incidencia en los niños están en orden de frecuencia las leucemias, los tumores del sistema nervioso central y los linfomas4.
La base del tratamiento contra el cáncer es la quimioterapia, radioterapia y cirugía, dichas terapias pueden implementarse solas o en adyuvancia y tienen como fin la curación y un aumento de la supervivencia infantil. No obstante, los tratamientos contra el cáncer no son inocuos, ya que de manera simultánea a su acción terapéutica sobre las células neoplásicas, también tienen repercusiones sobre las células propias del organismo del niño, entre las que se encuentran efectos en su sistema inmunitario como inmunosupresión, linfocitopenia y neutropenia, en muchas ocasiones estas consecuencias de los tratamientos se intensifican debido a los efectos propios de la enfermedad5. Dicha disminución de la respuesta inmunitaria celular representa un alto riesgo para contraer infecciones, incluidas las prevalentes en la infancia e inmunoprevenibles6-8. Frente a este contexto, la vacunación se sigue considerando la estrategia más efectiva y es por ello que se hace necesario revisar las particularidades de esta en situaciones de cáncer infantil como un eje fundamental para la prevención, así como la reducción de la morbimortalidad6.
La vacunación o inmunización activa en cáncer infantil ha presentado distintos debates a lo largo de los años, a tal punto que países como EE.UU., India y Australia han diseñado pautas para la administración de inmunobiológicos en las diferentes fases del tratamiento oncológico; dichas pautas se han basado en el tipo de vacuna, la medición previa de anticuerpos, edad del niño, tipo y tiempo de terapia, entre otros criterios8. Sin embargo, a pesar de que dichas guías reflejan el consenso de autoridades en el tema de cáncer infantil, varias de las recomendaciones allí incluidas requieren una mayor fuerza de la evidencia que fundamente la toma de decisiones al respecto. Por ello, es de interés revisar la evidencia disponible y derivada de estudios clínicos frente a los aspectos relacionados con la vacunación en el contexto del cáncer infantil.
De acuerdo con lo anterior, el presente estudio tiene como objetivo integrar la literatura científica disponible acerca de la vacunación en cáncer infantil para, en primer lugar, identificar las vacunas, tipos de vacunas, ajustes a esquemas de vacunación, y efectos terapéuticos y secundarios de estas; en segundo lugar, identificar tendencias en investigación acerca de la vacunación en cáncer infantil; y en tercer lugar, generar recomendaciones para la práctica del cuidado del niño con cáncer en el área de vacunación.
Materiales y métodos
Esta revisión de literatura es tipo scoping review, la cual permite obtener resultados amplios y con una profundidad adecuada mediante una integración de la evidencia relevante, que permita la difusión e identificación de vacíos en la investigación existente9 de la vacunación en cáncer infantil. A continuación se presentan las dos fases del desarrollo metodológico de este trabajo.
Búsqueda y selección de artículos primarios
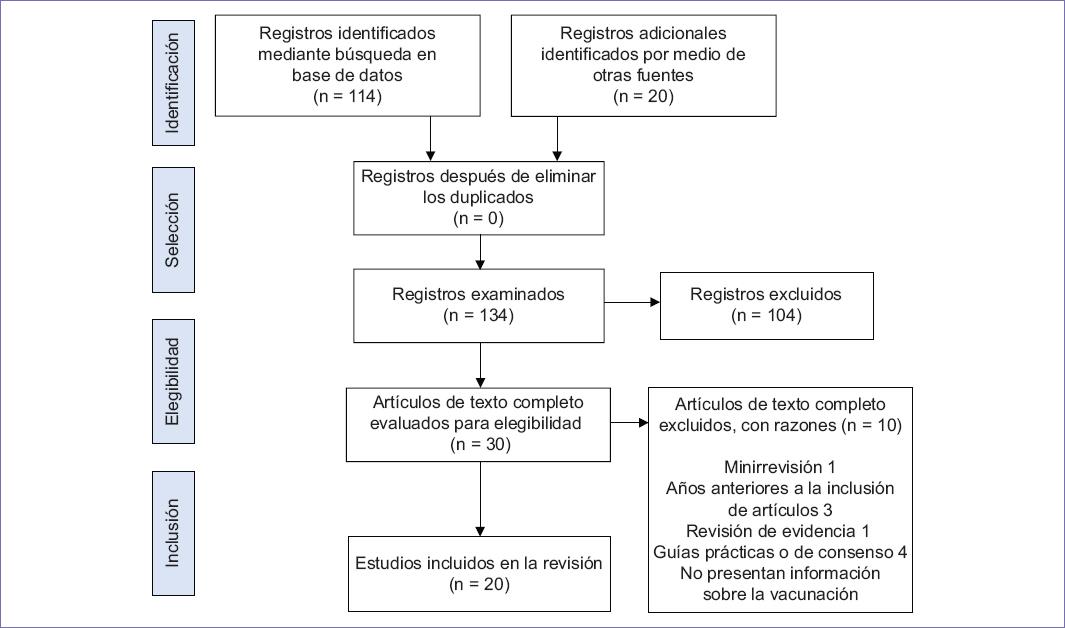
La búsqueda y selección de artículos primarios se realizó con base en la metodología PRISMA (Preferred Reporting Items for Systematic reviews and Meta-Analyses). La identificación se realizó mediante la construcción de una ecuación de búsqueda que incluyó los términos MESH: “Children”, “Cancer”, “Vaccination”, “Diphtheria”, “Tetanus”, “Pertussis”, “Influenzae type B”, “Hepatitis B”, “Streptococcus pneumoniae”, “Influenza”, “Varicella”, “Yellow fever”, “COVID-19”, “BCG” y “MMR” solos y combinados con el uso de los operadores booleanos “AND”, “OR” y “NOT”, en idioma inglés, español o portugués. Dicha ecuación de búsqueda se aplicó en las bases de datos Scopus, Medline (por medio de PubMed), Science Citation Index, Complementary Index, ScienceDirect, Academic Search Complete, Supplemental Index, Newspaper Source, Science Citation Index y Regional Business News. Se aplicaron filtros de búsqueda que identificaran artículos publicados en revistas indexadas en los idiomas mencionados, entre los años 2016 y 2021. En la fase de cribado se realizó la lectura de los títulos y los resúmenes de manera independiente por dos autores, allí se excluyeron publicaciones no relacionadas con el tema de interés, revisiones de evidencia y consenso de expertos. Durante la fase de elegibilidad, los artículos potencialmente elegibles fueron leídos a texto completo por dos de los autores para evaluar su pertinencia en el estudio. En este punto se verificó la calidad de los estudios con la aplicación de las listas de chequeo de los requisitos mínimos de reporte para los diferentes tipos de estudio disponibles en la plataforma The Equator Network10, cualquier desacuerdo durante esta etapa se resolvió con el consenso entre los autores. Finalmente, en la fase de selección se integraron 20 artículos a esta revisión. En la figura 1 se presenta el flujograma PRISMA.
Extracción, clasificación e integración de los hallazgos
Cada artículo fue leído y sus hallazgos más relevantes fueron extraídos, clasificados e integrados en una matriz de revisión en el programa Excel. En dicha matriz se registraron características de interés de los artículos como: idioma, país, año, tipo y diseño de estudio, tipo de cáncer que se estudia, participantes, contexto del estudio, instrumentos de recolección de la información, vacuna estudiada con sus características, nivel de evidencia, tipos de vacunas, calendarios y efectos de la vacunación en el contexto del cáncer infantil.
Resultados
Este apartado se organiza a partir de una planeación de preguntas que responden a los objetivos propuestos, los cuales enmarcan los efectos del tratamiento sobre los anticuerpos, efectos de la vacunación, administración de dosis de refuerzo, administración de vacunas vivas y recomendaciones por parte del personal de salud.
¿Cuál es el efecto del tratamiento contra el cáncer sobre los anticuerpos de enfermedades inmunoprevenibles?
- Sarampión, paperas y rubéola: dos estudios reportaron el efecto potencial del tratamiento contra el cáncer sobre los anticuerpos contra sarampión, parotiditis y rubéola. El primero, conducido en cuatro pacientes con leucemia mieloide crónica en tratamiento activo de imatinib con antecedentes vacunales incompletos reportó que tres pacientes tenían títulos negativos de rubéola y sarampión, mientras que los cuatro totales presentaron títulos negativos contra parotiditis11. El segundo, conducido con 55 pacientes con un tiempo de al menos seis meses después de la terminación de la quimioterapia, mostró que no estaban protegidos contra las enfermedades pues el 14% no tenía titulaciones de anticuerpos contra rubéola, el 16% contra paperas y el 9% contra sarampión12.
- Varicela: los estudios han mostrado un posible efecto del proceso patológico y la quimioterapia en la disminución de los anticuerpos contra varicela. Ghassemi et al.13 reportaron que, en fase de mantenimiento de la quimioterapia, ninguno de los participantes tenía anticuerpos contra varicela. De la misma manera, Bettoni et al.11, con cuatro pacientes en la misma fase de tratamiento, tampoco evidenciaron anticuerpos. No obstante, dos estudios reportaron pérdidas parciales de anticuerpos: el estudio de Garonzi et al.12 evidenció una pérdida de títulos séricos de anticuerpos después de la quimioterapia en 9 de 24 pacientes y el estudio de Top et al.14, quienes, en una población de 78 participantes con leucemia linfoblástica aguda (LLA), encontraron que solo 48 tenían niveles de anticuerpos seropositivos después de finalizada la quimioterapia.
- Hepatitis: Toret et al.15 en pacientes con LLA reportaron los títulos de seronegatividad para hepatitis B en un 76% de la población después de seis meses finalizada la quimioterapia. Así mismo, Keskin et al.16 reportaron que, de los 162 pacientes, el 44% fueron negativos para el anticuerpo anti-HBs o anticuerpos del núcleo de la hepatitis B (HBcAb) y se evidenció que la inmunidad era más baja en pacientes con linfoma Hodgkin (73%) y linfoma no Hodgkin (55%). En otro estudio, el total de la muestra (43 pacientes) presentó antígenos negativos de la superficie de la hepatitis B (HBsAg), HBcAb y antígeno e de la hepatitis B (HBeAg)17. También, Shin et al.18 reportaron que un 85.4% de los 89 pacientes con LLA y mieloide aguda tenía un anticuerpo HBsAb negativo y en pacientes después de la quimioterapia se evidenció una tasa de pérdida en los títulos séricos de anticuerpos para hepatitis B en 12 de 31 pacientes13.
En el caso de la hepatitis A, Toret et al.15, en su estudio con 46 pacientes con LLA que tenían registro de antecedentes vacunales, encontraron que seis meses después de la finalización de la quimioterapia, el 83% tenía un título de seronegatividad para hepatitis A.
- MMR o triple viral: Keskin et al.16, en su estudio con 162 pacientes con antecedentes vacunales, reportaron que solo 19 pacientes (12.4%) resultaron ser inmunes a MMR después del tratamiento contra el cáncer.
- Neumococo conjugada PCV13: dos estudios realizaron investigaciones sobre la vacuna de neumococo conjugada PCV13 en niños con cáncer. El primer estudio, con 46 pacientes pertenecientes al grupo de tratamiento activo y 36 pacientes al grupo de tratamiento finalizado, evidenció que el primer grupo solo poseía títulos seroprotectores contra Streptococcus pneumoniae en 10 serotipos, mientras que el segundo grupo solo tenía protección contra ocho serotipos19. El segundo estudio, con un total de 78 participantes con LLA sin evaluación de los antecedentes vacunales, declaró que después de la finalización de la quimioterapia la mayoría de los anticuerpos de PCV tenían bajos niveles protectores14.
Frente a la neumococo conjugada PPV23, Top et al.14 evidenciaron en 78 participantes con LLA después de la finalización de la quimioterapia que los niveles seroprotectores de PPV23 solo estaban en el serotipo 15B; los serotipos 11A, 12F y 33F estaban por debajo de los niveles de seroprotección. Sin embargo no evaluaron los antecedentes vacunales para obtener una relación más sólida.
- Influenza: un estudio con 75 pacientes en quimioterapia activa y terminada reportaron que las tasas de seroprotección fueron 52% para la cepa H1N1, 49% para H3N2 y 39% para B20. Así mismo, Kotecha et al.21 declararon que en 100 pacientes, el 80% era susceptible a la cepa H3N2, el 67% a la H1N1 y el 88% a la cepa B.
- Poliovirus: Garonzi et al.12 reportaron que en 34 pacientes que después de la quimioterapia no tenían protección contra la enfermedad, los títulos de protección para cada tipo de poliovirus era del 26% para el tipo 1, el 24% para el tipo 2 y el 21% para el tipo 3.
- Clostridium tetani: Garonzi et al.12 reportaron que en 40 pacientes después de la quimioterapia que no tenían protección contra la enfermedad, solo 35 de ellos tenían títulos seroprotectores contra C. tetani.
- S. pneumoniae: Garonzi et al.12 evidenciaron que en 31 pacientes después de la quimioterapia que no tenían protección contra la enfermedad, solo 17 de ellos tenían títulos seroprotectores contra S. pneumoniae.
¿Se recomienda administrar dosis de refuerzo de vacunas en el niño con cáncer posterior al tratamiento?
- Sarampión, paperas y rubéola: Bettoni et al.11, respecto al sarampión, paperas y rubéola, recomiendan posponer cualquier vacuna viva hasta después del primer año de tratamiento con inhibidores de la tirosina cinasa. En la misma línea, Garonzi et al.12 declaran que la aplicación de inmunobiológicos después de la quimioterapia debe realizarse de 6 a 12 meses posteriores. Otros dos estudios15,22 recomiendan la revacunación como un medio de bajo costo para la prevención de enfermedades prevenibles, pero no indican el periodo de tiempo para la administración.
- Varicela: Bettoni et al.11 también recomiendan para la varicela posponer cualquier vacuna viva hasta después del primer año de tratamiento con inhibidores de la tirosina cinasa. Así mismo, Fayea et al.23 recomiendan ver la reactividad de las células T y la IgG antes de vacunar al paciente. Otros tres estudios12,13,24 recomiendan la vacunación por la importancia en el aumento de coberturas vacunales y la recomiendan de 6 a 12 meses después de la quimioterapia.
- Hepatitis: para el caso de la hepatitis B cuatro estudios12,15,24,25 recomiendan la revacunación para aumentar los niveles seroprotectores, así como fecha de administración de 6 a 12 meses después de la quimioterapia. Keskin et al.16 recomiendan realizar pruebas de inmunidad antes de aplicar la vacuna, pero enfatiza la necesidad de revacunación en pacientes seronegativos. En cambio, Shin et al.18 informan que es necesario posponer la vacunación hasta que exista una restauración de linfocitos en número y funcionalidad y en vez de la aplicación de una dosis, se administren tres. Frente a la hepatitis A, dos estudios15,24 recomiendan la revacunación después de una rehabilitación inmunobiológica para aumentar niveles de seroprotección, sin embargo no se especifican las condiciones para su administración.
- Difteria, Poliomielitis, Haemophilus influenzae B (HIB): según un estudio realizado por Fayea et al.22 para las vacunas difteria, poliomielitis y HIB se recomienda una revacunación; sin embargo no se especifica el momento ni condiciones para su administración por variaciones en las pautas.
- Gripe, DTPa/dTpa o dT, polio, meningococo C, neumococo polisacárida 23v, papiloma humano, tos ferina: una investigación realizada por Fernández et al.24 recomienda la inmunización para las vacunas gripe, DTPa/dTpa o dT, polio, meningococo C, neumococo polisacárida 23v, papiloma humano y tos ferina después de la quimioterapia, ya que es importante para el aumento de coberturas vacunales en esta población; sin embargo no se especifica el momento ni condiciones para su administración.
- MMR o triple viral: Fernández et al.24 recomiendan la inmunización después de la quimioterapia, pero no se especifica momento ni condiciones para su administración. Así mismo, se recomienda que la vacuna MMR de refuerzo se administre especialmente para todos los niños menores de cinco años y aquellos que experimentaron un intervalo de tiempo prolongado después del tratamiento, pero no se especifica el tiempo26.
- Neumococo conjugada PCV13: dos estudios24,19 recomiendan la inmunización después de la quimioterapia debido a que provoca un efecto de refuerzo, sin embargo no especifica tiempo ni condiciones para su administración. Mientras que Top et al.14 recomiendan la administración cuatro meses después de la quimioterapia.
- Neumococo conjugada PCV23, neumococo conjugada PPV23, DTaP-IPV-Hib o pentavalente: a partir del estudio realizado por Top et al.14 se recomienda la administración de las vacunas antes mencionadas al menos cuatro meses después de la quimioterapia por la buena tolerancia inmunológica. Para el caso de la Neumococo conjugada PCV7, Lee et al.27 recomiendan la inmunización, así como realizar vigilancia de las estrategias de vacunación en pacientes altamente inmunosuprimidos, pero no especifica tiempo ni condiciones para la administración de la vacuna.
- Influenza: tres estudios realizan recomendaciones sobre la vacuna de la influenza en niños con cáncer. El primero recomienda la inmunización después del tratamiento; sin embargo no posee evidencia sobre la respuesta eficaz en el sistema inmunitario en términos clínicos20. El segundo recomienda una vacunación en las personas del hogar como factor de prevención de la enfermedad28 y el tercero recomienda que la vacunación sea en niños menores de 10 años con administración de dos dosis sin importar los antecedentes vacunales, así como para lograr una seroprotección más efectiva se debe realizar antes de la quimioterapia a altas dosis y con recuentos linfáticos y niveles de IgG normales21.
- Influenza tipo A y B: Choi et al.29 recomiendan la vacunación de influenza tipo A y B; sin embargo enfatiza en obtener los niveles de linfopenia del paciente, ya que podría ser un importante predictor de una falta de respuesta inmunológica a la vacuna. Este estudio no pudo identificar que la respuesta tuviera eficacia clínica y no enfatizó en el tiempo para la administración de esta vacuna.
- Poliovirus, C. tetani, S. pneumoniae: en un estudio se recomienda dosis de refuerzo de 6 a 12 meses después de finalizado el tratamiento contra el cáncer, pero no sobre las condiciones del paciente para la administración12.
¿Cuál es el efecto de la vacunación en el niño con cáncer en tratamiento?
- Sarampión, paperas y rubéola: dos estudios realizaron la administración de las vacunas sarampión, paperas y rubéola en niños con cáncer. El primer estudio, con cuatro pacientes, reportó después de la administración de la vacuna que solo tres de ellos poseían títulos positivos de anticuerpos para sarampión, paperas y rubéola, mientras que el otro paciente obtuvo resultados indeterminados para rubéola y paperas11. En el segundo estudio, con 55 pacientes, a solo 10 de ellos se les aplicó vacuna de refuerzo y se obtuvo una restauración de los anticuerpos en dos de cada seis pacientes para rubéola, en cuatro de cada seis para el virus del sarampión y en dos de cada seis pacientes para virus de las paperas12. Los dos estudios no reportaron efectos adversos agudos o tardíos11,12.
- Varicela: Bettoni et al.11 en su estudio con cuatro pacientes reportó después de la administración de la vacuna que tres de ellos obtuvieron resultados negativos o indeterminados respecto a los títulos de anticuerpos, así mismo no se reportaron efectos adversos tras la vacunación. Garonzi et al.12 en su investigación con 55 pacientes, en 10 de ellos se les aplicó vacuna de refuerzo y se obtuvo una restauración de los anticuerpos en cuatro de cada cinco pacientes para varicela, sin presentar efectos adversos. En otro estudio13, con 46 pacientes, 31 de ellos (67.4%) obtuvieron una muestra de suero del título IgG positiva y 15 (32.6%) tuvieron resultados negativos después de la vacunación, solo el 13% de los pacientes tuvo efectos secundarios; tres pacientes experimentaron erupción maculopapular, dolor de cabeza, fiebre y trombocitopenia.
Así mismo, van de Wetering et al.23, en su estudio con 31 pacientes, evidenciaron en seis de ellos que el ADN del virus de varicela zóster se volvió detectable en sangre periférica después de seis semanas, así mismo, en 14 pacientes se detectó IgG específica para el virus después de la primera vacunación y después de la segunda dosis de vacuna, 20 pacientes obtuvieron un aumento del 70% en la tasa de seroconversión de IgG. Los efectos adversos leves fueron reportados en siete pacientes (22.5%) presentándose exantemas y fiebre en tres pacientes (9.6%).
- Hepatitis B: Garonzi et al.12 en su investigación aplicaron la vacuna de refuerzo a 10 niños y se obtuvo una restauración de los anticuerpos en dos de cada tres pacientes para el virus de hepatitis B. También, Keskin et al.16, en su estudio con 162 pacientes, evidenciaron que 96 niños con niveles de anticuerpos protectores antes de la vacunación obtuvieron niveles bajos de protección de los anticuerpos en 25 de ellos (26%) después de la inmunización y en 66 pacientes que no tenían protección antes del tratamiento solo 6 (9%) obtuvieron niveles positivos para los anticuerpos. En otro estudio realizado por Fayea et al.17 se realizó la administración de la vacuna en 37 pacientes, de los cuales se evidenció que 29 de ellos (90.6%) fueron seropositivos, tres pacientes (9.4%) no lograron aumentar los anticuerpos y cinco pacientes no obtuvieron un nivel determinado de anticuerpos. Finalmente, Shin et al.18, con una población de 89 pacientes, evidenciaron que en 74 pacientes, 33 (44.6%) hicieron seroconversión a HBsAb positivo y 41 pacientes permanecieron HBsAb negativo después de la vacunación, por lo cual se les administró una segunda dosis a 40 pacientes y solo 23 obtuvieron títulos de anticuerpos positivos. Ningún estudio registró efectos adversos12,16-18.
- MMR o triple viral: un estudio con 153 pacientes a los cuales se les administró la vacuna, reportó que solo 19 de ellos (12.4%) presentaron niveles de anticuerpos positivos para MMR16. En otro estudio con 57 pacientes se evidenció que después de la administración el 61.4% tenía títulos seropositivos y el 38.6% era seronegativos26. Ningún estudio registró efectos adversos16,26.
- Neumococo conjugada PCV13: en su estudio Hung et al.19 reportaron que en una población de 82 pacientes después de la vacunación, el 70% tenía títulos de anticuerpos protectores para 9 y 11 serotipos de PCV. Se presentaron efectos adversos como dolor, enrojecimiento o hinchazón en el sitio de inyección, dos participantes desarrollaron fiebre (> 38.58 °C) dentro de 48 horas después de la vacunación y un tercer participante fue diagnosticado y tratado para la sepsis por S. pneumoniae después de presentar fiebre y neutropenia 25 días después de la vacunación. Top et al.14 reportaron que, de los 78 participantes, a 66 de ellos se les evaluó los efectos de la vacunación 12 meses después, evidenciando que todos los serotipos fueron protectores, además el 76% reportó efectos adversos.
- Neumococo conjugada PPV23: Top et al.14 reportó que a 66 pacientes se les evaluó los efectos de la vacunación 10 meses después, evidenciando que tres de los cuatro serotipos de PPV23 tenían seropositividad, reportando efectos adversos en el 67%.
- Influenza: en el estudio de Doganis et al.20 las tasas de protección después de la vacunación fueron del 79% para el H1N1, el 75% para el H3N2 y el 59% para el virus de la influenza B. Las vacunas fueron bien toleradas, pero en algunos generó eritema, hinchazón, dolor leve o combinaciones en cuatro niños, así como fiebre leve en las siguientes 48 horas después de la vacunación en dos niños. Kotecha et al.21 encontraron seroprotección en el 55% para H3N2, el 61% para H1N1 y el 41% para cepa B después de la vacunación; solo ocurrió reactogenicidad en cuatro niños, desarrollando fiebre dentro de las 24 horas después de recibir la vacuna.
- Influenza tipo A y B: Choi et al.29 reportaron en su estudio que 98 de 157 pacientes (62%) mostraron una seroconversión en al menos un serotipo de influenza A después de la vacunación; para la influenza tipo B no se realizaron evaluaciones de protección. Respecto a los efectos adversos, se presentó fiebre en todos los casos de gripe de pacientes positivos. Se documentó además que la infección por influenza ocurrió de uno a cinco meses después de la vacunación.
- DTaP-IPV-Hib o pentavalente: Top et al.14 reportaron en 66 participantes después de 12 meses de la administración de la vacuna que la toxina pertussis y tétano tenían niveles de seropositividad y que el 76% reportó efectos adversos después de la vacunación.
- Poliovirus: Garonzi et al.12 demostró en pacientes a los que se les aplicó vacuna de refuerzo una restauración de los anticuerpos en ocho de cada ocho pacientes para poliovirus. No se registraron efectos adversos o reacciones de la vacuna.
- C. tetani: Garonzi et al.12 aplicaron una vacuna de refuerzo y como consecuencia se obtuvo una restauración de los anticuerpos en siete de ocho pacientes para C. tetani. No se registraron efectos adversos o reacciones de la vacuna.
- S. pneumoniae: Garonzi et al.12, en pacientes a los que se les aplicó la vacuna de refuerzo, obtuvieron una restauración de los anticuerpos en dos de cada tres pacientes para S. pneumoniae. No se registraron efectos adversos o reacciones de la vacuna.
Cuáles son las prácticas de vacunación recomendadas por parte del personal que atiende a niños con cáncer?
Dos estudios reportan recomendaciones por parte del personal de salud sobre las prácticas de vacunación en el cáncer infantil. En el estudio de Arora et al.30 informaron que los oncólogos de 37 instituciones recomiendan la administración de las vacunas inactivadas pero no vivas en un 49% y el 73% recomendó inmunización después de seis meses del tratamiento para las vacunas de sarampión, paperas y rubéola. Así mismo, para las vacunas de varicela, influenza y hepatitis B se recomienda la administración para hermanos y padres, y respecto a la vacuna de polio, los encuestados (57%) modificarían el calendario de vacunación de los hermanos, principalmente omitiendo la vacuna oral contra la polio o reemplazándola por la versión inyectable. En otro estudio, de Fernández et al.24, recomiendan realizar una correcta continuidad de los cuidados médicos y de enfermería al proporcionar un seguimiento estrecho de la inmunización del niño a lo largo del proceso tumoral para lograr una mejor tasa de adaptación a las inmunizaciones en las vacunas de sarampión, paperas, rubéola, hepatitis B, hepatitis A, difteria, HIB, gripe, DTPa/dTpa o dT, meningococo C, MMR o triple viral, neumococo conjugada PCV13, neumococo polisacárida 23v, papiloma humano, tos ferina y polio.
Discusión
En esta revisión se observó que después de administrados los tratamientos para el cáncer existe un efecto en las reacciones inmunológicas de los niños, principalmente asociado a bajos o nulos niveles de anticuerpos que se presentaron en los estudios, lo cual implica un riesgo de infección por enfermedades que son inmunoprevenibles. Respecto a esto, la administración de vacunas vivas se debe posponer después del tratamiento contra el cáncer hasta obtener recuentos de linfocitos y niveles de anticuerpos estables12,23 por evidencias de una respuesta de vacunación ineficaz en la mayoría de los niños. Así mismo, se enfatiza en la aplicación en un periodo de 6 a 12 meses después del tratamiento en vacunas como sarampión, paperas, rubéola, varicela, hepatitis B, poliovirus, C. tetani y S. pneumoniae12.
Además, en los estudios realizados sobre la administración de vacunas de varicela, sarampión, paperas, rubéola, hepatitis B, MMR o triple viral, neumococo conjugada PCV13, neumococo conjugada PPV23, influenza, influenza tipo A y B, DTaP-IPV-Hib o pentavalente, poliovirus, C. tetani y S. pneumoniae, se evidenció que en la mayoría de pacientes se obtuvo una muestra de anticuerpos positiva después de la vacunación en la primera o segunda dosis13,14,16,18-21,24,26, lo cual destaca la importancia de una revacunación y dosis de refuerzo en esta población después del tratamiento contra el cáncer.
No obstante, en el estudio de Keskin et al.16 que examinó los anticuerpos de hepatitis B y MMR se evidenció que los pacientes que no tenían títulos seroprotectores antes de la vacunación, no lograron, en su mayoría, obtener anticuerpos positivos para estas vacunas, es decir, si el paciente no posee un adecuado nivel de anticuerpos antes de la vacunación no logrará un nivel de seroprotección ante las enfermedades prevalentes, por lo cual se esperaría después de determinado tiempo realizar la aplicación de las vacunas. En consecuencia, la mayoría de estudios no daban recomendaciones en tiempo, ni condiciones para la administración de vacunas por falta de evidencia clínica de una buena respuesta en la población infantil con cáncer en vacunas como varicela, hepatitis B, difteria, poliomielitis, HIB, gripe, DTPa/dTpa o dT, polio, meningococo C, neumococo polisacárida 23v, papiloma humano, tos ferina, MMR, neumococo conjugada PCV13, neumococo conjugada PCV7, influenza tipo A y B, poliovirus, C. tetani y S. pneumoniae12,15,19,22,24,26,27,29.
Debido a lo antes expuesto, en los artículos se generaron recomendaciones para próximas investigaciones, las cuales se enfocan principalmente en realizar estudios más amplios, con un mayor número de población y profundidad sobre la eficacia clínica de las vacunas. Por un lado, Bettoni et al.11 plantearon que la investigación es necesaria para resolver preguntas que se desarrollaron a lo largo de su estudio, tales como cuáles son los efectos de los medicamentos inhibidores de la tirosina cinasa sobre la inmunidad humoral, quién debería tener este medicamento para que se permita la vacunación y si la baja inmunosupresión afecta la probabilidad de seroconversión al recibir una vacuna viva. Así mismo, Garonzi et al.12 y Shin et al.18 plantearon que es necesario determinar el tiempo adecuado para la administración de las vacunas durante el tratamiento o si se puede realizar durante alguna fase del tratamiento activo. Además se deben investigar las dosis necesarias para mantener una seroprotección junto con estudios específicos que midan la duración de niveles altos de anticuerpos19 y a partir de esto realizar la difusión de pautas específicas para la inmunización30.
Conclusión
Diversos estudios han abarcado métodos y aplicaciones de administración de vacunas con énfasis en fases de tratamiento, edad, tipos de cánceres y tipos de vacunas, los cuales demuestran una gran eficacia en la población objetivo por sus niveles seroprotectores después de la vacunación; sin embargo, según la evidencia presentada en esta revisión es necesario realizar un mayor número de investigaciones mediante estudios clínicos con un número superior de población y con fuerte evidencia clínica que permita dar recomendaciones según el tiempo, tipo de vacuna, condiciones del paciente y precauciones que tener en la administración de inmunobiológicos.











 nova página do texto(beta)
nova página do texto(beta)