Introducción
El melanoma es la neoplasia maligna más letal de la piel, consiste en la proliferación anárquica resultado de la degeneración y atipia del melanocito. Este tipo celular se encuentra a menudo en varios tejidos del organismo, como piel, ojos, oídos, tracto gastrointestinal, leptomeninges y membranas de la mucosa oral y genital1. El melanoma maligno posee una incidencia en incremento; especialmente, cuando se supera los 30-40 años de edad2,3. Del mismo modo, la mortalidad de esta neoplasia se aprecia alarmante, puesto que se le atribuye el 65% de todos los cánceres de piel, el cual refleja su naturaleza letal3. Se ha demostrado que alrededor del 70-90% del melanoma que se presenta en cabeza y cuello ocurre en la cara4, siendo la mejilla el sitio más común5. Sin embargo, el sitio menos frecuente es el cuero cabelludo y frente6,7. Según el Instituto Nacional de Cancerología de Colombia, los sitios de mayor interés son la región acral seguida de cabeza y cuello8. Se consideran factores pronóstico en el desarrollo de metástasis en el melanoma cutáneo: sexo masculino, tipo histológico nodular, índice de Breslow mayor a 4 mm y ulceración9.
Se expone el caso de una paciente de 76 años de edad, que consulta por melanoma gigante sangrante en un sitio de localización inusual con factores de mal pronóstico como subtipo histológico nodular, ulceración, un índice de Breslow mayor a 4 mm y un nivel de Clark 5; no obstante, la paciente no demuestra metástasis en satélite, en tránsito, nodo linfático y distante.
Presentación del caso
Paciente de sexo femenino de 76 años de edad, procedente del área rural, que ingresa a la sala de emergencias por sensación de masa en región frontonasal hace dos meses asociado a sangrado abundante que se exacerba hace dos días. El médico de cuidado primario observa lesión prominente acompañada de signos locales de infección y sangrado profuso, realizando impresión diagnóstica de melanoma infectado. Inicia terapia antibiótica con oxacilina más clindamicina sin respuesta adecuada, por lo que remite a centro de mayor complejidad. Entre los antecedentes de importancia: hemitiroidectomía derecha indicada por nódulo tiroideo, en manejo con levotiroxina 100 mcg/día, hipertensión arterial esencial tratada con losartán 100 mg/día y su padre falleció por neoplasia de próstata con metástasis a columna. Al arribar a nuestro hospital se observa al examen físico: paciente en aceptable estado general, con signos vitales estables: tensión arterial 130/73 mmHg, frecuencia cardiaca 73 latidos por minuto, frecuencia respiratoria 18 respiraciones por minuto, temperatura 36.2 °C, peso 58 kg, talla 1.65 cm, saturación de oxígeno 96%. A la exploración física: normocéfalo, se observa tumoración exofítica sobresaliente en región frontal, aproximadamente de 7 x 6 cm de diámetro, friable, con sangrado profuso y deformante, bordes irregulares, mal delimitada, no circunscrita, se observan áreas ulceradas y hemorrágicas, sin signos locales de infección o síndrome de respuesta inflamatoria sistémica (Fig. 1). El resto del examen físico sin anormalidades destacadas. Es valorada por el servicio de oncología clínica, que descarta melanoma infectado y considera melanoma infiltrante y hemorrágico, solicita estudio imagenológico de extensión (tomografía computarizada [TC] de tórax y abdomen) en el que no se evidencia compromiso metastásico; por ende, determina melanoma maligno infiltrante en estadio clínico inicial 1B que requiere procedimiento quirúrgico. Es valorada por especialista en cirugía maxilofacial, quien programa para cirugía y solicita estudios adicionales: ecografía de cuello que reporta ganglios con ligero engrosamiento cortical, con presencia de hilio ecogénico en zona 3 izquierda y TC de cuello en el que se observa ganglio en zona II derecha de aspecto reactivo y hemitiroidectomía derecha. El 13 de mayo de 2020 se realiza intervención quirúrgica de resección de melanoma maligno localizado en región frontal mayor a 6 cm y bordes irregulares más colgajo sin complicaciones. La paciente es hospitalizada para seguimiento clínico postoperatorio, el cual presenta evolución satisfactoria, sin signos de respuesta inflamatoria local o sistémica, ni sangrado por herida quirúrgica. Se decide dar egreso hospitalario al siguiente día. Acude a cita de control con reporte patológico que informa resección local amplia y márgenes libres de tumor. El diagnóstico histopatológico de melanoma maligno nodular en fase de crecimiento radial y vertical, con índice de Breslow > 4 mm, nivel de Clark 5, ulcerado, numero de mitosis > 3 x 10 campos de gran aumento, con escaso infiltrado linfocitario peritumoral e intratumoral nulo, sin invasión vascular y perineural, satelitosis negativa, tipo celular predominante epitelioide, elastosis actínica de la dermis peritumoral negativa, clasificación PTNM: T4BN0M0 (Fig. 2 A-C).

Figura 1 Se observa lesión gigante de 6.5 x 6 cm de diámetro en región superciliar derecha que oculta la visión de la paciente con áreas de ulceración, hemorragia y necrosis.
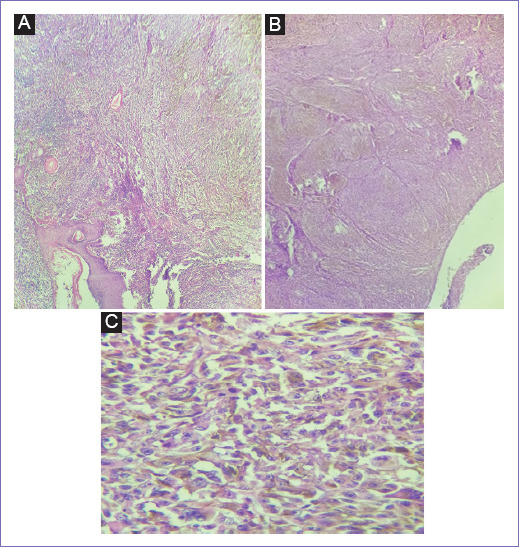
Figura 2 A: la imagen muestra piel con una proliferación tumoral maligna que compromete la dermis y está constituida por una población fusocelular con pigmento melanocítico en algunas células. B: la lesión exhibe extensa ulceración epidérmica y nidos de células separados por delicados septos fibrosos. C: nótese ampliación a 40X. Se observa una población atípica de melanocitos pleomórficos con formas fusadas y epitelioides, se resalta la presencia de pigmento y algunas mitosis.
Discusión
El melanoma es la neoplasia más representativa de la piel. Se define como la transformación maligna del melanocito que contiene los organelos productores de melanina conocidos como melanosomas1. Se destaca por ser la neoplasia de piel con mayor mortalidad3,10. En Colombia, según los datos proporcionados por el Instituto Nacional de Cancerología, en el año 2018 el melanoma fue el tercer cáncer de piel, con un 16.1%, precedido por el carcinoma basocelular (52.7%) y el escamocelular (22.6%)8. El melanoma en cabeza y cuello es muy variable, se ha descrito en algunos estudios que se encuentra entre el 10-25% en esa localización11 y en otros alrededor del 40-60% en cara, 14-49% en cuero cabelludo y 8-11% en oído6,7,11. En la región frontonasal se ha documentado muy escasamente en la literatura. En Colombia, según los autores y de acuerdo con la revisión de la literatura, no hay casos reportados con estas características; por el cual, podría tratarse del primer caso reportado en Colombia.
El patrón epitelioide, también denominado «patrón animal», es un tipo histológico muy inusual12. Se caracteriza por una pigmentación oscura intensa, parda oscura, negra o negra azulosa, su apariencia es nodular, pero puede aparecer como parche12. En el caso presentado, se evidencia una lesión prominente e irregular, color azuloso oscuro e intensa, con amplias áreas hemorrágicas, lo cual corresponde con la descripción clínica informada en la literatura. El análisis que realizaron Magro et al.13 determina que puede ser útil la biopsia de ganglios, teniendo en cuenta algunas series de casos que exhiben metástasis a ganglios regionales en el 46% de los pacientes13. En nuestro caso no se presentó evidencia de metástasis locales a ganglios regionales.
El melanoma maligno gigante en esa región sin metástasis a los ganglios del cuello, cerebral u ocular es muy raro. Según Faries et al.14, la ocurrencia de metástasis a nodos linfáticos no está asociada con el sitio del tumor primario y según Hoersch et al.15, aquellos con melanoma localizado en cabeza y cuello no mostraron una reducción en la supervivencia respecto a la de los melanomas en otros sitios. A pesar de la evidencia que no hay incremento de riesgo para metástasis por la localización inusual, el comportamiento agresivo del tumor está latente, ya que varios predictores para mal pronóstico y metástasis como patrón histológico nodular, en fase de crecimiento radial y vertical, ulceración, numero de mitosis > 3 x 10 campos de gran aumento, un índice de Breslow > 4 mm y un nivel de Clark 5 se encuentran presentes en este caso. En la literatura se han descrito varios de estos factores que influyen en la migración metastásica a otros sitios16. Por ejemplo, Cherobin et al.9 han reportado factores pronósticos como subtipo histológico nodular, índice de Breslow > 4 mm y ulceración, hallazgos compatibles con los descritos en el caso presentado. Se han encontrado diferentes elementos con repercusión en el comportamiento biológico del melanoma maligno como el índice de Breslow > 4 mm, el cual se ha planteado como uno de los más importantes para determinar la ocurrencia de metástasis (p = 0.0011)9. En ese sentido, se ha correlacionado a estadios más avanzados en conjunto con el crecimiento vertical que condicionan la naturaleza agresiva de estos tumores17,18. De acuerdo con Brauer et al.19, el grosor del melanoma incrementa el riesgo de metástasis temprana (entre seis meses a tres años del tumor inicial) comparado a metástasis tardías, que generalmente ocurren después de los nueve años del tumor primario. Así mismo, Stucky et al.20 sustentan que el riesgo de metástasis locales aumenta cuando el índice de Breslow es mayor. El estudio de Sartore et al.21 demostró que hay mayor riesgo de micrometástasis a nódulo linfático centinela (NLC) con el aumento del índice de Breslow. Por su parte, el nivel de Clark es determinante en la metástasis a NLC22.
El melanoma nodular tiene mayor riesgo de diseminación de la enfermedad en comparación con el melanoma superficial y el lentigo maligno9,23. Del mismo modo, se ha observado que tiene mayor probabilidad de compromiso de los nodos linfáticos24, lo que significa baja supervivencia en los pacientes con este tipo histológico23. Se ha asumido que el comportamiento agresivo del melanoma nodular corresponde a la alta carga mutacional de BRAF (68.8%) y baja frecuencia de la mutación NRAS (12.5%)25. Cabe destacar que el crecimiento vertical y radial, la invasión al sistema vascular y linfático, hace parte de la naturaleza aberrante del melanoma nodular26-28.
En cuanto a la ulceración, es un predictor independiente de metástasis a NLC9,22, se relaciona con reducción de la supervivencia en cinco años del 80 al 55%29. Según informan Francken et al.30, la ulceración y el índice de Breslow son las variables que mayor influencia tienen en la supervivencia a los 10 años en los pacientes con melanoma localizado. En un estudio reciente realizado en Corea encontraron que el subtipo histológico nodular, ulceración y el índice de Breslow contribuyeron al desarrollo de metástasis31. El índice mitótico interviene en el grosor del tumor y en el aumento de metástasis. En esta paciente se observó una actividad del índice mitótico > 3 x 10 campos, lo que concuerda con los hallazgos de otros autores que han detectado alto riesgo de metástasis en estos tumores32,33.
Es imprescindible la escisión quirúrgica, calificada como la primera opción en el tratamiento de los melanomas en cabeza y cuello34. Hay que tener en cuenta que por el sitio donde se encuentra la lesión el manejo terapéutico tanto quirúrgico como estético es fundamental comparado con otras partes del cuerpo35-38.
Conclusión
En conclusión, se ha evaluado en conjunto los factores pronóstico que intervienen en la metástasis del melanoma maligno. La paciente cumple con muchos criterios para este desenlace; sin embargo, no se produjo metástasis local o distante documentada, lo que es excepcional y muy interesante. Por ello es necesaria mayor investigación en la biología molecular y genética del melanoma para lograr comprender este fenómeno.











 nueva página del texto (beta)
nueva página del texto (beta)


