Introducción
Proporcionalmente hablando, el mieloma múltiple (MM) es el cáncer que con mayor frecuencia afecta al esqueleto. Se estima que del 80 al 90% de los pacientes con MM desarrolla lesiones óseas de tipo osteolítico durante el transcurso de su enfermedad, las cuales se asocian con dolor severo y debilitante, hipercalcemia y complicaciones óseas, primordialmente fracturas de tipo patológico1. La ocurrencia de eventos relacionados con el esqueleto (ERE, término que puede incluir fracturas patológicas, radioterapia a hueso, compresión medular y cirugía ósea2) en individuos afectados por MM empeora su pronóstico y constituye un factor determinante para la disminución de calidad de vida relacionada con la salud e incremento de mortalidad3-5.
La atención de los ERE impone una carga financiera sustancial sobre los sistemas de salud. Está bien documentado que los ERE elevan el uso de servicios médicos, tales como consultas de especialidad, atención en el servicio de urgencias, estancia hospitalaria, procedimientos quirúrgicos y no quirúrgicos (p. ej., radioterapia), sesiones de fisioterapia, así como la adquisición de medicamentos, dispositivos ortopédicos y material de osteosíntesis, según sea el caso6-9.
La mediana de tiempo transcurrido para ocurrencia de ERE en MM varía de 3 a 10 meses, siendo los pacientes que cuentan con historia de ERE significativamente más propensos a experimentar eventos subsecuentes2. Por ello, es fundamental su prevención. Tanto el denosumab como el ácido zoledrónico (AZ) cuentan con evidencia favorable en este ámbito10,11 y se recomiendan en diversas guías de práctica clínica a nivel internacional12-15. No obstante, estos agentes difieren en su mecanismo de acción y vía de administración, con el denosumab asociándose con ciertas ventajas en aspectos generales de eficacia y de seguridad renal10,12-15.
Una evaluación económica consiste en el análisis comparativo de los costos y desenlaces en salud entre dos o más intervenciones mutuamente excluyentes, destinado a contribuir en la toma de decisiones16. El objetivo del presente estudio fue comparar los costos y la efectividad del uso de denosumab en MM con respecto al empleo del AZ o no tratamiento (en aquellos donde el AZ está contraindicado por tener insuficiencia renal grave) desde la perspectiva del sector público de salud en México como pagador.
Material y métodos
Descripción general
El análisis se desarrolló conforme a la Guía para la Conducción de Estudios de Evaluación Económica para la Actualización del Cuadro Básico de Insumos del Sector Salud en México17. Se trata de un análisis de costo-efectividad, utilizando como medidas de desenlace el número de ERE y los meses de supervivencia libre de progresión (SLP).
Población objetivo
Pacientes adultos, derechohabientes de las instituciones del sector público de salud en México, con MM de diagnóstico reciente y que presentaron al menos una lesión lítica ósea documentada.
Intervenciones competitivas
Se comparó el denosumab a dosis de 120 mg administrada por vía subcutánea una vez cada cuatro semanas contra un escenario mixto en donde los pacientes pueden recibir AZ a dosis de 4 mg administrada mediante infusión intravenosa una vez cada cuatro semanas o no tratamiento (Mix AZ/No trt). La proporción de pacientes del escenario mixto que no reciben tratamiento es el 21.1%18 y corresponde a los individuos que presentan contraindicación al AZ por insuficiencia renal grave19.
Horizonte temporal y tasas de descuento intertemporal
Puesto que los pacientes con MM se encuentran en riesgo permanente de experimentar ERE, se contempló un horizonte temporal de por vida, definido operacionalmente como 500 ciclos de 28 días (≈ 38 años)20,21. Los costos y medidas de efectividad se descontaron a una tasa anual del 5% en el caso base17.
Modelo de decisión
Se adaptó un modelo semi-Markov de supervivencia particionada utilizado previamente por otros autores20,21. El modelo consta de cinco estados de salud: cuatro de ellos se definen combinando las dicotomías según el uso (Sí/No) de una terapia dirigida al hueso (TDH; en este caso, denosumab o AZ) y la ocurrencia (Sí/No) de progresión de la enfermedad; el quinto estado de salud es «Muerto». Todos los pacientes con denosumab o AZ inician en el estado de salud «En tratamiento y preprogresión MM», mientras que los pacientes con enfermedad renal grave del brazo Mix AZ/No trt comienzan en el estado de salud «Fuera de tratamiento y preprogresión MM». El horizonte temporal transcurre en ciclos de 28 días (cuatro semanas). Mientras se encuentran bajo tratamiento, el modelo contempla los costos de adquisición y (si aplica) administración de denosumab o AZ, así como la posibilidad de experimentar eventos adversos serios o ERE. Los pacientes bajo tratamiento con TDH pueden suspender la terapia asignada, transitando así a cualquiera de los estados cuyo nombre comienza con «Fuera de tratamiento» (p. ej., «Fuera de tratamiento y preprogresión MM» o «Fuera de tratamiento y posprogresión MM» según corresponda), en el cual enfrentan riesgos mayores de sufrir ERE. Al experimentar progresión de la enfermedad, los pacientes transitan a cualquiera de los estados de salud cuyo nombre termina con «Posprogresión MM». En cualquier ciclo, e independientemente de si están bajo tratamiento o ya lo suspendieron y de si ya experimentaron progresión de la enfermedad o aun no lo han hecho, los pacientes pueden morir. Es importante señalar que el modelo incluye cuatro líneas de tratamiento antimieloma, con la primera de ellas comenzando al iniciar el modelo.
Parámetros clínicos
La tabla 1 presenta los parámetros clínicos del modelo. En el caso base, las frecuencias de ERE para denosumab y AZ se modelaron mediante las tasas crudas estimadas para cada tratamiento con la información del análisis de supervivencia con punto temporal de referencia (landmark) a 15 meses del ensayo clínico pivotal10,20. La razón para utilizar este enfoque es que la mayoría de los ERE registrados en dicho ensayo clínico ocurrió durante los primeros tres meses, de tal manera que al establecer a 15 meses el punto temporal de referencia es posible observar el efecto de los agentes estudiados de una manera más adecuada. Por su parte, la tasa de ERE en los pacientes que inician sin tratamiento por tener contraindicación al AZ o en aquellos que eventualmente abandonan el tratamiento con denosumab o AZ es más elevada que con cualquiera de las TDH y se calcula como el cociente de la tasa de AZ que corresponda y 0.57, siendo este último parámetro la razón de riesgos (RR) para ERE de AZ frente a no tratamiento11. Al igual que en otras evaluaciones económicas, las tasas crudas se ajustaron al alza, permitiendo que sean más representativas de lo que se observa en el mundo real20,21. Las tasas crudas anualizadas de ERE ajustadas para el mundo real se transforman a tasas por ciclo dividiéndolas por el número de ciclos de 28 días que hay en promedio por año; esto es, dividiéndolas por 13.04 ≈ 365.25/28. La distribución porcentual por tipo de ERE se calculó considerando las cifras combinadas de eventos registradas en ambos brazos (denosumab y AZ) durante el ensayo clínico pivotal10,20: fractura patológica (1,280; 81.6%), radioterapia a hueso (174; 11.1%), cirugía ósea (104; 6.6%) y compresión medular (10; 0.6%). Se asumió que dicha distribución aplica por igual, tanto a las propias TDH como al no tratamiento.
Tabla 1 Principales parámetros clínicos del modelo
| Variable | Mínimo | Caso base | Máximo | Referencia |
|---|---|---|---|---|
| Contraindicación a AZ | 20.2% | 21.1% | 22.0% | Qian et al. 201718 |
| Tasa cruda anualizada de ERE | Raje et al. 201820 | |||
| AZ, primeros 14 meses | 0.78 | 0.84 | 0.90 | |
| AZ, mes 15 en adelante | 0.14 | 0.18 | 0.22 | |
| Denosumab, primeros 14 meses | 0.77 | 0.83 | 0.89 | |
| Denosumab, mes 15 en adelante | 0.09 | 0.12 | 0.15 | |
| RRERE AZ vs. No trt | 0.37 | 0.57 | 0.76 | Mhaskar et al. 201711 |
| Factor de ajuste a mundo real | 1.00 | 2.84 | 4.00 | Terpos et al. 201921 |
| SG: Weibull | Terpos et al. 201921 | |||
| Mu/Sigma | NA | 8.107/0.898 | NA | |
| SLP: Gamma generalizada | Terpos et al. 201921 | |||
| Mu (AZ/denosumab) | NA | 3.870/4.008 | NA | |
| Sigma (AZ/denosumab) | NA | 0.101/0.048 | NA | |
| Q (AZ/denosumab) | NA | 0.971/0.710 | NA | |
| TTD: Weibull | Cálculos propios* | |||
| Mu/Sigma | NA | 7.092/0.877 | NA | |
| Tasa de EA serios, por ciclo | Terpos et al. 201921 | |||
| ONM (AZ/denosumab) | NA | 0.002/0.0047 | NA | |
| Hipocalcemia (AZ/denosumab) | NA | 0.002/0.006 | NA | |
| Toxicidad renal (AZ/denosumab) | NA | 0.021/0.017 | NA |
*Estimaciones basadas en la descomposición de Cholesky de la matriz de covarianza (los parámetros de covarianza no se muestran en la tabla).
AZ: ácido zoledrónico; ERE: eventos relacionados con el esqueleto; NA: no aplica; No trt: sin tratamiento; ONM: osteonecrosis de la mandíbula; RR: razón de riesgos;
SG: supervivencia global; SLP: supervivencia libre de progresión; TTD: tiempo para discontinuación.
Las probabilidades de transición entre los estados de salud dependen de las curvas de SLP, supervivencia global (SG) y tiempo para discontinuación (TTD). Particularmente, en cada ciclo del modelo el área bajo la curva de SG representa la proporción de pacientes vivos, el área bajo la curva de SLP representa la proporción de pacientes que permanece en preprogresión y la diferencia entre ambas proporciones corresponde a la proporción de pacientes en posprogresión. De igual manera, el área bajo la curva de TTD determina la proporción de pacientes que continúa bajo tratamiento con TDH en cada ciclo del modelo. La información de los eventos progresión y muerte en el ensayo clínico pivotal10 fue utilizada para efectuar extrapolaciones de las curvas de SG y SLP. Debido a que el comportamiento de la ocurrencia de mortalidad fue parecido entre ambos agentes10, con un valor de hazard ratio (HR) para SG con denosumab vs. AZ igual a 0.90 (intervalo de confianza al 95% [IC 95%]: 0.70-1.16; p = 0.41) ambos brazos se combinaron y se produjo una sola extrapolación utilizando todos los datos20,21. Por el contrario, las curvas de SLP son específicas para cada TDH20,21, ya que en este caso sí se presentó una diferencia estadísticamente significativa en el ensayo clínico pivotal,10 con un HR para denosumab vs. AZ igual a 0.82 (IC 95%: 0.68-0.99; p = 0.036). Al igual que con SG, los datos relacionados con la duración de tratamiento con AZ y denosumab en el ensayo clínico pivotal10 fueron bastante parecidos entre sí, optándose en esta ocasión por aplicar a denosumab la misma curva de TTD calculada para AZ20,21. Se evaluaron diversas opciones de distribución paramétrica para cada curva, seleccionándose aquellas con la mejor combinación de bondad de ajuste y plausibilidad clínica. Así, el caso base se modela aplicando distribuciones Weibull para SG y TTD y distribuciones gamma generalizada para SLP.
El modelo está diseñado para que en ningún ciclo la probabilidad de muerte de los pacientes sea inferior a la de la población general de esa misma edad en México. La mortalidad por edad en México se estimó ponderando las probabilidades de morir en hombres y mujeres (calculadas a partir de las proyecciones de número de defunciones y de población a mitad de periodo en el año 2020, elaboradas por el Consejo Nacional de Población [CONAPO]22) y la distribución por sexo en el ensayo clínico pivotal (proporción de varones: 54.4%)10,21. Asimismo, el modelo evita que las curvas de SLP se crucen con la de SG, lo cual es implausible.
Los parámetros de cumplimiento terapéutico o intensidad de dosis proceden del mismo ensayo clínico pivotal10,20,21 y únicamente se utilizan para la estimación de costos: 0.881 (IC 95%: 0.871-0.971) y 0.854 (IC 95%: 0.842-0.866) para denosumab y AZ, respectivamente. Se consideraron los tres eventos adversos serios que han sido analizados en otras evaluaciones económicas diseñadas en pacientes con MM: osteonecrosis de la mandíbula, hipocalcemia y toxicidad renal20,21.
Uso de recursos y costos unitarios
Se evaluaron los costos directos médicos, constituidos por los siguientes rubros de gasto: adquisición de ambas TDH, administración de AZ mediante infusión intravenosa, manejo habitual de los pacientes, atención de ERE, tratamiento de eventos adversos serios y tratamiento antimieloma. Los valores se reportan en pesos mexicanos (de septiembre) del año 2020.
El costo de adquisición de las TDH se encuentra ajustado por persistencia (duración del tratamiento según la curva de TTD) y adherencia (p. ej., cumplimiento terapéutico conforme a la intensidad de dosis). El precio de un envase con un frasco ámpula de 120 mg de denosumab fue obtenido en Compranet23. El precio de un envase con un frasco ámpula de 4.0 mg de AZ se derivó con la información del Programa Anual de Adquisiciones, Arrendamientos, Servicios y Obra Pública (PAAASOP) 2020 del Instituto Mexicano del Seguro Social (IMSS)24. A la administración de AZ se le asignó un costo de $606.73, cifra equivalente a la diferencia entre el costo de una sesión de quimioterapia ($7,113) y el valor que de este corresponde a medicamentos ($6,558) en el IMSS25, actualizada por inflación. El costo del manejo habitual por cada ciclo de cuatro semanas consiste en una consulta de especialidad para todos los pacientes. Mientras el paciente se encuentre bajo tratamiento con AZ se agrega el costo de un estudio de laboratorio para monitorear el nivel de creatinina sérica19. Los costos unitarios de la consulta de especialidad ($1,549.57) y del estudio de laboratorio ($93.42) se determinaron actualizando por inflación los valores correspondientes para tercer nivel de atención en el IMSS25.
La tabla 2 muestra las estimaciones de costos para cada uno de los cuatro ERE y los tres eventos adversos serios considerados en el análisis. En el caso de fractura patológica, el costo incluye la fase inicial del tratamiento brindada en el hospital, ponderando la posibilidad de que el tratamiento sea quirúrgico o no quirúrgico, además de las consultas médicas y las sesiones de fisioterapia brindadas tras el egreso. El costo de los otros ERE contempla igualmente la fase aguda y las consultas médicas posteriores al egreso. Las estimaciones se basaron en los costos unitarios de una consulta de especialidad y de una sesión de fisioterapia en tercer nivel de atención25 y en los costos de ciertos grupos relacionados con el diagnóstico (GRD) en el IMSS26, actualizados por inflación, y en datos procedentes de distintas publicaciones5-7,27-29. Por tratarse de eventos adversos serios, se asumió que todos los pacientes que fuesen afectados ingresarían a hospitalización, de tal manera que el costo de cada uno de ellos refleja el valor actualizado por inflación del GRD26 que se consideró pertinente. Tanto los costos unitarios por servicios25 como los costos de GRD26 utilizados en el análisis son a nivel operativo-sustantivo.
Tabla 2 Costo de eventos relacionados con el esqueleto y de eventos adversos serios
| Evento | Atención aguda* | Consultas ambulatorias† | Sesiones de fisioterapia‡ | Total |
|---|---|---|---|---|
| Fractura patológica | $72,752.73a | $5,491.07h | $13,934.70 | $92,178.50 |
| Radioterapia a hueso | $71,312.17b | $6,508.18i | NA | $77,820.35 |
| Cirugía ósea | $250,224.30c | $4,183.83j | NA | $254,408.13 |
| Compresión medular | $301,221.97d | $6,353.23k | NA | $307,575.20 |
| ONM | $45,438.31e | NA | NA | $45,438.31 |
| Hipocalcemia | $25,931.88f | NA | NA | $25,931.88 |
| Toxicidad renal | $38,592.98g | NA | NA | $38,592.98 |
*Valores de GRD en el IMSS, versión 201826, actualizados por inflación: a) promedio ponderado de casos no quirúrgicos (58.7% según Barlev et al.6, con un costo equivalente al GRD 542) y de casos quirúrgicos, con un costo promedio ponderado calculado a partir de Thorsteinsdottir et al.,5 Trujillo-González et al.27 y diversos GRD (030, 168, 469, 480, 493 y 511); b) GRD 849; c) GRD 515; d) GRD 028; e) GRD 137; f) GRD 641, y g) GRD 700.
†Producto del costo por consulta de especialidad en tercer nivel en el IMSS para 201825 actualizado por inflación ($1,549.57) y la frecuencia de consultas reportada en Body et al.7,28: h) 3.5 consultas, promedio ponderado de huesos largos (32.6%, basado en Thorsteinsdottir et al.5) y otros huesos; i) 4.2 consultas; j) 2.7 consultas, y k) 4.1 consultas.
‡Producto del costo por sesión de fisioterapia en tercer nivel en el IMSS25 para 2018 actualizado por inflación ($1,059.57) y 13.2 sesiones, cifra basada en Thorsteinsdottir et al.5 y Dimai et al.29. Valores de GRD y de costos unitarios, a nivel operativo sustantivo. Todos los valores monetarios se expresan en pesos mexicanos.
GRD: grupo relacionado con el diagnóstico; IMSS: Instituto Mexicano del Seguro Social; NA: no aplica; ONM: osteonecrosis de la mandíbula.
El costo esperado para cada línea de tratamiento antimieloma se definió en función de dos factores: la distribución porcentual de los tratamientos al interior de la línea y el costo de tratamiento prorrateado por periodo de 28 días con cada uno de ellos. Las probabilidades de uso de los regímenes considerados en el análisis (talidomida, bortezomib, combinación de talidomida y bortezomib, quimioterapia con melfalán) para las primeras tres líneas de tratamiento antimieloma se estimaron con base en datos publicados por de Moraes Hungria et al.30. El cálculo de costos contempla la posología recomendada para cada agente en las respectivas cédulas descriptivas del Compendio Nacional de Insumos para la Salud31, usando como valores promedio de talla y peso corporal las cifras publicadas por Bohsain (160 cm y 63.7 kg, respectivamente)32 y los costos de adquisición estimados a partir del PAAASOP 2020 del IMSS24. Así, el costo por cada 28 días de tratamiento antimieloma aplicado en el modelo fue de: $4,673.15 en primera línea, $5,948.95 en segunda línea y $5,532.63 en tercera línea. Se asumió que el costo de la cuarta línea es igual al de la tercera. Las duraciones promedio de tratamiento con cada línea fueron 8, 9, 8 y 6 meses, respectivamente, con una brecha entre la segunda y tercera línea de 11 meses y otra de 7 meses entre la tercera y cuarta línea33.
Análisis de sensibilidad
Se llevaron a cabo análisis de sensibilidad de tipo determinístico (ASD) y probabilístico (ASP). La primera parte del ASD contempló análisis de escenario del precio de denosumab y sobre ciertos aspectos metodológicos, incluyendo el horizonte temporal. La segunda parte consistió en una serie de análisis univariantes, resumidos mediante diagramas de tornado. El ASP refleja los resultados obtenidos tras generar mil simulaciones de Monte Carlo de segundo orden. La proporción de pacientes que tienen contraindicación para AZ se modeló mediante una distribución beta. Las tasas de ERE y de eventos adversos con denosumab y AZ se modelaron con una distribución gamma. La razón de riesgos para ERE con AZ vs. No trt se modeló con una distribución log-normal. La distribución porcentual entre los ERE se definió usando una distribución Dirichlet. El número de dosis por ciclo, los costos de adquisición de denosumab y AZ y el factor de ajuste a mundo real se modelaron con una distribución normal, mientras que a los demás costos se les asignó una distribución gamma. Los parámetros de las distribuciones empleadas para modelar SG, SLP y TTD se definieron en función de la matriz de Cholesky.
Resultados
Como se puede apreciar en la tabla 3, una muy amplia proporción de los costos totales en ambas estrategias de tratamiento corresponde a la atención de ERE. La adquisición de denosumab representó únicamente el 11% del costo total en ese grupo. Aproximadamente, el 89% de la diferencia entre el costo en adquisición de denosumab y el de AZ ($200,430) se compensa por la suma de los ahorros logrados al reducir la frecuencia de ERE, la disminución en el costo de tratamiento antimieloma y el beneficio de no requerir infusiones intravenosas para su administración. La diferencia neta fue de tan solo $19,971, cifra que equivale a 1.1% del costo total con el Mix AZ/No trt. Dado que el denosumab resultó más costoso, pero más efectivo, se realizó un análisis incremental. El costo por ERE evitado con denosumab vs. Mix AZ/No trt fue igual a $13,942, mientras que la razón de costo-efectividad incremental (RCEI) para la otra medida de efectividad indicó un costo de $1,893 por mes extra vivido en SLP.
Tabla 3 Resultados del caso base y análisis de sensibilidad de escenario
| Valores descontados | Denosumab | Mix AZ/No trt | Diferencia |
|---|---|---|---|
| Costo total por paciente | $1,842,708 | $1,822,737 | $19,971 |
| Adquisición de TDH | $201,993 | $1,563 | $200,430 |
| Administración de TDH | $0 | $14,932 | $14,932 |
| Manejo ordinario | $127,309 | $130,001 | $2,692 |
| Atención de ERE | $1,428,892 | $1,576,034 | $147,142 |
| Tratamiento de EA serios | $2,860 | $2,006 | $855 |
| Tratamiento antimieloma | $81,654 | $98,200 | $16,547 |
| Frecuencia de ERE | 13.91 | 15.34 | 1.43 |
| Meses vividos en SLP | 50.4 | 39.9 | 10.6 |
| Descripción | Δ Costos | Δ ERE/Δ SLP | RCEIERE/RCEISLP |
| Caso base | $19,971 | 1.43/10.6 | $13,942/$1,893 |
| Denosumab, precio 5% más alto | $30,071 | 1.43/10.6 | $20,992/$2,850 |
| Denosumab, precio 5% más bajo | $9,872 | 1.43/10.6 | $6,891/$936 |
| HRERE denosumab vs. AZ* | $24,402 | 1.39/10.6 | $17,564/$2,313 |
| Análisis del conjunto total† | $63,379 | 1.01/10.6 | $62,759/$6,007 |
| Distribución Weibull para SLP | $28,444 | 1.43/5.4 | $19,857/$5,242 |
| Horizonte temporal a 10 años | $21,492 | 1.40/6.8 | $15,305/$3,167 |
*HR de 0.99 en los primeros 14 meses y de 0.71 del mes 15 en adelante20.
†Tasas anuales de ERE igual a 0.59 y 0.62 para denosumab y AZ, respectivamente20. Todos los valores monetarios se expresan en pesos mexicanos.
AZ: ácido zoledrónico; EA: eventos adversos; ERE: eventos relacionados con el esqueleto; HR: hazard ratio; No trt: sin tratamiento; RCEI: razón de costo-efectividad incremental; SLP: supervivencia libre de progresión; TDH: terapia dirigida al hueso.
Análisis de sensibilidad
La parte inferior de la tabla 3 presenta la comparación de los valores incrementales de costos y de efectividad para los seis escenarios evaluados como parte del ASD. Con excepción del escenario donde se excluye la información del análisis de supervivencia con punto temporal de referencia a 15 meses, sustituyéndola por la del análisis del conjunto total de datos, el resto de los escenarios tuvo un impacto limitado sobre los resultados con respecto a los valores obtenidos en el análisis del caso base.
Las figuras 1 y 2 muestran los diagramas de tornado. En ambos casos, el factor de ajuste de las tasas de ERE a mundo real fue la variable más influyente sobre la RCEI, seguida por la RR para ERE con AZ vs. no tratamiento y el costo por fractura patológica. Por su parte, las figuras 3 y 4 despliegan los diagramas de dispersión de costo-efectividad incremental. Aproximadamente un tercio de las simulaciones generadas durante el ASP se ubicó en el cuadrante IV del plano de costo y efectividad incrementales, indicando dominancia a favor del denosumab. Para un valor de disponibilidad a pagar (DAP) de $45,000 por ERE evitado, el denosumab resultó dominante o al menos costo-efectivo en el 69.2% de las simulaciones. De igual forma, para un valor de DAP igual a $45,000 por mes extra vivido en SLP, el denosumab resultó dominante o al menos costo-efectivo en el 95.5% de las simulaciones correspondientes.
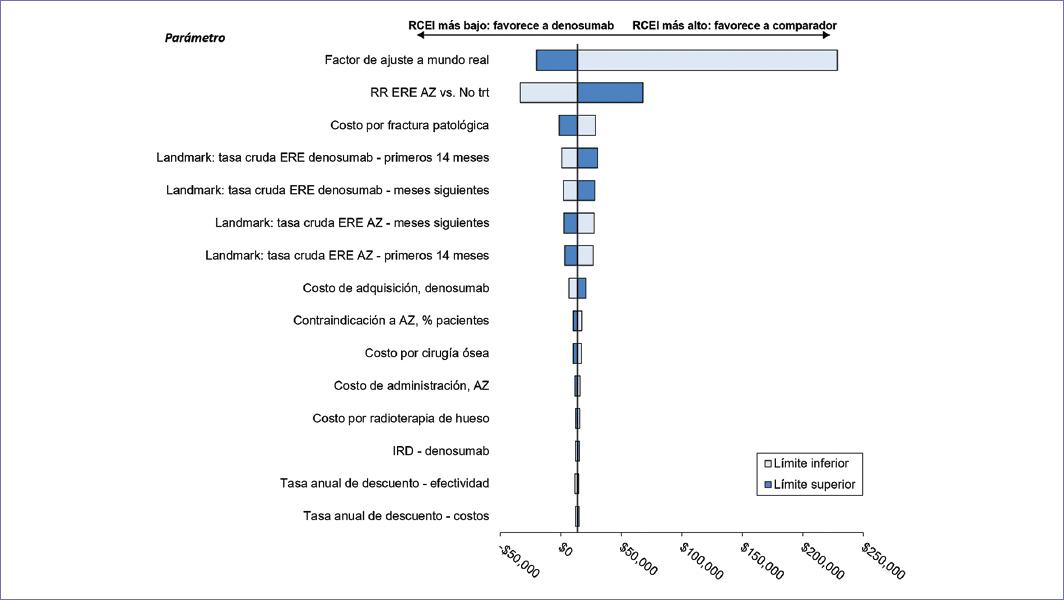
Figura 1 Diagrama de tornado para eventos relacionados con el esqueleto (ERE): denosumab vs. Mix AZ/No trt. Todos los valores monetarios se expresan en pesos mexicanos. AZ: ácido zoledrónico; IRD: intensidad relativa de dosis; No trt: sin tratamiento; RCEI: razón de costo-efectividad incremental; RR: razón de riesgos.

Figura 2 Diagrama de tornado para meses vividos en supervivencia libre de progresión (SLP): denosumab vs. Mix AZ/No trt. Todos los valores monetarios se expresan en pesos mexicanos.AZ: ácido zoledrónico; ERE: evento relacionado con el esqueleto; IRD: intensidad relativa de dosis; No trt: sin tratamiento; RCEI: razón de costo-efectividad incremental; RR: razón de riesgos.
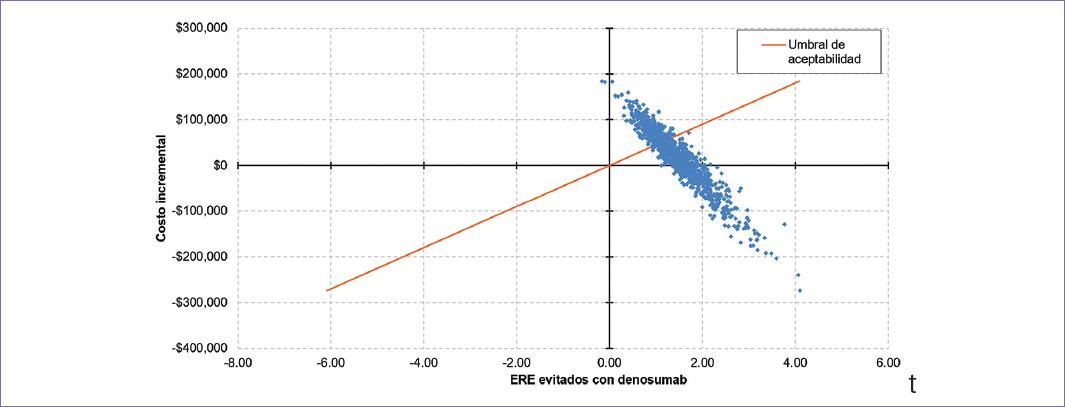
Figura 3 Diagrama de dispersión de costo-efectividad incremental para ERE: denosumab vs. Mix AZ/No trt.* *Umbral de aceptabilidad igual a $45,000 por ERE adicionalmente evitado. Todos los valores monetarios se expresan en pesos mexicanos.AZ: ácido zoledrónico; ERE: eventos relacionados con el esqueleto; No trt: sin tratamiento.

Figura 4 Diagrama de dispersión de costo-efectividad incremental para meses vividos en SLP: Denosumab vs. Mix AZ/No trt.**Umbral de aceptabilidad igual a $45,000 por mes de vida en SLP adicionalmente ganado. Todos los valores monetarios se expresan en pesos mexicanos.AZ: ácido zoledrónico; No trt: sin tratamiento; SLP: supervivencia libre de progresión.
Discusión
El progreso realizado en el ámbito del tratamiento de MM en los últimos años es notable. Si bien todavía se considera una enfermedad incurable, la expectativa de vida tras el diagnóstico de MM ha ido incrementándose, lo que a su vez impone la necesidad de contar con terapias más eficientes que atiendan los síntomas relacionados con calidad de vida e impacten en el curso de la propia enfermedad3. Los resultados del presente estudio sugieren que el denosumab ofrece una reducción del riesgo de ERE y un mayor tiempo vivido en SLP con respecto al Mix AZ/No trt. El incremento en costos asociado con la adquisición de denosumab puede compensarse en buena parte por los ahorros derivados con la prevención de ERE y porque los pacientes en SLP incurren generalmente en menos costos de tratamiento antimieloma que aquellos que ya han progresado. Aunado a lo anterior, el denosumab no requiere de infusiones intravenosas para su administración, lo que representa otra fuente de ahorro en comparación con el uso de AZ. A pesar de que no existe un umbral de aceptabilidad estándar para las medidas de costo-efectividad analizadas, las RCEI calculadas para denosumab frente al Mix AZ/No trt son relativamente bajas ($13,942 por ERE evitado y $1,893 por mes extra vivido en SLP), lo que permite sugerir que se trata de una intervención costo-efectiva. De hecho, al multiplicar 1,893 por 12 se obtiene el equivalente al costo por un año de vida en SLP ($22,716), cifra muy por debajo de un potencial umbral de aceptabilidad definido por el valor del producto interno bruto per cápita proyectado para 2020 en México ($176,203)34. Hay que añadir que la prevención de ERE representa un desenlace valioso en sí mismo3,12-15, y que la SLP constituye una medida subrogada que goza de amplia aceptación35,36.
El considerar al denosumab como potencialmente costo-efectivo resulta consistente con las publicaciones de Raje et al.20 y Terpos et al.21 No obstante, existen ciertas diferencias metodológicas entre nuestro análisis y los estudios referidos. Por un lado, la medida de desenlace en los estudios publicados fue el número de años de vida ajustados por calidad, mientras que en el análisis de México debido a la falta de información sobre preferencias por estados de salud a nivel local no fue posible implementar ese tipo de análisis. Por otra parte, la proporción de pacientes con insuficiencia renal grave fue mayor en nuestro modelo (21.1%, basado en Qian et al.18), que en el caso base de Raje et al.20, quienes aplicaron solo un 10%. Los propios autores referidos mencionan que posiblemente el 10% fue demasiado conservador y evaluaron un escenario con 25%, dando lugar a mejores resultados para el denosumab20. El comparar al denosumab contra un escenario mixto obedece a que en la práctica cotidiana se presentan pacientes con y sin insuficiencia renal grave, por lo que en condiciones reales el grupo de interés para la comparación está integrado por un subgrupo que efectivamente es candidato y, de hecho, recibe AZ y otro subgrupo en el que dicho agente está contraindicado y no lo recibe. Terpos et al.21 no incluyeron como tal un escenario mixto, sino que la comparación del caso base consistió en denosumab vs. AZ y añadieron un escenario donde el denosumab fue comparado exclusivamente contra No trt, ejemplificando así la contraindicación al AZ. En su análisis, el denosumab fue dominante (p. ej., menos costoso y más efectivo vs. No trt)21, situación que también ocurriría en México si se utilizara un enfoque similar al descrito. El análisis de supervivencia con punto temporal de referencia a 15 meses fue evaluado como caso base en nuestro estudio, mientras que en las otras dos publicaciones20,21 apareció como escenario en el análisis de sensibilidad.
La totalidad de participantes del ensayo clínico pivotal contaba con al menos una lesión lítica ósea documentada al inicio del estudio10. En consecuencia, la población objetivo de nuestro modelo se definió conforme a tal criterio de inclusión. Sin embargo, según las guías internacionales vigentes12-15, el estándar de cuidado en todos los pacientes con MM recién diagnosticado que inician tratamiento antimieloma es recibir concurrentemente TDH, incluso en ausencia de lesiones osteolíticas evidentes.
El estudio aquí desarrollado presenta varias limitaciones. Por un lado, como en cualquier evaluación económica se tuvo que recurrir a ciertos supuestos. Por ejemplo, se asignó la misma curva de SG a denosumab, AZ y No trt, lo cual parece conservador dada las ventajas de denosumab con respecto a la frecuencia de ERE y en el tiempo vivido en SLP. Por otra parte, para poder evaluar un horizonte temporal amplio fue necesario efectuar extrapolaciones a largo plazo, por lo que las estimaciones específicas deben tomarse con cierta cautela. No obstante, los análisis de sensibilidad sobre la duración del horizonte temporal y la selección de distribución para modelar SLP mostraron que las conclusiones son robustas. Otra limitación por tomar en cuenta es que, mientras la efectividad asignada al AZ proviene de un ensayo clínico que empleó la formulación de patente, el análisis de costos utiliza el precio de la formulación genérica. Una menor efectividad o un mayor riesgo de eventos adversos de la formulación genérica produciría mejores resultados a favor del denosumab. De igual forma, en el análisis de costos se asumió que las dosis de AZ se administran cada cuatro semanas. En la vida real, aquellos pacientes que reciben AZ cada tres semanas incurren en mayores costos de adquisición y administración, por lo que las estimaciones de costos para AZ aquí presentadas podrían estar ligeramente subestimadas. En contraparte, y considerando al esquema trimestral de AZ equivalente al mensual37, habría una sobrestimación en los costos de adquisición y administración de AZ aquí presentados con respecto a los costos de esos rubros en aquellos pacientes que recibieran el tratamiento cada 12 semanas en lugar de cada cuatro. En todo caso, la modificación del intervalo de aplicación de AZ tiene un efecto insignificante sobre los resultados farmacoeconómicos, pues la suma del costo de adquisición y administración de AZ representa tan solo 1% de los costos totales del Mix AZ/No trt calculados en el caso base.
Conforme a la perspectiva del análisis solo se evaluaron los costos directos médicos. De haber incorporado los costos indirectos asociados con pérdidas de productividad laboral por ERE o progresión de la enfermedad, los resultados habrían favorecido aun más al denosumab.
Dentro de las áreas de oportunidad para investigaciones futuras se plantea que es deseable acceder a información detallada sobre preferencias por estados de salud relacionados con los diferentes tipos de ERE y con las distintas etapas de la historia natural del MM en México. Ello permitiría contar con análisis de costo-utilidad, complementarios a los actuales de costo-efectividad, logrando así mayor grado de comparabilidad con respecto a publicaciones internacionales. Asimismo, sería fundamental disponer de información adicional sobre uso de recursos y patrones de tratamiento, tanto en lo que se refiere al manejo de los ERE como a la atención integral del MM en nuestro país. Finalmente, es importante señalar que el denosumab y el AZ pertenecen a distintas clases de tratamiento antirresortivo y, por lo tanto, no son intercambiables desde un punto de vista terapéutico.











 nueva página del texto (beta)
nueva página del texto (beta)


