Introducción
El dolor es el síntoma más común del cáncer al momento del diagnóstico y aumenta su prevalencia durante y más allá del tratamiento oncológico; incluso al día de hoy se reporta una prevalencia del 33 al 40% de pacientes supervivientes de cáncer con dolor1.
El dolor neuropático (DN) es un tipo de dolor común en el cáncer, como resultado del daño directo al sistema nervioso por un tumor primario, metástasis o por los esquemas de tratamiento (cirugía, quimioterapia, radioterapia, hormonoterapia, etc.)2.
En el 60% de los pacientes con cáncer, la causa predominante del dolor es nociceptivo, el 20% tiene un componente dominante neuropático y el 20% restante es una combinación de DN y nociceptivo (denominado dolor mixto). Por lo tanto, alrededor del 40% de los pacientes oncológicos puede presentar un síndrome doloroso con componente neuropático3.
El DN en cáncer se asocia con malos resultados. Se ha observado que se asocia con un mayor tratamiento oncológico y mayores requerimientos analgésicos (incluidos opioides potentes y analgésicos adyuvantes). Además, muestran menor rendimiento y peor funcionamiento físico, cognitivo y social4.
El DN tiene un impacto significativo en la calidad de vida de los pacientes, así como en el bienestar social, económico y psicológico. En particular, tiene una carga económica aun mayor para la sociedad en su conjunto cuando se considera el costo financiero de tratarlo en el entorno crónico5.
Las estimaciones de su prevalencia en la población general varían desde un 1% hasta un 7-8%, sin embargo, cuando se tienen en cuenta afecciones tales como diabetes (26%), herpes zóster (19%) y dolor posquirúrgico (10%), la incidencia es mucho mayor. Hay una serie de pautas, recomendaciones nacionales e internacionales para la evaluación y el tratamiento del DN6.
En el paciente oncológico, alrededor de 2/3 partes del DN está asociado a la tumoración como tal (infiltración directa del tumor primario o compresión de un nervio o un plexo nervioso, neuropatías paraneoplásicas y metástasis óseas), el 20% de los casos puede ser atribuido a los tratamientos oncológicos (cirugía, radioterapia, quimioterapia) y en el 10-15% a comorbilidades (neuropatía diabética distal dolorosa, deficiencia de vitamina B, neuralgia postherpética, esclerosis múltiple, trauma, tras evento vascular cerebral, etc.)7-9.
La terapia farmacológica conforma la base de la terapia de primera y segunda línea en DN. Los antidepresivos tricíclicos, los inhibidores de la recaptura de serotonina y noradrenalina, gabapentanoides, tramadol, lidocaína y capsaicina son las opciones más efectivas10.
El tapentadol es un nuevo analgésico de acción central, siendo considerado como un fármaco de una nueva clase de medicamentos, a los que se puede hacer referencia como medicamentos MOR-NRI (agonistas de receptores opioides μ-inhibidores de recaptación de noradrenalina). Posee una eficacia analgésica comparable con opioides clásicos fuertes como oxicodona/naloxona en pacientes con dolor crónico en espalda, aunque no superior a estos11.
Existen múltiples estudios y autores que han encontrado que es un fármaco efectivo para el tratamiento del DN, con una adecuada tolerabilidad y que mejora la calidad de vida de los pacientes posterior a su uso, sobre todo en pacientes con resistencia a los opioides11-13.
En nuestro país no se ha realizado ningún reporte sobre el empleo de tapentadol en pacientes oncológicos y DN, por lo que presentamos el siguiente estudio que tiene como objetivo determinar su efectividad en el paciente oncológico con DN que recibieron atención en la Clínica del Dolor de nuestro instituto.
Materiales y métodos
Se realizó un estudio descriptivo, longitudinal, observacional y prospectivo incluyendo pacientes con diagnóstico oncológico y DN atendidos en la Clínica del Dolor entre el 1 de enero de 2014 y el 31 de diciembre de 2019. Se revisaron los expedientes de todos los pacientes atendidos en la Clínica del Dolor con diagnóstico de DN. La información obtenida se colocó en la hoja de recolección de datos creada para tal fin. Los datos recolectados se colocaron en una base de datos con el programa SPSS versión 23.0, con el cual se obtuvo la estadística descriptiva (medidas de tendencia central y de dispersión). Para la comparación de las medias de las variables cuantitativas se usó la prueba t de Student y para la comparación de las proporciones se usó la prueba Z. Los datos se presentaron en gráficas dependiendo de las variables analizadas.
Se realizó una evaluación de dolor usando la escala numérica analógica para valorar el dolor (ENA), la escala verbal analógica para el dolor (EVERA) y el cuestionario de DN en cuatro preguntas (DN4). Para la comparación de los diferentes opioides se calcularon las dosis equianalgésicas usando los cuadros de equivalencias publicados por Hernández-Ortiz (2015)14 en donde, tomando en cuenta que la morfina por vía intravenosa es tres veces más potente que la morfina por vía oral, y dos veces más potente que la morfina por vía subcutánea, se calculó la dosis a mg de morfina oral. En el cuadro de conversión la dosis total del opioide original se multiplica por el factor de conversión del cuadro si el opioide al que se cambia es menos potente que la morfina o se divide por el factor de conversión si el opioide es más potente.
Resultados
Se incluyeron un total de 63 pacientes con una edad promedio de 59.07 ± 11.06 años, con un rango entre 27 y 83 años. En lo que respecta al sexo, el 76.2% (n = 48) fueron de sexo femenino. Un 81% (n = 51) de los pacientes no tuvo ninguna comorbilidad, del resto de pacientes, el 12.7% (n = 8) tuvo diabetes mellitus, siendo esta la comorbilidad más frecuente (Fig. 1). El diagnóstico oncológico primario más frecuente fue el cáncer de mama, con un 27% (n = 17) seguido de cáncer cervicouterino con un 19.0% (n = 12) en segundo lugar. El diagnóstico algológico de mayor frecuencia fue la actividad tumoral con un 38.1% (n = 24) y un 19.05% (n = 12) secundario a quimioterapia (Fig. 2). El valor del ENA al inicio del estudio tuvo una media de 5.34 ± 0.98 puntos, con un rango entre 3 y 8. En la evaluación del EVERA al inicio del estudio el resultado más frecuente fue moderado en un 88.9% (n = 56), siendo severo solo en el 4.8% (n = 3). De acuerdo con la escala DN4, el 95.2% (n = 60) tuvo un resultado mayor a 4. El tratamiento algológico opioide inicial fue con tramadol en el 73% (n = 46) (Fig. 3). La dosis promedio equivalente de morfina fue de 31.5 ± 10.89 mg/día, con un rango entre 15 y 60 mg/día. El tiempo promedio hasta el ajuste de la dosis fue de dos meses con una proporción de 44.4% (n = 28) frente a un 19% (n = 12) que tardó seis meses o más (Fig. 4). La dosis promedio equivalente de morfina al mes fue de 31.47 ± 12.93 mg/día, con un rango entre 15 y 60 mg/día, y la dosis promedio de morfina a los tres meses fue de 42.73 ± 16.38 con un rango entre 15 y 90 mg/dl. Se comparó la dosis inicial con la dosis al primer mes encontrando una p = 0.989 no significativa, posteriormente se comparó la dosis inicial vs. la dosis a los tres meses, encontrando una p < 0.001 y la dosis al mes vs. la dosis a los tres meses, encontrando una p < 0.001, demostrando un aumento significativo al tercer mes.
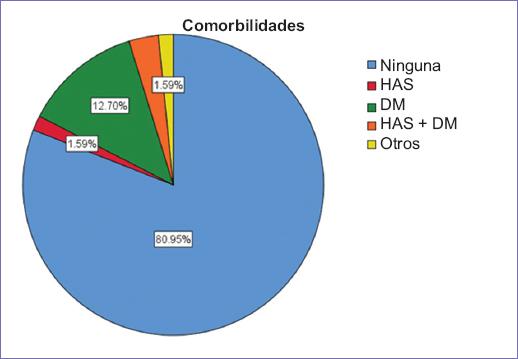
Figura 1 Gráfica de sectores que muestra la distribución de los pacientes del estudio de acuerdo con la presencia de comorbilidades. HAS: hipertensión arterial sistémica; DM: diabetes mellitus.

Figura 2 Gráfica de sectores que muestra la distribución de los pacientes del estudio de acuerdo con el diagnóstico algológico. DN: dolor neuropático; AT: actividad tumoral; QT: quimioterapia; QX: cirugía.
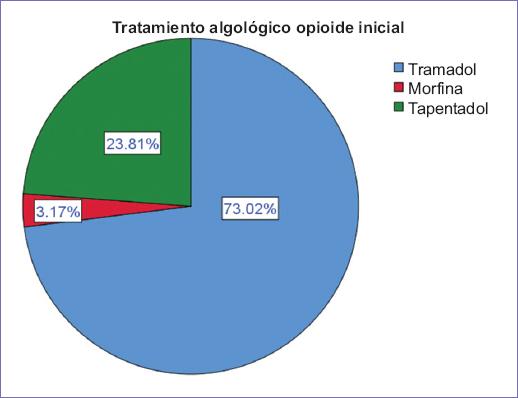
Figura 3 Gráfica de sectores que muestra la distribución de los pacientes del estudio de acuerdo con el tratamiento algológico opioide al inicio del estudio.

Figura 4 Gráfica de sectores que muestra la distribución de los pacientes del estudio de acuerdo con el tiempo hasta el ajuste de dosis.
El porcentaje de incremento de la dosis a los tres meses más frecuente fue de un 20% con un 22% (n = 14) y de un 30% con un 22% (n = 14) ambos con el mismo número de pacientes. La rotación del opioide se realizó al tercer mes en el 100% (n = 63), en un 88.9% (n = 56) a tapentadol (Fig. 5).
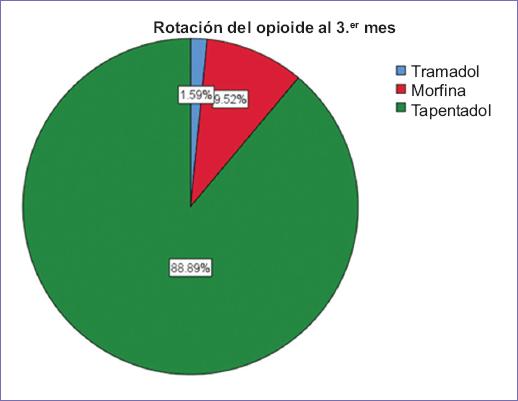
Figura 5 Gráfica de sectores que muestra la distribución de los pacientes del estudio de acuerdo con la rotación del opioide a los tres meses.
El 100% de los pacientes en el estudio recibió tratamiento coadyuvante con neuromodulador: el 49.2% (n = 31) recibió pregabalina, siendo el tratamiento más frecuente, y el 39.7% (n = 25) recibió gabapentina, siendo el segundo tratamiento más frecuente. En lo que respecta a los eventos adversos de forma global se presentaron en el 90.5% (n = 57) de los pacientes del estudio, siendo el más frecuente las náuseas en el 7.9% (n = 5), como se observa en la figura 6. En los 15 pacientes que recibieron tapentadol al inicio, el 60% (n = 9) presentó algún efecto adverso en comparación del grupo que no recibió tapentadol, en donde el 100% (n = 48) presentó algún efecto adverso con una diferencia significativa con un valor de p < 0.001 (Tabla 1).

Figura 6 Gráfica de sectores que muestra la distribución de los pacientes del estudio de acuerdo con la presencia de eventos adversos.
Tabla 1 Comparativa entre tapentadol inicial vs. otros fármacos opioides en el manejo de dolor
| Variable | Grupo con tapentadol (n = 15) | Grupo sin tapentadol (n = 48) | Valor de p |
|---|---|---|---|
| ENA | 5.2 ± 1.32 | 5.39 ± 0.86 | 0.005* |
| EVERA inicial | Moderado 66.7% (n = 10) | Moderado 95.8% (n = 46) | 0.02* |
| EVERA post-tx | Leve 73.35 (n = 11) | Leve 100.0% (n = 48) | 0.02* |
| DN4 inicial | Menor a 4 13.3% (n = 2) | Menor a 4 2.1% (n = 1) | 0.21 |
| DN4 post-tx | Menor a 4 86.7% (n = 13) | Menor a 4 100% (n = 48) | 0.13 |
| Tiempo al ajuste de tratamiento | 3.46 ± 2.16 | 2.62 ± 1.82 | 0.227 |
| Dosis promedio de morfina inicial | 30.46 ± 14.60 | 31.82 ± 9.61 | 0.543 |
| Dosis promedio de morfina a 1 mes | 27.51 ± 12.63 | 32.70 ± 12.91 | 0.441 |
| Dosis promedio de morfina al mes 3 | 27.81 ± 8.94 | 47.39 ± 15.40 | 0.008* |
| Porcentaje de aumento de dosis al mes 3 | 23.33 ± 34.10 | 37.08 ± 33.81 | 0.488 |
| Eventos adversos | 60% (n = 9) | 100% (n = 48) | < 0.001* |
*p < 0.05.
ENA: escala analógica de dolor; EVERA: escala verbal analógica; DN4: dolor neuropático en cuatro preguntas; tx: tratamiento.
La escala EVERA después del tratamiento fue leve en el 93.7% (n = 59) y el DN4 postratamiento fue menor a 4 en el 96.8% (n = 61). Se comparó el porcentaje de pacientes que reportó intensidad moderada del dolor por EVERA inicial y postratamiento, encontrando un valor de p < 0.001; también se comparó el porcentaje de pacientes con resultado menor a 4 en la escala DN4 al inicio y postratamiento, encontrando un valor de p < 0.001.
Se realizó un análisis comparativo dividido en dos grupos, dependiendo del tratamiento inicial para el manejo del dolor. En el grupo donde no se usó tapentadol de primera línea, se encontró un ENA y EVERA iniciales significativamente más altos, pero sin diferencia en el DN4 inicial. Sin embargo, postratamiento se observó una dosis equivalente de morfina significativamente mayor al tercer mes (Tabla 1). Al realizar una comparación de las variables asociadas con el manejo del dolor posterior a los tres meses, cuando se realizó la rotación del fármaco opioide, no se encontraron diferencias estadísticamente significativas entre el tapentadol y otros fármacos (Tabla 2).
Tabla 2 Comparativa entre tapentadol iniciado al 3.er mes vs. otros fármacos opioides en el manejo de dolor
| Variable | Grupo con tapentadol (n = 56) | Grupo sin tapentadol (n = 7) | Valor de p |
|---|---|---|---|
| ENA | 5.30 ± 0.95 | 5.71 ± 1.25 | 0.381 |
| EVERA inicial | Moderado 91.1% (n = 51) | Moderado 71.4% (n = 5) | 0.26 |
| EVERA post-tx | Leve 96.4% (n = 54) | Leve 71.4% (n = 5) | 0.15 |
| DN4 inicial | Menor a 4 3.6% (n = 2) | Menor a 4 14.3% (n = 1) | 0.43 |
| DN4 post-tx | Menor a 4 96.4% (n = 54) | Menor a 4 100% (n = 7) | 0.15 |
| Eventos adversos | 92.9% (n = 52) | 71.45 (n = 5) | 0.22 |
ENA: escala analógica de dolor; EVERA: escala verbal analógica; DN4: dolor neuropático en cuatro preguntas; tx: tratamiento.
En el grupo donde se utilizó tapentadol como fármaco de primera línea, se observó una proporción mayor de pacientes en tratamiento concomitante con pregabalina como fármaco coadyuvante en un 86.7% (n = 13), mientras que en los pacientes sin tapentadol como primera línea se usó una mayor proporción de gabapentina como fármaco coadyuvante, 52.1% (n = 25), y de pregabalina un 37.5% (n = 18).
Discusión
La edad de nuestra población fue de más de 55 años, lo cual corresponde con lo previamente publicado por otros autores como Coluzzi et al. (2015)14 y en donde también incluyeron una mayor proporción de pacientes del sexo femenino. El estudio de Coluzzi se limitó a pacientes con mieloma múltiple, mientras que en nuestro estudio incluimos a pacientes con diferentes diagnósticos oncológicos, lo cual mejora la validez externa de los datos obtenidos. Se encontraron principalmente pacientes con cáncer de mama y cáncer cervicouterino, que continúan siendo las dos principales patologías oncológicas que afectan al sexo femenino en nuestro país14.
En lo que respecta a las comorbilidades, la más frecuente fue la presencia de diabetes mellitus, que ya por sí misma puede llegar a causar DN, pues entre sus complicaciones se encuentra el daño a nivel sensitivo y es la forma más común de neuropatía en el mundo15.
Sin embargo, en nuestro estudio se encuentran incluidas pocas pacientes a las que se atribuye diabetes mellitus como causa principal del DN, esto debido a que en nuestro hospital, al ser un centro de referencia oncológico, la principal etiología del dolor se debe a causas referentes a la patología oncológica, ya que en estos pacientes la causa del DN puede ser debida a múltiples factores relacionados con el manejo de su patología o a la invasión a tejidos adyacentes y de las vainas nerviosas, encontrando en nuestro estudio que el DN se asocia principalmente a la actividad tumoral.
En lo referente al tratamiento, encontramos como hallazgo principal que independientemente del fármaco usado, existe una mejoría significativa en el manejo del dolor pretratamiento y postratamiento, lo cual se pone de manifiesto con las escalas EVERA y DN4, por lo que estamos logrando el objetivo principal de la Clínica del Dolor, que es en muchos casos un manejo efectivo del dolor, lo que a su vez impacta en una mejora en la calidad de vida13.
En relación con el tratamiento para DN, en nuestra clínica se usó con mayor frecuencia de primera línea el tramadol, un fármaco con buena eficacia y tolerabilidad, dejando el tapentadol para la rotación al tercer mes. Ahora bien, en relación con la prescripción de tapentadol como fármaco de primera línea, aunque la proporción de pacientes fue baja, se identificó que condiciona menos efectos adversos comparados con otros opioides.
En los pacientes que recibieron tapentadol como fármaco de rotación, no encontramos diferencias significativas en el control del dolor con otros fármacos, hallando que tiene la misma efectividad que el manejo convencional cuando se utiliza de segunda línea.
Al realizar la conversión a la dosis equivalente de morfina, uno de los hallazgos a favor del uso inicial del tapentadol fue una dosis significativamente menor al tercer mes, contrario a los pacientes que iniciaron con otros fármacos, los cuales tenían una dosis equivalente en mg/día de morfina mayor a la empleada con tapentadol, lo que se puede asociar a un mayor perfil de eventos adversos. Lo anterior se corroboró con lo encontrado por Sugiyama et al. (2018)13, quienes evaluaron el uso de tapentadol como fármaco de primera línea, encontrando un margen de seguridad aceptable.
Otro hallazgo importante fue que el 100% de los pacientes de nuestro estudio utilizó terapia con neuromoduladores como parte del esquema de manejo del DN y aunque nuestro estudio no tenía como finalidad registrar los miligramos utilizados de neuromoduladores, se observó durante la revisión de expedientes, dosis que no pasaban de 300 y 600 mg para pregabalina y gabapentina respectivamente; en la combinación de estos fármacos, se ha visto que reduce las dosis promedio en 24 horas del opioide, mejorando significativamente el manejo del dolor.
Conclusiones
– Los diagnósticos oncológicos primarios corresponden a los más frecuentes encontrados en población femenina, que representó el 76.2% de los pacientes incluidos en el estudio.
– El diagnóstico algológico más frecuente fue DN secundario a actividad tumoral, con un 38.1%
– El tratamiento con opioide inicial más frecuente fue el tramadol con un 73%, mientras que al tercer mes para hacer la rotación de opioide se uso con mayor frecuencia el tapentadol en un 88.9%
– El 100% de los pacientes recibió tratamiento coadyuvante con algún neuromodulador.
– El tapentadol demostró ser una herramienta igual de eficaz que otros tratamientos al hacer la rotación del opioide al tercer mes, sin embargo se debe considerar como fármaco de primera línea por su menor incidencia de efectos adversos. Se requiere de ensayos clínicos para determinar su eficacia.
– El tapentadol usado de primera línea tuvo una dosis equivalente de morfina significativamente menor en comparación con el tramadol como fármaco de inicio.
– Independientemente del tratamiento empleado existió una mejoría global en la puntuación de EVERA y DN4 después del tratamiento.











 nueva página del texto (beta)
nueva página del texto (beta)


