Introducción
Los incidentalomas suprarrenales son masas clínicamente silentes descubiertas casualmente en procedimientos imagenológicos durante el estudio, tratamiento o seguimiento de otras condiciones clínicas, excluyendo a los pacientes sometidos a pruebas de imagen como parte de la estadificación o seguimiento oncológico. Es una entidad en aumento en la práctica clínica habitual debido al gran número de exploraciones radiológicas que se realizan1-3.
Las glándulas suprarrenales son órganos endocrinos en los que se suman dos orígenes embriológicos: un componente ectodérmico con secreción de catecolaminas y un componente mesodérmico en el que se reconocen las tres líneas de corticosteroides especializados: glucocorticoides, mineralocorticoides y esteroides sexuales (Fig. 1). Se encuentran en situación retroperitoneal, por dentro de la cápsula adiposa renal, fascia de Gerota, inmediatamente por encima y en contacto con el polo superior del riñón4,5.

Figura 1 Componentes de la glándula suprarrenal y las consecuencias de su secreción hormonal en exceso (adaptada de Hanna, et al., 20185).
Frecuencia y prevalencia
La frecuencia de los incidentalomas suprarrenales se estima del 3 al 10% en la población mundial. La prevalencia aumenta con la edad y suele ser mayor en sujetos obesos, diabéticos e hipertensos. La mayoría de las definiciones restringen el diagnóstico a lesiones ≥ 10 mm3, a menos de que existan estigmas clínicos de aumento en la producción de hormonas suprarrenales, posterior a la detección de la lesión. Varían según tamaño, naturaleza secretoria, potencial evolutivo maligno o no y su localización unilateral o bilateral. Ante un incidentaloma suprarrenal detectado por pruebas de imagen, resulta clave determinar si la lesión es hormonalmente funcionante o no funcionante, y si es benigna o maligna. Los resultados serán determinantes en la decisión de resecar la lesión o realizar un manejo conservador2,5,6.
La mayoría son adenomas benignos hormonalmente inactivos. Sin embargo, existen causas potencialmente letales que deben ser diagnosticadas y tratadas correctamente, como el carcinoma adrenal y los tumores adrenales funcionantes. De todas las lesiones incidentales, el 70% son adenomas no funcionantes, el 5-16% adenomas funcionantes, el 6% feocromocitomas, el 5% carcinomas adrenocorticales, el 2% metástasis y el resto son otros tipos de lesiones (mielolipomas, hematomas, quistes o linfoma)3,6,7.
Diagnóstico
Aunque la gran mayoría de los incidentalomas suprarrenales son no funcionantes, un número considerable de estos pacientes presentan una forma subclínica de disfunción hormonal y suelen representar una población con alto riesgo de alteraciones metabólicas y enfermedades cardiovasculares. Por ello, ante la aparición de un incidentaloma suprarrenal son necesarias una historia clínica completa, con énfasis en síntomas hormonomediados, incluyendo exploración física, valoración bioquímica hormonal y, en ocasiones, estudios radiológicos adicionales. La mayoría son adenomas y solo el 8% son carcinomas. Por lo tanto, el hallazgo incidental de una masa suprarrenal puede ser considerado una oportunidad curativa de lesiones malignas. Los carcinomas adrenocorticales son tumores con una incidencia anual estimada de 0.7-2 casos por año, con una prevalencia mundial de 4-12 casos por millón de habitantes al año. Su estadificación requiere estudios bioquímicos e imagenológicos especializados. Basado en la literatura actual, el incidentaloma en estudios histopatológicos se clasifica en: adenoma inactivo, síndrome de Cushing subclínico, feocromocitoma, mielolipoma, ganglioneuroma, aldosteroma, carcinoma adrenal, metastásis a distancia, quistes y otras lesiones no frecuentes. Estos tumores malignos pueden diagnosticarse por exceso de esteroides, síntomas compresivos por crecimiento tumoral o durante la evaluación de incidentalomas suprarrenales6-8.
La evaluación bioquímica es esencial en el manejo preoperatorio, ya que el componente funcional de los incidentalomas suprarrenales se relaciona directamente con los efectos adversos que se pueden presentar durante el evento anestésico. En la tabla 1 se describen las pruebas que realizar de acuerdo con el comportamiento clínico observado9.
Tabla 1 Evaluación bioquímica del incidentaloma suprarrenal
| Evaluación bioquímica del incidentaloma suprarrenal | |||
|---|---|---|---|
| Alteración hormonal | Pacientes que evaluar | Prueba de cribado recomendada | Resultados esperados |
| Síndrome de Cushing (incluyendo subclínico) | Todos los pacientes | Prueba de supresión con 1 mg de dexametasona nocturno | Nivel de cortisol: No funcionante: < 1.8 mcg/dl Intermedio: 1.8 5 mcg/dl Productor de cortisol: > 5.0 mcg |
| Feocromocitoma | Todos los pacientes | Metanefrinas en plasma o catecolaminas en orina de 24 h | Niveles > 2 a 4 veces el límite superior de referencia indicado para feocromocitoma |
| Hiperaldosteronismo primario | Pacientes con hipertensión y/o hipopotasemia inexplicable | Niveles séricos de aldosterona y actividad de renina plasmática. Calcular la relación de aldosterona sérica y renina plasmática (RRA) | RRA > 20 30 es indicativo de hiperaldosteronismo |
Si los estudios de imagen son sugestivos de carcinoma adrenocortical, considerar la medición de hormonas sexuales y precursores esteroideos
Adaptada de Mazzaglia, et al., 20209
Recomendaciones de manejo
El manejo del incidentaloma suprarrenal debe ser multidisciplinario, en especial en cuanto a lesiones que imagenológicamente no correspondan a una lesión benigna y/o cuando hay evidencia de secreción hormonal excesiva, incluyendo la secreción autónoma de cortisol. Se recomienda la adrenalectomía en caso de considerar malignidad o si el crecimiento tumoral dentro de los 6 a 12 meses de seguimiento es mayor del 20% o al menos de 5 mm de diámetro. No es necesario el seguimiento por imagen en caso de presentarse una masa homogénea y rica en lípidos (< 10 UH) o si la lesión es < 4 cm y presenta características inequívocas de benignidad. No requiere de nueva evaluación hormonal a menos de que se presenten nuevos signos clínicos de actividad endocrina o si empeoran las comorbilidades (diabetes o hipertensión)10,11.
El tratamiento de estos tumores depende de su naturaleza, su potencial evolutivo y las características del paciente. Los tumores secretores y los malignos o sospechosos de malignidad se tratan quirúrgicamente, con el objetivo de realizar exéresis completa. La biopsia únicamente está indicada para confirmar diagnóstico histopatológico antes de iniciar terapia sistémica para enfermedad metastásica avanzada. La cirugía debe ser con enfoque curativo, evitando las resecciones incompletas y/o la ruptura de la cápsula del tumor. Actualmente la cirugía laparoscópica es el estándar de manejo, independientemente de que sean tumores secretores o no. Sin embargo, presenta limitaciones en tumores de grandes dimensiones, invasión a tejidos adyacentes, en donde el riesgo de fragmentación y dispersión es mayor, casos en donde debe considerarse el abordaje abierto. La resección en bloque se recomienda cuando existe invasión local, incluyendo la presencia de trombos en vena cava o ganglios linfáticos macroscópicamente afectados, considerando la necesidad de circulación extracorpórea. La linfadenectomía profiláctica no está claramente asociada con un mejor pronóstico y no es obligatoria9,12,13.
La incidencia en la mayoría de las series de feocromocitoma maligno es del 4-14%. La diferencia de malignidad o benignidad no depende de parámetros histológicos, sino de la presencia de metástasis o la invasión de tejidos vecinos. Si bien en algunos tumores existe un prominente grado de pleomorfismo nuclear, no existe ningún parámetro histológico que nos sirva para valorar su posible malignidad. Es por ello la importancia de los datos clínicos y hallazgos transquirúrgicos encontrados, los que apoyen este diagnóstico. Los feocromocitomas suponen el 6.5% de los incidentalomas suprarrenales. Pueden ser esporádicos o encontrarse asociados a varias enfermedades genéticas: neoplasia endocrina múltiple 2, enfermedad de von Hippel-Lindau, neurofibromatosis de tipo 1 y paraganglioma familiar con mutaciones en la succinato deshidrogenasa. Los pacientes con la mutación de la succinato deshidrogenasa B tienen más probabilidad de desarrollar enfermedad maligna. El pronóstico es bueno, excepto en los casos de enfermedad maligna, donde la tasa de supervivencia a los cinco años es menor del 50%14-17.
El objetivo de este artículo es describir un caso clínico de incidentaloma suprarrenal con descompensación hemodinámica súbita durante el protocolo preoperatorio que se manejó con resección de la lesión de manera urgente por la inestabilidad refractaria a manejo médico, con evolución satisfactoria tras la resolución quirúrgica y cuyo diagnóstico histopatológico final fue feocromocitoma maligno metastásico.
Caso clínico
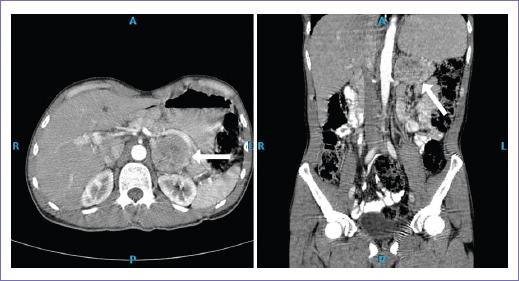
Se trata de un hombre de 37 años de edad originario de Guerrero y residente de la Ciudad de México, profesor de secundaria. Antecedente de hipertensión arterial sistémica de un año de diagnóstico en tratamiento con losartán; diabetes mellitus tipo 2 de 1 año de diagnóstico tratada con sitagliptina. Gastropatía crónica de origen biliar con esofagitis, diagnosticada por endoscopia, pérdida de peso de 25 kg en 18 meses. Es referido a nuestra unidad por hallazgo incidental de tumor dependiente de glándula suprarrenal izquierda por tomografía de abdomen (Fig. 2). Se solicitaron marcadores funcionales: corticotropina, hormona adrenocorticotrópica plasmática, cortisol plasmático, aldosterona sérica, adrenalina sérica, noradrenalina sérica y ácido vanilmandélico en orina, los cuales no fue posible realizar por falta de recursos en la unidad. A la exploración física, sin actividad tumoral palpable, ni signos clínicos de síndrome de Cushing. Durante su internamiento, presentó deterioro del estado de alerta y descompensación hemodinámica súbita, taquicardia, taquipnea, hipotensión sostenida e insuficiencia cardiaca, por lo que se decide manejo avanzado de la vía aérea y colocación de catéter venoso central para iniciar apoyo vasopresor. Por el deterioro súbito, se realizó angiotomografía, que evidenció zonas de consolidación pulmonar bilateral (Fig. 3). Se ingresó a terapia intensiva con doble apoyo vasopresor, norepinefrina y vasopresina, para obtener tensiones arteriales perfusorias, logrando de manera parcial estabilidad hemodinámica.

Figura 3 Tomografía computarizada de tórax, realizada una hora después del inicio de descompensación hemodinámica donde se observan zonas de consolidación en ambas bases pulmonares y zonas en vidrio despulido en los segmentos anteriores.
Ante la sospecha clínica de un tumor funcional y que la inestabilidad hemodinámica estuviese dada por descarga adrenérgica, se decide resecar el tumor dependiente de glándula suprarrenal izquierda. Se le realizó laparotomía exploradora, incisión suprainfraumbilical sobre línea media, accediendo al retroperitoneo mediante maniobra de Rokitansky, apertura de la fascia de Gerota, evidenciando dos lesiones; la menor, en contacto con la parte posterior de la cola del páncreas, y la mayor, invadiendo espacio pararrenal ipsilateral, pero sin involucrar parénquima renal. Mediante disección roma se liberan ambas lesiones, ligadura de pedículo vascular único, extrayendo ambas piezas. No se identifican ganglios macroscópicamente afectados, ni evidencia de actividad tumoral residual.
Presentó variaciones de la frecuencia cardiaca, 139 lpm, así como de la presión arterial, llegando a 200/110 mmHg durante la incisión y manipulación del tumor, requiriendo 5 mg de clorhidrato de esmolol y posterior a la resección caída de la tensión arterial, 70/40 mmHg, por lo que se inició norepinefrina a 0.02 mcg/kg/min, sevoflurano CAM 0.8, fentanilo 200 mcg, egresando de quirófano a Unidad de Cuidados Intensivos, donde evolucionó de forma favorable, logrando remisión de sintomatología y retirada de aminas, así como de apoyo ventilatorio 48 horas después. Evolucionó de forma favorable y egresó en adecuadas condiciones generales una semana después. El reporte histopatológico describe producto de resección de tumor retroperitoneal, dos especímenes nodulares referidos como glándula suprarrenal; el menor de 3 x 2.8 cm, el mayor referido como región pararrenal ipsilateral de 6 x 3 cm: feocromocitoma maligno con metástasis a región pararrenal ipsilateral, con pleomorfismo leve. No se identifica necrosis (Figs. 4 y 5, anatomía patológica).
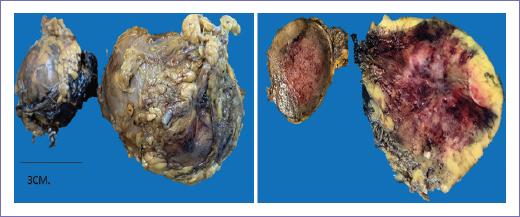
Figura 4 Anatomía patológica. Aspecto macroscópico. Aspecto externo de glándula suprarrenal y tumor retroperitoneal (izquierda). Superficie de corte con cápsula fina y tumor retroperitoneal, coloración típica amarilla marrón y zonas hemorrágicas (derecha).
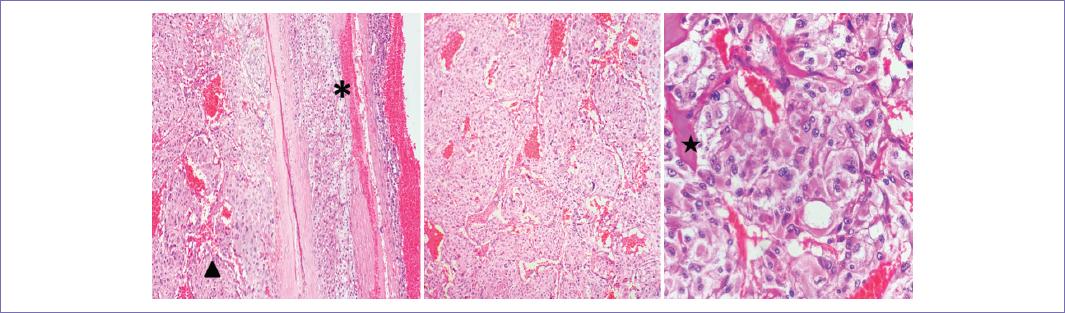
Figura 5 Anatomía patológica. Aspecto microscópico. Tinción hematoxilina-eosina (HyE) 10x glándula suprarrenal: Corteza *, médula p (izquierda). HyE 20x. Configuración «Zellballen» (Centro). HyE 40x. Células tumorales con pseudoinclusiones y amiloide (derecha). En los cortes histológicos correspondientes a glándula suprarrenal se observa un ribete de corteza suprarrenal (*), que se continúa en médula p con cápsula delgada de tejido fibroconectivo, que se organizan en nidos «cuerpos de Zellballen», unidos por delicado estroma fibrovascular focalmente con amiloide. Las células varían de tamaño y forma, con citoplasma granular, basófilo y anfofílico, los núcleos van de redondos a ovalados con núcleos prominentes y pseudoinclusiones citoplasmáticas.
Discusión
La preparación para la cirugía debe considerar las eventuales complicaciones y los momentos más críticos. La literatura actual describe que previo a la intervención quirúrgica debe considerarse el bloqueo betaadrenérgico al menos dos semanas previas al evento quirúrgico, así como caracterizar funcionalmente el tumor con evaluación hormonal en búsqueda de aumento de glucocorticoides y catecolaminas, con la intención de predecir los posibles efectos adversos durante el evento anestésico-quirúrgico. En el presente caso, el paciente presentó deterioro hemodinámico súbito durante el protocolo de estudio, por lo que aún no contaba con bloqueo betaadrenérgico; ante la disfunción orgánica refractaria al manejo, requerimiento de doble apoyo vasopresor, falla orgánica múltiple e inestabilidad hemodinámica refractaria al manejo médico, se optó por la intervención quirúrgica. La fisiopatología de estas alteraciones se explica porque durante la inducción anestésica los niveles de catecolaminas pueden elevarse y durante la manipulación del tumor pueden llegar a cien veces su valor basal. Es recomendable tener preparados fármacos vasoactivos para el manejo tanto de la hipertensión como de la hipotensión. Ban, et al. describen que la incidencia de inestabilidad hemodinámica intraoperatoria es muy variable, y puede presentarse en entre el 17 y el 83% de los pacientes. Los parámetros hemodinámicos intraoperatorios que considerar son: presión arterial tanto sistólica como diastólica, valores máximos y mínimos; promedio mayor y menor de la frecuencia cardiaca; requerimientos de agentes vasodilatadores y vasoconstrictores de manera transoperatoria y en el postoperatorio inmediato18-21.
Los casos clínicos de feocromocitoma descritos en la literatura inician con hipertensión paroxística, así como una amplia gama de alteraciones cardiacas como síndrome coronario agudo, insuficiencia cardiaca, arritmias letales e incluso paro cardiorrespiratorio. En todos ellos, realizándose la caracterización hormonal y estudios imagenológicos de extensión previo a la intervención quirúrgica. En el presente caso, dada la falla orgánica múltiple refractaria al manejo médico (cardiaca, hepática, respiratoria y renal), se optó por la resección quirúrgica inmediata, basándose en las características de malignidad presentes, tamaño del tumor, alteraciones metabólicas presentes desde los antecedentes, el entorno hospitalario y los predictores elevados de mortalidad22-26.
Tras los avances tecnológicos en medicina crítica, ante una crisis de catecolaminas inducida por un feocromocitoma, la resolución quirúrgica urgente ha sido desplazada por alternativas de soporte circulatorio mecánico y ventilatorio tal como la membrana de oxigenación extracorpórea, sin embargo, es necesario tomar en consideración que no en todos los centros hospitalarios se cuenta con todos los fármacos y equipos sofisticados para el soporte circulatorio mecánico y la asistencia ventilatoria27-30.
Tras resolver la inestabilidad hemodinámica, la radiografía de tórax (Fig. 6) no evidencia zonas de consolidación, por lo que se considera que las zonas de consolidación pulmonar reportadas en la tomografía de tórax se debieron a una descarga de catecolaminas y sobrecarga de volumen a nivel pulmonar. Los resultados de laboratorio muestran un descenso de la hemoglobina de 9.5 g/dl (previa de 15.8 g/dl, 2 días antes), que puede ser explicado por hemodilución, ya que tras la redistribución de líquidos se reporta normal. También presentó hiperglucemia de 250 mg/dl, así como lesión renal aguda (urea de 91 y creatinina de 2.1) y transaminasemia (aspartato aminotransferasa 537, alanina aminotransferasa 2,163 y deshidrogenasa láctica 658); esta última puede explicarse por hígado de choque.
Posterior al egreso hospitalario, se mantiene en vigilancia, en espera de control tomográfico. Corresponde a un estadio clínico IV según el American Joint Committee on Cancer 8, siendo T3N0M1, sin requerir tratamiento sistémico por el momento, ya que este se reserva para pacientes con evidencia de metástasis. La malignidad del feocromocitoma está dada por las metástasis, la invasión local o la recurrencia. La quimioterapia se recomienda para pacientes, con alta carga tumoral o feocromocitoma irresecable y rápidamente progresivo. La radioterapia se reserva para enfermedad ósea metastásica31,32.
El tratamiento para el feocromocitoma metastásico en pacientes con enfermedad limitada y estable debe ser expectante, tomando en consideración la destumorización en caso de considerarlo necesario. En caso de enfermedad extensiva y/o progresión lenta se recomiendan los radiofármacos como la 131I-metaiodobenzilguanidina y el lutecio-177. En caso de progresión rápida, las opciones quimioterapéuticas son esquemas con ciclofosfamida, vincristina y dacarbazina y/o temozolamida32-34.
Conclusiones
En el presente artículo se expone el caso de un paciente con feocromocitoma metastásico a espacio pararrenal ipsilateral con disfunción hemodinámica que derivó en falla orgánica múltiple, que no pudo resolverse hasta la resección quirúrgica del tumor, y quien presentó evolución favorable.











 nueva página del texto (beta)
nueva página del texto (beta)