Introducción
La neoplasia mucinosa papilar intraductal (NMPI), al igual que las neoplasias quísticas mucinosas, el cistoadenoma seroso y el tumor sólido pseudopapilar representan el 90% de las entidades con potencial maligno, denominadas neoplasias quísticas pancreáticas1. Estas lesiones quísticas se informaron por primera vez en la década de 1970; Ohhashi, et al.2 fueron los primeros en describir la NMPI y en 1996 fue reconocida como una entidad separada3.
La NMPI, se origina en el epitelial de los conductos pancreáticos, ya sea el conducto principal, alguna de sus ramas o ambos, condicionando una dilatación quística de los mismos. Presenta una proliferación intraductal de células neoplásicas productoras de mucina distribuidas en proyecciones papilares4. Dependiendo del conducto involucrado se clasifican en: tipo I, dependiente del conducto principal (MD-NMPI); tipo II, dependiente de una ramificación del conducto (BD-NMPI), y tipo III o de tipo mixto5. Las BD-NMPI son las más frecuentes, un 40-65% de los casos6.
Alrededor del 60% de los pacientes cursa con ictericia obstructiva, dolor epigástrico náuseas y vómito durante la ingesta alimentaria. Hasta el 12% de los pacientes presenta diabetes mellitus, lo cual se asocia con una transformación maligna de la neoplasia7. De forma clásica se describe la tríada de Ohhashi, caracterizada por: a) dilatación quística del conducto de Wirsung; b) mucina intraductal o intraquística, y c) protrusión de la papila en la luz del duodeno por donde excreta abundante mucina8.
Para el diagnóstico, además de la sospecha clínica, se requiere estudio de imagen. Los hallazgos por tomografía trifásica computarizada (TC), con aproximación diagnóstica del 40-81%, relacionados con NMPI incluyen: quistes ≥ 3 cm con pared engrosada, nódulo mural, componente sólido reforzado > 5mm y dilatación del conducto pancreático principal entre 5-9 mm. Los hallazgos por TC relacionados con NMPI de alto riesgo son: lesiones quísticas en la cabeza del páncreas asociadas a ictericia obstructiva, nódulo mural > 5 mm y diámetro del conducto pancreático principal ≥ 10 mm9. Las características por imagen se pueden complementar con ultrasonido endoscópico (USE), con sensibilidad de 74% y especificidad de 49% en lesiones > 3cm y que permite la toma de muestras del componente mucinoso mediante aspiración con aguja fina (BAAF) para evaluación citológica, (sensibilidad de hasta 50%) determinación de amilasa y de antígeno carcinoembrionario (ACE) en la muestra10.
Con un potencial de malignidad que oscila del 20 al 70%, la ubicación de la lesión es un factor importante para determinarlo, siendo incluso cercano al 80% en las MD-NMPI11. Durante largo tiempo se consideró que el tamaño > 30 mm estaba entre los principales predictores de transformación maligna, sin embargo, ahora se entiende que el tamaño por sí solo no es un predictor significativo, por lo que lesiones < 10 mm, pueden conferir un riesgo de transformación maligna12,13. La supervivencia a cinco años de los pacientes depende del componente invasivo de las NMPI, siendo de un 40 a un 60% en las NMPI invasivas14.
Reporte de casos
Caso 1
Paciente masculino de 41 años de edad. Niega antecedentes de importancia, tabaquismo durante dos años. Refiere padecimiento de 4 años de evolución con dolor abdominal en epigastrio y plenitud postprandial, recibiendo manejo medico con mejoría parcial de los síntomas; 48 meses posteriores al inicio de los síntomas presenta ictericia con incremento de la sintomatología digestiva. Se inicia protocolo de estudio documentándose por TC: páncreas con disminución de volumen, contornos lobulados por infiltración grasa, tumor quístico en el proceso uncinado con dimensiones de 26 x 36 mm, con septos, vascularizado y con calcificaciones puntiformes con comportamiento expansivo y márgenes definidos, conducto pancreático principal de 7 mm. La aorta, tronco celiaco y arteria mesentérica superior sin alteraciones (Figs. 1 y 2).

Figura 1 Plano axial de la tomografía computarizada contrastada con lesión quística hipodensa de 26 x 36 mm dependiente del proceso uncinado del páncreas.

Figura 2 Plano coronal de la tomografía computarizada contrastada con lesión quística hipodensa dependiente de proceso uncinado de páncreas y conducto pancreático de 7 mm.
Laboratorios: Albumina 2.8, Bilirrubina Total 30 mg/dl (Bilirrubina Directa 24 mg/dl; Bilirrubina Indirecta 6 mg/dl), marcadores tumorales: ACE: 1.08 ng/ml, Ca 19-9: 14.48 U/ml y AFP: 0.99 ng/ml. Resto del análisis bioquímico dentro de parámetros normales.
Se establece el diagnóstico de probable neoplasia mucinosa papilar intraductal de cabeza de páncreas efectuando manejo quirúrgico mediante duodenopancreatectomía total + gastroyeyuno anastomosis en Y de Roux. Se reportan los siguientes hallazgos: tumor de cabeza de páncreas de 6 x 6 cm con contenido mixoide, intensa reacción desmoplásica peripancreática y retroperitoneal, parénquima pancreático indurado con evidencia de conducto principal dilatado en todo su trayecto, requiriendo estudio transoperatorio que documento actividad tumoral en el margen de corte del conducto de Wirsung, por lo cual se decide realizar pancreatectomía total. Presencia de ganglios de característica inflamatoria a nivel del colédoco, conducto cístico y sobre la arteria hepática; sin evidencia de actividad tumoral a otro nivel (Fig. 3).

Figura 3 Fotografía de corte de la pieza quirúrgica con tumor de 6 x 6 cm en cabeza de páncreas, conducto pancreático principal dilatado.
El reporte histopatológico mostró una NMPI dependiente de cabeza de páncreas, ulcerada, abscedada, asociada a adenocarcinoma invasor, sin invasión linfática y vascular, 19 ganglios sin neoplasia. Neoplasia intraepitelial pancreática PanIN 1A externa y PanIN 3 multifocal.
El paciente curso adecuada evolución postquirúrgica, ameritando 5 días en la Unidad de Cuidados Intensivos. Actualmente paciente asintomático y sin evidencia de recurrencia.
Caso 2
Paciente de sexo masculino de 25 años que presenta ictericia súbita progresiva, sin dolor agregado y con perdida ponderal de 14 kg. Se inicia protocolo de estudio, documentándose por TC: lesión hipodensa, quística, de bordes irregulares, de 35 x 48 mm, dependiente de cabeza de páncreas que desplaza vena porta. La aorta, tronco celiaco y arteria mesentérica superior sin alteraciones (Figs. 4 y 5).

Figura 4 Plano axial de la tomografía computarizada contrastada con lesión quística hipodensa de 35 x 48 mm dependiente de cabeza de páncreas.
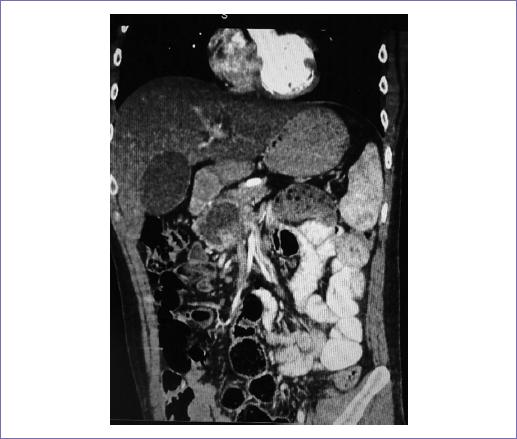
Figura 5 Plano coronal de la tomografía computarizada contrastada con lesión quística hipodensa dependiente de cabeza de páncreas que desplaza vena porta, tronco celiaco y arteria mesentérica superior sin alteraciones.
Cuenta con laboratorios: Albumina 2.5, Bilirrubina Total 26 mg/dl (Bilirrubina Directa 22 mg/dl; Bilirrubina Indirecta 4 mg/dl), marcadores tumorales: ACE: 1.32 ng/ml, Ca 19-9: 220 U/ml y AFP: 1.25 ng/ml. Resto del análisis bioquímico dentro de parámetros de normalidad.
Se realiza colangiopancreatografía retrógrada endoscópica, reportando estenosis maligna de colédoco tercio medio y distal por compresión extrínseca, colangitis, y se realiza esfinterotomía mas colocación de endoprótesis de 10 fr. Posteriormente es manejado quirúrgicamente mediante procedimiento de Longmire - Traverso III, reportando como hallazgos: tumor dependiente de cabeza de páncreas de 8 x 6 cm, cavitado, contenido mixoide, conducto pancreático dilatado, intensa reacción desmoplásica peripancreática, colédoco dilatado, hígado sin datos de actividad tumoral (Fig. 6).

Figura 6 Fotografía de corte de la pieza quirúrgica con tumor de 8 x 6 cm en cabeza de páncreas, conducto pancreático principal dilatado y extensa reacción desmoplásica.
El reporte histopatológico establece: NMPI en cabeza de páncreas, sin invasión perineural, sin invasión linfática y vascular, proceso uncinado negativo a neoplasia, duodeno negativo a neoplasia, 19 ganglios sin neoplasia. Adecuada evolución postquirúrgica, actualmente asintomático y sin evidencia de recurrencia.
Discusión
Una característica de las NMPI es su capacidad para segregar una enorme cantidad de material mucinoso, crecimiento relativamente lento y progresión natural a cáncer en aproximadamente cinco años. Según estudios, el 50% de las lesiones quísticas en el páncreas son NMPI.
Tanto los consensos internacionales como las guías de la American Gastroenterological Association y los criterios de Fukuoka recomiendan la resección quirúrgica en pacientes con NMPI y características de alto riesgo de malignidad, así como seguimiento mediante USE-BAAF. Mukewar, et al. reportaron un mayor riesgo de cáncer de páncreas a cinco años en pacientes con lesiones con características de alto riesgo de acuerdo con los criterios de Fukuoka en comparación con los que no las presentaban (49.7 vs. 4.1%; p < 0.001)15.
Sin embargo, la ausencia de criterios de malignidad no disminuye totalmente el riesgo de displasia de alto grado o carcinoma invasor; las NMPI sin criterios de malignidad pueden presentar riesgo de cáncer invasor a cinco años del 2-3% ameritando la evaluación cautelosa e individualizada de cada caso, por ejemplo: un crecimiento > 5 mm en dos años de seguimiento se ha incluido como signo de alarma9. Otra de las técnicas de estudio que puede considerarse es el análisis molecular del componente mucinoso de la lesión para determinación de KRAS/GNAS, PTEN, P53 y PIK3CA con una sensibilidad y especificidad del 89 y el 100% respectivamente3.
Las directrices del consenso internacional indican que las NMPI tipo 1 deben ser resecadas por pancreaticoduodenectomía, pancreatectomía total o parcial con disección linfática en pacientes aptos. Mientras que las NMPI tipo 2 deben someterse a resección si poseen datos de alto riesgo (tamaño > 3 cm, síntomas clínicos, hallazgos radiológicos sospechosos como nódulos, dilatación de la vía biliar pancreática, tamaño del quiste que aumenta rápidamente y linfadenopatías).
Los criterios para identificar progresión de la enfermedad no son uniformes en los diferentes estudios. En el caso de nuestros pacientes, ambos presentaban una lesión con evidente potencial maligno por la localización del tumor y la afectación del conducto principal, lo que llevó a normar la conducta terapéutica radical, ya que el mantener en vigilancia el cuerpo y cola del páncreas residual está asociado al 65-70% de recurrencia16.











 nueva página del texto (beta)
nueva página del texto (beta)


