Introducción
En el mundo, el cáncer de pulmón es la principal causa de muerte debida a cáncer, en el 2018 esta patología causó 1.8 millones de muertes, representando el 18.4% de la mortalidad por cáncer; además, es el cáncer con mayor incidencia, presentándose para el 2018 2.1 millones de casos nuevos1. Al desglosar la mortalidad de esta patología por regiones en el 2018 América del Norte aporto 173 mil casos, cerca de 18 mil casos América Central y el Caribe y aproximadamente 63 mil casos América del Sur, siendo Asia el continente que más casos aporta. Por su alta incidencia y mortalidad es una patología de alto impacto en salud pública, adicionalmente se ha evidenciado el aumento en la tendencia de utilización de los inhibidores de punto de control inmunitario PD-1/PD-L1 (programmed death-ligand 1, molécula de muerte programada 1, y su ligando PD-L1) para el tratamiento del cáncer de pulmón de célula no pequeña (CPCNP). Los inhibidores de punto de control inmunitario son medicamentos dirigidos a complejos PD-1/PD-L1 o CTLA-4/B7-1/B7-2 para permitir en algunos casos que las células del sistema inmunitario, como las células T, destruyan las células cancerosas; por esta razón estos medicamentos son utilizados para el tratamiento de diferentes tipos de cáncer2. Específicamente los inhibidores del complejo PD-1/PD-L1 son anticuerpos monoclonales humanizados, cuyo mecanismo de acción se basa en inhibir dicho complejo; los anti-PD-1, como el pembrolizumab y el nivolumab, inhiben el receptor PD-1 en las células tumorales, el cual es utilizado por estas para escapar del ataque del sistema inmunitario y así evitar ser eliminadas2. Para que estos fármacos sean eficaces frente al tumor, las células tumorales deben expresar la proteína PD-1 en su membrana en un porcentaje suficiente, ya que si esto no sucede así los fármacos carecen de diana y el tumor escapa a los controles del organismo por otras vías3. En comparación, los anti-PD-L1, como el atezolizumab, el avelumab o el durvalumab, inhiben el ligando en las células T2. En los últimos años esta terapia ha mostrado un aumento de la supervivencia global, de la tasa de respuesta objetiva y de la supervivencia libre de progresión, en comparación con las terapias convencionales; por lo anterior se realizó una revisión breve para evaluar la eficacia y seguridad de este tratamiento. Adicionalmente, dado que se han descrito casos de enfermedad hiperprogresiva (HPD) en pacientes tratados con inhibidores del punto de control inmunitario, la revisión incluyó una búsqueda para determinar factores que pudieran ser usados como predictores de la HPD4.
Objetivo
Proveer la evidencia científica de seguridad y eficacia de los inhibidores del punto de control inmunitario del complejo PD-1/PD-L1, comparado con la quimioterapia en el tratamiento del CPCNP metastásico e identificar posibles factores predictores de HPD, donde el valor de la inmunoterapia es aún controvertido.
Metodología
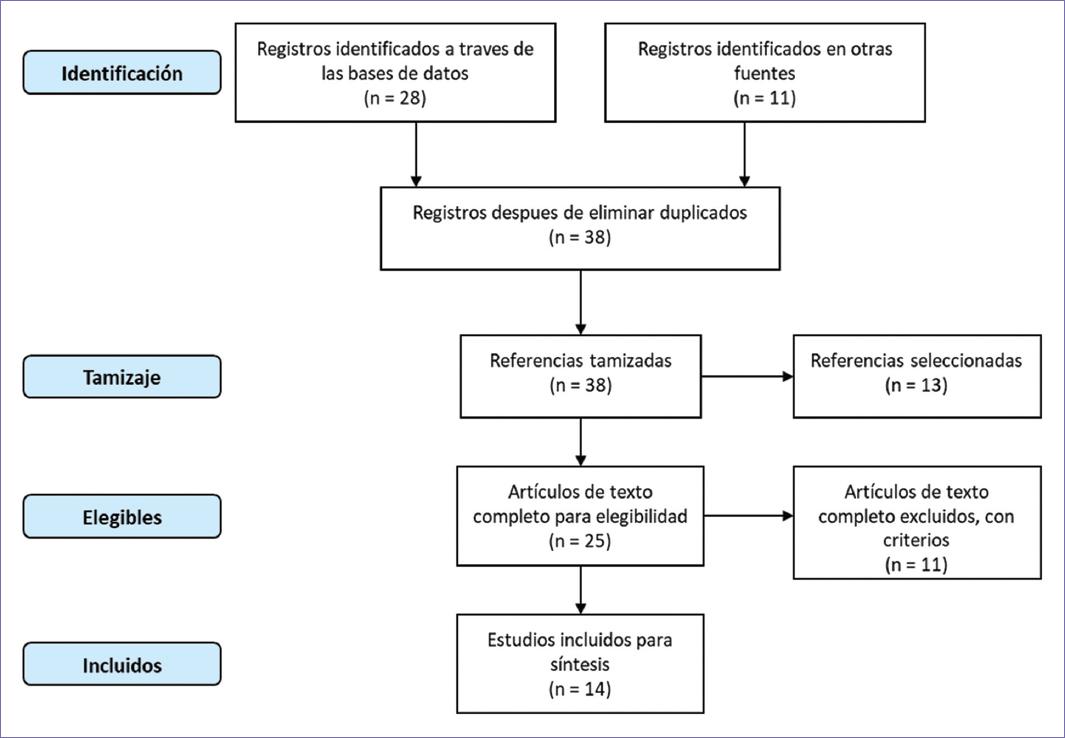
Se utilizó el marco de cinco etapas para una RSL rápida, así: 1) desarrollo de la pregunta PICO de investigación; 2) identificación de literatura relevante; 3) selección de guías de práctica clínica (GPC) y evaluaciones de tecnologías sanitarias (HTA, por sus siglas en inglés); 4) extracción y calificación de la evidencia de los estudios primarios de las recomendaciones que hacen referencia al tratamiento con inmunoterapia dirigida al complejo PD-L1/PD-1, mediante el sistema GRADE registrados en la tabla 15 y 5) síntesis de los resultados y conclusiones de la revisión. Las búsquedas fueron realizadas el 28 de octubre de 2019 en PubMed, organismos desarrolladores de GPC y la página Web del Centre for Reviews and Dissemination de la Universidad de York, limitados a guías clínicas y HTA en inglés y español en los últimos cinco años. De acuerdo con la estrategia de búsqueda construida se encontraron 39 referencias, de las cuales después de eliminar duplicados y tamizar por criterios de inclusión finalmente se evaluaron 14 estudios, registrados en el diagrama PRISMA (Fig. 1), adicionalmente se realizó una búsqueda para determinar factores predictivos de HPD.
Tabla 1 Resumen de calificación GRADE de la evidencia
| Evaluación de calidad | N.º de pacientes en cada intervención | Resultados | Calidad | Importancia | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| N.º de estudios | Diseño de estudio | Riesgo de sesgo | Inconsistencia | Evidencia indirecta | Imprecisión | Otras consideraciones | Intervención 1 | Intervención 2 | Efecto relativo (IC 95%) | ||
| Estudio KEYNOTE 024 | Pembrolizumab | Quimioterapia basada en platino | |||||||||
| Supervivencia global (seguimiento: mediana 25.2 meses; evaluado con: tiempo desde la aleatorización hasta la muerte por cualquier causa) | |||||||||||
| 1 | Ensayos aleatorizados | No es serio | No es serio | No es serio | No es serio | Ninguno | 154 participantes | 151 participantes | HR 0.63 (0.47-0.86) | ⊕⊕⊕⊕ Alta | Crítico |
| Eventos adversos serios (seguimiento: rango 3.5 a 7.9 meses; evaluado con: National Cancer Institute Common Terminology Criteria for Adverse Events, version 4.0) | |||||||||||
| 1 | Ensayos aleatorizados | No es serio | No es serio | No es serio | No es serio | Ninguno | 48/154 (31.2%) | 80/150 (53.3%) | No estimable | ⊕⊕⊕⊕ Alta | Crítico |
| Estudio KEYNOTE 042 | Pembrolizumab | Quimioterapia basada en platino | |||||||||
| Supervivencia global (seguimiento: mediana 12.8 meses; evaluado con: tiempo desde la aleatorización hasta la muerte por cualquier causa) | |||||||||||
| 1 | Ensayos aleatorizados | No es serio | No es serio | No es serio | No es serio | Ninguno | 637 participantes | 637 participantes | HR 0.81 (0.71-0.93) | ⊕⊕⊕⊕ Alta | Crítico |
| Supervivencia libre de progresión (seguimiento: mediana 12.8 meses; evaluado con: tiempo desde la aleatorización hasta la progresión de la enfermedad [radiológica] o muerte por cualquier causa) | |||||||||||
| 1 | Ensayos aleatorizados | No es serio | No es serio | No es serio | No es serio | Ninguno | 637 participantes | 637 participantes | HR 1.07 (0.94-1.21) | ⊕⊕⊕⊕ Alta | Crítico |
| Eventos adversos serios (evaluado con: National Cancer Institute Common Terminology Criteria for Adverse Events, version 4.0) | |||||||||||
| 1 | Ensayos aleatorizados | No es serio | No es serio | No es serio | No es serio | Ninguno | 113/636 (17.8%) | 252/615 (41.0%) | No estimable | ⊕⊕⊕⊕ Alta | Crítico |
| Estudio KEYNOTE 189 | Pembrolizumab + quimioterapia basada en platino + pemetrexed | Placebo + quimioterapia basada en platino + pemetrexed | |||||||||
| Supervivencia global (seguimiento: mediana 10.5 meses; evaluado con: tiempo desde la aleatorización hasta la muerte por cualquier causa) | |||||||||||
| 1 | Ensayos aleatorizados | No es serio | Serio* | No es serio | No es serio | Ninguno | 410 participantes | 206 participantes | HR 0.49 (0.38-0.64) | ⊕⊕⊕◯ Moderado | Crítico |
| Supervivencia libre de progresión (seguimiento: mediana 10.5 meses; evaluado con: tiempo desde la aleatorización hasta la progresión de la enfermedad [radiológica] o muerte por cualquier causa) | |||||||||||
| 1 | Ensayos aleatorizados | No es serio | No es serio | No es serio | No es serio | Ninguno | 410 participantes | 206 participantes | HR 0.52 (0.43-0.64) | ⊕⊕⊕⊕ Alta | Crítico |
| Eventos adversos serios (seguimiento: media 7.4 meses; evaluado con: National Cancer Institute Common Terminology Criteria for Adverse Events, version 4.0) | |||||||||||
| 1 | Ensayos aleatorizados | No es serio | No es serio | No es serio | No es serio | Ninguno | 272/405 (67.2%) | 133/202 (65.8%) | No estimable | ⊕⊕⊕⊕ Alta | Crítico |
| Estudio KEYNOTE 021 | Pembrolizumab + quimioterapia basada en platino + pemetrexed | Placebo + quimioterapia basada en platino + pemetrexed | |||||||||
| Supervivencia global (seguimiento: mediana 10.6 meses; evaluado con: tiempo desde la aleatorización hasta la muerte por cualquier causa) | |||||||||||
| 1 | Ensayos aleatorizados | No es serio | Serio* | No es serio | Serio † | Ninguno | 60 participantes | 63 participantes | HR 0.90 (0.42-1.91) | ⊕⊕⊕◯ Baja | Crítico |
| Supervivencia libre de progresión (seguimiento: mediana 10.6 meses; evaluado con: tiempo desde la aleatorización hasta la progresión de la enfermedad [radiológica] o muerte por cualquier causa) | |||||||||||
| 1 | Ensayos aleatorizados | No es serio | No es serio | No es serio | Serio † | Ninguno | 60 participantes | 63 participantes | HR 0.53 (0.31-0.91) | ⊕⊕⊕◯ Moderado | Crítico |
| Eventos adversos serios (seguimiento: mediana 8.0 meses; evaluado con: National Cancer Institute Common Terminology Criteria for Adverse Events, version 4.0) | |||||||||||
| 1 | Ensayos aleatorizados | No es serio | No es serio | No es serio | Serio † | Ninguno | 23/59 (39.0%) | 16/62 (25.8%) | No estimable | ⊕⊕⊕◯ Moderado | Crítico |
| Estudio IMpower150 | Atezolizumab + bevacizumb + carboplatino + paclitaxel | Bevacizumab + carboplatino + paclitaxel | |||||||||
| Supervivencia global (seguimiento: mediana 15.4 meses; evaluado con: no disponible) | |||||||||||
| 1 | Ensayos aleatorizados | No es serio | No es serio | No es serio | No es serio | Ninguno | 400 participantes | 400 participantes | HR 0.78 (0.64-0.96) | ⊕⊕⊕⊕ Alta | Crítico |
| Supervivencia libre de progresión (seguimiento: mediana 15.4 meses; evaluado con: tiempo desde la aleatorización hasta la progresión de la enfermedad [radiológica] o muerte por cualquier causa) | |||||||||||
| 1 | Ensayos aleatorizados | No es serio | No es serio | No es serio | No es serio | Ninguno | 400 participantes | 400 participantes | HR 0.62 (0.52-0.74) | ⊕⊕⊕⊕ Alta | Crítico |
| Eventos adversos serios (seguimiento: mediana 8.2 meses; evaluado con: National Cancer Institute Common Terminology Criteria for Adverse Events, version 4.0) | |||||||||||
| 1 | Ensayos aleatorizados | No es serio | No es serio | No es serio | No es serio | Ninguno | 230/393 (58.5%) | 197/394 (50.0%) | No estimable | ⊕⊕⊕⊕ Alta | Crítico |
| Estudio KEYNOTE 407 | Pembrolizumab + carboplatino + paclitaxel | Placebo + carboplatino + paclitaxel | |||||||||
| Supervivencia global (seguimiento: mediana 7.8 meses; evaluado con: Tiempo medido desde la aleatorización hasta la muerte) | |||||||||||
| 1 | Ensayos aleatorizados | No es serio | No es serio | No es serio | No es serio | Ninguno | 278 participantes | 281 participantes | HR 0.64 (0.49-0.85) | ⊕⊕⊕⊕∘ Alta | Crítico |
| Supervivencia libre de progresión (seguimiento: mediana 7.8 meses; evaluado con: tiempo medido desde la aleatorización hasta la muerte) | |||||||||||
| 1 | Ensayos aleatorizados | No es serio | No es serio | No es serio | No es serio | Ninguno | 278 participantes | 281 participantes | HR 0.56 (0.45-0.70) | ⊕⊕⊕⊕ Alta | Crítico |
| Eventos adversos (seguimiento: mediana 7.8 meses; evaluado con: número de eventos adversos serios [grado 3, 4 y 5) | |||||||||||
| 1 | Ensayos aleatorizados | No es serio | No es serio | No es serio | No es serio | Ninguno | 194/278 (69.8%) | 191/281 (68.0%) | No estimable | ⊕⊕⊕⊕ Alta | Crítico |
| Estudio CheckMate-057 | Nivolumab | Docetaxel | |||||||||
| Supervivencia global (seguimiento: rango 13.2 meses a -; evaluado con: sin información) | |||||||||||
| 1 | Ensayos aleatorizados | No es serio | No es serio | No es serio | No es serio | Ninguno | 292 participantes | 290 participantes | HR 0.73 (0.59-0.89) | ⊕⊕⊕⊕ Alta | Crítico |
| Supervivencia libre de progresión (evaluado con: sin información) | |||||||||||
| 1 | Ensayos aleatorizados | No es serio | No es serio | No es serio | Serio‡ | Ninguno | 292 participantes | 290 participantes | HR 0.92 (0.77-1.11) | ⊕⊕⊕◯ Moderado | Crítico |
| Eventos adversos serios (seguimiento: mediana 12 semanas; evaluado con: National Cancer Institute Common Terminology Criteria for Adverse Events, version 4.0) | |||||||||||
| 1 | Ensayos aleatorizados | No es serio | No es serio | No es serio | No es serio | Ninguno | 31/287 (10.8%) | 145/268 (54.1%) | No estimable | ⊕⊕⊕⊕ Alta | Crítico |
| Estudio CheckMate-017 | Nivolumab | Docetaxel | |||||||||
| Supervivencia global (seguimiento: rango 11 meses a -; evaluado con: sin información) | |||||||||||
| 1 | Ensayos aleatorizados | No es serio | No es serio | No es serio | No es serio | Ninguno | 135 participantes | 137 participantes | HR 0.59 (0.44-0.79) | ⊕⊕⊕⊕ Alta | Crítico |
| Supervivencia global (seguimiento: rango 11 meses a ?; evaluado con: sin información) | |||||||||||
| 1 | Ensayos aleatorizados | No es serio | No es serio | No es serio | No es serio | Ninguno | 135 participantes | 137 participantes | HR 0.62 (0.47-0.81) | ⊕⊕⊕⊕ Alta | Crítico |
| Eventos adversos serios (seguimiento: mediana 16 semanas; evaluado con: National Cancer Institute Common Terminology Criteria for Adverse Events, version 4.0) | |||||||||||
| 1 | Ensayos aleatorizados | No es serio | No es serio | No es serio | No es serio | Ninguno | 9/131 (6.9%) | 74/129 (57.4%) | No estimable | ⊕⊕⊕⊕ Alta | Crítico |
| Estudio KEYNOTE 010 | Pembrolizumab | Docetaxel | |||||||||
| Supervivencia global (seguimiento: mediana 13.1 meses; evaluado con: tiempo transcurrido entre la aleatorización y la muerte por cualquier causa) | |||||||||||
| 1 | Ensayos aleatorizados | No es serio | No es serio | No es serio | No es serio | Ninguno | 346 participantes | 343 participantes | HR 0.61 (0.49-0.75) | ⊕⊕⊕⊕ Alta | Crítico |
| Supervivencia libre de progresión (seguimiento: mediana 13.1 meses; evaluado con: tiempo desde la aleatorización hasta la progresión de la enfermedad definida por RECIST v1.1 o muerte por cualquier causa) | |||||||||||
| 1 | Ensayos aleatorizados | No es serio | No es serio | No es serio | No es serio | Ninguno | 346 participantes | 343 participantes | HR 0.79 (0.66-0.94) | ⊕⊕⊕⊕ Alta | Crítico |
| Eventos adversos (seguimiento: mediana 3.5 meses; evaluado con: National Cancer Institute Common Terminology Criteria for Adverse Events version 4.0) | |||||||||||
| 1 | Ensayos aleatorizados | No es serio | No es serio | No es serio | No es serio | Ninguno | 55/343 (16.0%) | 109/309 (35.3%) | No estimable | ⊕⊕⊕⊕ Alta | Crítico |
| Estudios OAK | Atezolizumab | Docetaxel | |||||||||
| Supervivencia global (seguimiento: mediana 21 meses; evaluado con: tiempo desde la aleatorización hasta la muerte por cualquier causa) | |||||||||||
| 1 | Ensayos aleatorizados | No es serio | No es serio | No es serio | No es serio | Ninguno | 241 participantes | 222 participantes | HR 0.74 (0.58-0.93) | ⊕⊕⊕⊕ Alta | Crítico |
| Supervivencia libre de progresión (seguimiento: mediana 21 meses; evaluado con: tiempo desde la aleatorización hasta la progresión de la enfermedad definida por RECIST v1.1 o muerte por cualquier causa) | |||||||||||
| 1 | Ensayos aleatorizados | No es serio | No es serio | No es serio | No es serio | Ninguno | 241 participantes | 222 participantes | HR 0.91 (0.74-1.12) | ⊕⊕⊕⊕ Alta | Crítico |
| Eventos adversos serios (seguimiento: mediana 3.4 meses; evaluado con: National Cancer Institute Common Terminology Criteria for Adverse Events version 4.0) | |||||||||||
| 1 | Ensayos aleatorizados | No es serio | No es serio | No es serio | No es serio | Ninguno | 90/609 (14.8%) | 248/578 (42.9%) | No estimable | ⊕⊕⊕⊕ Alta | Crítico |
| Estudios POPLAR | Atezolizumab | Docetaxel | |||||||||
| Supervivencia global (seguimiento: mediana 14.8 meses; evaluado con: tiempo desde la aleatorización hasta la muerte por cualquier causa) | |||||||||||
| 1 | Ensayos aleatorizados | No es serio | No es serio | No es serio | No es serio | Ninguno | 48 participantes | 61 participantes | HR 0.59 (0.40-0.85) | ⊕⊕⊕⊕ Alta | Crítico |
| Supervivencia libre de progresión (seguimiento: mediana 14.8 meses; evaluado con: tiempo desde la aleatorización hasta la progresión de la enfermedad definida por RECIST v1.1 o muerte por cualquier causa) | |||||||||||
| 1 | Ensayos aleatorizados | No es serio | No es serio | No es serio | No es serio | Ninguno | 144 participantes | 143 participantes | HR 0.94 (0.72-1.23) | ⊕⊕⊕⊕ Alta | Crítico |
| Eventos adversos serios (seguimiento: mediana 3.7 meses; evaluado con: N ational Cancer Institute Common Terminology Criteria for Adverse Events version 4.0) | |||||||||||
| 1 | Ensayos aleatorizados | No es serio | No es serio | No es serio | No es serio | Ninguno | 17/142 (12.0%) | 55/135 (40.7%) | No estimable | ⊕⊕⊕⊕ Alta | Crítico |
| Estudios IMpower 132 | Atezolizumab + carboplatino (o cisplatino) + pemetrexed | Carboplatino (o cisplatino) + pemetrexed | |||||||||
| Supervivencia global (seguimiento: mediana 14.8 meses; evaluado con: no hay información) | |||||||||||
| 1 | Ensayos aleatorizados | No es serio | Serio | No es serio | No es serio | Ninguno | 292 participantes | 286 participantes | HR 0.81 (0.64-1.03) | ⊕⊕⊕◯ Moderado | Crítico |
| Supervivencia libre de progresión (seguimiento: mediana 14.8 meses; evaluado con: no hay información) | |||||||||||
| 1 | Ensayos aleatorizados | No es serio | No es serio | No es serio | No es serio | Ninguno | 292 participantes | 286 participantes | HR 0.60 (0.49-0.72) | ⊕⊕⊕⊕∘ Alta | Crítico |
| Eventos adversos serios (Grado 3, 4 y 5; evaluado con: National Cancer Institute Common Terminology Criteria for Adverse Events version 4.0) | |||||||||||
| 1 | Ensayos aleatorizados | No es serio | No es serio | No es serio | No es serio | Ninguno | 166/291 (57.0%) | 114/274 (41.6%) | No estimable | ⊕⊕⊕⊕ Alta | Crítico |
| Estudio IMpower130 | Atezolizumab + carboplatino + paclitaxel nab-P | Carboplatino + paclitaxel nab-P | |||||||||
| Supervivencia global (seguimiento: mediana 18.5 meses; evaluado con: sin información) | |||||||||||
| 1 | Ensayos aleatorizados | No es serio | No es serio | No es serio | No es serio | Ninguno | 483 participantes | 240 participantes | HR 0.79 (0.64-0.98) | ⊕⊕⊕⊕ Alta | Crítico |
| Supervivencia libre de progresión (seguimiento: mediana 18.5 meses; evaluado con: sin información) | |||||||||||
| 1 | Ensayos aleatorizados | No es serio | No es serio | No es serio | No es serio | Ninguno | 483 participantes | 240 participantes | HR 0.64 (0.54-0.77) | ⊕⊕⊕⊕ Alta | Crítico |
| Eventos adversos serios (seguimiento: media 8.9 meses; evaluado con: National Cancer Institute Common Terminology Criteria for Adverse Events, version 4.0) | |||||||||||
| 1 | Ensayos aleatorizados | No es serio | No es serio | No es serio | No es serio | Ninguno | 354/473 (74.8%) | 141/232 (60.8%) | No estimable | ⊕⊕⊕⊕ Alta | Crítico |
| Estudio IMpower131 | Atezolizumab + carboplatino + paclitaxel nab-P | Carboplatino + paclitaxel nab-P | |||||||||
| Supervivencia global (seguimiento: mediana 17.1 meses; evaluado con: sin información) | |||||||||||
| 1 | Ensayos aleatorizados | Serio§ | No es serio | No es serio | Serio ‡ | Ninguno | 343 participantes | 340 participantes | HR 0.96 (0.78-1.18) | ⊕⊕◯ Baja | Crítico |
| Supervivencia libre de progresión (seguimiento: mediana 17.1 meses; evaluado con: sin información) | |||||||||||
| 1 | Ensayos aleatorizados | Serio§ | No es serio | No es serio | No es serio | Ninguno | 343 participantes | 340 participantes | HR 0.71 (0.60-0.85) | ⊕⊕⊕◯ Moderado | Crítico |
| Eventos adversos serios (seguimiento: mediana 6.7 meses; evaluado con: National Cancer Institute Common Terminology Criteria for Adverse Events, version 4.0) | |||||||||||
| 1 | Ensayos aleatorizados | Serio§ | No es serio | No es serio | No es serio | Ninguno | 231/334 (69.2%) | 193/334 (57.8%) | No estimable | ⊕⊕⊕◯ Moderado | Crítico |
*Inconsistencia entre resultados de estudio KEYNOTE 189 y KEYNOTE 021 para supervivencia global.
†Por tamaño de la muestra.
‡No hay significación estadística del efecto evaluado.
§La evaluación del riesgo de sesgo fue realizada a partir del documento de presentación de los resultados del estudio en el 2018, reunión anual de ASCO.
Se realizó una breve descripción de cuatro estudios primarios adicionales (CheckMate-026, MYSTIC, Javelin LUNG 200 y CheckMate-227) que no habían sido seleccionados inicialmente, pero son relevantes para mencionar.
Resultados
Se incluyeron siete GPC y tres HTA con catorce estudios primarios y una RSL que incluyó nueve estudios primarios sobre HPD. Además, se adicionó una breve descripción de cuatro estudios relevantes para mencionar que no se habían incluido en la metodología inicial. El presente informe presenta un resumen de los resultados encontrados en cada uno de estos estudios en cuanto a supervivencia global, supervivencia libre de progresión y evaluación de eventos adversos; los detalles de los principales estudios revisados se pueden visualizar en la tabla 1. Los estudios registran haber evaluado eventos adversos severos, conforme a lo definido por los Criterios Comunes de Terminología para Eventos Adversos versión 4.0 (CTCAE, por sus siglas en inglés) del Instituto Nacional de Cáncer de EE.UU.; esto incluye desde grado 3 (médicamente significativo, que requiere manejo intrahospitalario, pero no pone en peligro la vida de inmediato), grado 4 (potencialmente mortal, que requiere intervención urgente) y grado 5 (genera muerte)6. Los criterios de inclusión varían, por lo que brevemente se resume en cada punto la recomendación de la GPC con las consideraciones que se tuvieron en cuenta en cada estudio, como: el estadio de la patología (utilizando la terminología reportada por los estudios), se menciona la presencia o no de expresión de PD-L1 y si el estudio se basa en evaluar tratamiento de primera o segunda línea.
Inmunoterapia dirigida a PD-1/PD-L1 como único tratamiento de primera línea
- En pacientes con CPCNP metastásico, independientemente del tipo histológico, cuando los niveles de PD-L1 son mayores al 50% y el resultado de las pruebas para las mutaciones del receptor de factor de crecimiento epidérmico (EGFR) y reordenamiento del receptor transmembrana ALK (anaplastic lymphoma kinasa) son negativos o se desconocen, sin tratamiento previo, el tratamiento con pembrolizumab como agente único generó resultados más favorables comparado con quimioterapia. En el estudio KEYNOTE 024, que evaluó esta población, se obtuvo un hazard ratio (HR) de 0.63 (intervalo de confianza [IC] 95%: 0.47-0.86) a favor de la inmunoterapia como agente único en la evaluación de la supervivencia global (calidad de la evidencia: alta), con un menor porcentaje de eventos adversos en los pacientes tratados con pembrolizumab (31.2 vs. 53%)7.
-
- En pacientes con CPCNP metastásico, independientemente del tipo histológico, y niveles de PD-L1 entre un 1 y un 49% y resultado de las pruebas para mutaciones EGFR y reordenamiento ALK negativo o desconocido, sin tratamiento previo, el tratamiento con pembrolizumab como agente único generó resultados superiores comparado con quimioterapia. Esta recomendación se apoya en el estudio KEYNOTE 042, en el cual se observó un HR de 0.81 (IC 95%: 0.71-0.93) para supervivencia global a favor de la inmunoterapia como agente único (calidad: alta), con el beneficio de un menor número de eventos adversos en el brazo de pembrolizumab (17.4%) vs. quimioterapia (41%) (calidad: alta)8.
Adicionalmente, el estudio CheckMate-026, que evaluó al nivolumab como primera línea, no lo asoció con una supervivencia libre de progresión significativamente mayor que la quimioterapia entre pacientes con CPCNP en estadio IV o recurrente sin tratamiento previo con un nivel de expresión de PD-L1 del 5% o más; la supervivencia general fue similar entre los grupos y el perfil de seguridad fue favorable en el brazo de nivolumab en comparación con la quimioterapia9.
Otro estudio que comparó el uso de durvalumab frente a la terapia convencional con quimioterapia como tratamiento de primera línea en pacientes con CPCNP y metástasis, con expresión PD-L1 25%, fue el estudio MYSTIC, que mostró resultados que en cuanto a supervivencia global y supervivencia libre de progresión no tuvieron significancia estadística en los criterios de valoración primaria10.
Inmunoterapia dirigida a PD-1 + inmunoterapia dirigida a CTLA-4 como tratamiento de primera línea
- En el estudio CheckMate-227, la supervivencia libre de progresión fue significativamente mayor con nivolumab más ipilimumab en manejo de primera línea que con quimioterapia entre pacientes con CPCNP y una alta carga mutacional tumoral, independientemente del nivel de expresión de PD-L1, los resultados anteriores validan el beneficio de nivolumab más ipilimumab en CPCNP y el papel de la carga mutacional tumoral como biomarcador para la selección de pacientes11.
Inmunoterapia dirigida a PD-1/PD-L1 + quimioterapia como tratamiento de primera línea
- En pacientes con CPCNP no escamoso metastásico sin mutaciones de EGFR y ALK, independientemente de los niveles de expresión de PD-L1, la combinación de pembrolizumab y quimioterapia basada en platino y pemetrexed como terapia de primera línea resultó más eficaz que el manejo con quimioterapia. Evidenciado en el estudio KEYNOTE 189, que halló una HR de 0.49 (IC 95%: 0.38-0.64) para la supervivencia global a favor de la terapia combinada de inmunoterapia y quimioterapia vs. quimioterapia y placebo (calidad: moderada)12; el estudio KEYNOTE 021 evaluó la misma intervención, pero la calificación de la calidad fue baja13.
- En pacientes con CPCNP no escamoso, con resultado negativo o desconocido de las pruebas de mutaciones EGFR y reordenamiento ALK, independientemente de los niveles de expresión de PD-L1, la combinación de atezolizumab, bevacizumab y quimioterapia como terapia de primera línea resultó más favorable que la terapia con quimioterapia y bevacizumab. Esto fue evaluado en el estudio IMpower150, en el que se observó una HR de 0.62 (IC 95%: 0.52-0.74) para la supervivencia libre de progresión a favor de la terapia combinada con atezolizumab y bevacizumab más quimioterapia vs. quimioterapia y bevacizumab (calidad: alta); aunque para la primera combinación se presentó un mayor porcentaje de eventos adversos (58.5 vs. 50%)14.
- En pacientes con CPCNP escamoso metastásico, independientemente de los niveles de expresión de PD-L1, la combinación de pembrolizumab más carboplatino y paclitaxel como terapia de primera línea resultó superior a la quimioterapia más placebo. Demostrado en el estudio KEYNOTE 407 en el cual se evidenció un beneficio en la supervivencia global dado por un HR de 0.64 (IC 95%: 0.49-0.85) a favor de la terapia combinada con pembrolizumab y quimioterapia vs. quimioterapia y placebo, así como una mayor supervivencia libre de progresión en la primera combinación, con un HR de 0.56 (IC 95%: 0.45-0.70). Calidad: alta15.
- En pacientes con CPCNP no escamoso y metastásico, sin mutaciones de EGFR o ALK, sin quimioterapia previa, el tratamiento con atezolizumab en combinación con pemetrexed y quimioterapia basada en platino presentó beneficio en cuanto a la supervivencia libre de progresión, pero no presentó diferencia significativa en cuanto a supervivencia global comparado con la quimioterapia. En el estudio IMpower 132 se observó una HR de 0.81 (IC 95%: 0.64-1.03) en la supervivencia global con un intervalo de confianza que cruza la unidad, por lo que no se encuentra diferencia entre las dos intervenciones (calidad: moderada). En cuanto a la supervivencia libre de progresión, se evidencia claramente el beneficio a favor de la inmunoterapia dirigida a PD-L1 con un adecuado intervalo de confianza (HR: 0.60; IC 95%: 0.49-0.72) (calidad: alta); se destaca que la primera combinación presentó mayor porcentaje de eventos adversos (57 vs. 41.6%)16.
- En pacientes con CPCNP no escamocelular y estadio IV, sin quimioterapia previa, la combinación de atezolizumab, carboplatino y paclitaxel unido a albúmina (nab-P), seguido de mantenimiento con atezolizumab, resultó más eficaz que nab-P, según lo demostró el estudio IMpower 130 con una HR de 0.79 (IC 95%: 0.64-0.98) para supervivencia global (calidad: alta) y un HR de 0.64 (IC 95%: 0.54-0.77) para supervivencia libre de progresión (calidad: alta), ambos efectos a favor de la terapia combinada con inmunoterapia17. Sin embargo, la primera combinación presentó mayor porcentaje de eventos adversos serios (74.8 vs. 60.8%). Calidad: alta17.
- En pacientes con CPCNP escamocelular y metastásico, independientemente de los niveles de expresión de PD-L1, sin quimioterapia previa, el uso de atezolizumab con carboplatino y nab-P no representó diferencia terapéutica comparado con la combinación de carboplatino y nab-P en cuanto a supervivencia global, pero favorable en cuanto a la supervivencia libre de progresión. Según el estudio IMpower 131, no se encontró una diferencia entre los dos grupos en cuanto a la supervivencia global (HR: 0.96; IC 95%: 0.78-1.18; Calidad: baja), pero sí un resultado a favor de la terapia con atezolizumab al evaluar la supervivencia libre de progresión (HR: 0.71; IC 95%: 0.60-0.85; calidad de la evidencia: moderada). Por otra parte, la frecuencia de eventos adversos fue superior en el grupo con atezolizumab (69.2 vs. 57.8%)18.
Inmunoterapia dirigida a PD-1/PD-L1 como segunda línea de tratamiento
- En pacientes con CPCNP metastásico y progresión de la enfermedad después de terapia de primera línea con quimioterapia, el tratamiento con nivolumab, atezolizumab o pembrolizumab fue más eficaz que la quimioterapia, independientemente del tipo histológico y del nivel de expresión del PD-L1. Esto quedó demostrado por los estudios CheckMate-05719, CheckMate-01720, OAK21 y POPLAR22, en los que se observó una mayor supervivencia global y libre de progresión, y una menor presentación de eventos adversos en los grupos tratados con inmunoterapia dirigida a PD-L1 en comparación con docetaxel. Calidad: alta. Aunque estos estudios no consideraron el nivel de expresión de PD-L1 como criterio de inclusión, sí analizaron los niveles de expresión de PD-L1; en este análisis no se encontraron resultados significativos que contradijeran el beneficio de la inmunoterapia independiente del nivel de expresión de PD-L1, el resultado global de cada estudio está registrado en la tabla 1.
- El estudio KEYNOTE 010 incluyó pacientes con CPCNP metastásico y progresión de la enfermedad después de terapia de primera línea con quimioterapia, con expresión PD-L1 positiva, además evaluó la diferencia en dosis de tratamiento. Comparando la dosis de 10 mg/kg de pembrolizumab vs. la de 2 mg/kg frente a docetaxel a 75 mg/m2, se mostró una mayor supervivencia global (HR: 0.61; IC 95%: 0.49-0.75) a favor de la dosis de 10 mg/kg, con una calidad de la evidencia alta; la mayor dosis de pembrolizumab también fue más eficaz en términos de la supervivencia libre de progresión (HR: 0.79; IC 95%: 0.66-0.94). Calidad: alta23.
- El estudio JAVELIN lung 200 comparó el uso de avelumab vs. docetaxel, en pacientes con CPCNP estadio IIIB o IV o recurrente, previamente tratado con platino, con estratificación de la expresión de PD-L1 ≥ 1% vs. < 1%; los resultados de este estudio no encontraron mejoría en cuanto a la supervivencia global en los pacientes con PD-L1 positivo, pero tuvo un perfil de seguridad favorable24.
Enfermedad hiperprogresiva
Una de las definiciones más utilizadas de HPD es la aceleración del crecimiento tumoral que excede el doble. Esto se evalúa con base a imágenes realizadas en tres puntos de tiempo diferentes (pretratamiento, basal y post/sub tratamiento), estos hallazgos son de importancia porque algunos estudios han descrito que en pacientes con CPCNP o cáncer gástrico avanzado la HPD es más común en cohortes que han recibido inmunoterapia anti-PD-1/PD-L1 comparado con pacientes tratados con quimioterapia25. Dentro de la búsqueda realizada, frente a posibles factores predictores de HPD, se encontró: de acuerdo con la RSL de Kim, que analizó nueve estudios observacionales retrospectivos en 1,519 sujetos con cáncer, se reconocen cinco factores asociados significativamente a HPD, entre los cuales se tienen niveles elevados de lactato deshidrogenasa sérica (odds ratio [OR]: 1.89; IC 95%: 1.02-3.49), más de dos sitios metastásicos (OR: 1.86; IC 95%: 1.34-2.57), metástasis hepáticas (OR: 3.33; IC 95%: 2.07-5.34), puntaje pronóstico de Royal Marsden Hospital de 2 o más (OR: 3.33; IC 95%: 1.96-5.66) y expresión positiva de PD-L1 que se correlacionó inversamente con HPD (OR: 0.60; IC 95%: 0.36-0.99)23. Otros factores, como edad mayor de 65 años, sexo femenino, puntaje ECOG (Eastern Cooperative Oncology Group) mayor a 1, puntaje de 2 o más en las escalas LIPI (Lung Immune Prognostic Index) o GRIM (Gustave Roussy Immune), junto a los biomarcadores de células T CD28+ CD4 memoria/efectoras aún no han sido claramente establecidos como predictores positivos de HPD en pacientes con CPCNP metastásico25. Se sigue investigando al respecto incluyendo también el papel de las mutaciones somáticas en STK11 y KEAP1 como biomarcadores pronósticos, no predictivos, para la terapia anti-PD-1/anti-PD-L1, según estudios observacionales como el de Papillon-Cavanagh26.
Conclusión
Hay evidencia del beneficio de utilizar inhibidores del punto de control inmunitario dirigidos al complejo PD-1/PD-L1 para el tratamiento de pacientes con CPCNP metastásico con expresión PD-L1 positiva, existiendo aún vacíos en la literatura sobre el posicionamiento de dichos inhibidores. Por esta razón los inhibidores del punto de control inmunitario se pueden considerar como tratamiento de primera línea en pacientes con CPCNP cuando los niveles de PD-L1 son > 50%. Aunque en niveles de PD-L1 entre 1-49% o desconocidos, también muestran beneficio en comparación con quimioterapia, se debe evaluar el costo-beneficio para indicarlos como tratamiento de primera línea. Se evidencia además el beneficio frente a eventos adversos como agente único de primera línea o como segunda línea posterior a quimioterapia; este beneficio se invierte cuando se utiliza en terapia combinada con quimioterapia encontrándose mayor proporción de eventos adversos severos. A pesar de los eventos adversos, la terapia combinada (inmunoterapia + quimioterapia) presenta mayor beneficio en supervivencia libre de progresión comparado con quimioterapia sin inmunoterapia, por lo que se debe evaluar el riesgo-beneficio de dicha terapia. Adicionalmente, se han identificado algunos factores predictores de HPD que pueden servir para identificar a los pacientes que no se beneficiarían de la inmunoterapia y por el contrario podrían presentar HPD. Este es un campo importante para nuevas investigaciones.
Limitaciones del estudio
Este estudio es una revisión rápida de los estudios primarios que sustentan las recomendaciones encontradas en las guías seleccionadas, por lo tanto no son homogéneos, dado que hay variedad en cuanto a la clasificación de los pacientes, pues en algunos estudios los desenlaces son distintos y el diseño de los estudios puede variar, así como la etapa de los estudios, pues algunos son de fase II (estudian si un tipo de cáncer responde al tratamiento nuevo) y otros fase III (estudian si un tratamiento nuevo es mejor que un tratamiento estándar).
En cuanto a la RSL realizada por Kim25 que hace referencia a los posibles criterios de hiperprogresión, existen sesgos frente a la clasificación de los estudios incluidos, pues no todos son pacientes con CPCNP, también incluyeron estudios de cáncer gástrico, hepático, genitourinario y otros.











 nova página do texto(beta)
nova página do texto(beta)