Introducción
La leucemia mieloide aguda (LMA) es una enfermedad clonal del tejido hematopoyético, caracterizada por la proliferación anormal de células progenitoras mieloides. En niños menores de 15 años, la LMA constituye el 15-20% de los casos de leucemia aguda1. Existen varios tipos de LMA y se clasifican según sus características fenotípicas, anormalidades genéticas como mutaciones, fusión de genes y alteraciones cromosómicas, o su asociación con algún síndrome2. Uno de los varios subtipos de LMA es la leucemia mielomonocítica aguda M4 de acuerdo con la clasificación Francesa-Americana-Británica (FAB), en la que proliferan precursores de monocitos y neutrófilos con 20% o más de mieloblastos en médula ósea, y se presenta entre el 5 y el 10% de los casos con LMA1.
La anormalidad citogenética más recurrente en la LMA-M4 es la inv(16)(p13.1q22) o t(16;16) (p13.1;q22), que está asociada con mayor frecuencia a la variante eosinófila, donde los pacientes muestran remisión completa y tasas de supervivencia alta3,4. También se han descrito anormalidades citogenéticas raras o inusuales con implicaciones terapéuticas y pronósticas desconocidas, entre ellas, la t(2;11)(q31;p15) con fusión de los genes NUP98 en 11p15 y HOXD en 2q315, que resulta en una proteína quimérica con actividad leucemogénica que actúa como un factor de transcripción aberrante6 y bloquea la diferenciación de las células precursoras hematopoyéticas7. La translocación t(2;11)(q31;p15) se ha descrito en cinco casos como alteración única y en cuatro casos asociada con otras alteraciones citogenéticas7-10.
Por otra parte, la FLT3 (FMS-like tyrosine kinase 3) pertenece a la familia de receptores clase III tirosina cinasa y tiene un papel importante en el desarrollo normal de células madre hematopoyéticas y del sistema inmunitario. Aún existe controversia respecto al significado pronóstico de la duplicación FLT3-ITD, ya que está involucrada en el incremento de porcentaje de recaída y disminución de la supervivencia. Numerosos ensayos clínicos han demostrado una recuperación clínica menor en presencia de la duplicación FLT3-ITD11, pero parece no influir en la tasa de remisión completa11-13. La frecuencia de FLT3-ITD acompañada de otras translocaciones de pronóstico favorable fue del 37% con t(15;17)(q24;q21), t(8;21)(q22;q22.1) en el 9%, inv(16)(p13.1q22) en el 7% y se concluyó que el impacto clínico de FLT3-ITD puede variar según la translocación citogenética que la acompañe14. La duplicación interna en tándem de FLT3 (FL3-ITD) ha sido detectada en todos los subtipos FAB de LMA (con mayor frecuencia en el subtipo M3) y está presente entre el 10 y el 15% de los casos con LMA en pacientes pediátricos15.
En este artículo describimos el décimo paciente con t(2;11)(q31;p15) y el hallazgo adicional de la duplicación FLT3-ITD.
Presentación del caso
Paciente de sexo femenino de 8 años procedente de medio rural con antecedente de exposición crónica a pesticidas de uso en la agricultura. Acudió al médico por palidez progresiva, astenia y adinamia, y posteriormente presentó náuseas, vómitos y dolor abdominal. La paciente evolucionó con equimosis relacionadas con trauma mínimo, además de petequias en tórax y zona pélvica. Después de un mes con estos síntomas, ingresó al Hospital Infantil Teletón de Oncología. En el examen físico se encontró palidez, hepatoesplenomegalia, equimosis y petequias. A su ingreso mostró hemoglobina 6.5 g/dl (13-16 g/dl), leucocitos 42,000 cel/µl (4,500-13,000 cel/µl), plaquetas 15 x 103/µl (150-400 x 103 µl) y deshidrogenasa láctica 1,102 U/l (135-345 U/l); en el frotis de médula ósea se observaron blastos con gránulos azurófilos, mieloxidasa positiva, promonocitos, monocitos y células en maduración de estirpe neutrofílica, principalmente metamielocitos, bandas y segmentados con cambios displásicos. Además, se realizó la tinción de esterasas dobles, que demostró la doble población monocítica-neutrofílica.
El análisis de citometría de flujo (CF) mostró un 23% de mieloblastos positivos para CD34, CD13, CD15 y un 47% de células monocíticas positivas para CD13, CD65, CD11c y MPO. El cariotipo en médula ósea mostró 46,XX, t(2;11)(q31;p15) en 20 células analizadas (Fig. 1). De acuerdo con el diagnóstico multidisciplinario, se diagnosticó como LMA-M4.
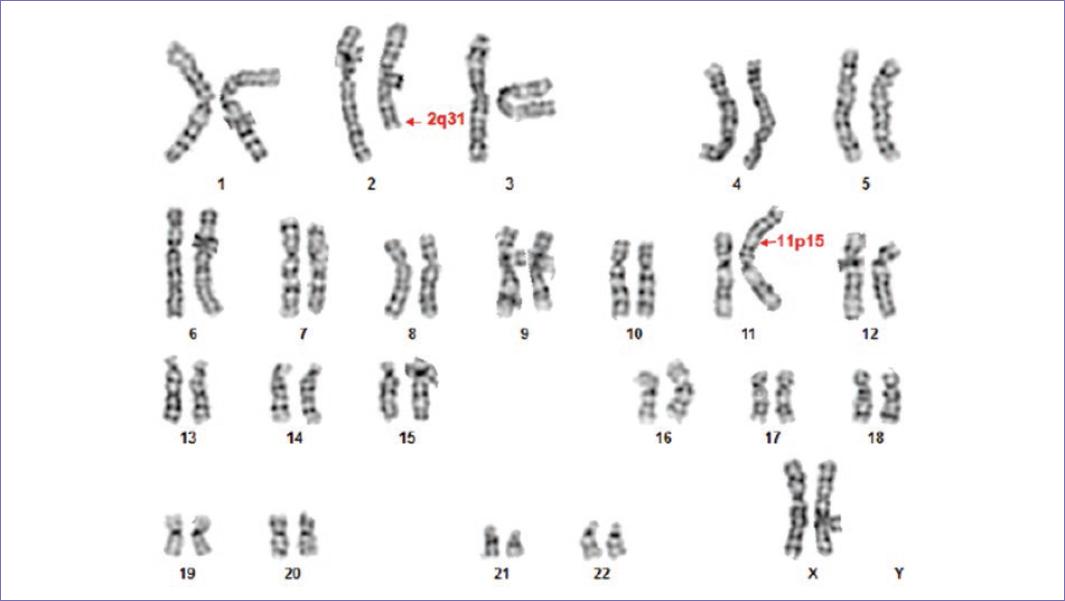
Figura 1 Cariotipo en aspirado de médula ósea con bandas G mostrando la translocación t(2;11)(q31;p15). Los cromosomas translocados, der(2) y der(11) están señalados con flechas rojas.
La detección de la duplicación FLT3-ITD se realizó según lo publicado por Murphy, et al.12, siendo positiva con un radio alélico de 0.008.
Posterior a la inducción a la remisión recibió dos ciclos de consolidación y quimioterapia intratecal con metotrexato, hidrocortisona y citarabina. En su evolución mostró episodios infecciosos graves de bronconeumonía resistente a antibióticos, celulitis y eventos documentados por herpes zóster, Pseudomona y Aspergillus pulmonar asociados con neutropenia intermitente. Siete meses después de su diagnóstico falleció en la unidad de cuidados intensivos por choque séptico con evidencia de enfermedad mínima residual (EMR) sin actividad tumoral en sistema nervioso central.
El seguimiento de la enfermedad se realizó por cariotipo, analizando el porcentaje de células positivas para la translocación t(2;11)(q31;p15) y EMR por CF siguiendo el patrón de expresión al momento del diagnóstico (CD65+/CD13+/MPO+/CD34+). En la tabla 1 se muestran los resultados de cinco mediciones de EMR por CF, se observan porcentajes mayores al límite de sensibilidad considerando refractariedad de la enfermedad al tratamiento.
Tabla 1 Seguimiento por cariotipo y enfermedad mínima residual por citometría de flujo
| EDD (días) | Cariotipo | % de alteración | EMR CF |
|---|---|---|---|
| 0 | 46,XX,t(2;11)(q31;p15)[20] | 100% | 70% |
| +25 | 46,XX,t(2;11)(q31;p15)[13]/46,XX[7] | 65% | 3.8% |
| +45 | 46,XX[20] | 0% | 1.3% |
| +134 | 46,XX[20] | 0% | 0.07% |
| +197 | Sin desarrollo | N/A | 0.25% |
EDD: evaluación después del diagnóstico; EMR: enfermedad mínima residual; CF: citometría de flujo; N/A: no aplica.
Discusión
La t(2;11)(q31;p15) es poco frecuente pero recurrente en LMA de novo y LMA asociada a tratamiento (tLMA)5,10; predomina en la población asiática6. A la fecha hay nueve casos descritos en la literatura (Tabla 2), involucrando la fusión de los genes NUP98-HOXD7, de los cuales el 66% presentan LMA-M45,6,16-18 y el 34% otros diagnósticos como: LMA-M619, leucemia mieloide crónica (LMC)8, LMA-M29 y síndrome mielodisplásico asociado a tratamiento (tSMD) con LMA10; en nuestro caso, la paciente presentó morfología y CF compatible con LMA-M4. Este reporte es el décimo de la casuística de pacientes que presentan la t(2;11)(q31;p15), el séptimo en LMA-M4 y el único reportado con la duplicación FLT3-ITD.
Tabla 2 Casos reportados con t(2;11)(q31;p15) y sus características clínicas
| Caso | Edad/Sexo | PO | Diagnóstico | Cariotipo | Ref. |
|---|---|---|---|---|---|
| 1 | 10 a/M | A | t-LMA-M6 | 46,XY,t(2;11)(q31;p15) | Raza-Egilmez, et al., 199819 |
| 2 | 68 a/M | J | Denovo LMA(M4) | 46,XY,t(2;11)(q31;p15) | Arai, et al., 20005 |
| 3 | 10 m/F | J | Denovo LMA(M4) | 46,XX,t(2;11)(q31;p15) | Shimada, et al., 20006 |
| 4 | 15 a/M | J | Denovo LMA(M4) | 46,XY,t(2;11)(q31;p15) | Taketani, et al., 200216 |
| 5 | 15 a/F | A | LMC | 46,XX,t(2;11)(q31;p15),t(9;22;14)(q34;q11;q32)[20] | Kobzev, et al., 20048 |
| 6 | 11 m/F | J | Denovo LMA(M4) | 46,XX,t(6;15;9)(q21;q22;q22)[2]/46,XX,t(9;15)(q22;q22)[1]/46,XX[17] | Hidaka, et al., 200717 |
| 7 | 9 m/M | B | Denovo LMA-M4 | 46,XY,t(2;11)(q31;p15) | Emerenciano, et al., 201118 |
| 8 | 59 a/F | A | t-SMD/LMA | 46,XX,t(2;11)(q31;p15)[14]/47,XX,t(2;11)(q31;p15),+8[6] | Bhalla, et al., 201310 |
| 9 | 22 a/F | C | Denovo LMA-M2 | 45,X,X,t(3;21;8)(p21;q22;q22)[12]/45,idem,t(2;11)(q31;p15)[5]/46,XX[3] | Park, et al., 20169 |
| 10 | 8 a/F | M | Denovo LMA-M4 | 46,XX,t(2;11)(q31;p15) | Presente caso |
PO: país de origen; A: EE.UU.; C: Corea; B: Brasil; M: México; J: Japón; tSMD: síndrome mielodisplásico asociado a tratamiento; a: años; m: meses; M: masculino;
F: femenino; LMC: leucemia mieloide crónica.
De los nueve casos descritos en la literatura, seis se presentaron en edad pediátrica, al igual que en nuestra paciente (Tabla 2); el 50% de estos los casos se manifestaron durante el primer año de edad6,17,18 y en uno de ellos (caso 5) se documentó que la translocación estaba presente desde el nacimiento17.
Percibimos que, aunque al día 45 de tratamiento no se observó la translocación por cariotipo, la CF continuó mostrando células anormales hasta el día 197, poco antes de su fallecimiento, manifestando refractariedad a regímenes de quimioterapia multiagente. Esta discrepancia de resultados entre metodologías se puede explicar por la diferente sensibilidad del cariotipo (5%) vs. la CF (0.01%).
Se ha documentado que la fusión de NUP98-HOXD13 puede contribuir a un curso agresivo de la enfermedad8. Si bien no se conoce el impacto clínico de la presencia de la t(2;11)(q31;p15) y la duplicación FLT3-ITD, Palmqvist, et al.20 demostraron que la sobreexpresión del receptor de la tirosina cinasa wild-type FLT3 colabora con las fusiones NUP98-HOX (NUP98-HOXA10 y NUP98-HOXD13) para inducir LMA agresiva20; sin embargo, aún no existe evidencia de que la duplicación FLT3-ITD esté relacionada con NUP98-HOX. Por otra parte, Hara, et al. reportaron en 2014 que pacientes positivos a la duplicación FLT3-ITD con los subtipos FAB M4 y M5 tienen un peor pronóstico que otros subtipos FAB y además puede estar asociada a una pobre supervivencia21, lo que podría estar relacionado con la supervivencia disminuida de nuestra paciente.
Conclusión
Tanto la presencia de la fusión génica NUP98-HOX como la duplicación FLT3-ITD están relacionadas con progresión de la enfermedad e incremento en la recaída. Este es el primer caso reportado con estas anormalidades que pudieron haber influido en que la paciente presentara refractariedad al tratamiento y una supervivencia de 7 meses.











 nueva página del texto (beta)
nueva página del texto (beta)


