Introducción
El cáncer de mama es el tipo de cáncer más común en mujeres en todo el mundo. Durante la edad reproductiva la mujer puede padecer diversos tipos de cáncer; para fines del presente artículo, se define al cáncer de mama asociado a embarazo (CMAE) como todo aquel cáncer de mama diagnosticado durante el periodo del embarazo y hasta un año posterior al alumbramiento, y es también el cáncer más comúnmente diagnosticado en esta etapa reproductiva1-3. Aunque se dispone de mejor información sobre este tema, los datos disponibles siguen siendo débiles1-4. En este artículo se actualiza la información más relevante respecto al estudio y tratamiento del CMAE en México.
Epidemiología
En relación a la incidencia del CMAE, Smith, et al. reportaron una incidencia en EE.UU. de 15 a 35 casos por 100,000 nacidos vivos3. Un reporte europeo revela que esta entidad ha aumentado entre los años 1963 y 2000 de 16.0 a 34.4 casos por 100,000 nacimientos vivos4. En México, a pesar de que el CMAE es la entidad más frecuentemente diagnosticada en mujeres en edad fértil, no se cuenta con registros o bases de datos que informen con precisión sobre su incidencia o prevalencia en el país1,5.
Diagnóstico y estadificación
Se conocen en general los factores de riesgo para cáncer de mama no asociado a embarazo, sin embargo, no se han identificado factores de riesgo específicos para cáncer de mama y embarazo. Frecuentemente, el CMAE se diagnostica en las etapas localmente avanzado y avanzado, con un pronóstico menos favorable debido al retraso en el diagnóstico, el cual frecuente es por autoexploración. El cuadro clínico más común es la presencia de un nódulo o tumor en la mama, muchas veces confundido y subestimado por los cambios propios del embarazo: hipertrofia, mamas congestivas y de mayor volumen. En los casos de cáncer metastásico el cuadro clínico dependerá del sitio específico del daño, como ocurre en el cáncer de mama no asociado a embarazo. Es sabido el riesgo que representa la mutación en BRCA1 y BRCA2 para desarrollar cáncer de mama en la mujer no embarazada; con base en la información conocida y los grados de evidencia no parece ser diferente para la mujer embarazada1,3,6-8.
Estadificación (estudio por imágenes y biopsia)
Ultrasonografía
Es el método de elección para el estudio inicial de la mama y de evaluación de metástasis (axilas, cuello o hígado). La ultrasonografía emite baja radiación ionizante y tiene sensibilidad hasta del 100% para definir si el nódulo es de naturaleza sólida o quística, así como las características de vascularidad, bordes etc., vs. 78% de sensibilidad con la mamografía. Es útil también para la detección de ganglios axilares en un 90% de los casos y para realizar biopsias de corte guiadas9.
Mamografía
Esta técnica se recomienda en casos de diagnóstico confirmado de malignidad, siempre y cuando complemente la estratificación o modifique la conducta terapéutica. Se puede realizar bajo adecuada protección al feto; con los equipos y técnicas de protección modernos el riesgo de daño fetal es mínimo, ya que la exposición de radiación es menor a 0.03 mGy, cuando las dosis teratogénicas son de 50,000 mGy9-11.
Resonancia magnética nuclear (RMN)
Esta técnica cuando utiliza gadolinio como contraste no puede utilizarse durante el embarazo debido a que el gadolinio cruza la barrera hematoplacentaria, y debe ser considerado como potencialmente teratogénico. Cuando el ultrasonido es insuficientemente informativo, la RMN sin contraste podría ser utilizada, siempre y cuando los resultados esperados permitan modificar una decisión clínica respecto a un procedimiento diagnóstico o de tratamiento. Durante la lactancia este método podría ser utilizado, sin embargo, los cambios propios de la lactancia limitan su interpretación y utilidad. Se recomienda suspender la lactancia para la realización del estudio y reiniciarla después de 12 a 24 horas de haberse realizado este12-14.
Tomografía axial y gammagrafía ósea
Técnica conocida también como rastreo óseo, no son considerados estudios indispensables como estudio de extensión o estratificación del cáncer de mama durante el embarazo; solo se recomienda en casos muy particulares en los que se deba modificar el tratamiento.
Tomografía por emisión de positrones (PET-CT)
Al momento no se cuenta con información suficiente disponible en relación con el CMAE y aunque la disponibilidad de PET-CT en México es limitada, no es un estándar para el estudio de cáncer de mama en general1,4.
Biopsia de corte
Es sin duda el estudio estándar de oro para confirmación diagnóstica; es indispensable que sea método de corte, ya que el tejido obtenido es útil para el estudio de biomarcadores por inmunohistoquímica como: receptores hormonales para estrógeno y progesterona, HER2-neu (C-Erb-2), Ki-67 y p53 entre otros. Así mismo, este estudio proporciona información valiosa respecto a factores pronósticos como el grado de diferenciación y permeación vasculolinfática4,15. Aproximadamente, entre el 70 y 100% de los casos de CMAE corresponden al tipo histológico ductal grado III, en un 40-95% presentan invasión linfovascular y receptores hormonales para estrógeno y progesterona negativos2. Un 42% son positivos a HER2neu (un promedio considerablemente más alto que en el cáncer de mama no asociado a embarazo). Se sabe que todos estos factores patológicos están más determinados por la edad joven de las pacientes y no por el embarazo propiamente dicho1,15,16. A pesar de estas diferencias biológicas, la supervivencia global no cambia al comparar CMAE y en no embarazadas1,2.
Tratamiento
El estudio y tratamiento del CMAE debe ser siempre llevado por un grupo multidisciplinario y transdisciplinario con las especialidades básicas de la oncología: ginecooncología u oncología quirúrgica, oncología médica y oncología radioterapia, y en colaboración con médicos especializados en medicina maternofetal, anestesiología, radiología y neonatología. Previo a la aplicación de cualquier tipo de estudio o tratamiento, tanto la madre como el feto deben ser evaluados cuidadosamente por un médico obstetra con experiencia en embarazo de alto riesgo para determinar la edad gestacional, el crecimiento del feto, líquido amniótico, función placentaria y el estado de la madre (Figura 1)1-4.
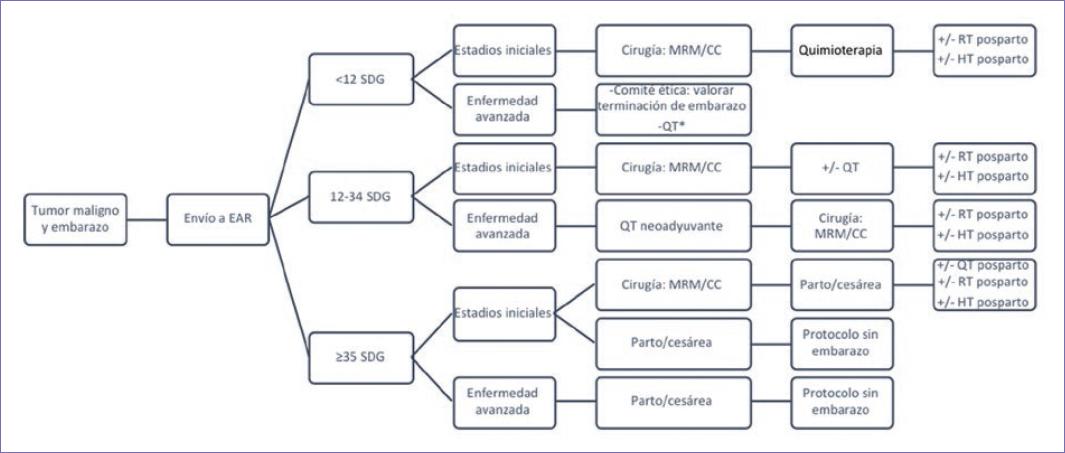
Figura 1 Algoritmo propuesto para el manejo de cáncer de mama y embarazo. *El tratamiento con quimioterapia antes de las 12 semanas de gestación no se recomienda, excepto en casos apremiantes por crisis viscerales que amenacen la vida de la madre, o en casos que se decida el término del embarazo como medida terapéutica. EAR: embarazo de alto riesgo; SDG: semanas de gestación; MRM: mastectomía radical modificada; CC: cirugía conservadora de mama; QT: quimioterapia; RT: radioterapia; HT: hormonoterapia. La decisión de parto o cesárea se realizará por el equipo de obstetricia. El protocolo sin embarazo se llevará a cabo de acuerdo con las normas vigentes del país.
Cirugía
Los lineamientos del tratamiento quirúrgico recomendado en CMAE son iguales en pacientes embarazadas que en pacientes no embarazadas y se pueden implementar en cualquier momento del embarazo1,2. Tanto la mastectomía como la cirugía conservadora de mama son opciones quirúrgicas con mínimo riesgo postoperatorio y su realización está basada en la etapa clínica, características biológicas, edad gestacional, estudio genético de BRCA cuando esté disponible y el deseo de la paciente. Debido a que la mayoría de los casos son cáncer de mama localmente avanzados, con frecuencia se inicia un tratamiento sistémico neoadyuvante con las ventajas conocidas que esta modalidad representa: respuesta patológica, bajo riesgo de metástasis y manejo quirúrgico conservador por disminución de tamaño tumoral y ganglionar. La cirugía puede ser realizada en cualquier momento durante el embarazo. No hay efectos deletéreos en el feto tras el alumbramiento. Aun así se recomienda realizar el procedimiento posterior al tercer trimestre para disminuir riesgos al feto. Deben ser considerados los cambios anatómicos y fisiológicos propios del embarazo: hipercoagulabilidad, retardo en el vaciamiento gástrico, aumento de volumen sanguíneo, capacidad cardiaca, disminución de la capacidad pulmonar residual y disminución de la actividad de colinesterasa, entre otros. Los riesgos de la cirugía en el segundo y tercer trimestre del embarazo son trabajo de parto prematuro y alumbramiento temprano. Es muy importante la participación puntual y precisa del equipo multidisciplinario (médico obstetra, cirujano, anestesiólogo, atención maternofetal y neonatólogo) y considerar el acceso a una unidad de cuidados intensivos, si es necesario. La cirugía puede planearse hasta después del alumbramiento, cuando sea posible. Se debe tener especial cuidado con el uso de narcóticos para control del dolor para no crear dependencia del recién nacido4,16,17.
La cirugía conservadora de mama ya no es una contraindicación absoluta durante el embarazo, siempre y cuando se elija apropiadamente a las pacientes para este tipo de procedimiento1-4. Kuerer, et al. han documentado la utilidad de la cirugía conservadora en CMAE en una serie de 22 pacientes en etapas clínicas I y II, encontrando que el PLE y SVG son similares al ser comparadas en pacientes no embarazadas18. Finalmente, en relación con la aplicación de la técnica de ganglio centinela, su uso debe ser individualizado. Aunque sea considerada como un procedimiento estándar durante el embarazo, algunos estudios avalan la seguridad del procedimiento con el uso de radiocoloide, la radiación emitida por este elemento es de 0.1-0.2 Gy, y al campo del abdomen y el feto solo alcanza 0.00045 Gy.; otros grupos recomiendan su uso solo después de la semana 30 de embarazo (National Comprehensive Cancer Network), sin embargo, el procedimiento debe ser discutido por el equipo multidisciplinario y la paciente4,19,20. No es recomendable el uso de azul patente por la alta posibilidad de reacciones anafilácticas en la madre, con posible repercusión en el feto.
PROCEDIMIENTO ANESTÉSICO
Aunque, en general, los procedimientos y fármacos utilizados por anestesiología son seguros, el uso de anestésicos en el manejo del CMAE involucra el binomio madre-feto. En la madre deben considerarse todos los cambios anatómicos y fisiológicos inducidos por el embarazo; en el feto, los riesgos son debidos a hipoxemia o asfixia por disminución del flujo uterino, hipotensión materna, hipoxia materna, depresión del sistema cardiovascular o del sistema nervioso. Otra consideración fetal es el efecto teratogénico de algunos fármacos en etapas tempranas del embarazo y en las etapas finales se corre el riesgo de alumbramiento pretérmino tanto por el procedimiento quirúrgico como por los anestésicos21. El equipo multidisciplinario oncológico en conjunto con el médico anestesiólogo, el médico obstetra y el neonatólogo deberán tener el cuidado y atención de cualquier complicación maternal (dolor, sangrado, fiebre, infección, trombosis, etc.) o fetal (hipoxia, hipotensión, hipoglucemia, etc.). Mazze y Kallen reportan cirugías en 5,406 mujeres embarazadas, encontraron que el riesgo de malformaciones fetales no es mayor que en 720,000 mujeres no embarazadas. En otra serie de 2,565 mujeres, Duncan, et al. demostraron que la incidencia de malformaciones fetales no es mayor en pacientes embarazadas que en pacientes no embarazadas que fueron operadas también1-4.
Radioterapia
El uso de radioterapia en la gran mayoría de los casos de CMAE no se hace indispensable, debido a que la cirugía y el tratamiento sistémico son las modalidades frecuentemente aplicadas en este periodo. En general la radioterapia no se recomienda durante el embarazo, y debe postergarse si está indicada, hasta después del alumbramiento1-4,10.
Tratamiento sistémico
QUIMIOTERAPIA
En la actualidad, hay suficientes datos que avalan el uso seguro de quimioterapia durante el embarazo, sin embargo, los efectos citotóxicos dependerán de la edad gestacional en que se aplique. Durante los 10 primeros días del embarazo (periodo de fertilización e implantación) se determina el desarrollo normal del embrión y en este periodo no se recomienda el uso de quimioterapia. Así mismo durante el periodo de organogénesis (embriogénesis) entre el octavo día y la décima semana de la concepción, no se debe utilizar quimioterapia debido al alto riesgo de teratogénesis. Durante el segundo y tercer trimestre del embarazo, cuando ocurren esencialmente el crecimiento y maduración fetal, es segura la aplicación de quimioterapia. Se debe tomar en cuenta que algunos autores han reportado restricción en el crecimiento, prematuridad y supresión hematopoyética1-3,22,23. Por protección al feto, la quimioterapia está estrictamente contraindicada hasta la décima semana del embarazo. Es recomendable un periodo de seguridad de 2 a 4 semanas más, pudiendo iniciar la aplicación de quimioterapia entre las semanas 12 y 1423.
Los lineamientos para la aplicación de quimioterapia en CMAE son iguales que para pacientes no embarazadas, dependen de la etapa clínica y características biológicas específicas del cáncer. En el plan integral del tratamiento deberá de considerarse el momento oportuno para la cirugía y la radioterapia. La aplicación de quimioterapia puede ser en plan adyuvante, neoadyuvante o paliativo, según corresponda el caso y etapa clínica de la enfermedad, siempre y cuando sea después del primer trimestre del embarazo. Pueden ser utilizados esquemas estándar como AC (adriamicina y ciclofosfamida), EC (epirubicina y ciclofosfamida), FAC (5-fluorouracilo, adriamicina y ciclofosfamida) y FEC (5-fluorouracilo, epirubicina y ciclofosfamida). Respecto al uso de taxanos (paclitaxel semanal o docetaxel cada 3 semanas), estos medicamentos que son base del tratamiento del cáncer de mama, a pesar de que su uso es relativamente seguro durante el embarazo, deben ser usados con precaución, preferentemente hay que usarlos si no fuera posible el uso de antraciclinas; en 20 casos de mujeres embarazadas expuestas a taxanos no se documentaron malformaciones congénitas, solo un caso presentó estenosis pilórica, pero la exposición fue a múltiples citotóxicos y otros medicamentos1,2,24. Es posible usar dosis densas de quimioterapia si así se considera25,26. Otros medicamentos activos contra el cáncer de mama podrían ser utilizados con cuidado durante el segundo y tercer trimestre del embarazo, como los platinos (cisplatino y carboplatino), otros antimetabolitos (capecitabina y gemcitabina), y vinorelbina, entre otros, ya que se tiene menos experiencia durante el embarazo1-3. Algunos autores resaltan la importancia que tienen los cambios farmacocinéticos de los medicamentos durante el embarazo, entre otros, cambios en el incremento del sistema hematopoyético, aumento en la tasa de filtración glomerular, cambios hormonales y en la funcionalidad hepática27. Para variedades especiales como es el cáncer inflamatorio, se sabe que la respuesta clínica es igual que en pacientes no embarazadas, pero no hay analizados gran número de casos en este contexto28. Las dosis de quimioterapia deben calcularse de la misma manera que en pacientes no embarazadas, basadas en la superficie corporal total por metro cuadrado. Son pocos los reportes del paso de medicamentos citotóxicos a través de la barrera placentaria1,2,29,30.
Respecto al crecimiento y desarrollo de los hijos de madres a quienes se les aplicó quimioterapia durante el embarazo, son muy escasos. Se conoce un poco más en hijos de mujeres con neoplasias hematológicas que recibieron quimioterapia (con antraciclinas) durante el embarazo. Un reporte de 84 hijos con un seguimiento a 19 años muestra que no hay anormalidades congénitas, neurológicas, inmunológicas, psicológicas o de otra índole, sin embargo, los métodos de análisis de este estudio no se explican en detalle31. Actualmente, en un seguimiento ecocardiográfico en 81 niños que nacieron de madres que recibieron antraciclinas, con una media de 17 años de edad, no se encontraron anormalidades32.
TRATAMIENTO HORMONAL
No están recomendados durante el embarazo ni tamoxifeno ni inhibidores de la aromatasa. El tamoxifeno se asocia hasta en un 20% a malformaciones congénitas como genitales ambiguos, malformaciones craneofaciales, sangrado vaginal, aborto espontáneo y muerte fetal, entre otros1-3,33,34. Respecto a nuevos medicamentos anti-CD 4/6 como el palbociclib, el ribociclib y el abemaciclib, no se tiene experiencia de su uso durante el embarazo, por lo que no recomendamos su utilización durante este periodo1.
BIFOSFONATOS
Los bifosfonatos, particularmente el ácido zoledrónico, en combinación con tratamiento hormonal, son altamente efectivos en el tratamiento de las metástasis de hueso por cáncer de mama35. Estos medicamentos no han sido aprobados para su uso durante el embarazo. Su uso durante el embarazo en animales han causado toxicidad maternal, subdesarrollo en fetos, hipocalcemia, retardo en la madurez esquelética y muerte fetal. Hay reportes de que en mujeres con cáncer sin saberse embarazadas que recibieron bifosfonatos no se encontraron malformaciones. Aun así no se recomienda su uso en pacientes embarazadas1-3.
TERAPIA BIOLÓGICA
El uso de terapias anti-HER2/neu (trastuzumab, pertuzumab y trastuzumab emtansina) está contraindicada durante todo el embarazo35. El trastuzumab es el fármaco más estudiado y más utilizado en pacientes embarazadas con cáncer de mama HER2+. Se debe considerar que el HER2 se expresa fuertemente en el epitelio renal fetal y su uso en el embarazo se puede asociar a oligohidramnios, hipoplasia pulmonar, anormalidades esqueléticas, insuficiencia renal y muerte neonatal38. En 15 casos de fetos expuestos a trastuzumab, 3 de ellos presentaron insuficiencia renal y 4 más fallecieron39. Los agentes antiangiogénicos como el bevacizumab y los inhibidores de tirosina cinasa (como el lapatinib) no deben ser utilizados en mujeres embarazadas debido a que no se tiene información suficiente1-4.
MEDICAMENTOS DE SOPORTE
Los factores estimulantes de colonias de granulocitos pueden ser utilizados con seguridad durante el embarazo40,41. El uso de antagonistas 5-HT3 como ondansetrón, palonosetrón y granisetrón durante el embarazo representa bajo riesgo. No hay datos maduros respecto a inhibidores de neurocininas como aprepitant y fosaprepitant, por lo que se debe tener precaución en su uso42,43. Otros medicamentos de uso común, como esteroides, antihistamínicos y bloqueadores H2, son de uso seguro44,45.
Pronóstico
Más del 50% de los casos de CMAE se diagnostican en etapas localmente avanzadas y avanzadas, lo que empobrece considerablemente las posibilidades de curación; la minoría son diagnosticados en etapas tempranas. Es conocido que el pronóstico es dependiente de la edad, etapa clínica y características biológicas de la enfermedad y no por el embarazo per se. Biológicamente, la evolución del embarazo no se ve afectada por el cáncer1-3,46.
Cuidado prenatal
Como se ha expuesto antes, es muy importante que médicos especialistas en obstetricia y neonatología formen parte del equipo multidisciplinario a cargo del estudio y el tratamiento. Preferentemente la madre debe ser vigilada en una clínica de embarazo de alto riesgo con el objetivo de terminar el embarazo después de la semana 37 de gestación. Es importante no aplicar quimioterapia 3 semanas antes del alumbramiento y tener todo el cuidado de prevenir complicaciones hematológicas como neutropenia, trombocitopenia, anemia, etc., así como tomar toda medida para evitar complicaciones como infecciones y hemorragias, entre otras, tanto en la madre como en el recién nacido. Posterior al alumbramiento, procede el uso de radioterapia si hay indicación clínica y es posible el uso de terapia biológica con anticuerpos monoclonales, así como terapia hormonal. No se debe dar lactancia a los recién nacidos de madres que recibieron quimioterapia durante el embarazo o que la reciben después del alumbramiento4,24,46.
Conclusiones
El tratamiento adecuado del CMAE es altamente posible. La atención deberá ser otorgada por un equipo multidisciplinario que incluya oncología en sus diversas disciplinas, anestesiólogo, radiólogo, obstetra y pediatra neonatólogo. La paciente y su familia siempre deben ser cuidadosamente informados del diagnóstico. Los objetivos del tratamiento son con la intención de preservar al máximo posible la salud del binomio madre-hijo, así como el pronóstico. La madre y el esposo deberán formar parte de la decisión del tratamiento a seguir.
En nuestro medio, debemos seguir acumulando experiencia en el conocimiento de aspectos biológicos básicos y clínicos que nos permitan mejorar la atención del cáncer de mama y embarazo.
Los esfuerzos deben seguir para mejorar los sistemas de registro de estos casos en nuestro país, para poder establecer mejores estrategias de atención.











 nueva página del texto (beta)
nueva página del texto (beta)


