Glosario de términos
| Adherencia | La manera en la que el paciente sigue las recomendaciones de su médico. |
| Ajuste | Procedimiento estadístico en el cual se minimiza el efecto de las diferencias en las características (valores de variables) de la población en estudio. |
| Aleatorización | Consiste en asignar aleatoriamente (al azar) a los participantes en un ensayo a dos o más grupos de tratamiento o de control. La aleatorización es una de las formas de evitar los sesgos de selección; su propósito es posibilitar las comparaciones en los grupos de asignación de los tratamientos. |
| Algoritmos | Diagramas de flujo que se utilizan en la toma de decisiones clínicas para apoyar la incorporación de las recomendaciones a la práctica cotidiana. |
| Aplicabilidad | El grado en el que las recomendaciones contenidas en una guía de práctica clínica (GPC) o un documento de consenso puedan ser incorporadas a un escenario clínico en particular. |
| Appraisal of Guidelines, Research and Evaluation (AGREE) | Colaboración internacional de investigadores con el objetivo de mejorar la calidad de las GPC. El instrumento AGREE fue diseñado para evaluar la calidad de las GPC (http://www.agreecollaboration.org). |
| Asociación | Relación estadística entre dos o más eventos, características u otras variables. La relación puede ser o no causal. |
| Análisis de intención de tratar (ITT, Intention-to-treat) | Forma de análisis estadístico de los resultados que incluye a todos los pacientes que han sido inicialmente asignados a cada grupo de tratamiento independientemente de que completaran el protocolo en su totalidad. |
| Calidad de vida relacionada con la salud (HRQL, Health-related quality of life) | La percepción que la persona tiene del impacto que ha provocado la enfermedad o su tratamiento sobre su sentimiento de bienestar y la capacidad de actuación (funcionalidad). Estas dimensiones básicas deben ser analizadas en los dominios físico, emocional y social. |
| Cáncer de tiroides | Cáncer que se forma en la glándula tiroidea (un órgano ubicado en la base de la garganta que produce hormonas que ayudan a controlar la frecuencia cardíaca, la presión arterial, la temperatura del cuerpo y el peso). Los cuatro tipos más importantes de cáncer de tiroides son el papilar, el folicular, el medular y el anaplásico. Los cuatro tipos se determinan según el aspecto de las células al microscopio. |
| Estudio de casos y controles | Estudio observacional en donde el investigador selecciona a los individuos que han experimentado algún evento de interés y otros que no lo han presentado, para después evaluar si fueron expuestos a una posible causa. |
| Cegamiento | Las manera en la que los investigadores, el equipo de investigación o los participantes del estudio evitaron conocer la manera en la que las intervenciones fueron asignadas durante el estudio de investigación. |
| Comorbilidad | Coexistencia de dos o más condiciones patológicas o enfermedades en un mismo individuo. |
| Crisis visceral | Disfunción orgánica severa evaluada por datos clínicos y de laboratorio, con rápida progresión de la enfermedad. No solo implica la extensión metastásica, sino que además corresponde a una falla severa de la función. |
| Desenlace | Medición de los posibles resultados relevantes para considerar mejoría del padecimiento con la exposición a la intervención terapéutica. |
| Efectividad | La efectividad clínica es una medición del beneficio positivo de un tratamiento concreto en la práctica médica. |
| Efecto absoluto | La diferencia en el riesgo de la ocurrencia de algún evento entre dos grupos (uno en relación con el otro) en un estudio comparativo. |
| Eficacia | La eficacia clínica es una medición del resultado positivo de un tratamiento concreto en el contexto de un estudio de investigación controlado. |
| Estado basal | El conjunto de características y variables al inicio del estudio y con los que los resultados subsecuentes serán comparados. |
| Estándar de referencia | La prueba diagnóstica más cercana a la veracidad del fenómeno en estudio de la que se puede disponer en un momento determinado y que será utilizada para comparar con las características de la prueba diagnóstica que se desea evaluar. |
| Estudio de cohorte | Estudio prospectivo o retrospectivo. Un grupo de individuos que comparten características y que se definen por su exposición o no exposición a un factor de riesgo. |
| Estudio clínico controlado | Se trata de un experimento o estudio en el que el investigador «manipula» uno o más factores de estudio (por ejemplo, deciden qué tratamiento, con qué pauta y durante cuánto tiempo lo recibirán los sujetos de cada uno de los grupos de estudio) con objeto de valorar posteriormente los efectos producidos (o respuesta, resultado, variable dependiente) basándose en un plan preestablecido. Su objetivo es evaluar la eficacia y seguridad de cualquier intervención, ya sea preventiva, curativa o rehabilitadora, y es el diseño que proporciona la evidencia de mayor calidad acerca de la relación causal entre una intervención y el efecto observado. |
| Equitativo | Distribución justa de beneficios o recursos. |
| Evidencia | El cúmulo de información en la que una decisión clínica se sustenta. Se obtiene de fuentes que incluyen estudios clínicos controlados, estudios observacionales, estudios de prueba diagnóstica, revisiones sistemáticas y consensos de expertos. |
| Ganglio centinela | El ganglio centinela es el primer ganglio linfático que encuentran las células tumorales al intentar diseminarse por medio de la linfa. |
| Grupo control | En un ensayo clínico, el grupo de participantes que no reciben la intervención experimental objeto de estudio. El grupo testigo puede recibir una intervención que se considera eficaz (normal) o un placebo o no recibir ninguna. Los resultados del grupo testigo se comparan con los del grupo experimental para determinar si hay diferencias estadísticas. |
| Heterogeneidad | En el metaanálisis la heterogeneidad se refiere a la variabilidad o a las diferencias en las estimaciones de los efectos entre los estudios. En ocasiones se distingue entre la «heterogeneidad estadística» (diferencias en los efectos declarados) y la «heterogeneidad metodológica» (diferencias en el diseño de estudios). |
| Homogeneidad | La noción de homogeneidad define a la igualdad mayor o menor de los valores de una variable o de una combinación de características en un conjunto geográfico. Los parámetros de dispersión estadística, en particular la varianza, miden su inversa, la heterogeneidad. |
| Intervalo de confianza (CI) | Un intervalo de confianza es un rango de valores, derivado de los estadísticos de la muestra, que posiblemente incluya el valor de un parámetro de población desconocido. Debido a su naturaleza aleatoria, es poco probable que dos muestras de una población en particular produzcan intervalos de confianza idénticos. |
| Intervención | Acción terapéutica o de algún otro tipo que modifica el estado basal del paciente. |
| Tiroidectomía | Cirugía para extirpar toda la tiroides (total) o parte de ella (parcial). |
| Médico clínico | Médico que se encarga se proveer atención clínica. |
| Metástasis | Cuando ocurre una metástasis, las células cancerosas se separan del tumor original (primario), viajan por el sistema sanguíneo o linfático y forman un tumor nuevo en otros órganos o tejidos del cuerpo. El nuevo tumor metastásico es el mismo tipo de cáncer que el tumor primario. |
| Metaanálisis | El metaanálisis es un conjunto de herramientas estadísticas que son útiles para sintetizar los datos de una colección de estudios. El metaanálisis se inicia recopilando estimaciones de un cierto efecto (expresado en un índice de tamaño del efecto, como la diferencia de medias tipificada, la razón de riesgo o la correlación) de cada estudio. El metaanálisis permite valorar estos efectos en contexto: si el tamaño del efecto es consistente, el efecto del tratamiento puede ser considerado como fuerte y el tamaño del efecto se estima con mayor precisión que con un solo estudio. Si el tamaño del efecto varía, esa variación puede ser descrita y, potencialmente, explicada. |
| Método de consenso | Cuando hablamos de consenso nos referimos a la toma de decisiones en común acuerdo por parte de todos los miembros de un grupo y no por la mayoría o por una representatividad. Lo que caracteriza al consenso es el proceso por el que el grupo ha de pasar para llegar a un acuerdo. El método de consenso es deseable cuando es improbable forzar el cumplimiento de la decisión, igual como si cada participante adoptara independientemente una misma decisión unánime. Por ello algunos grupos reservan el método de decisión por consenso para decisiones particularmente complejas, arriesgadas o importantes. |
| Número necesario que tratar (NNT, Number Needed to Treat) | El número (de pacientes) que es necesario tratar o NNT (también conocido por los calcos «número necesario a tratar» y «número necesario para tratar») es el recíproco de la reducción del riesgo absoluto; es un valor o indicador específico para cada tratamiento. |
| Placebo | Sustancia que carece de acción curativa, pero produce un efecto terapéutico si el enfermo la toma convencido de que es un medicamento realmente eficaz; tiene el mismo aspecto, gusto y forma que un medicamento verdadero, pero está hecho de productos inertes y sin ningún principio activo. |
| P values | El valor de p (a veces conocido simplemente como el p-valor, la p, valor de p consignado, o bien directamente en inglés p-value) se define como la probabilidad de obtener un resultado al menos tan extremo como el que realmente se ha obtenido (valor del estadístico calculado), suponiendo que la hipótesis nula es cierta, en términos de probabilidad condicional. |
| Pregunta clínica | Se refiere a la pregunta identificada por el grupo de expertos en donde se ha detectado la necesidad de dar directrices dentro de la guía de práctica clínica y que debe de tener una estructura. |
| Posología | Determinación de las dosis en que deben administrarse los medicamentos. |
| Pronóstico | El pronóstico, generalmente de una enfermedad, es el conjunto de datos que posee la ciencia médica sobre la probabilidad de que ocurran determinadas situaciones en el transcurso del tiempo o historia natural de la enfermedad. Es la predicción de los sucesos que ocurrirán en el desarrollo de una enfermedad en términos estadísticos. Es un tipo de juicio clínico. |
| Quimioterapia | Tratamiento con medicamentos para detener el crecimiento de las células cancerosas, ya sea mediante su destrucción o impidiendo su multiplicación. La quimioterapia se puede administrar por la boca (vía oral), en inyección (intramuscular, intravenosa o subcutánea), por infusión o sobre la piel, de acuerdo con el tipo y estadio del cáncer tratado. Se puede administrar sola o con otros tratamientos, como cirugía, radioterapia o terapia biológica. |
| Radioterapia | La radiación puede venir de una máquina fuera del cuerpo (radioterapia de haz externo) o de un material radiactivo colocado en el cuerpo cerca de las células cancerosas (radioterapia interna o braquiterapia). La radioterapia sistémica usa una sustancia radiactiva, como un anticuerpo monoclonal radiomarcado. |
| Razón de momios (OR, Odds Ratio) | La razón de momios (OR, odds ratio), razón de oportunidades o razón de probabilidades es una medida estadística utilizada en estudios epidemiológicos transversales y de casos y controles, así como en los metaanálisis. En términos formales, se define como la posibilidad de que una condición de salud o enfermedad se presente en un grupo de población frente al riesgo de que ocurra en otro. En epidemiología, la comparación suele realizarse entre grupos humanos que presentan condiciones de vida similares, con la diferencia de que uno se encuentra expuesto a un factor de riesgo mientras que el otro carece de esta característica. Por lo tanto, la OR es una medida de tamaño de efecto. |
| Resumen | Conjunto de datos denominado «Resumen» de un estudio, que pudo haber sido publicado solo o con el trabajo en extenso. |
| Revisión cochrane | Una revisión sistemática de la literatura de estudios clínicos controlados que responde una pregunta clínica mediante un protocolo explícito y que fue producido por el grupo colaborativo Cochrane. Disponible en la Biblioteca Cochrane. |
| Revisión sistemática | Las revisiones sistemáticas son artículos científicos integrativos ampliamente usados en disciplinas del área de la salud que siguen un método explícito para resumir la información que se conoce acerca de un determinado tema o problema de salud. Revisan y pueden combinar principalmente ensayos clínicos controlados, que son los estudios primarios. Se distinguen de las revisiones narrativas en que provienen de una pregunta estructurada y de un protocolo de investigación previo. La Colaboración Cochrane es la principal organización que produce y financia revisiones sistemáticas. Además, la búsqueda de la evidencia se ha desarrollado de manera sistemática con una declaración de los criterios de selección y se ha hecho una evaluación crítica de los artículos primarios y una síntesis basada en la calidad metodológica de los estudios. Cuando una revisión sistemática termina de manera cuantitativa, en un estimador estadístico, se denomina metaanálisis. |
| Riesgos | Los eventos adversos de una intervención. |
| Riesgo relativo | El riesgo relativo (RR) es una medida relativa del efecto porque indica cuánto más veces tiende a desarrollar el evento el grupo de sujetos expuestos al factor de exposición o factor de riesgo en relación con el grupo no expuesto. El RR no tiene dimensiones, es una razón. |
| Serie de casos | Reporte de un número de casos de un padecimiento en particular, en donde se describe la evolución del padecimiento y la respuesta al tratamiento. |
| Sesgo | Una desviación sistemática de la verdad en los resultados del estudio que es causada por la manera en la que este fue diseñado o conducido. |
| Variables confusoras | Las variables de confusión, también llamadas terceras variables, son variables que el investigador no controló o no eliminó y que dañan la validez interna de un estudio de investigación. |
Introducción
El carcinoma de la glándula tiroides es una enfermedad fascinante y controvertida. En el año 2012 en México se presentaron 3,036 casos, 725 en varones y 2,311 en mujeres, constituyendo el 2.5% de las neoplasias malignas, para una tasa de incidencia ajustada por edad de 2.6 por 100,000 habitantes-año; en tanto que la tasa de mortalidad fue de 0.6 por 100,000 habitantes-año1. Aunque es una neoplasia relativamente rara, su incidencia crece rápidamente, pero la mortalidad permanece constante, lo que sugiere que el uso indiscriminado de estudios de imagen lleva al diagnóstico de lesiones clínicamente irrelevantes porque nunca progresarán.
La mayoría de los carcinomas se presentan como nódulos tiroideos (NT), pero solo uno de cada 20 NT finalmente resulta ser un carcinoma. Esto hace del NT un problema clínico importante, porque resulta imprescindible distinguir preoperatoriamente a los nódulos con probabilidad de malignidad de los benignos, ya que solo los primeros requieren cirugía. Por otra parte, el carcinoma de tiroides con frecuencia es sobretratado, lo que lleva a morbilidad y costos injustificados.
El cáncer de tiroides, específicamente el carcinoma papilar (CP), el carcinoma folicular (CF), el carcinoma poco diferenciado y el carcinoma anaplásico derivan de las células foliculares, mientras que de las células parafoliculares o células C surge el carcinoma medular, aunque la glándula también origina linfomas primarios y ocasionalmente aloja enfermedad metastásica.
El cáncer diferenciado de tiroides (CDT) que incluye al CP y CF y representa el 90% de las neoplasias malignas del tiroides. Suele comportarse como una enfermedad indolente y ello propicia controversias en su tratamiento, ya que da al médico una falsa seguridad de que proporcionó un tratamiento correcto debido a los buenos resultados a corto plazo, pero el curso clínico prolongado de la enfermedad hace que los resultados deban ser evaluados a largo plazo y dificulta la investigación clínica bien diseñada.
En el CDT la cirugía es el pilar del tratamiento, pero la extensión idónea aún es motivo de discusión, como lo son las indicaciones y características del tratamiento adyuvante con yodo radioactivo (131I) y levotiroxina (LT4). Además, recientemente se han agregado al armamentario terapéutico del CDT fármacos que contribuyen a la seguridad y bienestar del paciente, como la tirotropina sérica recombinante humana (rhTSH) y los inhibidores de cinasas de tirosina (ICT), lo que ha agregado complejidad a las decisiones terapéuticas.
Debido a su frecuencia e importancia clínica, esta guía se enfoca en el tratamiento del cáncer diferenciado. Se busca orientar al médico tratante en el manejo diagnóstico y tratamiento correcto con base en la mejor evidencia disponible, aunque no desplaza la necesidad de experiencia y un buen juicio clínico.
Medicina basada en evidencia y los objetivos de la guía
La medicina basada en la evidencia se define como el «uso juicioso, explícito y concienzudo de la mejor evidencia científica disponible, aunado con la mejor experiencia clínica, los valores y preferencias de los pacientes y considerando los costos para el mejor cuidado de los pacientes»2. La toma de decisiones clínicas lleva un proceso de aprendizaje e integración del conocimiento que requiere de tiempo y que se va perfeccionando progresivamente hasta obtener las habilidades diagnósticas y terapéuticas para un mejor cuidado de los pacientes2-4. La medicina basada en la evidencia, sin duda, requiere de herramientas que faciliten la incorporación de todo el conocimiento científico que va surgiendo a la toma de decisiones clínicas en nuestros pacientes4. Las revisiones sistemáticas (RS) de la literatura contienen protocolos de investigación explícitos, rigurosos y exhaustivos para identificar y evaluar de forma crítica, así como sintetizar, los estudios relevantes5. Después de casi cuatro décadas de desarrollar una metodología que persigue la disminución de sesgo en las conclusiones, las RS de la literatura se han convertido en la piedra angular de la medicina basada en la evidencia2,5 (Fig. 1).

Figura 1 Ciclo de vida de las guías de práctica clínica. Las etapas de desarrollo, diseminación, implementación y de evaluación del impacto de la implementación de las guías de práctica clínica en los distintos escenarios clínicos constituyen su ciclo de vida. Adaptada de José Luis Mayorga-Butrón, Liliana Velasco-Hidalgo, Francisco Javier Ochoa-Carrillo. Guías de práctica clínica basadas en evidencia, cerrando la brecha entre el conocimiento científico y la toma de decisiones clínicas. Documento de la serie MBE, 3 de 3. GAMO, 2015;14(6):329-34.
Al inicio de la década de 1990 se da un impulso clave a otro instrumento que se situará como pieza clave en la medicina basada en la evidencia, las guías de práctica clínica (GPC) basadas en evidencia6-8. El reporte del Instituto Nacional de Medicina de Estados Unidos de Norteamérica (IOM, por sus siglas en inglés) define a las GPC como «recomendaciones desarrolladas sistemáticamente para asistir a los clínicos y a los pacientes en su toma de decisiones para una mejor calidad en la atención de la salud en condiciones específicas». Los objetivos primordiales de las GPC son cerrar la brecha entre el conocimiento científico y la toma de decisiones por parte de profesionales de la salud y pacientes, apoyar en los procesos de educación médica, auxiliar a los desarrolladores de políticas públicas y administradores para hacer más eficiente el uso de recursos y decidir sobre las tecnologías en salud más rentables9-11 (Fig. 2).
Las GPC requieren un protocolo bien establecido para su desarrollo. Precisan además que a la mejor evidencia disponible se le incorpore la mejor experiencia clínica pero también los puntos de vista de los usuarios finales, entre los que se deben de contemplar los pacientes y sus cuidadores, los administrativos, los médicos familiares y los realizadores de políticas en salud, así como cualquier organización que se desarrolle en el campo de la atención médica11-13.
La clasificación de la evidencia científica se llevó a cabo tomando en cuenta la clasificación desarrollada por la Red Colegiada para el Desarrollo de Guías de Escocia (SIGN, por sus siglas en inglés) (Tabla 1). En ella se otorga el nivel más alto de evidencia a las RS de estudios controlados (ECA) con muy bajo riesgo de sesgo, y así va disminuyendo la calidad de la evidencia, pasando por ECA con alto riesgo de sesgo, estudios de cohortes, casos y controles, hasta llegar a los estudios no analíticos, como las series de casos y los reportes de casos, y en el nivel inferior de la evidencia la opinión de los expertos14.
Tabla 1 Clasificación del nivel de la evidencia y de los grados de recomendación de acuerdo con la Scottish Intercollegiate Guidelines Network (SIGN), 2001
| Niveles de evidencia | Grados de recomendación |
|---|---|
|
1++ Revisiones sistemáticas con
metaanálisis de ECA, o ECA con muy bajo riesgo de
sesgo 1+ Revisiones sistemáticas de la literatura con metaanálisis de ECA, o ECA con bajo riesgo de sesgo 1- Revisiones sistemáticas de la literatura con metaanálisis de ECA, o ECA con alto riesgo de sesgo |
A Al menos una revisión sistemática con metaanálisis, o un ECA clasificado como 1++ y que sea directamente aplicable a la población o una revisión sistemática de ECA o evidencia que consistiera en estudios clasificados como 1 + aplicables directamente a la población objetivo y que demuestren resultados consistentes |
| 2++ Revisiones sistemáticas de alta calidad de estudios de cohortes o casos y controles con muy bajo riesgo de sesgo, de variable confusoras, o una alta probabilidad de que la asociación sea causal | B Evidencia que incluye estudios clasificados como 2++ y que sean directamente aplicables a la población objetivo y que demuestren resultados consistentes o evidencia extrapolada de estudios clasificados como 1++ o 1+ |
| 2+ Estudios de casos y controles bien diseñados con un riesgo bajo de sesgo, de variable confusoras, o una probabilidad moderada de que la asociación sea causal |
C Evidencia que incluye
estudios clasificados como 2 + y que sean directamente aplicables a
la población objetivo y que demuestren resultados consistentes o
evidencia extrapolada de estudios clasificados como
2++ D Evidencia nivel 3 o 4 o evidencia extrapolada y clasificada como 2+ |
| 2- Estudios de casos y controles con un riesgo alto de sesgo, de variable confusoras, o riesgo significativo de que la asociación no sea causal | |
| 3 Estudios no analíticos, (p. ej., series de casos, reportes de casos) | |
| 4 Opinión de expertos |
ECA: Estudios clínicos aleatorios Adaptada de Harbour, et al., 200114
Los objetivos de esta GPC para el tratamiento del cáncer de tiroides se enfocaron en brindar recomendaciones basadas en evidencia para el tratamiento quirúrgico, médico y radiológico de todas las fases de la enfermedad con la intención de brindar más herramientas a los clínicos y de esta forma mejorar los desenlaces de los pacientes que padecen esta enfermedad tan prevalente en el mundo.
Material y methods
Grupo de desarrollo de la guía
El grupo de desarrollo de la guía (GDG) se integró de forma interdisciplinaria compuesto por expertos clínicos en oncología médica, cirugía oncológica y radiooncología representantes de la Sociedad Mexicana de Oncología. También se incluyeron expertos metodológicos con experiencia en el desarrollo de RS de la literatura y GPC. Un grupo base (core group) se reunió en múltiples ocasiones para definir el modo de trabajo, los tiempos y la distribución de las responsabilidades, así como los aspectos importantes en la definición de alcances generales de la GPC y la lista de preguntas clínicas estructuradas.
Definición de alcances
El GDG llevó a cabo la definición de los alcances generales de la GPC, en donde se acordaron las características de la población incluida a tratar, así como también las características de la población que no se incluirá en el documento. El documento de alcances provee el marco general en el cual el trabajo de desarrollo de la GPC se condujo. Describe brevemente los aspectos generales de la enfermedad y define los aspectos clínicos que cubre la GPC, así como los aspectos que no serán cubiertos por esta. De igual forma, el documento de alcances describe a la audiencia blanco que se considera de interés para la GPC y a la cual se dirigen las recomendaciones clínicas (Anexo A).
Los aspectos más importantes del documento de alcances se enumeran a continuación:
La características de la población incluida.
La definición de la población no cubierta por la GPC.
El escenario o escenarios clínicos en los cuales se planea que las recomendaciones de la GPC serán implementadas.
Los diferentes tipos de aspectos clínicos evaluados durante el desarrollo de la GPC y en los cuales se contemplan pruebas diagnósticas, intervenciones médicas e intervenciones quirúrgicas, entre otros.
Información específica para los usuarios
Los desenlaces clínicos considerados para evaluar las distintas intervenciones terapéuticas y diagnósticas.
Los aspectos en los cuales la GPC se espera que contribuirá al tratamiento de la enfermedad.
Preguntas clínicas estructuradas
El GDG, una vez que acordó el contenido del documento de alcances, prosiguió a desarrollar la lista de preguntas clínicas estructuradas.
El objetivo de esta fase fue el de elaborar el listado completo de preguntas clínicas que desarrollen el tema para aborda la guía. La respuesta a estas preguntas originó recomendaciones para los usuarios de la GPC. Se aseguró que las preguntas clínicas abordaran brechas en el conocimiento y temas clínicos relevantes según los miembros del GDG. Todos los problemas clínicos definidos en el alcance de la guía se vieron reflejados en esta etapa mediante las preguntas clínicas, para garantizar así que la GPC se desarrolló conforme a los objetivos planteados. Se trató, por tanto, de que las preguntas clínicas sean claras, precisas y específicas para facilitar la búsqueda y la revisión de la evidencia científica, y así evitar recomendaciones poco ajustadas a los problemas clínicos que plantea la GPC (Anexo B).
El listado de preguntas contempló la población, las intervenciones y los comparadores estipulados en el documento de alcances. El GDG evitó introducir aspectos nuevos que no estaban incluidos en el alcance de la guía.
Se consideró el esquema (problem, intervention, comparation, outcome) PICO y de acuerdo con este se tomaron en cuenta los siguientes componentes:
Paciente: grupos de edad, estadio de la enfermedad, comorbilidad, etc.
Intervención: intervención, factor pronóstico, agente etiológico, prueba diagnóstica, tratamiento habitual o placebo, ausencia de un factor de riesgo, ausencia de agente etiológico, patrón oro o de referencia de una prueba diagnóstica, etc.
Comparación: se refiere a la alternativa a la intervención a estudio, tales como tratamiento habitual o placebo, ausencia de un factor de riesgo, ausencia de agente etiológico, patrón oro o de referencia de una prueba diagnóstica, etc.
Desenlaces (outcomes): variables de resultado clínicamente importantes en el caso de estudios sobre eficacia, pronóstico o etiología, y estimadores de rendimiento o validez.
Búsqueda exhaustiva de la evidencia científica
La evidencia fue identificada siguiendo algoritmos y estrategias validadas internacionalmente. Se identificaron y emplearon términos MeSH (Medical Subject Headings) para de esta forma ensamblar una estrategia de búsqueda sensible y específica, además de explícita para que sea reproducible en un futuro5. De acuerdo con la naturaleza de la pregunta clínica a responder se estableció el tipo de estudio que fuera más fiable para contestarla y, partiendo de ahí, otros tipos de estudio que pudieran responderla aunque con menos confianza en los resultados, siguiendo los modelos de clasificación de la evidencia. Entre estos criterios se consideraron las variables de desenlaces importantes para clínicos y pacientes, y el diseño de estudio más adecuado en función de la pregunta que se debe responder (Anexo C).
La búsqueda se llevó a cabo a partir de las preguntas clínicas estructuradas. La revisión bibliográfica preliminar incluyó la localización de GPC relevantes que ya existen sobre el mismo tema. Esto permitió facilitar el ensamblaje del documento de alcances y la identificación de preguntas clínicas relevantes sobre el tema. Además, esto nos ayudó en la identificación, la evaluación y la síntesis de la evidencia científica.
Las RS juegan un papel crucial en el proceso de elaboración de una GPC. Los estándares internacionales actuales proponen la utilización de las RS como herramientas indispensables para la localización y selección de la evidencia científica que alimente las recomendaciones clínicas. El tipo de estudio clínico más adecuado para responder una pregunta clínica y a partir de ahí llegar a una conclusión y formular recomendaciones clínicas dependerá del tipo de pregunta clínica (Anexo C).
Una vez que los elementos de la búsqueda y selección fueron claramente definidos, se seleccionaron las bases de datos en función del tipo de publicación que se quería buscar y el tema objeto de cada pregunta clínica. Para el resto de las publicaciones (RS o estudios originales), las bases de datos bibliográficas son las herramientas idóneas para recuperar información, al agrupar conjuntos de referencias de documentos almacenadas electrónicamente que se pueden buscar y seleccionar de manera interactiva mediante un lenguaje de consulta o interrogación.
Las bases de datos que recopilan GPC fueron consultadas usando los términos MeSH. Las distintas bases de datos que fueron consultadas para localizar las distintas GPC publicadas y relevantes para nuestra GPC se enumeran a continuación:
Organismos recopiladores. El más completo es el NGC (National Guideline Clearinghouse, Centro Nacional de Guías de EE.UU.), de cobertura internacional, perteneciente a la AHRQ (Agency for Health Research and Quality, Agencia para la investigación y la calidad en salud). En el Reino Unido destaca el NeLH (Guidelines Finder National Electronic Library for Health, Localizador de Guías de la Biblioteca Electrónica Nacional de Salud del Reino Unido). El catálogo de guías realizadas en España se recoge en Guiasalud. La base de datos Trip Database es un motor de búsqueda útil que ofrece una idea rápida del volumen de GPC existentes. Se consultaron también las bases de datos de las principales sociedades y academias del área de especialidad a nivel internacional en búsqueda de GPC publicadas.
Organismos elaboradores: como el NICE (National Institute for Clinical Excellence, Instituto Nacional para la Excelencia Clínica del Reino Unido), el SIGN (Scottish Intercollegiate Guidelines Network, Red Escocesa Intercolegiada sobre GPC), el ICSI (Institute for Clinical System Improvement, Instituto para la mejora de los sistemas clínicos) en EE.UU., el Consejo Nacional Australiano de Salud e Investigación Médica (National Health and Medical Research Council) de Australia o el NZGG (New Zealand Guidelines Group, Grupo sobre Guías de Nueva Zelanda).
Centros de metodología. Destacan por su interés el GIN (Guideline International Network, Red Internacional de Guías), la colaboración AGREE (Appraisal of Guidelines, Research and Evaluation) y el GRADE Working Group como grupo de trabajo que desarrolla el sistema emergente GRADE: bases de datos generales. En bases como Medline se indexan también GPC y existen filtros que se pueden aplicar en las búsquedas. No obstante, no es la forma más eficiente de localizarlas.
Para la búsqueda exhaustiva de RS se ensamblaron distintas estrategias de búsquedas y se utilizaron distintas bases de datos generales y especializadas en RS. Se emplearon estrategias de búsquedas publicadas y validadas que hayan demostrado ser sensibles y específicas, así como los términos MeSH.
Las bases de datos consultadas para identificar RS se enumeran a continuación: Cochrane Library (contiene RS de ECA de alta calidad, independientes y fiables para ser incluidas en el cuerpo de evidencia), Best practice, The Campbell Collaboration Library of Systematic Reviews, Centre for Reviews and Dissemination databases (incluye DARE, Database of Abstracts of Reviews of Effects), Centre for Reviews and Dissemination, National Institute for Health Research (Reino Unido), The Database of Promoting Health Effectiveness Reviews (DoPHER), Trip Database, The Evidence for Policy and practice Information and Co-ordinating Centre (EPPI-Centre), Medline, PubMed (National Library of Medicine in the United States), Scopus Large International y Embase por medio de OVID, NICE y el NIHR (National Institute for Health Research de Reino Unido) para identificar HTAs de alta calidad.
Solamente en los casos donde las preguntas clínicas no encontraron una RS de la literatura para ser respondidas o las GPC no hubieran identificado evidencia científica de alta calidad, se llevaron a cabo búsquedas exhaustivas de la literatura para identificar estudios clínicos que respondieran a esa pregunta.
Las bases de datos que se consultaron para identificar estudios clínicos publicados fueron: The Cochrane Library hasta 2017, Cochrane Central Register of Controlled Trials, Cochrane Database of Systematic Reviews, y DARE (Issue 1 2017), Medline 1950-2017 (OVID), Embase 1980-2017 (OVID), Cinahl 1982-2017 (NLH Search 2.0), Health Economic and Evaluations Database (HEED) hasta 2017, Cumulative Index to Nursing and Allied Health Literature (1982 a 2017), Literatura Latinoamericana de Información en Ciencias de la Salud (LILACS) (1998 a 2017), ARTEMISA (1999 a 2017) y SciELO (1999 a 2017).
Evaluación de calidad y jerarquización de la evidencia
Se emplearon herramientas diseñadas y validadas internacionalmente para evaluar la calidad de la evidencia científica considerando el tipo de documento evaluado. En el caso de las GPC se empleó la herramienta AGREE II, que fue diseñada para evaluar la calidad metodológica y variabilidad de las GPC. En el caso de las RS de la literatura se empleó la herramienta AMSTAR II (Assessing the Methodological quality of Systematic Reviews). Para el caso en el que se condujo una RS de estudios clínicos se utilizaron las siguientes herramientas validadas: directrices para ECA CONSORT (Consolidated Standards of Reporting Trials), MOOSE (Meta-analysis Of Observational Studies in Epidemiology), QUADAS (Quality Assessment of Diagnostic Accuracy Studies) para estudios de prueba diagnóstica y STROBE (Strengthening the Reporting of Observational Studies in Epidemiology) para estudios observacionales (Tabla 2).
Tabla 2 Herramientas de evaluación crítica de la literatura. En el caso de las guías de práctica clínica se empleó la herramienta AGREE II (The Appraisal of Guidelines for Research & Evaluation); para las revisiones sistemáticas de la literatura se empleó la herramienta AMSTAR II (Assessing the Methodological quality of Systematic Reviews); para estudios clínicos controlados las directrices CONSORT (Consolidated Standards of Reporting Trials); QUADAS (Quality Assessment of Diagnostic Accuracy Studies) para estudios de prueba diagnóstica y STROBE (Strengthening the Reporting of Observational Studies in Epidemiology) para estudios observacionales Adaptado de https://gco.iarc.fr/today/data/factsheets/populations/484-mexico-fact-sheets.pdf

Cada una de estas herramientas califican distintos rubros y usan diferentes escalas. Se emplearon de manera individual y calificada por pares, con un tercer evaluador en caso de que hubiera poca concordancia entre los revisores.
Se han publicado una gran cantidad de clasificaciones para evaluar la calidad de la evidencia, nosotros decidimos por consenso utilizar la escala desarrollada por SIGN, que utiliza dos atributos para evaluar la calidad de la evidencia científica (nivel de evidencia): el diseño del estudio y el riesgo de sesgo. Para la clasificación del diseño del estudio se utilizan los números del 1 al 4. El número 1 corresponde a ensayos clínicos o a RS de estos ensayos, y el 4 a la opinión de expertos. Para evaluar el riesgo de sesgo se utilizan signos que informan sobre el grado de cumplimiento de los criterios clave relacionados con ese potencial riesgo (++, + y -). De esta forma, con la ayuda de la plantilla de lectura crítica se evalúa cada estudio, ya sean estudios individuales (ECA, cohortes, etc.) o RS. Esta valoración de la calidad de la evidencia científica de los diferentes estudios disponibles para responder a las preguntas formuladas será posteriormente utilizada en la graduación de la fuerza de las recomendaciones (Tabla 1).
Extracción de la evidencia y análisis
Las GPC preferentemente tienen que incorporar RS para sostener las recomendaciones clínicas. Una vez que las RS fueron evaluadas en su calidad e incorporadas al cuerpo de evidencia científica, se llevaron a cabo reuniones con el GDG para revisar el texto completo de cada una de las RS para poder extraer los resultados. Se consideraron las medidas de asociación resultado de los metaanálisis reportados en las RS para determinar el tamaño del efecto global, ya fuere de la razón de momios (OR, de odds ratio), el riesgo relativo (RR, relative risk) o la diferencia de los promedios ponderados de los efectos (weighted mean estimate of the effect) de acuerdo con los distintos desenlaces definidos por el GDG. Para estudios de prueba diagnóstica es importante considerar otras medidas de asociación, tales como la sensibilidad, la especificidad y los valores predictivos positivos y predictivos negativos.
En los casos de las preguntas clínicas en donde no se encontraron RS publicadas de buena calidad, se llevó a cabo la RS para identificar estudios clínicos. Una vez hecha la evaluación de calidad y de posibilidad de sesgo, se realizó el metaanálisis.
Lo primero que se llevó a cabo fue definir la naturaleza de los valores de acuerdo con el tipo de desenlace a estudiar. Una vez extraídas las medidas de asociación, se determinó el grado de heterogeneidad entre los resultados de los estudios, para ello se utilizó la prueba Q de Der Simonian y Laird. Una vez que se demostró que la heterogeneidad no era significativa, se llevó a cabo el metaanálisis bajo el modelo de efectos fijos cuando se asumió que no existía heterogeneidad entre los estudios incluidos en la revisión y el modelo de efectos aleatorios cuando se asumió que los estudios incluidos en la revisión constituían una muestra aleatoria de todos los estudios existentes. En los casos pertinentes se presenta la información en una gráfica de forest plot en la que se pretendió mostrar el efecto estimado en cada estudio junto con el valor obtenido combinando los resultados de todos los estudios, acompañados por sus respectivos intervalos de confianza. El gráfico contiene además la línea vertical del valor correspondiente a la ausencia de efectos (RR = 1 o diferencia de medias = 0) y los límites de relevancia clínica, lo que determina si las diferencias, además de alcanzar significación estadística, son de una magnitud relevante.
Consenso formal de expertos
El método Delphi de consenso formal es el recomendado en el escenario de desarrollo de una GPC. Es un método sistemático, interactivo, iterativo y que se basa en la reunión de un grupo de expertos. Cada uno de los expertos contestan preguntas, las cuales pueden ser ajustadas de acuerdo con las respuestas en distintas rondas posteriores. En cada una de esta ronda de preguntas y respuestas, a las cuales se les puede dar un carácter cualitativo y/o cuantitativo, un grupo más reducido perteneciente al GDG, en donde se encuentran los coordinadores generales y los coordinadores metodológicos de la GPC, llevan a cabo la integración de las respuestas de todos los expertos de la ronda previa y hacen el ajuste del texto que logre mejorar el porcentaje de acuerdo entre estos. Es deseable que los expertos revisen su respuesta previa y consideren la nueva respuesta para dirigirse a un porcentaje más alto de acuerdo. Finalmente, el proceso se detiene cuando se alcanza un grado mínimo de consenso entre los expertos.
Los coordinadores del GDG establecieron un grupo nuclear (grupo core) que trabajó de cerca cada uno de los documentos y pasos clave en el desarrollo de esta GPC. De igual forma, los coordinares metodológicos apoyaron durante todo el proceso. Las recomendaciones clínicas fueron redactadas y propuestas por el grupo nuclear en base a la evidencia científica identificada, evaluada, extraída y sintetizada. La estructura que se le dio a la información permitió que las contribuciones de los expertos fueran consensuadas y recogidas de manera que se pudieran desarrollar los textos que se exponen a consideración al resto del GDG. El grupo nuclear llevó el control de la interacción entre los participantes procesando la información y filtrando el contenido relevante. Esto nos permitió reducir de manera importante el efecto negativo de las discusiones cara a cara entre los expertos y resolvió los problemas que se observan en las dinámicas de grupo habitualmente.
Una vez que los miembros del GDG hubieron revisado la redacción de las recomendaciones clínicas y la evidencia científica identificada y evaluada en su calidad, se determinó el grado de acuerdo en el texto utilizando una escala de Likert. La escala de Likert empleada va del 1 al 9, el número 1 significa que el experto está «totalmente en desacuerdo» con el planteamiento de la recomendación y el número 9 que el experto está «totalmente de acuerdo con ella. Los números intermedios manifiestan que el experto no tiene una postura completamente definida en el planteamiento o la redacción de la recomendación (Tabla 3).
Tabla 3 Escala de Likert empleada durante la conducción del Panel Delphi modificado
| ¿Usted considera que la recomendación está soportada por la evidencia, está actualizada, es consistente con la evidencia, es aceptable y aplicable para ser incluida en el documento para México? Marque su respuesta con una X | ||||||||
|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 |
| Totalmente en desacuerdo | Fuertemente en desacuerdo | En desacuerdo | Ligeramente en desacuerdo | Indiferente | Ligeramente de acuerdo | De acuerdo | Fuertemente de acuerdo | Totalmente de acuerdo |
| Argumente su respuesta basándose en su experiencia clínica y los valores y preferencias de sus pacientes | ||||||||
| Es obligatorio incluir un argumento en cada respuesta, no importando su calificación numérica. | ||||||||
Internacionalmente, se ha definido el 70% como un porcentaje mínimo deseable de acuerdo entre los expertos participantes en un Panel Delphi. Cuando al menos el 70% de los expertos han manifestado estar de acuerdo con la recomendación clínica (calificación entre 7 y 9) se considera que se ha llegado a un consenso. Además de evaluar el porcentaje de expertos que califican la recomendación, se llevó a cabo el cálculo de las medidas de tendencia central y de dispersión. Se calculó la media, mediana, moda, desviación estándar y el recorrido de los rangos intercuartiles. Se estableció un mínimo de 7.0 en la media como criterio para alcanzar un grado mínimo de consenso. Se empleó un sistema electrónico anónimo para que los integrantes del GDG calificaran cada recomendación de manera anónima, lo que permitió obtener la estadística de las calificaciones en tiempo real.
Redacción de las recomendaciones
Los miembros del GDG nuclear se reunieron en diversas ocasiones para revisar el cúmulo de evidencia que responde a las preguntas clínicas estructuradas y de acuerdo con el nivel de evidencia poder determinar el grado de recomendación y la redacción de estas. Las recomendaciones clínicas deben de proveer guía para los tomadores de decisión, por ello el GDG tuvo cuidado en que su redacción evitará ambigüedad al momento de la redacción. Se tomó en cuenta la evidencia científica, pero el GDG también consideró su experiencia clínica en la redacción de las recomendaciones. Las recomendaciones consideraron también la relación riesgo/beneficio para establecer la toma de decisiones.
Programa de involucramiento de los pacientes
La importancia de recabar los valores y preferencias de los pacientes durante el desarrollo de una GPC es cada vez más patente en la literatura internacional. Cada vez más organizaciones internacionales elaboran programas para facilitar el involucramiento de los pacientes en el proceso de su desarrollo. La Sociedad Mexicana de Oncología, comprometida con mejorar la calidad de la atención clínica en todos los padecimientos oncológicos, hizo extensiva la invitación a participar en el desarrollo de la GPC a una de las asociaciones de pacientes con mayor trayectoria en el tratamiento de padecimientos oncológicos. Se solicitó que la asociación propusiera un grupo de representantes para validar y proponer modificaciones a las recomendaciones clínicas y el documento final. Los pacientes fueron parte de las mesas de discusión en conjunto con los expertos clínicos durante el desarrollo de la GPC.
Cuerpo de la evidencia
Se llevaron a cabo búsquedas para identificar GPC en las bases de datos descritas anteriormente. Además, se llevaron a cabo 25 estrategias de búsqueda exhaustiva de la literatura en PubMed y Embase (Anexo C) para identificar RS de la literatura con o sin metaanálisis de acuerdo con estrategias validadas internacionalmente. Se elaboró un diagrama de flujo de los estudios que se encontraron y que fueron eliminados en la primera ronda de revisión (Fig. 3).
Recomendaciones clínicas y evidencia científica
La siguiente sección presenta las recomendaciones que se hacen con respecto a los tópicos mencionados previamente.
Nódulos tiroideos (Tabla 4)
Pregunta clínica 1. ¿Cómo debe valorarse inicialmente un nódulo tiroideo?
Recomendación. La evaluación inicial de un paciente con NT debe incluir anamnesis, examen físico, ultrasonografía (US) y valoración de la tirotropina sérica (TSH). Nivel de evidencia 2+, grado de recomendación C.
Revisión de la literatura y análisis. Un NT es una lesión discreta en la glándula tiroides. Lógicamente, por imagen, en especial por US, es distinto al parénquima adyacente, y puede ser palpable o no. Los no palpables y diagnosticados por estudios de imagen son conocidos como incidentalomas. Se presentan en el 19 al 68% de la población general15, son más comunes en mujeres y aumentan en frecuencia con la edad y en poblaciones con baja ingesta de yodo. Los NT son malignos en el 5% de los casos16-18.
Con la anamnesis se buscan antecedentes de radiación, síndromes familiares y síntomas asociados a malignidad como adenopatías, alteraciones de voz, crecimiento progresivo, disfagia, disnea y hemoptisis16. Con el examen físico se buscan datos de sospecha de malignidad como NT, ganglios pétreos, grandes o adheridos a planos adyacentes e infiltración de la piel.
La US es el método más sensible para diagnosticar lesiones tiroideas. Es un estudio seguro, no invasivo, económico y reproducible15,18,19. La medición de la TSH se practica sistemáticamente para el estudio de NT; el riesgo de malignidad es bajo cuando existen alteraciones en la concentración sérica, ya que indica trastornos funcionales rara vez asociados con malignidad20,21.
Pregunta clínica 2. ¿Cuándo se debe realizar una ultrasonografía tiroidea?
Recomendación. Recomendamos practicar sist- emáticamente una US tiroidea al paciente que presenta nódulo(s) tiroideo(s), ganglio cervical palpable, nódulo(s) hipercaptante(s) o incidentaloma por otros estudios de imagen. Nivel de evidencia 2+, grado de recomendación C.
Revisión de la literatura y análisis. Aunque la evaluación clínica es muy útil, se requieren estudios confirmatorios. La US es el estudio inicial de elección, permite evaluar el tamaño tiroideo, características del parénquima, características del nódulo y asociación con linfadenopatías. La US aislada de NT con una característica aislada de riesgo tiene bajo valor predictivo para malignidad. Un estudio prospectivo analizó NT con varias características de riesgo, alcanzando sensibilidad del 87.7%, especificidad del 97.8% y precisión diagnóstica del 96.2%15,22.
La US es un método diagnóstico seguro, rápido, económico, reproducible y confortable, que además guía biopsias de lesiones sospechosas, contribuyendo a definir la naturaleza de la lesión. El uso de imágenes con color Doppler mejora la caracterización del patrón de flujo sanguíneo, el cual está aumentado en el interior de la lesión y está ausente o levemente incrementado en el tejido perinodular en la mayoría de las lesiones malignas, lo que se asocia a una tasa de precisión diagnóstica que alcanza el 89%23.
Múltiples metaanálisis concluyen que la aplicación y estandarización de la técnica de elastografía aumenta la sensibilidad, especificidad y el valor predictivo negativo para diagnosticar malignidad de NT24, pero el estudio no está fácilmente disponible en nuestro medio.
Pregunta clínica 3. ¿Cuáles son las características de una ultrasonografía idónea?
Recomendación. Sugerimos que la US de cuello sea practicada por un médico especialista entrenado y dedicado a la evaluación de la glándula tiroides y se utilicen sondas de alta resolución para evaluar las estructuras anatómicas y lesiones con precisión. Nivel de evidencia 2+, grado de recomendación C.
Revisión de la literatura y análisis. De forma distinta a lo que sucede con otros estudios de imagen, la calidad de la US depende en gran medida del operador. La US debe ser practicada por un médico radiólogo entrenado y dedicado, usando sondas de alta resolución (10-15 MHz). El estudio debe evaluar la glándula, ganglios linfáticos regionales, vasos, nervios y el esófago25. Para mantener la precisión se sugiere evaluar al menos 30 casos de tumores tiroideos, ganglios linfáticos metastásicos, recaídas locales y practicar al menos 150 biopsias por aspiración con aguja delgada (BAAD) por año, con muestreo inadecuado menor al 10%.
El reporte de un paciente con NT que busca caracterizar la naturaleza de la lesión debe contener como mínimo el tamaño en tres dimensiones, localización, características del nódulo como proporción sólida, quística o espongiforme, ecogenicidad, tipo de márgenes, presencia y tipo de calcificaciones, proporción alto/ancho y vascularidad26.
Si la sospecha de malignidad es elevada, el estudio debe evaluar además la extensión local y regional de la enfermedad, en el sentido de definir la invasión de estructuras adyacentes y la presencia de ganglios con características metastásicas, aunque pierde sensibilidad en el caso de lesiones profundas, voluminosas y cuando se interpone aire o hueso. Finalmente se deberán corroborar los hallazgos mediante BAAD, lo cual idealmente debe hacerse en la misma sesión26,27.
Pregunta clínica 4. ¿Cuáles son las características ultrasonográficas que sugieren malignidad en un nódulo tiroideo?
Recomendación. Aunque ciertas características sugieren malignidad subyacente, recomendamos considerar las características ultrasonográficas y clínicas en conjunto para definir grupos de riesgo de malignidad, que orienten las decisiones diagnósticas subsecuentes. Las principales características de malignidad son: nódulo más alto que ancho, signo del halo ausente, microcalcificaciones, márgenes irregulares, hipoecogenicidad, nódulo sólido, vascularidad intranodular y nódulo solitario. Nivel de evidencia 2++, grado de recomendación B.
Revisión de la literatura y análisis. En múltiples RS y metaanálisis las características asociadas a malignidad fueron: nódulo más alto que ancho (RR: 10.15), signo del halo ausente (RR: 7.14), microcalcificaciones (RR: 6.76), márgenes irregulares (RR: 6.12), hipoecogenicidad (RR: 5.07), nódulo sólido (RR: 4.69), vascularidad intranodular (RR: 3.76), historia familiar (RR: 2.29), nódulo ≥4 cm (RR: 1.63), nódulo solitario (RR: 1.43), historia de irradiación del cuello (RR: 1.29) y sexo masculino (OR: 1.22). La ausencia de las características de riesgo descarta con seguridad malignidad, sin embargo, el valor predictivo positivo para malignidad es bajo ante cualquier signo de riesgo aislado22,28.
Márgenes mal definidos significan que la interfase entre el nódulo y el parénquima tiroideo es difícil de definir; no equivale a márgenes irregulares, estos indican que la interfase entre el nódulo y el parénquima es visible, pero variable, infiltrativo o espiculado. La probabilidad de cáncer es mayor entre nódulos con márgenes microlobulados o con microcalcificaciones más que en nódulos hipoecoicos sin esas características. Las macrocalcificaciones combinadas con microcalcificaciones se asocian al mismo riesgo de malignidad que microcalcificaciones aisladas. Un NT con calcificación periférica interrumpida, asociado a tejido blando fuera de la calcificación se asocia a mayor probabilidad de malignidad y correlaciona con extensión extratiroidea (EET)28.
El CF tiene características distintas respecto al CP. En un estudio donde el 98% de los tumores eran CP, la vascularidad intranodular no tuvo valor predictivo independiente, sin embargo, otros dos estudios, incluyendo un metaanálisis con altos porcentajes de CF (10-22%) demostraron que la vascularidad intranodular se asocia a CF. El CF tiende a ser iso o hiperecogénico, sin calcificaciones, de forma redonda (más ancho que alto) y tiene márgenes regulares y lisos, mientras que la variedad folicular del CP tiene apariencia ecográfica similar al CF28.
La apariencia espongiforme regularmente significa benignidad. Deriva de múltiples componentes microquísticos en más del 50% del volumen del nódulo. Los nódulos espongiformes pueden exhibir reflexiones brillantes, mientras que los nódulos mixtos pueden exhibir ecos finos en la US, causados por cristales de coloide o realce acústico de la pared posterior del área microquística15,22.
Además de la evaluación de la glándula, siempre que se detecta un NT debe realizarse la exploración de los ganglios linfáticos de los compartimentos central (peritiroideos o nivel VI y VII) y lateral (cadena yugular profunda o niveles II a V). Si la US identifica ganglios de aspecto sospechoso debe practicarse BAAD de estos26,28.
Considerando las características mencionadas es posible caracterizar los nódulos con diferentes riesgos de malignidad:
Nódulos de alta sospecha (riesgo de malignidad: 70 a 90%). Son hipoecoicos, aspecto sólido o parcialmente quístico, con márgenes irregulares (infiltrativos, microlobulados o espiculados), con microcalcificaciones, morfología más alta que ancha o con disrupción de calcificación linear con un componente hipoecoico que protruye (EET). Con estas características existe alta probabilidad de CP29.
Nódulos de sospecha intermedia (riesgo de malignidad: 10 a 20%). Son hipoecoicos, sólidos, con márgenes regulares y lisos, sin microcalcificaciones ni imagen compatible con EET, ni más altos que anchos29.
Nódulos de baja sospecha (riesgo de malignidad: 5 a 10%). Son iso o hiperecoicos, o parcialmente quísticos con nodulaciones sólidas excéntricas, pero sin microcalcificaciones, sin márgenes irregulares ni EET, tampoco son más altos que anchos. Solo del 15 al 20% de los carcinomas son iso o hiperecoicos y suelen corresponder a la variante folicular del CP o CF. Menos del 20% son parcialmente quísticos.
Nódulos de muy baja sospecha (riesgo de malignidad: menor al 3%). Son espongiformes, sin ninguna de las características sospechosas ya descritas.
Nódulos benignos (riesgo de malignidad: <1%). Son completamente quísticos30.
Pregunta clínica 5. ¿Cuál es el estudio con mayor precisión diagnóstica preoperatoria de los nódulos tiroideos?
Recomendación. La BAAD, en especial la guiada por US, es el estudio más sensible y específico para definir malignidad en los NT. Recomendamos practicar el estudio combinado en todos los pacientes con nódulos sospechosos. Nivel de evidencia 2++, grado de recomendación B.
Revisión de la literatura y análisis. Una mayor proporción de carcinomas tiroideos puede ser detectada por BAAD guiada por US respecto a la BAAD ordinaria. Singh, et al.31, en una RS en la que se incluyeron 79,541 NT también presentaron cambios de diagnóstico. Los principales problemas con la BAAD convencional fueron: a) lesiones difíciles de palpar (n = 55) y b) carcinomas sin material suficiente para análisis (n = 44) (p. ej., carcinoma quístico y carcinomas con calcificación). Se concluyó que la BAAD guiada es una poderosa técnica para detectar microcarcinomas, carcinomas quísticos, cánceres asociados a lesiones benignas y tiroiditis de Hashimoto.
Pregunta clínica 6. ¿Cuándo debe realizarse biopsia por aspiración con aguja delgada a un nódulo tiroideo?
Recomendación. Recomendamos practicar BAAD de todas las lesiones que por sus características ultrasonográficas se asocien a riesgo significativo de malignidad. Nivel de evidencia 2+, grado de recomendación C.
Revisión de la literatura y análisis:
Nódulos de alta sospecha: si miden más de 1 cm siempre se debe practicar BAAD.
Nódulos de sospecha intermedia: se toma BAAD en los mayores a 1 cm.
Nódulos de baja sospecha: pueden ser vigilados sin practicar BAAD si son menores a 15 mm.
Nódulos de muy baja sospecha: se considera BAAD si son iguales o mayores a 2 cm.
Nódulos benignos: la BAAD no está indicada, pero se puede considerar la aspiración y ablación con etanol30,32.
Pregunta clínica 7. ¿Cuándo deben tomarse biopsias guiadas por ultrasonografía?
Recomendación. Recomendamos guiar mediante US todas las BAAD, ya que disminuye la tasa de falsos negativos con buena relación costo-efectividad. Nivel de evidencia 2+, grado de recomendación C.
Revisión de la literatura y análisis. La BAAD guiada por US disminuye la tasa de falsos negativos por errores de muestreo. Esta práctica sistemática es eficaz en relación con el costo.
La BAAD guiada por US es especialmente fiable cuando se reporta benigno (<1% de probabilidad de malignidad) o maligno31.
Contraindicaciones para la BAAD son alteraciones probadas de la coagulación. Considere que los NT sospechosos menores de 1 cm o con localización posterior se asocian a alta tasa de falsos negativos y que los nódulos hiperfuncionantes presentan riesgo de malignidad menor al 1%, por lo que se sugiere individualizar las conductas.
Pregunta clínica 8. ¿Cuándo debe repetirse una biopsia por aspiración con aguja delgada?
Recomendación. Se recomienda repetir la BAAD guiada por US cuando exista sospecha clínica o por US de neoplasia maligna y la citología de la punción inicial haya sido reportada como: no diagnóstica, atipia de significado indeterminado, insuficiente o inadecuada. Se sugiere individualizar la conducta cuando existe discordancia clínico-cito-radiológica. Nivel de evidencia D, grado de recomendación 4.
Revisión de la literatura y análisis. Una muestra de BAAD es no diagnóstica cuando se obtuvo sangre, la muestra es insuficiente, inadecuada por errores de muestreo o ha sido mal fijada. Esto ocurre a menudo por errores técnicos, inexperiencia, falta de cooperación del paciente o por no usar guía ultrasonográfica. Además, se recomienda repetir la BAAD cuando durante el seguimiento las características clínicas o por US del NT cambian e indican malignidad26,33,34.
Pregunta clínica 9. ¿Cuándo debe practicarse una biopsia con aguja de núcleo?
Recomendación. No se sugiere el uso sistemático de las biopsias con agujas de núcleo, ya que no han demostrado superioridad sobre las BAAD. Nivel de evidencia 4, grado de recomendación D.
Revisión de la literatura y análisis. En términos generales no es necesario practicar biopsias con aguja de núcleo. Aunque la biopsia con aguja de núcleo es un procedimiento seguro, no existe indicación para su uso sistemático35, porque la BAAD guiada por US diagnostica la mayoría de los casos y se asocia a menores riesgos y costos. Sin embargo, puede ser practicada ante grandes adenopatías o tumores tiroideos irresecables, que sugieren cáncer anaplásico, linfoma o metástasis a la tiroides, en cuyos casos se requiere un diagnóstico histológico preciso para iniciar tratamiento médico28,36,37.
Pregunta clínica 10. ¿Cómo debe evaluarse una tiroides con múltiples nódulos sospechosos?
Recomendación. Recomendamos evaluar independientemente cada uno de los NT sospechosos y no solo el nódulo dominante por su tamaño o consistencia. Nivel de evidencia 2++, grado de recomendación C.
Revisión de la literatura y análisis. Si bien múltiples nódulos sugieren bocio multinodular, la glándula con múltiples nódulos no está exenta del riesgo de malignidad. Debe evaluarse de la misma forma que la glándula con un solo nódulo. Cada nódulo se caracteriza por US y se efectúa BAAD de cada nódulo con riesgo de malignidad significativo38,39.
Pregunta clínica 11. ¿Cuál es el método diagnóstico idóneo para evaluar los ganglios cervicales?
Recomendación. Recomendamos usar la US con BAAD para documentar o descartar la presencia de metástasis ganglionares regionales. Nivel de evidencia 2++, grado de recomendación B.
Revisión de la literatura y análisis. De forma similar a lo que sucede con la evaluación de los NT y considerando un médico radiólogo dedicado y experimentado, la US es sensible en la detección de ganglios cervicales metastásicos; el diagnóstico correcto produce un mejor tratamiento y respuesta a la terapia. Las características por US asociadas a mayor probabilidad de ganglio metastásico son: tamaño mayor de 1 cm, adenopatías redondas, pérdida del patrón de vascularidad del ganglio, pérdida del hilio graso, presencia de calcificaciones en la cortical del ganglio, hiperecogenicidad de la corteza, presencia de microcalcificaciones, bordes irregulares, cambios quísticos y formación de conglomerados. Entre las limitaciones de la US se cuenta no poder caracterizar a los ganglios retrofaríngeos, paraesofágicos y mediastinales.
La US y la tomografía computarizada (TC) tienen la misma sensibilidad y especificidad cuando valoran los distintos niveles ganglionares de cuello, sin embargo, los costos son menores con la US. Debe destacarse que en una RS que incluyó 1,691 pacientes se demostró mayor sensibilidad cuando se usan ambos estudios combinados40. La TC está indicada cuando se duda su resecabilidad y para evaluar niveles no visualizados por US.
Pregunta clínica 12. ¿Cuáles son las características de una citología tiroidea adecuada?
Recomendación. Las características de una citología tiroidea adecuada consideran un número mínimo de células por muestra; cada laminilla debe contener 6 grupos de células foliculares, compuesto cada uno por al menos 10 células. Esto fue establecido por el grupo de trabajo que desarrolló el sistema Bethesda. Nivel de evidencia 2++, grado de recomendación B.
Revisión de la literatura y análisis. El sistema Bethesda establece criterios citológicos para definir una muestra adecuada: el número mínimo de células por muestra debe ser 6 grupos de células foliculares, compuesto cada uno por al menos 10 células33,34. Sin embargo, hay excepciones al requerimiento numérico de células foliculares. El número tiene importancia secundaria cuando el frotis contiene abundante coloide que sugiere nódulo coloide y en el caso de tiroiditis linfocitaria, en ambos son innecesarios un mínimo de 6 grupos de células foliculares. El diagnóstico de muestras inadecuadas en un laboratorio puede variar desde el 2 hasta el 20%, sin embargo no debe exceder el 10% del total de las muestras33,34.
Pregunta clínica 13. ¿Cómo debe tomarse una biopsia por aspiración con aguja delgada?
Recomendación. Recomendamos practicar BAAD guiada por US observando una técnica estandarizada para obtener resultados reproducibles y consistentes. Nivel de evidencia 2+, grado de recomendación C.
Revisión de la literatura y análisis. Se recomienda que la BAAD guiada sea practicada por un médico radiólogo entrenado. Luego de obtener el consentimiento informado por escrito, el paciente se coloca en posición supina con el cuello extendido, pero podría estar sentado o en decúbito. Se localiza la lesión por palpación o US, luego se practica asepsia de la piel y se usa un transductor lineal de alta resolución (7.5-15 MHz). Se inyecta anestésico local para el procedimiento, por ejemplo 1 a 2 ml de solución de clorhidrato de lidocaína al 1 o 2%. Se usa una aguja de calibre 22 a 27 con una jeringa de 2 a 20 ml para la punción. Se puede utilizar o no un soporte de jeringa. Se practican al menos 15 pases por lesión. Se utiliza una técnica de biopsia a mano alzada y se obtiene el material mediante capilaridad o por aspiración de diferentes áreas del nódulo25.
Se recomienda practicar dos punciones en diferentes áreas de la lesión, seguida de evaluación inmediata por el patólogo o citopatólogo para determinar si la muestra es adecuada o no. No se requerirá más muestra si la lesión corresponde a un quiste y ha sido completamente drenado, si no existe lesión residual o si el material aspirado es adecuado. Se recomienda una biopsia adicional si hay lesión residual después de drenar el quiste, si la celularidad es escasa o se necesita más material para bloque celular o estudios auxiliares24.
Pregunta clínica 14. ¿Cuándo debe procesarse la muestra de biopsia por aspiración con aguja delgada con la técnica de citología de base líquida?
Recomendación. No recomendamos el uso sistemático de la citología de base líquida en el análisis de las muestras de BAAD. Su uso es materia de preferencia personal. Nivel de evidencia 2+, grado de recomendación C.
Revisión de la literatura y análisis. La citología de base líquida aún no ha demostrado superioridad disminuyendo la proporción de muestras inadecuadas o de diagnóstico indeterminado41.
Las muestras de BAAD para estudio citológico convencional requiere de varias laminillas para su evaluación; en contraste, la citología de base líquida solo requiere una laminilla, ya que contiene mayor cantidad de material. La citología de base líquida tiene varias ventajas, como disminuir la cantidad de material hemático en los frotis, mayor fijación de las células y menor cantidad de insumos, además conserva el material para un posterior estudio molecular o de inmunohistoquímica42.
Un punto importante que considerar es el menor costo de las muestras procesadas como citología convencional respecto a la citología de base líquida, que requiere material e insumos de mayor costo. La decisión de usar un método u otro debe considerar el costo, la factibilidad y la exactitud de la prueba en cada laboratorio.
Pregunta clínica 15. ¿Cómo debe reportarse una citología?
Recomendación. Recomendamos usar el sistema Bethesda para el reporte de las citologías tiroideas. Nivel de evidencia 2++, grado de recomendación B.
Revisión de la literatura y análisis. El sistema Bethesda34 permite unificar criterios morfológicos y de terminología para facilitar la comunicación entre citopatólogos, endocrinólogos, radiólogos, cirujanos, etc. Es un sistema ampliamente aceptado y practicado. La interpretación con este sistema provee información relevante que apoya al clínico en el tratamiento de los pacientes; el resultado debe incluir: el diagnóstico o interpretación, el riesgo de malignidad y la recomendación para el tratamiento de cada paciente.
El sistema Bethesda reconoce seis categorías diagnósticas:
1) No diagnostica/insatisfactoria.
2) Benigno.
3) Atipia de significado incierto/lesión folicular de significado incierto.
4) Neoplasia folicular/sospechoso de neoplasia folicular, neoplasia de células Hürthle/sospechoso de neoplasia de células Hürthle.
5) Sospechoso de malignidad.
6) Maligno.
Un metaanálisis33 que incluyó 25,445 BAAD de NT reportó una sensibilidad con este sistema del 97.5%, especificidad del 68.8%, valor predictivo positivo del 55.9% y valor predictivo negativo del 96.3%, lo cual lo convierte en una clasificación segura.
Pregunta clínica 16. ¿Cuál es la conducta adecuada acorde al reporte citológico?
Recomendación. Recomendamos observar la conducta diagnóstica y terapéutica sugerida por el sistema Bethesda. Nivel de evidencia 2++, grado de recomendación B.
Revisión de la literatura y análisis. Sugerimos individualizar en cada caso el momento de la nueva BAAD y considerar la extensión de la cirugía acorde a las características clínicas de acuerdo con el sistema Bethesda (Tabla 5).
Tabla 5 Sistema Bethesda para el reporte de la citología tiroidea
| Diagnóstico | Riesgo de malignidad | Tratamiento |
|---|---|---|
| Insatisfactorio o no diagnóstico | 1-4% | Repetición de BAAD guiada por US |
| Benigno | 0-3% | Seguimiento clínico |
| Atipia o lesión folicular de significado indeterminado | 5-15% | Repetición de BAAD guiada por US |
| Neoplasia folicular o sospechoso de neoplasia folicular | 15-30% | Cirugía |
| Sospechoso de malignidad | 60-75% | Cirugía |
| Maligno | 97-99% | Cirugía |
BAAD: aspiración con aguja delgada; US: ultrasonografía.
Pregunta clínica 17. ¿Cuál es la utilidad del estudio transoperatorio?
Recomendación. Recomendamos el estudio transoperatorio (ETO) cuando el reporte de la US y el resultado del estudio citológico de la muestra obtenida por BAAD guiada por US no son concluyentes y el resultado del ETO pueda modificar la extensión de la cirugía. Nivel de evidencia 2++, grado de recomendación B.
Revisión de la literatura y análisis. El ETO utilizado en forma correcta brinda información importante, sin embargo no es útil cuando ya se cuenta con un diagnóstico citológico definido, aunque su rendimiento varía según la circunstancia específica. Cuando el diagnóstico citológico preoperatorio es de neoplasia folicular (Bethesda IV) el ETO no resulta costo-efectivo debido a que rara vez modifica el diagnóstico citológico43. Cuando el diagnóstico preoperatorio es Bethesda V los valores predictivos suelen ser suficientemente buenos para guiar la conducta terapéutica en forma correcta44. Cuando el diagnóstico preoperatorio es sospechoso de CP (Bethesda VI) el ETO tiene un VPP del 100% y un VPN del 50%, lo que facilita la decisión de completar la tiroidectomía total si está indicado, en la última circunstancia el ETO resulta costo-efectivo, pero el VPP y VPN puede variar sensiblemente entre instituciones de acuerdo con la prevalencia de malignidad45.
No se recomienda ETO sin haber practicado US y BAAD en el preoperatorio. Someter sistemáticamente a ETO a los pacientes sin USG y BAAD incrementa costos y puede llevar a los pacientes a cirugía innecesaria y a sus riesgos.
En caso de diagnóstico de neoplasia folicular, el ETO continúa siendo reportado como neoplasia folicular en la mayoría de las ocasiones y por ello se recomienda recurrir a indicadores clínicos que facilitan la decisión de completar o no la tiroidectomía total. Incluyen las características ultrasonográficas, antecedente de radiación en el cuello, sexo masculino y tamaño de la lesión mayor de 4 cm, aunque el tamaño aislado no parece tener valor predictivo consistente46. Cuando existe suficiente experiencia para mantener la morbilidad quirúrgica muy baja, la tiroidectomía total parece ser la decisión más eficaz en relación con el costo47.
Pregunta clínica 18. ¿Cuál es el papel de la medición de tiroglobulina, anticuerpos antitiroglobulina y calcitonina preoperatorias?
Recomendación. No recomendamos la medición de la tiroglobulina (Tg) y anticuerpos antitiroglobulina (anti-Tg) en el preoperatorio, ya que no tienen utilidad diagnóstica, sin embargo, la medición de la calcitonina sérica puede ser útil como estudio de detección de cáncer medular. Nivel de evidencia 2++, grado de recomendación B.
Revisión de la literatura y análisis. Las concentraciones de Tg suelen estar elevadas en varias patologías tiroideas, su medición preoperatoria no es útil para diferenciar patologías benignas de malignas. Valores altos no significan malignidad y valores bajos o normales de Tg preoperatoria no descartan el diagnóstico de cáncer48-51.
La medición de la calcitonina sérica preoperatoria puede ser útil para ayudar a establecer el diagnóstico preoperatorio de cáncer medular, que se traduciría en cirugías apropiadas y mayor proporción de curaciones, pero su uso en todos los NT es controvertido, ya que se duda de su costo-efectividad. La determinación preoperatoria de calcitonina sérica puede ser más útil en instituciones con alta prevalencia de malignidad y en pacientes con antecedentes familiares de cáncer tiroideo, cáncer medular y citología sospechosa de malignidad sin diagnóstico preciso52,29.
Pregunta clínica 19. ¿Cuál es el rol de la tomografía computarizada, la resonancia magnética y la tomografía por emisión de positrones preoperatorias?
Recomendación. Se recomienda practicar estudios de imagen distintos de la US, como TC y resonancia magnética (RM) ante lesiones voluminosas, lesiones clínicamente invasoras profundas y lesiones metastásicas para evaluar resecabilidad. La tomografía por emisión de positrones (PET-CT) no se usa de manera sistemática. Nivel de evidencia A++, grado de recomendación B.
Revisión de la literatura y análisis. La US pierde sensibilidad ante lesiones avanzadas, por lo que se recurre a otros estudios. La TC preoperatoria del cuello y tórax está indicada ante tumores tiroideos de grandes dimensiones, que se introducen en el estrecho superior del tórax, cuando existan signos clínicos que sugieren invasión de vías aerodigestivas superiores, como hemoptisis, disfagia, disnea, lesiones fijas y metástasis ganglionares voluminosas26,53. La TC tiene mayor sensibilidad diagnóstica para metástasis regionales cuando se combina con US40 y es el estudio inicial de elección para el diagnóstico y evaluación de lesiones metastásicas.
La RM es un estudio complementario indicado cuando la TC no es concluyente. Estos últimos dos estudios influyen significativamente en el plan quirúrgico26,53,54.
La PET-CT no está indicada de manera sistemática en el preoperatorio26, sin embargo, ante su uso cada vez más frecuente es importante destacar que existen múltiples series y metaanálisis que analizan poca población heterogénea y reportan una incidencia de incidentalomas del 0-3%, con un riesgo de malignidad del 25-50%. Las lesiones focales con suma mayor de 2.5 deben considerarse malignas53.
La sensibilidad para diagnóstico de lesiones metastásicas de la PET-CT no es superior a la asociada a TC o RM, pero está claramente indicada si dichas lesiones no captan iodo, convirtiéndose además en una herramienta pronóstica56.
Pregunta clínica 20. ¿Cuáles son las indicaciones de la gammagrafía tiroidea en nódulos tiroideos y cáncer diferenciado de tiroides?
Recomendación. Está indicada en NT con hipertiroidismo. No está indicado el uso sistemático de la gammagrafía tiroidea en la evaluación de malignidad, ya que sus valores predictivos son muy bajos. Nivel de evidencia A+, grado de recomendación C.
Revisión de la literatura y análisis. Un gammagrama tiroideo puede estar indicado en el paciente con NT y TSH suprimida, lo que sugiere NT hiperfuncional, que muy rara vez es maligno. Un nódulo hipercaptante es la expresión imagenológica de un nódulo hiperfuncional. En el CDT no tiene indicación27.
Pregunta clínica 21. ¿Cuál es el papel de la laringoscopia y la valoración ultrasonográfica laríngea preoperatoria?
Recomendación. Recomendamos practicar la laringoscopia a todo a aquel paciente con indicación quirúrgica, ya que puede existir invasión del nervio laríngeo recurrente (NLR) sin obvios cambios de la voz. La US puede evaluar la motilidad cordal en forma fiable cuando es practicada por un médico radiólogo capacitado. Nivel de evidencia 4, grado de recomendación D.
Revisión de la literatura y análisis. Conocer la función del nervio en el preoperatorio facilita las decisiones transoperatorias, especialmente cuando ambos nervios se encuentran comprometidos por una neoplasia durante la cirugía57,58. Es obligada la evaluación en reoperaciones (incluida cirugía de columna o cirugía vascular carotídea) y cuando los datos clínicos o de imagen sugieren EET por nódulos posteriores. Identificar pacientes con alteración de la movilidad cordal o aritenoidea en el preoperatorio elimina la posibilidad de atribuir la parálisis a la cirugía efectuada59.
La US de cuerdas vocales tiene alta sensibilidad, especificidad, valor predictivo positivo y negativo para evaluar la función perioperatoria cordal60.
Cáncer diferenciado de tiroides (Tabla 6)
Tabla 6A Recomendaciones clínicas, síntesis y niveles de evidencia para cáncer diferenciado de tiroides (CDT)

Tabla 6B Recomendaciones clínicas, síntesis y niveles de evidencia para cáncer diferenciado de tiroides (CDT)

Tabla 6C Recomendaciones clínicas, síntesis y niveles de evidencia para cáncer diferenciado de tiroides (CDT)

Tabla 6D Recomendaciones clínicas, síntesis y niveles de evidencia para cáncer diferenciado de tiroides (CDT)

Tabla 6E Recomendaciones clínicas, síntesis y niveles de evidencia para cáncer diferenciado de tiroides (CDT)

Pregunta clínica 22. ¿Cuál es la indicación de hemitiroidectomía y tiroidectomía total en el cáncer diferenciado de tiroides?
Recomendación. La lobectomía o hemitiroidectomía es tratamiento suficiente en pacientes seleccionados con enfermedad limitada y poco agresiva, los demás pacientes requieren al menos tiroidectomía total para obtener el mejor control local y disminuir recaídas. Nivel de evidencia 1+, grado de recomendación A.
Revisión de la literatura y análisis. La hemitiroidectomía o lobectomía es tratamiento suficiente cuando se reúnen todas las siguientes condiciones:
Tumores T1-T2.
Tumores sin extensión extratiroidea.
Pacientes menores de 55 años.
Sin evidencia de metástasis ganglionares.
Sin enfermedad metastásica a distancia.
Sin variantes histológicas agresivas.
Ausencia de antecedentes de irradiación en cabeza y cuello.
Ausencia de cáncer diferenciado de tiroides familiar.
Las recomendaciones de tamaño tumoral máximo para practicar hemitiroidectomía oscilan desde 1 a 4 cm, probablemente el mejor nivel de corte se encuentre alrededor de 2 cm, en todo caso parece más importante que se cumplan todas las condiciones anteriores. Los pacientes que no reúnen estas características deben someterse a tiroidectomía total y resección de otras estructuras involucradas, más disección del cuello si existe indicación61.
Pregunta clínica 23. ¿Cuál es el papel de la tiroidectomía abierta, endoscópica y robótica?
Recomendación. No se recomiendan la cirugía de invasión mínima o el acceso remoto sistemático, ya que no ha demostrado superioridad sobre la cirugía convencional. Nivel de evidencia 1+, grado de recomendación A.
Revisión de la literatura y análisis. No existe evidencia de alta calidad sobre la superioridad de la cirugía mínimamente invasiva y de acceso remoto en el tratamiento de las neoplasias tiroideas malignas. La cirugía abierta se mantiene como el estándar de oro en el tratamiento, aunque los procedimientos de mínima invasión son factibles y seguros62. Un metaanálisis demostró que las cirugías transaxilar y robótica se asocian a tasas de complicaciones y tiempos de hospitalización similares a los de la cirugía convencional, pero la cirugía robótica se asocia a mayores tiempos operatorios y costos. Las tiroidectomías mínima invasiva y de acceso remoto carecen de estudios que evalúen resultados oncológicos a largo plazo y que permitan compararlos. Los beneficios cosméticos solo se han evaluado a corto plazo63.
Pregunta clínica 24. ¿Cuáles son las indicaciones de una disección de cuello electiva y terapéutica en el cáncer diferenciado de tiroides?
Recomendación. Se debe practicar disección de los ganglios del cuello central y lateral ante la evidencia de ganglios metastásicos. Siempre se debe hacer un estudio diligente para documentar durante el preoperatorio metástasis ganglionares cervicales. Nivel de evidencia 1+, grado de recomendación A.
Revisión de la literatura y análisis. La disección electiva de los ganglios cervicales se practica en ausencia de enfermedad ganglionar probada, pero alto riesgo de enfermedad subclínica. La disección terapéutica se practica ante evidencia de metástasis64.
La disección electiva del cuello central debe considerarse durante la tiroidectomía en pacientes con EET macroscópica y tumores mayores de 4 cm, donde el 50% de ellos tienen enfermedad ganglionar demostrable en el estudio histopatológico. La disección electiva del compartimento central también debe ser considerada cuando ya existe enfermedad ganglionar probada en el cuello lateral (niveles II a V), ya que hasta el 70% de los casos tienen enfermedad metastásica central. En estas circunstancias, la disección electiva con alta probabilidad se torna terapéutica y se traduce en un mejor control regional. La disección terapéutica suele hacerse evidente ante la presencia de metástasis ganglionares centrales en el momento de la cirugía, ya que por su ubicación rara vez son obvias en los estudios de imagen preoperatorios29.
Sin embargo, no existe indicación de disección electiva del cuello lateral. La disección terapéutica del cuello lateral (niveles II-V) uni o bilateral se practica cuando se ha corroborado clínicamente, citológicamente o por imagen la presencia de ganglios metastásicos65.
Pregunta clínica 25. ¿Cuál es la extensión de la linfadenectomía central de la disección lateral de cuello?
Recomendación. Recomendamos ceñirse a los procedimientos estandarizados en el tratamiento de los ganglios regionales en CDT. Debe preferirse la disección en bloque. Nivel de evidencia 1-, grado de recomendación B.
Revisión de la literatura y análisis. La disección del cuello central o linfadenectomía central debe incluir los ganglios: prelaríngeo (Delfiano), paralaríngeos, pretraqueales, paratraqueales, peritiroideos, alrededor de nervios laríngeos recurrentes y del surco traqueoesofágico (niveles VI y VII). Anatómicamente incluye los ganglios localizados entre ambas arterias carótidas comunes a los lados, la arteria innominada inferiormente y el hioides superiormente63,66.
La linfadenectomía lateral debe incluir los ganglios yugulares superiores, medios e inferiores y del triángulo posterior por debajo del nervio espinal (niveles IIA a V). Esta recomendación surge de considerar los ganglios en mayor riesgo de afectación, conciliando el menor riesgo de complicaciones67,68,69.
Pregunta clínica 26. ¿Cuál es la conducta correcta ante infiltración de los nervios laríngeos?
Recomendación. Un nervio invadido con parálisis cordal secundaria puede ser resecado si el nervio contralateral está intacto y ello produce una resección macroscópica completa. Nivel de evidencia 1+, grado de recomendación A.
Revisión de la literatura y análisis. Herman, et al. demuestran en su revisión de más de 27,000 pacientes sometidos a tiroidectomía que la incidencia de lesiones del NLR disminuye significativamente cuando este es identificado70. Se ha reportado que del 12 al 18% de los NLR no son visualizados durante la cirugía.
La evaluación preoperatoria con laringoscopia es el estudio más sensible para identificar infiltración de los NLR, sin embargo, hasta el 67.5% de los NLR infiltrados no presentan parálisis. Si el nervio está envuelto pero funcional se debe intentar conservarlo manteniendo su integridad. Si ambos nervios están envueltos, se debe intentar la disección de ambos si están funcionales. Debe sospecharse ante la presencia de adenomegalias prelaríngeas57,71.
El manejo de un nervio aislado y obviamente invadido que produce parálisis no causa mayor controversia, se acepta que está indicada su resección. Si ambos están paralizados a menudo existen otras condiciones que hacen al caso irresecable. Sin embargo, si es posible la resección completa del tumor (R0), está indicada la resección considerando técnicas de reinervación más traqueostomía. Su resección no incrementa la supervivencia global.
Con las técnicas de reinervación como anastomosis primaria del NLR, anastomosis al músculo cricotiroideo, injerto nervioso del asa cervical, implantación neural a músculos tiroaritenoideos, etc., el 87.5% de los tumores con invasión por metástasis ganglionar y el 78.7% de los invadidos por el tumor primario presentaron mejoría funcional posteriormente a varios meses de la cirugía.
Pregunta clínica 27. ¿Cuál es la conducta ante la infiltración de la vía aérea y el esófago?
Recomendación. Recomendamos resecar los tejidos invadidos si el objetivo es la curación, ya que la resección completa se asocia a mejor supervivencia y esto no significa necesariamente la pérdida de funciones orgánicas, las cuales se pueden preservar con una reconstrucción apropiada. Nivel de evidencia 3, grado de recomendación D.
Revisión de la literatura y análisis. En una serie de 2,165 casos de cáncer tiroideo, el 14% tenían tumores T4a y el 78% de ellos tenían invasión por CDT. La mayoría presentaban datos clínicos como disnea, disfagia, tos y hemoptisis que progresaron rápidamente72.
La invasión no circunferencial limitada a la muscular del esófago e hipofaringe debe ser resecada, mientras que la mucosa rara vez está involucrada y puede ser preservada. En contraste, la invasión circunferencial implica resección de un segmento del esófago y reconstrucción.
La invasión limitada al pericondrio de la tráquea y laringe puede ser eliminada mediante «rasurado» si no produce enfermedad residual macroscópica; esto amerita que se realice una evaluación acuciosa de la profundidad de la invasión en el preoperatorio (broncoscopia y TC). La invasión intraluminal de la tráquea requiere de la resección del segmento involucrado para evitar un residual macroscópico que amenace la supervivencia a largo plazo. La resección de la porción o segmento involucrado aún es compatible con la preservación de las funciones si se practica una adecuada reconstrucción. En el caso de resección de una porción de la tráquea, o ventana traqueal, se puede recurrir a traqueostomía o colocar un parche con músculo esternocleidomastoideo. La resección de un segmento traqueal circunferencial requiere resección y traqueoplastia sin tensión. Si el segmento resecado rebasa los 5 cm la reconstrucción puede ser difícil o imposible y requerir laringectomía total. La mejor supervivencia se logra con las cirugías R0, aunque cirugías con residual microscópico y tratamiento adyuvante pueden alcanzar las mismas supervivencias. Siempre se requiere tratamiento adyuvante con 131I, radioterapia (RT) o ambos.
Avenia, et al., en su serie de 303 pacientes con cáncer tiroideo invasor de vía aérea, logró cirugía curativa con resección y reconstrucción (19.9%) y laringectomía (5.7%) con una mortalidad perioperatoria del 18.1%. Esto evidencia la complejidad del tratamiento de estos pacientes y su baja probabilidad de curación. Sin embargo, la cirugía tiene un importante papel en la paliación, aliviando complicaciones como asfixia y hemoptisis73.
Pregunta clínica 28. ¿Cuáles son los criterios de irresecabilidad e inoperabilidad de un cáncer diferenciado de tiroides?
Recomendación. Irresecabilidad significa baja probabilidad de resección completa por limitantes técnicas o riesgos inaceptables. Recomendamos identificar preoperatoriamente los pacientes con tumores irresecables, ya que llevarlos a cirugía y dejar tumor residual macroscópico no los beneficia. Con enfermedad residual macroscópica la supervivencia no mejora respecto a solo someter a biopsia, y se agregan riesgos, morbilidad y costos infructuosos. Nivel de evidencia 3, grado de recomendación D.
Revisión de la literatura y análisis. Inoperabilidad significa que la cirugía no es aconsejable por un alto riesgo quirúrgico debido a comorbilidades del paciente, cuando es intrascendente su resección por su mal pronóstico o cuando existe un tratamiento oncológico alternativo eficiente.
Irresecabilidad significa que la posibilidad de una resección completa es baja dada la localización o extensión del tumor, o es técnicamente posible pero asociada a riesgo quirúrgico inaceptable; esto sucede cuando un tumor tiroideo invade la fascia prevertebral, rodea en un 75% o más el perímetro de los grandes vasos del cuello o del mediastino. Un tumor irresecable debe ser tratado en forma paliativa.
Pregunta clínica 29. ¿Cuáles son los sistemas de estadificación recomendados en el cáncer diferenciado de tiroides?
Recomendación. Recomendamos usar la octava edición del sistema de estadificación de la American Joint Committee on Cancer (AJCC) para definir el pronóstico de supervivencia de los pacientes con CDT. Nivel de evidencia 4, grado de recomendación D.
Revisión de la literatura y análisis. La estadificación se establece en forma fiable luego de someter al paciente a tratamiento quirúrgico. Aunque de utilidad sentando pronóstico, las decisiones terapéuticas se toman con base en la consideración de factores pronósticos asociados a riesgo de recaída local, regional o sistémica. Esto sucede porque aún con excelente pronóstico de supervivencia puede existir un riesgo significativo de recaída y el diseño del mejor tratamiento debe considerar esto.
El sistema de estadificación más usado y recomendado es el propuesto por la AJCC en su octava edición (Tablas 7 y 8).
Tabla 7 Sistema de estadificación del American Joint Committee on Cancer (AJCC) para los carcinomas tiroideos, 8.ª edición
| T | Tumor primario | ||
|---|---|---|---|
| TX | No se puede evaluar el tumor primario | ||
| T0 | Sin evidencia de tumor primario | ||
| T1 | Tumor de diámetro máximo menor o igual a 2 cm, limitado al tiroides | ||
| T1a | Tumor de 1 cm o menos limitado al tiroides | ||
| T1b | Tumor de más de 1 cm, pero menor o igual de 2 cm, limitado al tiroides | ||
| T2 | Tumor de diámetro máximo mayor de 2 cm, pero menor o igual a 4 cm, limitado al tiroides | ||
| T3 | Tumor mayor de 4 cm limitado al tiroides o con extensión extratiroidea macroscópica que invade solo los músculos pretiroideos | ||
| T3a | Tumor mayor de 4 cm limitado al tiroides | ||
| T3b | Tumor de cualquier tamaño con extensión extratiroidea macroscópica que invade solo los músculos pretiroideos (esternohioideo, esternotiroideo, tirohioideo u omohioideo) | ||
| T4 | Incluye extensión extratiroidea macroscópica | ||
| T4a | Tumor de cualquier tamaño con extensión extratiroidea macroscópica que invade los tejidos blandos subcutáneos, laringe, tráquea, esófago o nervio laríngeo recurrente | ||
| T4b | Tumor de cualquier tamaño con extensión extratiroidea macroscópica que invade la fascia prevertebral o que envuelve la carótida o los vasos mediastínicos | ||
| Nota: Todas las categorías se pueden dividir en (s) tumor solitario y (m) tumor multifocal (el mayor tumor determina la estadificación) | |||
| N | Extensión ganglionar | ||
| NX | 5ajctabla o se pueden evaluar los ganglios linfáticos regionales | ||
| N0 | Sin evidencia de metástasis ganglionares regionales | ||
| N0a | Uno o más ganglios citológica o histológicamente confirmados benignos | ||
| N0b | Sin evidencia clínica o radiológica de metástasis ganglionares regionales | ||
| N1 | Metástasis ganglionares regionales | ||
| N1a | Metástasis en ganglios linfáticos del nivel VI y/o VII (pretraqueal, paratraqueal, prelaríngeo o ganglio Delfiano o mediastínicos superiores). Puede ser enfermedad unilateral o bilateral | ||
| N1b | Metástasis en ganglios cervicales unilaterales, bilaterales, contralaterales (niveles I, II, III, IV o V) o ganglios retrofaríngeos | ||
| M | Metástasis a distancia | ||
| M0 | Sin metástasis a distancia | ||
| M1 | Con metástasis a distancia | ||
Adaptado de AJCC Cancer Staging System 8th ed., 2018.
Tabla 8 Grupos de etapas pronósticas para el cáncer diferenciado de tiroides. De acuerdo con este sistema, la supervivencia a 10 años para el estadio I es del 98%, para estadio II del 90%, para estadio III del 80% y para estadio IV del 10%
| Edad al diagnóstico | TNM | Estadio |
|---|---|---|
| Menor de 55 años | Cualquier T, cualquier N, M0 | I |
| Menor de 55 años | Cualquier T, cualquier N, M1 | II |
| De 55 años o mayor | T1-T2, N0-NX, M0 | I |
| De 55 años o mayor | T1-T2, N1, M0 | II |
| De 55 años o mayor | T3a-T3b, cualquier N, M0 | II |
| De 55 años o mayor | T4a, cualquier N, M0 | III |
| De 55 años o mayor | T4b, cualquier N, M0 | IVA |
| De 55 años o mayor | Cualquier T, cualquier N, M1 | IVB |
Adaptado de AJCC Cancer Staging System 8th ed., 2018.
Pregunta clínica 30. ¿Cuáles son los factores pronósticos útiles en el cáncer diferenciado de tiroides y cuál es la importancia de evaluarlos?
Recomendación. Se recomienda identificar los factores pronósticos relevantes en cada paciente, ya que permite diseñar el tratamiento apropiado. Nivel de evidencia 2+, grado de recomendación C.
Revisión de la literatura y análisis. Los factores pronóstico son indicadores asociados a algún probable desenlace clínico. Son inherentes el tumor, como su extensión; al paciente, como su edad; e inherentes al equipo de tratamiento, como la experiencia. Los factores pronósticos pueden ser evaluados en cualquier momento del curso clínico de la enfermedad, pero evaluar los factores pronósticos en el postoperatorio permite predecir el riesgo de recaída74 y con ello detectar la necesidad de tratamiento subsecuente (adyuvante o terapéutico) para su administración racional.
-
Indican riesgo de recaída local:
-
Indican riesgo de recaída regional:
Indican riesgo de recaída a distancia:
Edad avanzada, EET macroscópica, variantes histológicas agresivas y carcinomas poco diferenciados, como el carcinoma insular, y el gran tamaño tumoral, especialmente si el tumor es mayor de 5 cm.
Pregunta clínica 31. ¿Cuál es la importancia de identificar las variables histológicas del cáncer diferenciado de tiroides?
Recomendación. Ciertas variantes o variedades histológicas también representan factores pronósticos, por ello recomendamos identificarlas y considerarlas en la evaluación pronóstica del paciente. Nivel de evidencia 2+, grado de recomendación B.
Revisión de la literatura y análisis. En el CDT las variedades asociadas a peor pronóstico respecto al CP convencional son: esclerosante difusa, folicular difusa, células altas, trabecular, células columnares, en tachuela y desdiferenciado (carcinoma poco diferenciado/indiferenciado con componente de CP)77. Estas variantes tienen mayor probabilidad de diseminación y peor respuesta al tratamiento.
Variedades asociadas con mejor pronóstico son la encapsulada y el microcarcinoma papilar. Con pronóstico similar: folicular, sólida, de células oxífilas (células de Hürthle), con estroma similar a fascitis nodular, macrofolicular, similar a tumor de Warthin, cribiforme morular y variedad con estroma lipomatoso76.
Un microcarcinoma es un CP menor de 1 cm de diámetro, suele asociarse a excelente pronóstico, pero en ocasiones representa un tumor agresivo de pequeño tamaño, por lo que se deben considerar todos los factores pronósticos77.
Pregunta clínica 32. ¿Cuál es la importancia de la determinación de la mutación del gen BRAF?
Recomendación. No se recomienda la determinación sistemática de BRAF, ya que no impacta significativamente en el tratamiento de los pacientes, aunque puede ser de utilidad en el caso de aspirados indeterminados. Nivel de evidencia 2++, grado de recomendación B.
Revisión de la literatura y análisis. El gen BRAF mutado a partir de muestras citológicas se ha asociado a otros factores pronósticos de tipo clínico y patológico que suponen peor pronóstico, como recaída, incluyendo la ausencia de cápsula, edad avanzada, pérdida de avidez por131I o enfermedad extensa78, pero la correlación no es perfecta. Solo está mutado en el 45% de los pacientes con CDT y por ello su ausencia no descarta malignidad, pero su presencia virtualmente siempre indica malignidad, es decir tiene alto valor predictivo positivo.
En varias RS con metaanálisis la sensibilidad de la prueba fue 40, 52 y 60%, mientras que la especificidad alcanzó del 99 al 100%78,79. Es decir, tiene baja utilidad diagnóstica, pero puede tener utilidad pronóstica cuando se documenta su mutación. No se recomienda su identificación en forma habitual, ya que en la mayoría de los pacientes es posible tomar decisiones diagnósticas y terapéuticas con los medios convencionales.
Su mayor utilidad parece ubicarse en los aspirados indeterminados (neoplasia folicular o sospechoso de malignidad) donde una prueba positiva documenta malignidad, pero una prueba negativa no lo descarta. En resumen, la determinación de la mutación de BRAF tiene dos potenciales utilidades:
En nódulos tiroideos con citología indeterminada, la presencia de BRAF mutado se asocia a malignidad80,81.
En pacientes con cáncer de tiroides la mutación de BRAF se asocia a mal pronóstico, mayor tasa de metástasis ganglionares, mayor tasa de recaída y resistencia a la terapéutica con 131I, sin embargo, esto suele ser obvio por la presencia de factores pronósticos convencionales82.
Pregunta clínica 33. ¿Qué información debe contener el reporte patológico de la pieza quirúrgica de cáncer diferenciado de tiroides?
Recomendación. Recomendamos usar protocolos estandarizados para el reporte de patología, ya que se asegura información pronóstica completa y relevante que guía el tratamiento subsecuente. Nivel de evidencia 2++, grado de recomendación B.
Revisión de la literatura y análisis. Los factores patológicos se cuentan entre los factores pronósticos más importantes, por ello el reporte de patología es primordial, ya que indica el pronóstico y ayuda a tomar decisiones terapéuticas. El reporte de patología debe incluir características del tumor necesarias para la estadificación, para estratificar el riesgo y determinar la necesidad de terapia complementaria83. El Colegio Americano de Patólogos recomienda reportar las siguientes características84:
Se aplica al tumor dominante, el cual se define como el tumor más agresivo o el de mayor grado. No necesariamente el de mayor tamaño, sino el más relevante, ya que dicta la conducta terapéutica. Si se encuentran tumores de diferente tipo histológico, se deberán reportar las características de cada uno.
Tamaño del tumor. El tamaño del tumor en cm tiene un impacto significativo en el pronóstico.
-
Tipo histológico. Se recomienda utilizar la clasificación de la Organización Mundial de la Salud (OMS) publicada en el 2004 con algunas modificaciones basadas en reportes subsecuentes:
Extensión extratiroidea. Se define por la presencia de tumor en los tejidos peritiroideos y se divide en mínima y extensa. La EET mínima consiste en tumor en los tejidos blandos peritiroideos inmediatamente adyacentes a la glándula. Incluye infiltración del músculo, vasos y nervios. Debido a que la cápsula tiroidea es incompleta en la mayoría de las glándulas y a que el tejido adiposo puede encontrarse en condiciones normales en la glándula tiroides, la sola visualización de tumor en el tejido adiposo no se considera criterio de EET. La EET «extensa» es evidente macroscópicamente e involucra invasión directa de tejido subcutáneo, órganos adyacentes (laringe, tráquea, esófago), NLR, arteria carótida o vasos sanguíneos mediastinales. La EET se asocia a incremento en el riesgo de recaída y mortalidad, está presente hasta en el 23% de los CP. Es un factor independiente de mal pronóstico85.
Evaluación de los márgenes. El reporte debe mencionar si existe algún margen positivo. Debido a que la glándula carece de una verdadera cápsula, el estado de los márgenes se refiere a la relación del tumor con la superficie del espécimen o en el margen entintado. Algunos autores han observado que la presencia de tumor en el margen posterior se asocia a mayor riesgo de recaída, mientras que un margen anterior positivo no supone riesgo significativo. Por lo tanto, se sugiere se entinten ambos márgenes y se reporten por separados29.
Características de las metástasis a ganglios regionales. La presencia de metástasis en ganglios linfáticos regionales es común. El impacto en la supervivencia específica y supervivencia libre de recaída es relativamente pequeño y más notable en el grupo de pacientes de mayor edad. La presencia de micrometástasis (<2 mm) no se asocia a mayor riesgo de recaída locorregional respecto los pacientes con ganglios negativos. El significado de los cuerpos de psammomas aislados en los ganglios linfáticos, sin evidencia de células neoplásicas, no se ha establecido. Sin embargo, se recomienda mencionarlo en el reporte. Recientemente se han descrito características adicionales asociadas a pronóstico, como el número y localización de ganglios afectados, número de ganglios examinados, tamaño de las metástasis y presencia de extensión extraganglionar.
La enfermedad ganglionar voluminosa se asocia a mayor riesgo de recaída locorregional, por lo que se debe registrar en el reporte final la dimensión del ganglio positivo de mayor tamaño y del mayor foco metastásico.
La extensión se define como la extensión de tumor más allá de la cápsula del ganglio linfático extraganglionar (rotura capsular). El criterio histológico más fiable es la observación de células neoplásicas en el tejido adiposo periganglionar. Un metaanálisis que incluyó 1,830 pacientes concluyó que su presencia se asocia a el doble de riesgo de recaída y persistencia de la enfermedad y el triple de riesgo de mortalidad86.
Invasión vascular e invasión linfática. El CP se disemina predominantemente por vía linfática y el CF por vía hematógena. Por tanto, los vasos invadidos por CP suelen ser linfáticos y en CF son vasos sanguíneos, aunque el CP puede invadir vasos sanguíneos. También es posible observar la presencia de cuerpos de psammomas en los linfáticos, lo cual equivale a invasión incluso cuando no se identifiquen células neoplásicas. Entre los criterios para el diagnóstico de CF se cuenta la invasión vascular. Los vasos sanguíneos invadidos deben estar localizados fuera del tumor, dentro de la cápsula o fuera de la cápsula. Se debe especificar si se trata de vasos linfáticos o sanguíneos, ya que la invasión vascular representa un tumor más agresivo. Tradicionalmente se ha descrito la presencia de tumor polipoide endotelizado como criterio mínimo de invasión vascular, pero recientemente se han propuesto criterios más rigurosos que incluyen invasión del tumor a través de la pared y la formación de trombos en asociación con el tumor. Se ha sugerido que el número de focos de invasión vascular tiene importancia pronóstica. En los CF y de células de Hürthle, la invasión vascular se clasifica como invasión focal o mínima (1 a 4 focos) e invasión extensa (>4 focos). La invasión vascular extensa se considera predictor independiente de recaída.
Invasión del espacio perineural. El significado clínico de la invasión perineural es aún desconocido, por lo que su inclusión en el reporte es opcional.
-
Invasión capsular. Se define como la presencia de un tumor que atraviesa completamente la cápsula tumoral con o sin formación de neocápsula o nódulo satélite neoplásico, localizado fuera de la cápsula tumoral. La existencia de invasión capsular es uno de los criterios diagnósticos que distinguen ciertos tipos de tumores tiroideos malignos de sus contrapartes benignas (CF vs. adenoma folicular).
Algunos autores utilizan el término «mínimamente invasor» para describir los tumores con invasión capsular microscópica. En este grupo se han incluido también tumores que presentan invasión de vasos de pequeño calibre. El término «ampliamente invasor» se utiliza para carcinomas con invasión macroscópicamente aparente, los cuales generalmente están acompañados por otros indicadores de agresividad, como EET e invasión vascular extensa.
-
Variantes histopatológicas asociadas con evolución distinta. Las variantes de CP con evolución desfavorable son: células altas, células columnares y células en tachuela. La variante de células altas se caracteriza por un predominio (>50%) de células cuya altura es al menos tres veces su anchura. Ocurre en pacientes de mayor edad y con estadio clínico avanzado. Se ha observado mayor tasa de recaída y supervivencia disminuida. El 80% de los casos presentan mutaciones en BRAF.
-
En la variante de células columnares se encuentran células con pseudoestratificación nuclear prominente. Tienen mayor riesgo de metástasis a distancia y mortalidad relacionada al tumor. Se encuentra mutación de BRAF en la tercera parte de los casos.
El CP con células en tachuela no se encuentra en la clasificación de la OMS del 2004 debido a que se describió recientemente. En esta variante predominan células con aspecto en tachuela, el núcleo se encuentra en localización apical y produce una prominencia hacia la superficie. Se ha asociado con metástasis a distancia (principalmente en pulmón) e incremento en el riesgo de muerte por la enfermedad. Al igual que los tipos histológicos descritos previamente, también se asocia a mutaciones de BRAF.
El CP de tipo esclerosante difuso se caracteriza por afectar extensamente la glándula. Se presenta en jóvenes y se asocia con mayor proporción de metástasis ganglionares y recaída locorregional. Sin embargo, la mortalidad total parece ser baja.
El CP con patrón folicular se ha subclasificado recientemente en: encapsulado (delimitado) e infiltrante (no encapsulado). El infiltrante tiene una evolución similar al convencional, mientras que el comportamiento clínico del encapsulado es más parecido al adenoma folicular, con bajo riesgo de recaída. Difieren también desde el punto de vista molecular, ya que los encapsulados suelen presentar mutaciones de RAS, mientras que los infiltrantes tienen mutaciones en BRAF V600E. La evaluación de los tumores encapsulados debe incluir un examen cuidadoso de la totalidad de la cápsula para descartar invasión capsular o vascular. Los CF que presentan solamente invasión capsular sin angioinvasión tienen una evolución favorable.
Algunos tipos histológicos se asocian a síndromes familiares. La variante cribiforme morular está asociada con mutaciones en APC o de beta-catenina. El tumor tiroideo puede preceder a las manifestaciones colónicas. Por otro lado, el CF puede desarrollarse en pacientes con síndrome PTEN-tumor hamartoma. Estos pacientes presentan numerosos NT encapsulados y tienen mayor riesgo de carcinomas de mama, endometrio y hamartomas colónicos, entre otras alteraciones.
-
Pregunta clínica 34. ¿Cuál es el tratamiento adecuado por grupo de riesgo?
Recomendación. El esquema de tratamiento debe ser acorde al pronóstico y riesgo de recaída, por ello se recomienda usar un sistema de estratificación pronóstica que facilite las decisiones terapéuticas. Proponemos la siguiente clasificación por grupos de riesgo que integra factores pronósticos ampliamente validados. Nivel de evidencia 1+, grado de recomendación A.
Revisión de la literatura y análisis.
-
Carcinoma papilar
Riesgo bajo. Incluye a menores de 55 años con todas las siguientes características: CP convencional, tumor menor de 2 cm, sin EET ni metástasis demostrables, con resección completa; estos pacientes tienen muy bajo riesgo de recaída y muerte87. El objetivo es lograr el control local con mínima morbilidad, se logra con hemitiroidectomía si el tumor está confinado a un lóbulo, o tiroidectomía total si existe enfermedad multicéntrica demostrable previa a la cirugía. Dado el buen pronóstico no requieren tratamiento con yodo ni supresión de TSH88.
Riesgo intermedio. Incluye a los pacientes menores de 55 años con EET microscópica85, o macroscópica limitada a músculos pretiroideos, o con metástasis ganglionares no voluminosas, o tumores de 2 a 5 cm, o combinaciones de estos factores; todos con resección macroscópica completa. Tienen riesgo de recaída local o regional, pero conservan un excelente pronóstico de supervivencia74,75. Requieren tiroidectomía total y disección de cuello ante ganglios regionales metastásicos. El objetivo es obtener el mejor control locorregional y optimizar el efecto del 131I adyuvante, necesario para abatir el riesgo de recaída.
Riesgo alto. Incluye a los pacientes mayores de 55 años con algún CP de variedad agresiva, o EET macroscópica, o extensión extraganglionar o tamaño tumoral mayor de 5 cm, con tumor residual macroscópico o con metástasis a distancia, sin importar la edad. Tienen supervivencia menos favorable86,89. Debe buscarse la resección completa del tejido tiroideo normal y neoplásico más la resección de otros tejidos involucrados y ganglios regionales metastásicos, incluso la resección de metástasis a distancia si son resecables. El objeto es optimizar el control locorregional y el efecto del 131I sobre las metástasis distantes, posibles o probadas.
-
Carcinoma folicular. Aunque el CP y CF son carcinomas diferenciados y su tratamiento es similar, existen algunas diferencias sutiles, por ello conforman solo dos grupos de riesgo29:
Bajo riesgo. Incluye a pacientes menores de 55 años, con un CF invasor mínimo, menor de 2 cm y sin metástasis a distancia. El pronóstico es muy bueno. Se recurre a hemitiroidectomía ya que la multicentricidad es rara. No se requiere tratamiento adyuvante.
Alto riesgo. Incluye a los mayores de 55 años o con tumores mayores de 2 cm, o con metástasis a distancia; o tumor con angioinvasión extensa sin importar la edad. En ellos se indica la resección total del tejido tiroideo normal o neoplásico, incluso la resección de metástasis a distancia en enfermedad oligometastásica. Se requiere tratamiento con 131I y RT paliativa de metástasis óseas sintomáticas, o que amenazan con fractura o compresión medular.
Pregunta clínica 35. ¿Cómo deben prepararse los pacientes para manejo con131I?
Recomendación. Recomendamos antes de administrar131I con fines diagnósticos o terapéuticos asegurar niveles superiores de TSH a 30 UI/ml. Nivel de evidencia 1+, grado de recomendación A.
Revisión de la literatura y análisis. Luego de realizar la cirugía indicada, los pacientes que requieren ablación o tratamiento adyuvante o terapéutico con131I deben someterse a preparación para que la TSH se encuentre elevada y el tejido tiroideo sea ávido por el131I. La preparación es posible de tres formas:
No administrar LT4 luego de la tiroidectomía total, o suspender su tratamiento durante 3 a 5 semanas, para que su ausencia permita incrementar las cifras de TSH por mecanismos contrarreguladores a cifras superiores a 30 UI/ml. Estas cifras deben ser corroboradas antes de administrar el131I (unos 5 días), ya que algunos pacientes no elevan la TSH en ese lapso, debido a deficiencia hipofisaria o tejido tiroideo residual funcionante no conocido29,92.
Administrar o no suspender las hormonas tiroideas, pero administrar TSH recombinante humana exógena (rhTSH) a dosis de 0.9 mg i.m. 48 y 24 horas antes de administrar 131I. Es la forma más costosa pero asociada con menores molestias y mejor calidad de vida91,92.
Suspender 4 semanas antes de la fecha planeada de administración de 131I la LT4, pero adicionar triyodotironina y suspenderlo una semana antes de la fecha planeada para el tratamiento con131I.
Estas dos últimas formas disminuyen las morbilidades asociadas al hipotiroidismo, como insuficiencia renal (TFG <50 mg/ml), arritmia cardíaca y depresión90,91.
Además, se recomienda una dieta baja en yodo dos semanas previas al tratamiento. El yodo de la dieta compite con el 131I y puede abatir su eficiencia. Por razones semejantes, no deben administrarse contrastes radiográficos yodados, por lo menos un mes antes de la radioablación93-95.
Pregunta clínica 36. ¿Cuáles son las dosis de131I necesarias para el tratamiento del cáncer diferenciado de tiroides?
Recomendación. Se recomienda usar dosis variables de 131I acordes a las necesidades individuales. Antes de su administración se debe descartar la presencia de tejido tiroideo residual macroscópico. Nivel de evidencia 1+, grado de recomendación A.
Revisión de la literatura y análisis. La dosis administrada es proporcional al tejido tiroideo residual estimado al riesgo de recaída y factores pronósticos, pero la eficacia del tratamiento además está relacionada con otros factores, como avidez del tumor por el yodo, sensibilidad intrínseca del tejido neoplásico, preparación y niveles de TSH.
Hay una serie de recomendaciones de dosis de131I en mCi (milicurios) acorde al grupo de riesgo, posterior a tiroidectomía total (Fig. 4).
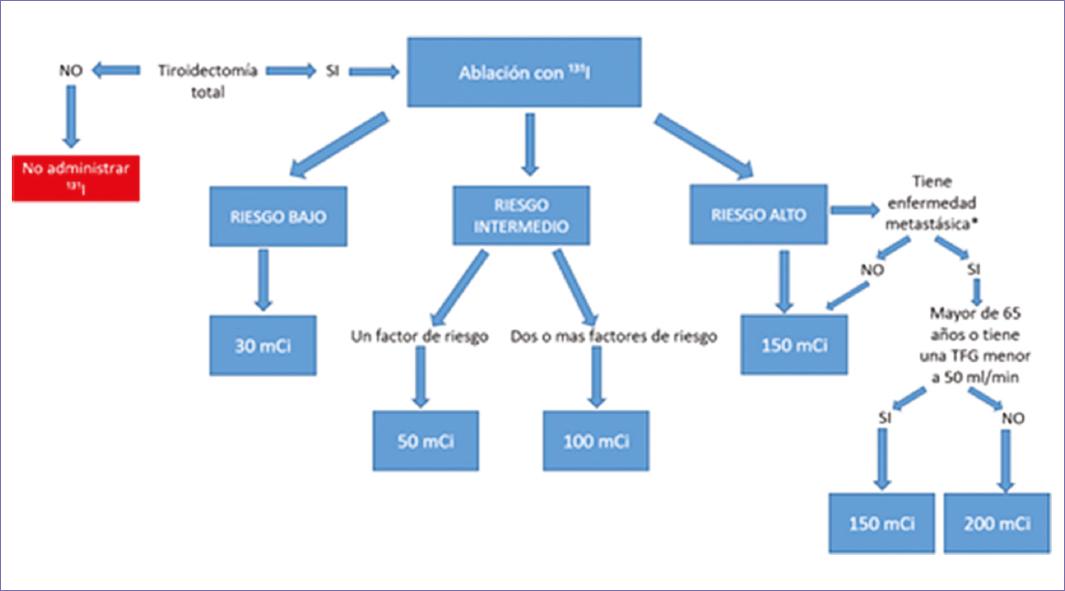
Figura 4 Dosis de 131I en mCi (milicurios) según el grupo de riesgo, después de tiroidectomía total (adaptada de Tuttle, et al., 201196). *Pulmonar, ganglionar mediastinal, hepática y ósea. TFG: Tasa de filtración glomerular.
La ablación en pacientes de riesgo bajo es controvertida, debido a que no abate el muy bajo riesgo de recaída y no modifica la supervivencia, sin embargo, otros la justifican aduciendo que simplifica el seguimiento del paciente y facilita identificar la recaída al eliminar residuos de tejido tiroideo, la producción de Tg y la producción continua de anticuerpos anti-Tg. Creemos que la ablación está justificada si no es posible documentar con precisión la ausencia de factores de riesgo.
Existen grupos96,97 que han definido las categorías de respuesta al tratamiento primario, resumiéndolas en:
Respuesta completa: sin evidencia de enfermedad clínica, estructural (imagen) y bioquímica (Tg suprimida <0.2 ng/ml o estimulada <1 ng/ml).
Respuesta bioquímica incompleta: con un método de imagen negativo, pero niveles de Tg suprimida >1 ng/ml, Tg estimulada >10 ng/ml o elevación de los anticuerpos anti-Tg.
Respuesta estructural incompleta: pacientes con enfermedad estructural o funcional por cualquier método de imagen, con cualquier nivel de Tg y/o anticuerpos anti-Tg.
Respuesta indeterminada: con hallazgos inespecíficos en estudios de imagen y niveles de Tg suprimida <1 ng/ml; niveles de Tg estimulada <10 ng/ml o niveles estables anticuerpos anti-Tg.
Los efectos secundarios son dependientes de la dosis, cuando están presentes. Los más frecuentes son disfunción de glándulas salivales (16-54%) y lagrimales (11%), disfunción testicular (35-100%) y ovárica (28%). La presencia de segundos primarios es más frecuente después de los 5 años de seguimiento y con dosis acumuladas mayores de 500 mCi98. Sawka, et al. evidenciaron en una RS con metaanálisis un riesgo relativo de segundos primarios en supervivientes de CDT tratados con cirugía y ablación con131I comparados a solo cirugía de 1.18-1.2. Los cánceres asociados más frecuentes son leucemia, sistema nervioso central y tracto digestivo99.
Pregunta clínica 37. ¿Cuáles son las indicaciones de la radioterapia externa en el cáncer diferenciado de tiroides?
Recomendación. No se recomienda el uso sistemático de radioterapia externa (RTE) ante factores pronósticos relacionados con recaída local o regional, ya que el131I es más eficiente. Nivel de evidencia 1-, grado de recomendación B.
Revisión de la literatura y análisis. La evidencia de la efectividad de la RTE en el CDT es limitada. La evidencia sugiere que la RTE mejora el control locorregional en pacientes de alto riesgo de recaída, pero no existen comparaciones con 131I. Basados en la información existente recomendamos su empleo, asociado o no a 131I, en los escenarios siguientes100:
Enfermedad macroscópica irresecable.
Alto riesgo de recaída: márgenes quirúrgicos positivos, extensión extracapsular ganglionar, EET, edad mayor de 50 años, variantes histológicas desfavorables, si por alguna razón el tratamiento con131I no es factible.
Enfermedad no captante de131I.
Metástasis óseas o cerebrales.
Las dosis recomendadas, idealmente con RT de intensidad modulada (IMRT), a áreas de bajo riesgo son 50 a 54 Gy, a áreas de riesgo intermedio (lecho tumoral, surco traqueoesofágico y compartimiento central ganglionar, nivel VI) 59.4 a 63 Gy, cuando existe enfermedad microscópica (márgenes positivos) hasta 63 a 66 Gy. En caso de enfermedad macroscópica, se recomienda administrar 70 Gy. Todos los esquemas se administran con fraccionamiento convencional de 1.8 a 2 Gy por sesión101.
Pregunta clínica 38. ¿Cuál es el rol de los estudios bioquímicos en el seguimiento?
Recomendación. Se recomienda practicar el seguimiento de los pacientes sometidos a resección completa del tejido tiroideo con determinaciones seriadas de Tg y anticuerpos anti-Tg, pero se debe considerar que la presencia de anticuerpos anti-Tg invalida la utilidad de las mediciones de Tg. Nivel de evidencia 2++, grado de recomendación B.
Revisión de la literatura y análisis. El seguimiento inicia cuando se ha alcanzado el control de la enfermedad, es decir, no existe evidencia alguna de enfermedad. El seguimiento busca detectar recaída en forma oportuna para mejorar los resultados del tratamiento. El seguimiento se hace con cuantificaciones de Tg y anticuerpos anti-Tg cada 6 meses durante 5 años y luego cada año.
Las cifras de Tg en ausencia de tejido tiroideo deben ser <2 ng/ml, o mejor aún, cercanos a 0.2 ng/ml y los anticuerpos <10 mUI/l, pero las cifras pueden variar entre distintos laboratorios. Se recomienda que las mediciones se realicen en el mismo laboratorio.
En pacientes con anticuerpos anti-Tg elevados, las cifras de Tg son imprecisas102,103 por ello el seguimiento se hace con rastreos con 3 a 5 mCi de 131I. Cuando el rastreo es negativo y los niveles de anticuerpos declinan se asume que se alcanzó la respuesta completa104.
Pregunta clínica 39. ¿Cuál es el rol de los estudios de imagen en el seguimiento? y ¿Cuáles son las indicaciones del rastreo con iodo, tomografía computarizada, resonancia magnética y tomografía por emisión de positrones?
Recomendación. La US es el estudio de elección en el seguimiento del paciente sometido a lobectomía. Los estudios de imagen distintos a la US se indican cuando existen elevaciones de Tg o anticuerpos que sugieren persistencia o recaída. Nivel de evidencia 2++, grado de recomendación B.
Revisión de la literatura y análisis. Los estudios de imagen se indican cuando las cifras de Tg y los anticuerpos se elevan, en pacientes con hemitiroidectomía o con sospecha clínica de recaída. La estrategia varía de acuerdo con las circunstancias específicas y la disponibilidad de infraestructura o experiencia.
Si el paciente fue sometido a hemitiroidectomía o hay anticuerpos anti-Tg elevados, las mediciones de Tg no son útiles. Si el paciente fue sometido a hemitiroidectomía el seguimiento se hace con US anual. Si presenta anticuerpos elevados, lo indicado es US del cuello y TC de tórax. Si la TC no es concluyente puede estar indicada una RM de mediastino o hígado29.
La indicación de PET-CT es Tg (preferible Tg >10 ng/ml) o anticuerpos elevados con rastreo con131I negativo. También está indicado como estudio inicial en cánceres mal diferenciados. Al fenómeno de mala o nula captación de 18F-FDG por tumores bien diferenciados se le denomina flip-flop56.
La PET/CT-FDG tiene importancia pronóstica, porque en la mayor parte de los pacientes con enfermedad metastásica tienen avidez por el 18F-FDG, lo que sugiere mayor agresividad, desdiferenciación y células metabólicamente activas; mientras que una PET/CT-FDG negativa predice pronóstico favorable105.
Pregunta clínica 40. ¿Cuál es la periodicidad de los estudios de imagen en el seguimiento?
Recomendación. Se recomienda practicar estudios de imagen solo ante indicaciones específicas, pero la US es el estudio de elección en el paciente sometido a hemitiroidectomía. Se recomienda practicar el US en forma anual los primeros 5 años de seguimiento. Nivel de evidencia 4, grado de recomendación D.
Revisión de la literatura y análisis. Las guías más recientes recomiendan realizar un seguimiento con ultrasonido cervical para evaluar la zona tiroidea y los compartimentos ganglionares centrales y laterales cada 6-12 meses y luego periódicamente, dependiendo del riesgo de recurrencia y el estatus de Tg29.
El resto de los estudios se solicitan ante la sospecha de recaída o persistencia con los patrones descritos en la recomendación anterior.
Pregunta clínica 41. ¿Cuál es la conducta ante la enfermedad persistente y recurrente?
Recomendación. Documentada la enfermedad con cambios estructurales en los estudios de imagen se recomienda la resección quirúrgica ante persistencia o recaída locorregional macroscópica, resecable. El131I es poco eficiente en estas circunstancias. Nivel de evidencia 2-, grado de recomendación C.
Revisión de la literatura y análisis. Documentada la persistencia o recaída, si la enfermedad es resecable se recurre a cirugía, por ejemplo, a disección del cuello o mediastinal. Si la enfermedad es irresecable pero localizada se recurre a RTE, si es irresecable y diseminada pero sensible a yodo se administra131I terapéutico29.
Si la Tg o los anticuerpos están elevados, o se ha documentado enfermedad por otro medio, pero el rastreo con 131I es negativo, se recurre a la PET-CT con 18-FDG, que evalúa mejor la extensión de la enfermedad y hace una evaluación pronóstica: un alto metabolismo se asocia a peor supervivencia106. Si la enfermedad es refractaria a 131I se consideran los ICT.
Pregunta clínica 42. ¿Cuál es el papel de la inyección de etanol, la radiofrecuencia y la ablación con láser en el tratamiento del cáncer diferenciado de tiroides?
Recomendación. Se considera la ablación no quirúrgica de lesiones tiroideas malignas como una alternativa en pacientes con riesgo elevado de morbilidad o mortalidad en caso de someterse a cirugía. Nivel de evidencia 1+, grado de recomendación A.
Revisión de la literatura y análisis. Chong, et al., en una RS con metaanálisis de 270 pacientes con recaída local con lesiones con un promedio de 0.8 a 2.1 cm y alto riesgo quirúrgico que fueron tratados con radiofrecuencia (1 a 3 sesiones), reportaron una disminución del volumen mayor del 50% de los casos y niveles de Tg en el 100%, respuesta completa en el 68.8% y complicaciones en el 5.8%. Los pacientes tratados con ablación con etanol (1-6 sesiones) presentaron disminución del volumen mayor al 50% en el 89.5% de los casos, respuesta completa en el 53.4% y complicaciones en el 1.6% de los casos. Ambos grupos de pacientes presentaron un seguimiento promedio de 9.4 a 65 meses107.
Zhou, et al. publicaron una serie retrospectiva de 21 pacientes con tiroidectomía total y linfadenectomía central con recaída local y/o regional de CDT, con 27 lesiones menores de 15 mm y con alto riesgo quirúrgico, que fueron tratadas con 1-2 sesiones de láser guiadas por US, con seguimiento de 14.9 ± 5.9 meses, obteniéndose ablación en 24 lesiones con una sesión, ameritando una segunda sesión en las otras tres lesiones. Los niveles de Tg fueron indetectables (<0.2 ng/ml) a los tres meses de seguimiento. Las complicaciones fueron menores y autolimitadas en dos semanas108.
Pregunta clínica 43. ¿Cuál es la indicación del tratamiento sistémico e inhibidores de la tirosinacinasa?
Recomendación. Se recomienda tratamiento solo ante enfermedad recurrente o metastásica irresecable y refractaria a 131I, que además es sintomática o rápidamente progresiva. Nivel de evidencia 1+, grado de recomendación A.
Revisión de la literatura y análisis. El tratamiento con quimioterapia ha sido el tratamiento sistémico durante décadas, sin embargo, solo se han publicado estudios fase II cuyos resultados reportan poca eficacia (respuesta parcial: 27.1% y respuesta completa: 2.5-3.4%); la monoterapia con adriamicina fue considerada la terapia estándar, aunque debe destacarse que no se han realizado estudios con fármacos de última generación109,110. En los últimos años la investigación ha permitido la introducción de los ICT como tratamiento sistémico, con mejores resultados.
Pregunta clínica 44. ¿Cuáles son los inhibidores de tirosinacinasa aprobados para tratamiento del cáncer diferenciado de tiroides?
Recomendación. El lenvatinib y el sorafenib están indicados en el tratamiento del CDT, recurrente locorregional e irresecable, o metastásico a distancia refractario a131I. Nivel de evidencia 1+, grado de recomendación A.
Revisión de la literatura y análisis. El lenvatinib es un inhibidor multicinasas de VEGF 1-3, FGF-R 1-4 y PDGF-R alfa, que interfiere con la angiogénesis y linfangiogénesis, pero también inhibe al oncogén RET y C-KIT. La diferencia más importante del lenvatinib respecto a otros ICT es la habilidad de inhibir FGF-R1, por lo que representa un fármaco efectivo en caso de resistencia a inhibidores VEGF/VEGF-R. El sorafenib es una molécula pequeña que inhibe C-RAF, BRAF, RET, c-KIT, PDGF-R y VEGFR 1-3111.
El estudio multicéntrico fase III SELECT comparó lenvatinib vs. placebo en pacientes con CDT que progresaron durante el tratamiento con131I. El objetivo fue evaluar la supervivencia libre de progresión (SLP); 261 pacientes fueron asignados aleatoriamente a recibir lenvatinib (24 mg/día en 28 días del ciclo) y 131 pacientes recibieron placebo. La media de SLP fue significativamente mayor en el grupo de lenvatinib: 18.3 vs. 3.6 meses (p < 0.001). A los 6 meses, la SLP fue de 77.5 vs. 25.4% en el grupo placebo. La respuestas fue superior con lenvatinib (64.8 vs. 1.5%; p < 0.001). Se logró respuesta parcial en el 63.2% y respuesta completa en el 1.5%112. Las ventajas se mantuvieron en los pacientes de edad más avanzada113.
El estudio fase III DECISION evaluó sorafenib en pacientes con CDT localmente avanzado o metastásico y refractario a131I, a dosis de 400 mg cada 12 h. Se incluyeron 416 pacientes, 207 en el grupo de sorafenib y 209 en el grupo placebo; se encontró superioridad en el grupo de sorafenib (SLP: 10.8 vs. 5.8 meses; p < 0.0001)114.
El lenvatinib, en comparación con el sorafenib, demostró beneficio en pacientes previamente tratados con otros ICT.
Pregunta clínica 45. ¿Cuáles son los efectos colaterales más frecuentes de los inhibidores de tirosinacinasa?
Recomendación. Se recomienda el uso de ICT aprobados solo luego de considerar cuidadosamente los beneficios y la toxicidad del tratamiento. Considere que la mayor parte de los pacientes se mantienen asintomáticos incluso con enfermedad diseminada. Nivel de evidencia 1+, grado de recomendación A.
Revisión de la literatura y análisis. Los eventos adversos grado 3 del lenvatinib reportados en el estudio SELECT fueron del 75.9% en el grupo de lenvatinib. Los efectos más comunes fueron hipertensión (68%), diarrea (59%), fatiga/astenia (59%), disminución del apetito (50%), pérdida de peso (46%), náusea (41%) y proteinuria (31%). Se reportaron 6 muertes: un caso de embolia pulmonar, un EVC hemorrágico, otro por deterioro del estado general de salud y 3 muertes súbitas; el 67.8% de los pacientes requirieron reducción de dosis a 17.2 mg/día; en el 14.2% de los casos se suspendió el tratamiento por eventos adversos. La hipertensión fue de fácil manejo115.
En cuanto a la toxicidad del sorafenib, se reportó grado 1 o 2 en 98.6 vs. 87.6% en el grupo de placebo, siendo el síndrome de mano-pie el más frecuente (76.3%) y también diarrea (68.6%), alopecia (67.1%), rash o descamación (50.2%), fatiga (49.8%), pérdida de peso (46.9%) e hipertensión (40.6%). Se requirió reducción de dosis en el 64.3% de los casos y la suspensión por efectos adversos en el 18.8% de los pacientes113; esto ha sido corroborado por metaanálisis recientes116,117.
Aunque no se han comparado directamente ambos fármacos, el lenvatinib parece más eficaz. Antes de iniciar tratamiento con ICT se debe considerar que estos fármacos son relativamente costosos y tóxicos, que incrementan la SLP, pero no la supervivencia global, y que muchos pacientes se mantienen asintomáticos y estables durante años solo con supresión de la TSH, por lo que un periodo de vigilancia activa inicial o considerar cirugía o RT en lesiones localizadas puede ser lo más apropiado118.
El tratamiento se reserva para enfermedad progresiva, sintomática o localizada en sitios que amenazan estructuras vitales no susceptibles de tratamientos locales119.
Investigación futura
Existen temas dentro de la guía que no tienen respuestas o que la evidencia no ha alcanzado la cobertura adecuada para dar poder a ciertas recomendaciones, por lo que mundialmente existen grupos de trabajo que se encargan de crear protocolos dirigidos a responder estas dudas. Un ejemplo de ello es el papel de la inmunoterapia en el cáncer de tiroides, en las diferentes modalidades. Existe mucho por explorar y aún hay que definir el tratamiento optimo del cáncer de tiroides, por ello en México debemos continuar en la suma de esfuerzos para establecer grupos cooperativos y concretar protocolos que apoyen el entendimiento y contribuyan a la evidencia en la literatura global de la enfermedad.
Actualización
Se planea un periodo de actualización de la GPC para incorporar nueva evidencia científica a las recomendaciones de 2 a 3 años.
Declaración de conflictos de interés
SRR, AMA, BCS, JAGO, JEBR, MLGT, CHAS, NGO, CFV, MHM, FJLR, LARR, DRS, BHH, JATT, YLBA, MAP y FJOC declaran no tener ningún conflicto de interés. RCGA ha participado como speaker y ha formado parte de Advisory Boards de Pfizer y Roche. RVV ha participado como speaker y ha formado parte de Advisory Boards de Amgen, Merck y Roche. JLMB, LVH, AGG, JAGO, BMV, MAFM, MZT, MAO y GMR recibieron honorarios como parte del grupo metodológico independiente.
Información importante
Esta GPC y los documentos que sean publicados basados en ella representan herramientas originadas por el consenso de expertos clínicos acerca de las terapias y toma de decisiones vigentes para el tratamiento del CDT. Este documento ha sido publicado para que especialistas consideren las recomendaciones clínicas y las incorporen a la toma de decisiones de su práctica clínica cotidiana. Sin embargo, estas recomendaciones no se encuentran por encima del criterio clínico independiente de cada médico y de las condiciones individuales de cada paciente.











 nueva página del texto (beta)
nueva página del texto (beta)








