Introducción
La médula ósea (MO) es un tejido de alta renovación celular, un factor que limita la aplicación de quimioterapia e irradiación es la toxicidad asociada con la mielosupresión. El continuo avance en el conocimiento de las células madre hematopoyéticas y su microambiente han permitido idear procedimientos que pueden eludir esta toxicidad1. Se han propuesto estudios de imagen como la resonancia magnética, la tomografía computarizada por emisión de fotón único y la tomografía por emisión de positrones para identificar las regiones hematopoyéticamente activas2-4. Algunas técnicas de teleterapia tales como la Radioterapia de Intensidad Modulada (IMRT) pueden utilizarse para excluir la MO activa fomentando su preservación, mejorando así la tolerancia a los campos de radiación, la quimioterapia, prevenir hospitalizaciones y disminuir la necesidad de transfusiones o factores estimulantes de granulocitos5,6. El objetivo de la presente revisión es fomentar el conocimiento e incorporación de las técnicas de preservación de MO con radioterapia en nuestro medio.
Anatomía y distribución de la médula ósea
La MO está compuesta principalmente por dos compartimentos celulares, el hematopoyético y el estromal; habitualmente se clasifica como médula roja, médula amarilla, componentes óseos y un sistema de soporte (estroma). La médula roja representa el tejido activo hematopoyético, con alta capacidad de autorrenovación, proliferación y diferenciación en líneas celulares después de la estimulación por diferentes factores de crecimiento7,8, su desarrollo está regulado localmente por las células estromales, lo que sugiere un microambiente inductivo hematopoyético y no solamente de soporte9.
Al nacer, la médula roja está presente en todo el esqueleto, la conversión de la médula inicia en el esqueleto apendicular distal y continúa en los huesos más proximales.
A los 25 años de edad, la distribución adulta de la médula roja persiste en el esqueleto axial, el húmero proximal y el fémur proximal; los principales sitios funcionales son la pelvis y las vértebras, que representan el 60% de la médula ósea total del cuerpo. En edad más avanzada, puede haber una mayor conversión de médula roja a amarilla, incluido el esqueleto axial. Utilizando los porcentajes medios de captación de fluorotimidina por región corporal, Campbell, et al. crearon un atlas de la distribución de la médula ósea funcional definidos por sexo y edad en una cohorte de pacientes adultos con cáncer de pulmón no microcítico (Tabla 1). En dicho estudio se encontró que las mujeres tenían mayores proporciones de la médula ósea funcional en la pelvis (23.9 vs. 22.2%, p = 0.038), ambos fémur proximales (6.9 vs. 5.1%, p < 0.01), y cráneo (7.9 vs. 5.1%, p < 0.01). Los hombres tenían mayores proporciones de la médula ósea funcional en el esternón (2.2 vs. 1.5%, p < 0.01), así como costillas, clavículas y escápulas (18.5 vs. 13.0%, p < 0.01). Este atlas podría ser una herramienta útil para guiar la planeación con radioterapia, sin embargo, cada caso debe individualizarse10.
Tabla 1 Atlas de distribución de médula ósea funcional
| Sitio | Porcentaje de médula ósea activa |
|---|---|
| Pelvis | 22.8% |
| Columna torácica | 17.7% |
| Costillas, clavícula y escápula | 16.6% |
| Columna lumbar | 14.8% |
| Sacro | 7.2% |
| Base de cráneo y huesos faciales | 6% |
| Fémur proximal bilateral | 5.7% |
| Columna cervical | 3.7% |
| Húmero proximal bilateral | 3.5% |
| Esternón | 2.0% |
Datos derivados de Campbell BA. Int J Radiat Oncol Biol Phys. 2015;92:1035-4310.
Radiobiología hematopoyética y estromal
El desarrollo de técnicas para ensayos de colonias de células hematopoyéticas ha permitido el estudio de los efectos de irradiación. En general las curvas de supervivencia tienen hombros pequeños11. Las curvas de supervivencia se caracterizan por dos parámetros, la «n» y la «Do». El hombro en la curva de supervivencia indica que las células son capaces de reparar el daño subletal. Esto se expresa mediante el número de extrapolación «n» (la intersección de la porción recta de la curva con el eje y) o la dosis cuasiumbral «Dq». La pendiente de la porción recta de la curva de supervivencia representa la radiosensibilidad de las células a niveles de dosis más altos y se expresa como «Do» (dosis necesaria para reducir el número de colonias al 37% del número inicial). Un estudio ha demostrado que las unidades formadoras de colonias de granulocitos/macrófagos al día 7 obtuvieron un «Do» de 115cGy con «n» = 1.0, lo que indica que estos progenitores tienen poca o ninguna capacidad para reparar el daño subletal12. Los progenitores de eritroides también son muy radiosensibles y tienen un potencial de reparación mínimo, con «Do» de 113cGy y «n» de 1.513.
El microambiente medular es un tejido de proliferación lenta, el daño a su capacidad de renovación se expresa tardíamente. Los efectos de irradiación con una alta tasa de dosis sobre la capacidad proliferativa de los progenitores fibroblásticos han demostrado un «Do» entre 99 y 130 cGy, la reducción de la tasa de dosis de 200 cGy a 5 cGy/min cambió el «Do» de 99 a 146 cGy14. No solo la reducción de la tasa de dosis, sino también el fraccionamiento de la dosis tiene un efecto conservador sobre los progenitores estromales15. En seres humanos, el análisis de la repoblación hematopoyética después de irradiación local a dosis de 4000 cGy demostró que la falla hematopoyética local se produjo debido a un daño irreversible en el microambiente de la MO16.
Toxicidad por radioterapia
La MO es muy radiosensible y manifiesta daño ante cualquier dosis. La destrucción de las células madre y precursoras se traduce periféricamente con la disminución progresiva de las células sanguíneas; la secuencia y tasa de declinación celular refleja la cinética medular de producción y maduración.
La linfopenia ocurre inmediatamente después de dosis moderadas de radiación, debido a su alta radiosensibilidad y muerte en interfase. Después de 30-40 Gy a grandes volúmenes de MO, la neutropenia ocurre en la primera semana, seguida por trombocitopenia en 2-3 semanas y anemia en 2-3 meses (Fig. 1)17.

Figura 1 Secuencia y cambios después de irradiación corporal (reproducido con permiso de Andrews, et al., 196717).
La dosis de radiación, la tasa de dosis y el volumen afectan la respuesta aguda de la MO. Cuando se irradian campos pequeños de MO que comprenden solo el 10-15%, la médula ósea no expuesta responde aumentando su población de células progenitoras18. Por lo tanto, no se observan efectos agudos a menos que se usen campos muy grandes que contengan una porción sustancial de MO.
El daño en el estroma explica los efectos crónicos por radiación. La irradiación a un campo pequeño entre 10-15% de la MO con dosis fraccionadas hasta 30 Gy o dosis únicas de 20 Gy produce una ablación o hipoplasia permanente19, sin embargo la capacidad de la médula no expuesta para compensar acelerando su tasa de hematopoyesis es suficiente. Cuando se irradian volúmenes corporales que incluyen el 50-75% de la MO, la actividad hematopoyética aumenta en los segmentos de la médula no expuesta, seguido de la extensión de la médula en funcionamiento en áreas previamente inactivas. Con dosis de 50 Gy existe daño irreparable a la microvasculatura asociado con fibrosis de la MO20.
Técnicas de imagen y planeación con radioterapia
La MO puede evaluarse utilizando técnicas no invasivas como la resonancia magnética y la exploración de medicina nuclear tomografía computarizada por emisión de fotón único, tomografía por emisión de positrones. La MO roja representa la porción hematopoyéticamente activa, con el avance de la edad, existe disminución de las trabeculaciones óseas y la subsecuente conversión hacia MO amarilla.
Resonancia magnética
En la secuencia T1, la médula roja se muestra como una intensidad de señal disminuida, menor que la grasa subcutánea, pero más alta que los discos intervertebrales o tejido muscular, la médula amarilla se muestra como una señal hiperintensa comparable con la grasa subcutánea en T1. Con la técnica STIR, se suprime la señal de la grasa y se preserva la señal del agua, proporcionando así un alto contraste tisular, que es muy útil en la evaluación de la médula ósea21.
La incorporación de la RM a la IMRT como un medio para reducir el volumen de MO pélvica irradiada fue realizada por Roeske JC, et al22.
En el plan convencional (no IMRT), la mayoría de los sitios de MO activos se incluyeron dentro de las líneas de isodosis del 70-100%. Cuando se ingresó la MO como una restricción en el plan de tratamiento, se observó una reducción en el volumen de MO irradiado de 50-100% (Fig. 2).

Figura 2 A la izquierda, plan convencional con RT3d. En medio plan con IMRT (sin limitación de dosis a MO). A la derecha, plan IMRT (con limitación de dosis a MO). Obsérvese que la mayor conformidad de la IMRT reduce el volumen de MO irradiado en las crestas ilíacas en este último corte. Se delineó MO con base en RM ponderada en T1 (reproducido con permiso de Roeske, et al., 200422). IMRT: radioterapia de intensidad modulada; MO: médula ósea.
Tomografía computarizada por emisión de fotón único (SPECT)
La incorporación de imágenes funcionales de MO en el proceso de planificación del tratamiento es otro enfoque. Los coloides de azufre como el Tc-99m son un ejemplo; este último habitualmente es secuestrado por los macrófagos asociados con la médula roja, y por lo tanto proporcionan un sustituto para la distribución de la médula activa23,24.
En un estudio de Roeske JC, et al. se incorporaron imágenes de SPECT en el proceso de planificación del tratamiento para reducir el volumen de MO irradiado en pacientes ginecológicos. Las áreas de mayor densidad de MO activa (MOA) se observaron en las vértebras lumbares, el sacro y la cresta ilíaca medial.
La técnica de IMRT redujo la dosis a estas áreas en un 50% para dosis superiores a 30 Gy en comparación con la planeación convencional; el plan IMRT no comprometió la cobertura del Planning Target Volume (PTV) o la preservación de los tejidos normales (Fig. 3)25.

Figura 3 Curvas de isodosis en pelvis para un plan de 4 campos convencional (A), un plan IMRT sin disminución de dosis de MO (B), un plan IMRT con delineación de MO solo con tomografía (C) y un plan IMRT con delineación MO con SPECT (D). El PTV en verde y la MO definida por SPECT se muestra en rojo. Se destacan las curvas de isodosis del 100% (magenta), el 90% (amarillo), el 70% (azul claro) y el 50% (naranja) (reproducida con permiso de Roeske, et al., 200525). IMRT: radioterapia de intensidad modulada; MO: médula ósea; SPECT: tomografía computarizada por emisión de fotón único.
Tomografía por emisión de positrones (PET CT)
Las imágenes funcionales con 18F-fluorodesoxiglucosa (18F-FDG-PET) pueden identificar subregiones dentro de la MO con valores de captación estandarizados más altos (SUV)26. En un estudio reciente se cuantificaron los cambios longitudinales de la MOA en pacientes con cáncer de cuello uterino tratados con quimiorradioterapia concomitante (QRC).
Los autores encontraron un aumento en la respuesta compensadora de MO extrapélvica, así como una mayor respuesta compensatoria en pacientes tratados con cisplatino en comparación con cisplatino más gemcitabina (p = 0.057), concluyendo que los pacientes tienen diferentes respuestas compensatorias subagudas después de la QRC, debido a la recuperación variable en la médula no irradiada (Fig. 4)27.
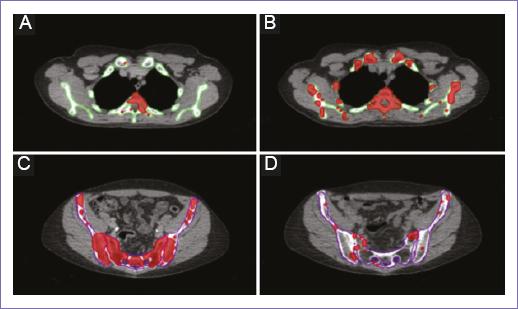
Figura 4 Cambios en la MOA pre y post QRC. Se muestra un volumen creciente de MOA (rojo) dentro de los huesos extrapélvicos, comparación pre (A) y post-tratamiento (B). Se muestra un volumen decreciente de MOA (rojo) dentro de los huesos pélvicos antes (C) y después (D) del tratamiento (reproducido con permiso de Noticewala, et al., 200727). MOA: médula ósea activa; QRC: quimiorradioterapia concomitante.
Una modalidad de imagen novedosa es la PET 18F-fluorotimidina (18F-FLT-PET), la captación de este análogo de timidina refleja el nivel de células que experimentan síntesis de ADN; algunos autores han demostrado una correlación entre la captación de 18F-FLT y la actividad de la MO, así como su distribución corporal28,29. Otros autores han demostrado su aplicación para monitorear cuantitativamente los cambios en el metabolismo de la MO debido a la QRC30, y como se mencionó anteriormente, también se ha utilizado para crear un atlas de la distribución de la MO funcional.
Técnicas avanzadas de radioterapia con preservación de médula ósea
La QRC es una estrategia que se usa en diversos tipos tumorales en toda la economía corporal. Por ejemplo, en pacientes con neoplasias pélvicas locorregionalmente avanzadas (que incluyen cáncer cervical, anal y rectal), la toxicidad hematológica aguda de alto grado ocurre en el 25 al 33% de los pacientes tratados con QRC estándar. Esto puede conducir a hospitalizaciones, interrupciones del tratamiento, necesidad de factores de crecimiento, antibióticos e infecciones, además podría generar una administración de quimioterapia subóptima31. Por otro lado, en la población pediátrica un estudio demostró que entre los pacientes que recibieron > 16 Gy para la MO activa, el riesgo de leucemia secundaria fue aproximadamente 4 veces mayor, por lo que las nuevas tendencias como la protonterapia se perfilan como una estrategia que podría mejorar dicho riesgo32. Es importante conocer el porcentaje de MO involucrada con los campos de radioterapia estándar (Tabla 2), así como también definir las ventajas que pueden ofrecer las aplicaciones avanzadas de la radioterapia para maximizar la preservación de MO activa33.
Tabla 2 Porcentaje de médula ósea (MO) involucrada con campos de radioterapia estándar
| Sitio | Porcentaje de MO en riesgo |
|---|---|
| Ganglios paraaórticos superiores | 45% |
| Pelvis | 26% |
| Manto (linfomas) | 25% |
| Sacro | 14% |
| Vertebras torácicas | 14% |
| Cráneo | 12% |
Adaptada de Ellis, et al., 196133.
A continuación se describen algunos estudios que han incorporado las nuevas técnicas de imagen en la planeación con radioterapia, así como la correlación de dosimetría en la MO y toxicidad hematológica.
En un estudio retrospectivo, se analizaron 37 pacientes con cáncer de cuello uterino tratados con QRC (IMRT). La MO solo se delineó en tomografía computarizada y se dividió en tres subsitios: columna lumbosacra, ilion y pelvis inferior. El aumento de V10 en MO (MO-V10) se asoció con leucopenia y neutropenia grado 2 (p = 0.006), los pacientes con MO-V10 > 90% tuvieron tasas más altas de leucopenia grado 2 o mayor, así como neutropenia, en comparación con los pacientes con MO-V10 < 90% (11.1 vs. 73.7%; p < 0.01; 5.6 vs. 31.6%; p = 0.09). Los parámetros dosimétricos que incluían la columna lumbosacra y la pelvis inferior tuvieron mayor asociación con toxicidad hematológica en comparación al ilion34.
En un estudio de cohorte de 17 pacientes con cáncer de cuello uterino tratados con QRC se definió la relación entre la respuesta de la MO y la dosis de radiación mediante el uso de 18F-FDG-PET. El hueso pélvico se consideró como MO total (MOTOT), la MO activa se contorneó en función de SUV mayor que el SUV medio de la MOTOT. El volumen de MOA se redujo significativamente después del tratamiento (de 651.5 a 231.6 cm3; p < 0.0001), el V30 se correlacionó con una reducción en SUV MOA (p < 0.001), y a su vez la reducción en SUV MOA (p < 0.001), y a su vez la reducción en SUV MOACT se correlacionó significativamente con la reducción de leucocitos a los 3 meses después del tratamiento (p = 0.04)35.
En un estudio clínico prospectivo, se utilizó la 18F-FLT-PET para limitar la dosis a la MOA pélvica utilizando IMRT. Las dosis de radiación de 4 Gy causaron una disminución del 50% en la captación de FLT en la MO pélvica después de 1 o 2 semanas de tratamiento con QRC. La captación de FLT en las regiones de MO pélvica que recibieron > 35 Gy fueron un 18.8% mayor a los 30 días después de finalizado el tratamiento en comparación a 1 año después de este.
Los recuentos de leucocitos, plaquetas, linfocitos y neutrófilos a 1 año después del tratamiento fueron todos menores en comparación con los valores previos a la terapia (p < 0.05). Aunque los planes de IMRT redujeron la dosis a la MO pélvica definida con FLT, la reducción de la toxicidad hematológica aguda fue difícil debido a la alta radiosensibilidad de la MO (4 Gy), así como la mielosupresión crónica con aquellas regiones que recibieron dosis > 35 Gy36.
Un estudio multicéntrico de fase II (grupo INTERTECC) reclutó pacientes con carcinoma de cuello uterino en estadio IB-IVA. Todos los pacientes recibieron cisplatino concomitante con IMRT, seguido de braquiterapia intracavitaria de acuerdo a protocolo. El análisis de subgrupos demostró que la IMRT guiada por imagen basada en PET (IG-IMRT) disminuyó la dosis a la MO funcional. Los pacientes tratados con IG-IMRT tuvieron una incidencia significativamente menor de neutropenia grado 3 en comparación con los pacientes tratados sin esta modalidad (8.6 vs. 27,1%; p = 0.035); también se demostró una incidencia no significativamente menor de leucopenia grado 3 (25.7 vs. 41.7%; p = 0.13) y cualquier grado 3 de toxicidad hematológica (31.4 vs. 43.8%; p = 0.25)37.
Por otro lado, en 48 pacientes con cáncer anal tratados con quimioterapia e IMRT, la toxicidad se manifestó como leucopenia grado 3-4 en el 56%, neutropenia en el 50%, anemia en el 8% y trombocitopenia en el 27%; en el análisis de regresión múltiple, los factores asociados significativamente con disminución de los leucocitos y neutrófilos (p < 0.05) fueron el aumento de V5, V10, V15 y V20 en MO pélvica. La positividad de los ganglios linfáticos se asoció significativamente con una disminución del nadir de leucocitos (p < 0.05)38.
En un estudio de cohorte de 48 pacientes con cáncer de pulmón de células no pequeñas tratados con QRC se determinaron las relaciones entre las dosis de radiación a la MO torácica y la disminución en el recuento de células sanguíneas. Se evaluaron los parámetros del histograma dosis-volumen para las vértebras torácicas (VT), el esternón, las escápulas, las clavículas y las costillas. Una mayor dosis a las VT se asoció con un mayor riesgo de leucopenia grado 3. Los valores para evitar la leucopenia grado 3 fueron la dosis vertebral media < 23.9 Gy, TVV20 < 56.0% y TVV30 < 52.1%. En el análisis de regresión múltiple, TVV30 (p = 0.018) y TVV20 (p = 0.048) se asociaron con el nadir de leucocitos39.
Con los datos de referencia en la literatura, la definición de la MO se puede realizar solamente sobre la tomografía de simulación al delinear/contornear el sistema óseo de la región de interés como su sustituto (huesos pélvicos/cuerpos vertebrales, etc.); o bien, cuando se tiene la posibilidad de incorporar estudios de imagen (RM, PET, etc.) para una mejor definición de la MO activa. Las restricciones de MO se sugieren en base a los estudios ya referidos, algunos autores observaron menor toxicidad hematológica con algunos parámetros dosimétricos en MO que se resumen en la tabla 3.
Tabla 3 Parámetros dosimétricos en médula ósea asociados con menor toxicidad hematológica
| Región de médula ósea | Parámetros dosimétricos | |
|---|---|---|
| Pelvis | V10 | <90% |
| V20 | <75% | |
| Media | <35Gy | |
| Columna torácica (T1 a T10) | V20 | <56% |
| V30 | <52% | |
| Media | <23.9Gy | |
Finalmente, se ha demostrado que las propiedades de los protones son dosimétricamente superiores a los fotones en numerosos entornos, con una dosis integral más baja y una conformidad de dosis mejorada40. En general, se espera que la radiación con protones proporcione un control tumoral equivalente mientras se reducen los efectos adversos de la radiación41. Aunque una descripción detallada de la terapia de protones está más allá del alcance de esta revisión, un buen ejemplo de su aplicación en preservación de MO se ha establecido en padecimientos que involucran tratamientos a cráneo-neuroeje con resultados alentadores; en un análisis fase 2, la toxicidad hematológica aguda grado 3 se manifestó como neutropenia (32%), anemia (5%), linfopenia (17%) y trombocitopenia (3%)42.
Conclusión
Las técnicas avanzadas de radiación tales como la Radioterapìa de Intensidad Modulada (IMRT) o la protonterapia pueden utilizarse para disminuir la dosis a la MO activa.
La protección de la MO funcional reduce la incidencia y gravedad de la toxicidad hematológica, conduciendo a una mejor tolerancia de tratamientos con quimioterapia y radioterapia, evitando hospitalizaciones, disminuyendo riesgo de infecciones, necesidad de transfusiones y uso de factores estimulantes de colonias de granulocitos, aspecto que puede tener una traducción positiva en el costo beneficio de los tratamientos para los pacientes.











 nueva página del texto (beta)
nueva página del texto (beta)


