Introducción
En España en el año 2015 el cáncer de ovario representó el noveno cáncer más frecuente en la mujer, con un total de 3,228 casos nuevos diagnosticados1. El cáncer epitelial de ovario (CEO), el cáncer de trompa de Falopio (CTF) y la carcinomatosis peritoneal primaria (CPP) se asocian con mal pronóstico, debido a que en la práctica clínica en la mayoría de los casos suelen presentarse en estadios avanzados en el momento del diagnóstico, al no existir métodos de cribado poblacional efectivos y presentar síntomas inespecíficos en las fases iniciales de la enfermedad2,3. Aunque la mayoría de los casos de CEO, CTF y CPP son esporádicos, se estima que el 11-15% de los casos son de carácter hereditario, sobre todo debido a la presencia de mutaciones en líneas germinales de genes de alta penetrancia como BRCA-1 y BRCA-2 (síndrome de cáncer de mama y ovario hereditario)4,5. Por ello, actualmente se recomienda realizar consejo genético oncológico a todas las pacientes con CEO no mucinoso, CTF y CPP6,7.
El tratamiento de CEO, CTF y CPP se basa fundamentalmente en la cirugía citorreductora (CCR) de máximo esfuerzo, con el objetivo de obtener una citorreducción óptima (CCR0) dejando solo enfermedad residual microscópica, en combinación con quimioterapia basada en sales de platino en los casos de alto riesgo de recidiva8,9. Sin embargo, a pesar de los notables avances en el conocimiento de la biología molecular y la aparición de nuevos tratamientos oncológicos sistémicos (bevacizumab, inhibidores de las enzimas poli-ADP-ribosa-polimerasas [PARP])10,11, el cáncer de ovario continúa siendo la primera causa de muerte por cáncer ginecológico y la quinta causa de muerte por cáncer en las mujeres españolas12. En su conjunto, el pronóstico de las pacientes con CEO, CTF y CPP es pobre, con una probabilidad de supervivencia global (SG) a los 5 años de 37-47%13. La SG de estas pacientes disminuye a medida que aumenta el estadio de la enfermedad al diagnóstico según la clasificación de la International Federation of Gynecology and Obstetrics (FIGO). La SG a los 5 años de las pacientes con estadios localizados (estadios I y II) en su conjunto es de alrededor del 80%, en comparación con los estadios avanzados (estadios III y IV), donde la SG a los 5 años es de tan solo 10-30%14.
Por este motivo, hemos llevado a cabo un estudio de una serie de 43 casos consecutivos de pacientes con CEO, CTF y CPP que han sido diagnosticadas y tratadas en nuestro centro desde su apertura en octubre de 2011 (usando la base de datos del Registro de Tumores del Hospital), con el objetivo de determinar el pronóstico de estas pacientes tratadas con CCR y/o quimioterapia basada en platino en condiciones reales (datos de la vida real), así como conocer la proporción de pacientes que presentan mutaciones germinales en los genes relacionados con CEO hereditario y su posible correlación con el pronóstico y las características clinicopatológicas. En nuestro centro se diagnostican de media unas 68 pacientes nuevas al año con tumores ginecológicos y el cáncer de endometrio es el tumor ginecológico más frecuente, seguido por el cáncer de cérvix y de ovario.
Material y métodos
Hemos llevado a cabo un análisis descriptivo y analítico de carácter retrospectivo de una serie de casos consecutivos de pacientes con CEO, CTF y CPP que han sido diagnosticadas y tratadas en nuestro centro desde su apertura en octubre de 2011. En este estudio se incluyeron todas las pacientes con diagnosticado histopatológico de CEO, CTF y CPP en cualquier estadio FIGO (estadios I, II, III y IV) registradas en la base de datos del Registro de Tumores de nuestro Hospital entre octubre de 2011 y octubre de 2017, y que además hubieran sido diagnosticadas y tratadas (CCR y/o quimioterapia basada en platino en primera línea de tratamiento) en nuestro centro, con el objetivo de determinar el pronóstico de estas pacientes en condiciones reales, así como conocer la proporción de pacientes que presentan mutaciones germinales en los genes relacionados con CEO hereditario y su posible correlación con las características clinicopatológicas y el pronóstico. Todas las pacientes del estudio dieron su consentimiento informado por escrito para el inicio del tratamiento con quimioterapia basada en platino en primera línea de tratamiento y/o para la CCR, así como para su inclusión en este estudio. Se excluyó del presente estudio a todas las pacientes con diagnóstico histopatológico diferente a CEO, CTF y CPP, las pacientes que no hubieran completado el tratamiento (CCR y/o quimioterapia basada en platino en primera línea) en nuestro centro, hubieran tenido una pérdida de seguimiento o presentaran un segundo tumor maligno sincrónico o metacrónico.
El presente estudio se ha llevado a cabo en consonancia con el código ético de la Organización Mundial de la Salud (Declaración de Helsinki).
Estrategias terapéuticas
Las pacientes del estudio fueron tratadas en la práctica clínica siguiendo una de las siguientes estrategias terapéuticas, tras decisión multidisciplinaria en el Comité de Tumores Ginecológicos de nuestro centro:
Si la enfermedad tumoral era considerada resecable de entrada, las pacientes eran sometidas a CCR primaria de máximo esfuerzo, seguido de quimioterapia basada en sales platino en los casos con criterios clinicopatológicos de alto riesgo de recidiva (estadio FIGO IC o G3, estadio FIGO II y estadio FIGO III). Los diferentes esquemas de quimioterapia empleados fueron: a) carboplatino área bajo la curva de 6 más paclitaxel 175 mg/m2 cada 21 días (CP) por vía intravenosa; b) CP más bevacizumab 15 mg/kg cada 21 días seguido de bevacizumab de mantenimiento por vía intravenosa hasta un máximo de 15 meses (CP-B), solo en los casos con estadios avanzados (estadios FIGO III y IV), y c) capecitabina 1,000 mg/m2 cada 12 horas durante 14 días por vía oral más oxaliplatino 130 mg/m2 intravenosa cada 21 días (CAPEOX), solo en los casos con diagnóstico de carcinoma mucinoso de ovario.
Si la enfermedad tumoral era considerada irresecable de entrada (estadio FIGO IIIC con carga tumoral y estadio FIGO IV), las pacientes eran tratadas con quimioterapia preoperatoria o de primera línea con los mismos esquemas descritos, seguido de CCR de intervalo de máximo esfuerzo en los casos con respuesta radiológica.
Estudios genéticos
A las pacientes con diagnóstico de CEO no mucinoso, CTF y CPP, siguiendo las recomendaciones de las guías clínicas actuales, se les ofreció la posibilidad de realizar asesoramiento genético en nuestra Unidad de Consejo Genético Oncológico. Todas las pacientes que aceptaron el estudio genético dieron su consentimiento informado por escrito para la realización del test y posteriormente se les extrajo una muestra de sangre periférica (un tubo de hemograma). Las muestras de sangre periférica fueron analizadas con una plataforma multigenes mediante la tecnología de secuenciación masiva. Esta plataforma incluye diversos genes relacionados con cáncer de mama y/u ovario hereditario (BRCA-1, BRCA-2, CHEK2, PALB2, BRIP1, TP53, PTEN, STK11, CDH1, ATM, BARD1, MLH1, MRE11A, MSH2, MSH6, MUTYH, NBN, PMS1, PMS2, RAD50 y RAD51C). La prueba de secuenciación genética se realizó utilizando un kit de captura de NimbleGen diseñado a medida y una plataforma Hiseq (Illumina) para su posterior secuenciación. Esta plataforma, en general, permite el análisis de más del 95% del gen diana con una sensibilidad superior al 99%. De esta forma, las mutaciones puntuales, las microinserciones, las deleciones y las duplicaciones (< 20 pb) pueden ser analizadas de forma simultánea.
Análisis estadístico y objetivos del estudio
Los objetivos primarios de nuestro estudio fueron el análisis de la supervivencia libre de progresión (SLP) y de la SG en el conjunto global de las pacientes del estudio, así como su análisis estratificado según diferentes subgrupos predeterminados: a) estadio FIGO (I-II vs. III-IV); b) subtipo histológico (seroso vs. mucinoso); c) tipo de CCR (óptima vs. subóptima), y d) tipo de tratamiento primario (CCR primaria vs. quimioterapia de entrada). La SLP y la SG en este estudio fueron expresadas tanto en forma de medianas con el intervalo de confianza al 95% (IC 95%), como en forma de probabilidad de SLP y SG a 1, 3 y 5 años. En el estudio, la SLP hacía referencia al periodo de tiempo que comprendía desde la fecha de inicio del tratamiento primario (CCR o quimioterapia) hasta la fecha en la que se produjo cualquiera de los siguientes eventos: progresión, muerte o fecha de último contacto si la paciente continuaba viva y libre de progresión. La SG hacía referencia al periodo de tiempo que comprendía desde la fecha del diagnóstico histopatológico hasta la fecha en la que se produjo la muerte o fecha de último contacto si la paciente continuaba viva.
En el estudio el intervalo libre de platino (ILP) se definió como el periodo que comprendía entre la fecha de la administración del último ciclo de quimioterapia basada en platino y la fecha de progresión. En función del ILP las pacientes con progresión fueron clasificadas como: a) refractarias al platino (progresión durante el periodo de administración de quimioterapia); b) resistentes al platino (si el ILP era inferior a 6 meses); c) sensibles intermedias al platino (si el ILP era de 6-12 meses), y d) sensibles altas al platino (si el ILP era superior a 12 meses).
Los objetivos secundarios del estudio fueron:
El análisis de la supervivencia posprogresión (SPP), definida como el periodo de tiempo que comprendía desde la fecha de progresión hasta la fecha de muerte o último contacto si la paciente continuaba viva, en el subgrupo de pacientes con progresión de la enfermedad tumoral tras CCR y/o quimioterapia de primera línea.
El análisis descriptivo de las mutaciones germinales en los genes relacionados con el CEO hereditario encontradas en las pacientes del estudio y su correlación con el pronóstico y las características clinicopatológicas.
Para el análisis estadístico del estudio se recurrió al empleo del paquete estadístico SPSS® versión 12.0, utilizando el método de Kaplan y Meier para el análisis de la SLP y la SG; para la comparación de las distintas curvas de supervivencias se empleó el log-rank test.
Resultados
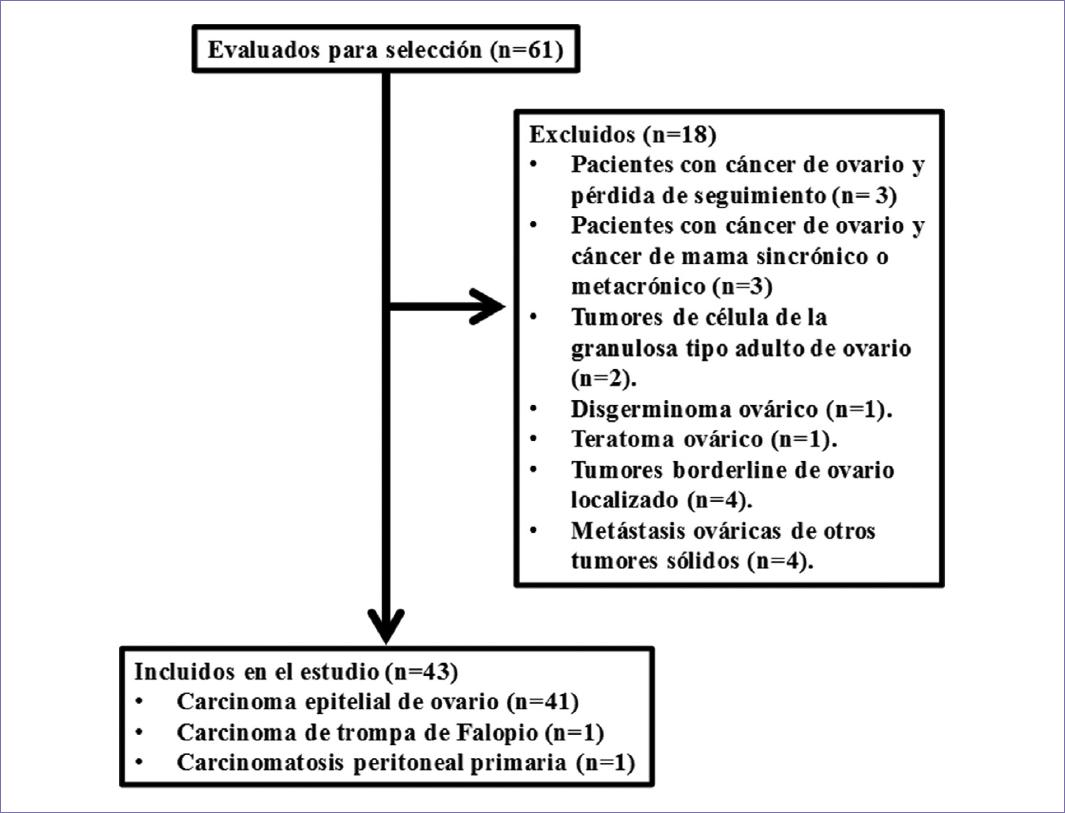
De las 61 pacientes registradas en la base de datos del Registro de Tumores de nuestro centro como tumores ováricos entre octubre de 2011 y octubre de 2017, un total de 43 pacientes consecutivas diagnosticadas de CEO, CTF y/o CPP fueron finalmente incluidas en el estudio para el análisis de los objetivos primarios y secundarios; excluyéndose 18 pacientes como se detalla en la figura 1.
Las características clinicopatológicas basales de las pacientes incluidas en el estudio se resumen en la tabla 1. La mediana de edad de las pacientes del estudio (n = 43) fue de 59 años (rango: 29-82). El 68% de las pacientes del estudio (n = 29) presentaban estadios avanzados (estadios FIGO III-IV) en el momento del diagnóstico, el 95% tenía CEO, el 63% presentaba carcinoma seroso de alto grado y el 95% tenía un buen estado general y funcional (Performance Status [PS] de 0-1). El 58% de las pacientes (n = 25) fueron intervenidas de entrada al ser considerada la enfermedad resecable, el 35% fueron sometidas a CCR de intervalo tras quimioterapia y 3 pacientes no tuvieron CCR en ningún momento de su evolución (todas ellas con estadio FIGO IV). En total, 33 pacientes incluidas en el estudio tuvieron una CCR óptima (CCR0), 23 pacientes de entrada y 10 de intervalo. El 88% de las pacientes del estudio fueron tratadas con quimioterapia de primera línea basada en platino (60% con CP, 23% con CP-B y 5% con CAPEOX).
Tabla 1 Características clinicopatológicas basales de la población total del estudio (n = 43)
| Variable | N | Proporción |
|---|---|---|
| Edad | ||
| < 60 años | 25 | 58% |
| > 60 años | 18 | 42% |
| Performance Status (PS) al diagnóstico | ||
| 0 | 25 | 58% |
| 1 | 16 | 37% |
| 2 | 2 | 5% |
| Estadio FIGO | ||
| IA | 5 | 12% |
| IC | 7 | 15% |
| IIA | 2 | 5% |
| IIIB | 2 | 5% |
| IIIC | 22 | 51% |
| IV | 5 | 12% |
| Subtipo histológico | ||
| Carcinoma seroso | 27 | 63% |
| Carcinoma mucinoso | 7 | 15% |
| Carcinoma endometrioide | 5 | 12% |
| Carcinoma de células claras | 2 | 5% |
| Mixto | 2 | 5% |
| Localización del tumor primario | ||
| Ovario | 41 | 95% |
| Peritoneal | 1 | 2.5% |
| Trompa de Falopio | 1 | 2.5% |
| Grado histológico (G) | ||
| G1 | 6 | 14% |
| G2 | 3 | 7% |
| G3 | 34 | 79% |
| Tipo de cirugía citorreductora (CCR) | ||
| CCR óptima de entrada | 23 | 53% |
| CCR óptima de intervalo | 10 | 23% |
| CCR subóptima de entrada | 2 | 5% |
| CCR subóptima de intervalo | 5 | 12% |
| Sin CCR | 3 | 7% |
| Primer tratamiento recibido | ||
| Cirugía | 25 | 58% |
| Quimioterapia | 18 | 42% |
| Esquema de quimioterapia de primera línea | ||
| Capecitabina-oxaliplatino | 2 | 5% |
| Carboplatino-paclitaxel-bevacizumab | 10 | 23 |
| Carboplatino-paclitaxel | 26 | 60% |
| No quimioterapia | 5 | 12% |
| Antecedentes familiares oncológicos | ||
| No | 33 | 77% |
| Cáncer de mama | 5 | 12% |
| Cáncer de ovario | 4 | 9% |
| Cáncer de mama y ovario | 1 | 2% |
Objetivos primarios del estudio
Al cierre del estudio, en marzo de 2018, se habían producido un total de 15 eventos de SLP (15 pacientes con progresión de la enfermedad tumoral) y 8 eventos de SG (8 muertes por progresión franca de la enfermedad tumoral). Con una mediana de seguimiento de 36 meses (IC 95%: 27-44) para las pacientes vivas, la mediana de SLP del conjunto global de las pacientes del estudio (n = 43) fue de 53 meses (IC 95%: 16-90), con una probabilidad de SLP a 1 año, a 3 años y a 5 años del 84, 54 y 40%, respectivamente (Fig. 2). De las 15 progresiones de la enfermedad tumoral detectadas (34.9% de la población global), el 13% (n = 2) fue refractaria al platino, el 7% (n = 1) resistente al platino, el 20% (n = 3) presentaba sensibilidad intermedia al platino y el 60% restante (n = 9) sensibilidad alta al platino. La mediana de SG del conjunto global de las pacientes del estudio no se había alcanzado, y la probabilidad de SG a 1, 3 y 5 años fue del 89, 82 y 64%, respectivamente (Fig. 3). De las 8 muertes descritas (18.6% de la población global), el 62.5% se produjo en las pacientes con ILP menor a 12 meses (n = 5).

Figura 2 Curva de supervivencia libre de progresión de la enfermedad de la población total del estudio (n = 43).
En cuanto al análisis estratificado de la supervivencia según los subgrupos pre-especificados, la mediana de SLP en las pacientes con estadios localizados (estadios FIGO I-II; n = 14) no se había alcanzado (con 1 solo evento de SLP); mientras que en las pacientes con estadios avanzados (estadios FIGO III-IV; n = 29) fue de 27 meses (IC 95%: 9-45), habiendo ocurrido 14 eventos en este subgrupo, lo cual representa el 93.3% de los eventos de SLP. La probabilidad de SLP a 5 años fue del 86% en el subgrupo de pacientes con estadios localizados y del 21% en el subgrupo de pacientes con estadios avanzados (p = 0.025) (Fig. 4). La mediana de SG no se había alcanzado en ninguno de los dos subgrupos, y la probabilidad de SG a 5 años fue del 100% en el subgrupo de pacientes con estadios localizados y del 57% en el subgrupo de pacientes con estadios avanzados (p = 0.094). La probabilidad de SG a 5 años fue del 58% para las pacientes con estadio FIGO III y del 50% para las pacientes con estadios FIGO IV (p = 0.488).

Figura 4 Curvas de supervivencia libre de progresión de la enfermedad en función de estadios (estadios FIGO I-II vs III-IV).
En cuanto al subtipo histológico, la mediana de SLP fue de 25 meses (IC 95%: 11-39) en el subgrupo de pacientes con carcinoma mucinoso y de 27 meses (IC 95%: 10-44) en el subgrupo de pacientes con carcinoma seroso. La probabilidad de SLP a 5 años fue del 33% en el subgrupo con carcinoma mucinoso y del 41% en el subgrupo con carcinoma seroso (p = 0.149). La probabilidad de SG a 5 años fue del 67% para el subgrupo de pacientes con carcinoma mucinoso y del 56% para el subgrupo de pacientes con carcinoma seroso (p = 0.351). No se había alcanzado la mediana de SG en ninguno de los dos subgrupos.
En el subgrupo de pacientes sometidas a una CCR óptima la mediana de SLP no se había alcanzado, mientras que en el subgrupo de pacientes con CCR subóptima (con enfermedad residual macroscópica) fue de 11 meses (IC 95%: 4-18). La probabilidad de SLP a 5 años fue del 55% en el subgrupo con CCR óptima, en comparación con una probabilidad de SLP del 0% en el subgrupo de pacientes con CCR subóptima (p < 0.0001). La probabilidad de SG a 5 años fue del 86% en el subgrupo con CCR óptima y del 17% en el subgrupo con CCR subóptima (p < 0.0001); la mediana de SG no se había alcanzado en el subgrupo con CCR óptima y fue de 18 meses (IC 95%: 1-35) en el subgrupo con CCR subóptima.
Por último, en cuanto al tipo de tratamiento primario, en el subgrupo de pacientes tratadas con CCR de entrada (n = 25; 58% de la población total) la probabilidad de SLP a 5 años fue del 57%, en comparación con una probabilidad del 24% en el subgrupo de pacientes tratadas con quimioterapia como primer tratamiento (p = 0.008). La mediana de SLP no se había alcanzado en el primer subgrupo y fue de 25 meses (IC 95%: 17-33) para el segundo subgrupo. La probabilidad de SG a 5 años fue del 89% en el subgrupo de pacientes tratadas con CCR de entrada frente al 44% en el subgrupo de pacientes tratadas con quimioterapia de entrada (p = 0.097), con medianas de SG no alcanzada en el primer subgrupo y de 60 meses (IC 95%: 12-108) en el segundo subgrupo.
Objetivos secundarios del estudio
En el subgrupo de pacientes con progresión de la enfermedad tras CCR y/o quimioterapia de primera línea (n = 15), la mediana de SPP fue de 60 meses (IC 95%: 10-124) y la probabilidad de SPP a 5 años fue del 43%. En las pacientes con enfermedad sensible al platino la mediana de SPP fue de 60 meses, en comparación con una mediana de SPP de 7 meses en las pacientes con enfermedad refractaria/resistente al platino, y la probabilidad de SPP al año fue del 90 y 25%, respectivamente (p = 0.033). La mediana de las líneas de tratamiento recibidas tras la progresión de la enfermedad fue de 4 (rango: 1-6).
En el estudio un total de 7 pacientes (16.3% de la población total) tenían mutaciones germinales patogénicas en los genes relacionados con CEO hereditario. Tres pacientes (6.9% de la población total) tenían mutaciones patogénicas en el gen BRCA-2: un caso con la mutación c.4859insA (p.NI544fs), un caso con la mutación c.1313_1314insT y otro caso con la mutación c.1587delTinsCA. Dos pacientes (4.7% de la población total) tenían mutaciones patogénicas en el gen BRCA-1 (un caso con la mutación EX1_17 DEL y otro caso con la mutación p.Pro1812Ala), una paciente tenía una mutación patogénica en el gen ATM (p.Gln501Ter) y otra en el gen MUTYH (p.Tyr179Cys). Las características clinicopatológicas basales de este subgrupo de pacientes y su comparación con el subgrupo de pacientes sin mutaciones se detallan en la tabla 2.
Tabla 2 Características clinicopatológicas basales de las pacientes con mutaciones germinales en genes relacionados con el cáncer de ovario hereditario y su comparación con la población no portadora de mutaciones germinales
| Variable | Con mutación (n = 7) | Sin mutación (n = 36) |
|---|---|---|
| Edad | ||
| Mediana | 60 | 56 |
| Rango | 43-82 | 29-78 |
| Performance Status (PS) al diagnóstico | ||
| 0 | 4 (57%) | 21 (58%) |
| 1 | 3 (43%) | 13 (36%) |
| 2 | 0 | 2 (6%) |
| Estadio FIGO | ||
| IA | 1 (14%) | 4 (11%) |
| IC | 0 | 7 (19%) |
| IIA | 0 | 2 (6%) |
| IIIB | 0 | 2 (6%) |
| IIIC | 4 (57%) | 18 (50%) |
| IV | 2 (29%) | 3 (8%) |
| Subtipo histológico | ||
| Carcinoma seroso | 7 (100%) | 20 (56%) |
| Carcinoma mucinoso | 0 | 7 (19%) |
| Carcinoma endometrioide | 0 | 5 (14%) |
| Carcinoma de células claras | 0 | 2 (6%) |
| Mixto | 0 | 2 (6%) |
| Localización del tumor primario | ||
| Ovario | 5 (72%) | 36 (100%) |
| Peritoneal | 1 (14%) | 0 |
| Trompa de Falopio | 1 (14%) | 0 |
| Grado histológico (G) | ||
| G1 | 0 | 6 (17%) |
| G2 | 0 | 3 (8%) |
| G3 | 7 (100%) | 27 (75%) |
| Tipo de cirugía citorreductora (CCR) | ||
| CCR óptima de entrada | 2 (29%) | 21 (58%) |
| CCR óptima de intervalo | 2 (29%) | 8 (22%) |
| CCR subóptima de entrada | 0 | 2 (6%) |
| CCR subóptima de intervalo | 1 (14%) | 4 (11%) |
| Sin CCR | 2 (29%) | 1 (3%) |
| Primer tratamiento recibido | ||
| Cirugía | 2 (29%) | 23 (64%) |
| Quimioterapia | 5 (71%) | 13 (36%) |
| Antecedentes familiares oncológicos | ||
| No | 1 (14%) | 32 (88%) |
| Cáncer de mama | 3 (43%) | 2 (6%) |
| Cáncer de ovario | 3 (43%) | 1 (3%) |
| Cáncer de mama y ovario | 0 | 1 (3%) |
En el subgrupo de pacientes con mutaciones germinales la mediana de SLP fue de 27 meses (IC 95%: 24-30), en comparación con una mediana de SLP de 53 meses (IC 95%: 19-87) en el subgrupo de pacientes sin mutaciones germinales; y la probabilidad de SLP a 5 años fue del 28 y del 43%, respectivamente (p = 0.53). La mediana de SG fue de 60 meses (IC 95%: 10-128) para el subgrupo de pacientes con mutaciones germinales y no se había alcanzado en el subgrupo de pacientes sin mutaciones; y la probabilidad de SG a 5 años fue del 42 y 71%, respectivamente (p = 0.596).
Discusión
Los resultados de nuestro estudio ponen de manifiesto la importancia de la CCR óptima en combinación con quimioterapia de primea línea basada en platino, así como la relevancia del consejo genético oncológico en las pacientes con CEO, CTF y CPP en la práctica clínica habitual.
Los resultados de supervivencia obtenidos en el conjunto global de las pacientes de nuestro estudio (datos en la vida real) son muy alentadores; son superiores a los datos publicados por otros autores en la vida real y en ensayos clínicos (en condiciones ideales con una selección más estricta de las pacientes). En la población total de nuestro estudio la probabilidad de SG a 5 años fue del 64%, mientras que en el estudio llevado a cabo por Siegel, et al. fue del 47%13 y en el estudio ICON-7 fue del 50%10. En el presente estudio el pronóstico de las pacientes con CEO, CTF y CPP venía marcado fundamentalmente por el estadio de la enfermedad al diagnóstico (peor pronóstico en los estadios FIGO III y IV), el tipo de CCR (menor supervivencia en los casos con CCR subóptima) y el tipo de primer tratamiento recibido (peor pronóstico en las pacientes tratadas con quimioterapia neoadyuvante). La probabilidad de SLP a 5 años fue significativamente superior en las pacientes con estadios localizados, en comparación con las pacientes con estadios avanzados, con una diferencia absoluta del 65% (86 vs. 21%, respectivamente; p = 0.025). También hubo una tendencia no significativa a mayor SG en las pacientes con enfermedad localizada, con una diferencia absoluta del 43% en la SG a 5 años (100 vs. 57%, respectivamente; p = 0.094). La SG de las pacientes con estadios avanzados de nuestro estudio fue superior a las descritas en la literatura; siendo la probabilidad de SG a 5 años del 58% para las pacientes con estadio FIGO III y del 50% para las pacientes con estadios FIGO IV. Las pacientes tratadas con CCR óptima tuvieron significativamente mayor SLP y SG, en comparación con las pacientes tratadas con CCR subóptima (SLP a 5 años del 55% con CCR óptima vs. 0% con CCR subóptima; p < 0.0001; SG a 5 años del 86 vs. 17%, respectivamente; p < 0.0001). La mediana de SG en las pacientes tratadas con CCR subóptima fue de tan solo 18 meses. Existe una gran evidencia científica que apoya la realización de una CCR de máximo esfuerzo con el objetivo de alcanzar una enfermedad residual microscópica, dado que se trata del factor pronóstico más relevante15,16, como también se demuestra en nuestro estudio. Por otra parte, la SLP fue significativamente mayor en las pacientes tratadas con CCR de entrada, en comparación con las pacientes tratadas con quimioterapia neoadyuvante, con una diferencia absoluta del 33% a los 5 años (SLP a 5 años del 57 vs. 24%; p = 0.008). También hubo una tendencia no significativa a mayor SG en las pacientes tratadas con CCR de entrada (SG a 5 años del 89 vs. 44%; p = 0.097). Por tanto, en nuestro estudio, al igual que en otros estudios publicados hasta la fecha, la CCR de entrada se asoció con mejor pronóstico en comparación con la CCR de intervalo tras quimioterapia neoadyuvante17,18.
Nuestro estudio también pone de manifiesto la relevancia de los tratamientos oncológicos recibidos a la progresión de la enfermedad tumoral, en especial en las pacientes con ILP superiores a 6 meses (sensibles al platino). En las pacientes con progresión de la enfermedad, la mediana de SPP fue de 60 meses y la probabilidad de SPP a 5 años del 43%. En las pacientes con enfermedad sensible al platino la SPP fue significativamente mayor (mediana de 60 meses para ILP ≥ 6 meses vs. 7 meses para ILP < 6 meses; p = 0.033).
Por último, el presente estudio pone de relieve la importancia del asesoramiento genético para las pacientes con CEO, CTF y CPP, y sus familiares. En este sentido, el 16.3% de las pacientes del estudio tenían mutaciones en líneas germinales en genes relacionados con CEO hereditario, de los cuales el 71.4% se dieron en los genes BRCA-1 y BRCA-2. El asesoramiento genético es de vital importancia en estas pacientes y sus familiares, dado que la presencia de estas mutaciones genéticas por una parte aumenta la sensibilidad a las sales de platino (cisplatino y carboplatino) y a los inhibidores de PARP (olaparib, rucaparib, niraparib)19,20; y por otra parte se asocia con un riesgo del 50% de transmisión hereditaria a la descendencia, con el consiguiente aumento de riesgo de cáncer de mama y ovario en los familiares. En este subgrupo de pacientes la histología dominante fue el carcinoma seroso de alto grado, y la mayoría de los casos (86%) se diagnosticaron en estadios avanzados (III y IV). A pesar de ello, el pronóstico de estas pacientes fue similar a las pacientes sin mutaciones genéticas.
Conclusión
Como conclusión, nuestro estudio demuestra la importancia de la CCR óptima de entrada, en combinación con quimioterapia de primea línea basada en platino, en las pacientes con CEO, CTF y CPP en la práctica clínica habitual; y además, pone de manifiesto la relevancia del consejo genético oncológico en estas pacientes. Nosotros recomendamos la realización del estudio de las mutaciones germinales de los genes implicados en la oncogénesis de CEO no mucinoso (como BRCA-1, BRCA-2, CHEK2, PALB2, BRIP1, TP53, PTEN, STK11, CDH1, ATM, BARD1, MLH1, MRE11A, MSH2, MSH6, MUTYH, NBN, PMS1, PMS2, RAD50 y RAD51C) mediante el uso de plataformas multigenes (tecnología de secuenciación masiva NGS), dada la alta prevalencia de estas mutaciones en estas pacientes.











 nueva página del texto (beta)
nueva página del texto (beta)