ANTECEDENTES
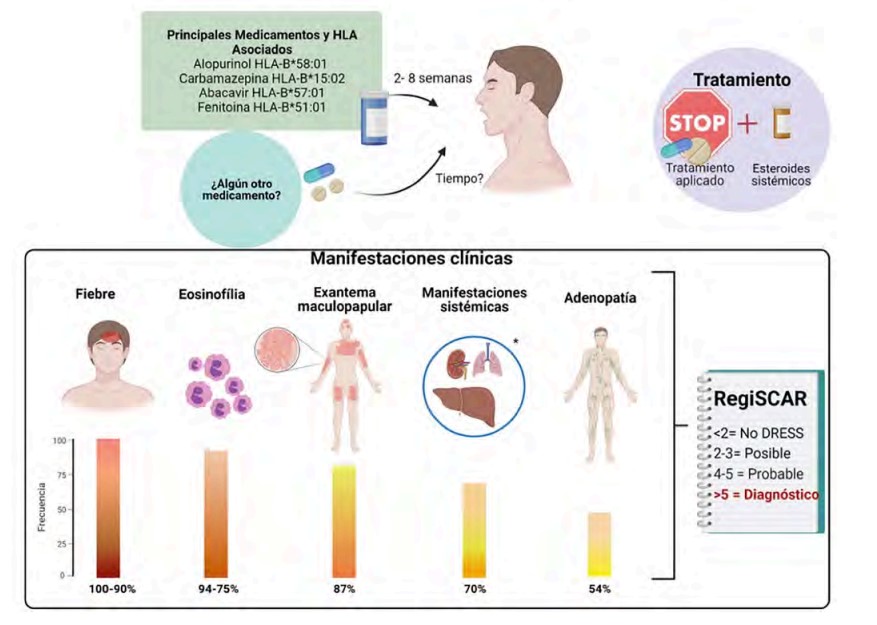
Dentro de las reacciones graves a medicamentos no mediadas por algún mecanismo de hipersensibilidad tipo I se incluye el síndrome de reacción a medicamentos con eosinofilia y síntomas sistémicos, o síndrome de DRESS (Drug Reaction with Eosinophilia and Systemic Symptoms). Esta enfermedad se caracteriza por fiebre, exantema maculopapular, recuento elevado de eosinófilos1 y manifestaciones clínicas multiorgánicas heterogéneas luego de la administración continua del fármaco sensibilizador, en un lapso de dos a ocho semanas.2 Figura 1
La tuberculosis (TB), en cualquiera de sus manifestaciones clínicas, sigue siendo un problema de salud pública.3 El tratamiento consiste en la combinación de fármacos antituberculosos durante dos años, según el tipo de afectación sistémica;4 no obstante, estas condiciones podrían predisponer a algunos pacientes al desarrollo del síndrome de DRESS.5
La principal información acerca el síndrome de DRESS inducido por fármacos antituberculosos (D-aTB) proviene de reportes de un solo caso.6 Describir el fenotipo clínico y los hallazgos de laboratorio, además de la evolución de los pacientes con D-aTB, fortalecerá el conocimiento disponible para que los especialistas establezcan el diagnóstico temprano e implementen el tratamiento adecuado, y de esta forma se eviten exacerbaciones, resistencia y aumento de la mortalidad por Mycobacterium tuberculosis.
MÉTODOS
Selección de pacientes
Estudio descriptivo efectuado a partir de la revisión de los expedientes de pacientes con síndrome de DRESS inducido por fármacos antituberculosos, identificados en la interconsulta del Departamento de Investigación en Inmunogénetica y Alergia, del Instituto Nacional de Enfermedades Respiratorias (INER) Ismael Cosío Villegas, Ciudad de México, entre 2014 y 2020. Los expedientes elegibles debían contar con la siguiente información: 1) pacientes con tuberculosis diagnosticada por manifestaciones de tos crónica, hemoptisis, pérdida de peso y fiebre durante seis meses, y cualquier prueba confirmatoria (reacción en cadena de la polimerasa y técnica de resistencia a rifampicina; GeneXpert MTB/RIF o microscopia de esputo); 2) cuyo tratamiento antituberculoso fuese prescrito por un neumólogo o infectólogo; 3) pacientes con tuberculosis sin tratamiento para otra enfermedad (por ejemplo: virus de inmunodeficiencia humana-VIH, hepatitis, diabetes, hipertensión y cáncer); 4) las características del síndrome de DRESS se establecieron según el registro de puntuación de reacciones adversas cutáneas graves (RegiSCAR) por un alergólogo (Cuadro 1);7 y 5) haber contado con tratamiento para el síndrome de DRESS (suspensión del tratamiento antituberculoso y prescripción de corticosteroides sistémicos). La evaluación clínica y las pruebas de laboratorio se analizaron al momento del diagnóstico, cinco días y un mes posterior a la instauración del tratamiento médico.
Diagnóstico y tratamiento del síndrome de DRESS
La puntuación RegiSCAR se aplicó para todos los casos (Cuadro 1).7 Se definió “posible caso” de DRESS si el paciente tuvo una puntuación de 2-3, “probable caso” cuando tuvo una puntuación de 4-5 y “caso confirmado” si el paciente reportó una puntuación mayor de 5. El tratamiento se estableció en consenso con el grupo médico adscrito al Departamento de Inmunogenética y Alergia del INER, de acuerdo con las recomendaciones de la American Academy of Dermatology (AAD) publicadas en 2013.8
En este estudio no se obtuvieron muestras biológicas para ensayos ni protocolos de investigación; tampoco se aplicaron maniobras experimentales ni se divulgaron datos personales. Todos los pacientes firmaron el consentimiento informado para la atención médica en la institución (INER-CEECL-01-07-2012) y el formato institucional de protección de datos personales (INER-TS-14-01-2013).
Cuadro 1 Sistema de puntuación RegiSCAR para establecer el diagnóstico de síndrome de DRESS
| Items | Puntaje | ||
|---|---|---|---|
| No | Sí | Desconocido | |
| Fiebre mayor de 38.5 °C | -1 | 0 | -1 |
| Ganglios linfáticos aumentados de tamaño (más de dos sitios, mayor de 1 cm) | 0 | 1 | 0 |
| Linfocitos atípicos | 0 | 1 | 0 |
| Eosinofilia | |||
| 700 - 1499 cels/mm3 o 10-19.9% | 0 | 1 | |
| ≥ 1500 cels/mm3 o ≥ 20% | 2 | ||
| Erupción cutánea | |||
| Extensión mayor del 50% | 0 | 1 | |
| Al menos dos de los siguientes criterios: edema, infiltración, púrpura, descamación | -1 | 1 | |
| Biopsia que sugiere síndrome de DRESS | -1 | 0 | |
| Afectación de órganos internos | |||
| Uno | 0 | 1 | 0 |
| Dos o más | 2 | ||
| Curación después de 15 días | -1 | 0 | -1 |
| Evaluación de causas adicionales (ANA's, hemocultivo; serología para VHA/VHB/VHC, Chlamydia/Mycoplasma; si ninguna de estas es positiva y más de 3 negativas) | 0 | 1 | 0 |
| DRESS: Drug Rash with Eosinophilia and Systemic Symptoms; ANA's: anticuerpos antinucleares; VHA: virus hepatitis A; VHB: virus hepatitis B; VHC: virus hepatitis C. | |||
Análisis estadístico
Las variables cuantitativas se expresaron en medianas y rangos intercuartílicos (p25-p75). El tiempo de diagnóstico (t0) se comparó con el tiempo de curación del síndrome de DRESS (t1), según la prueba de Wilcoxon, y los análisis entre poblaciones se realizaron mediante la prueba U de Mann-Whitney. La latencia se analizó con la prueba de Kaplan-Meier y Log Rank. Se obtuvieron frecuencias para las variables cualitativas y se compararon con la prueba de x². Todos los datos se analizaron con el programa SPSS v.21 (IBM corporation, New York, USA.). Se consideró estadísticamente significativo el valor de p < 0.05.
RESULTADOS
Diagnóstico del síndrome de DRESS
Se identificaron 15 pacientes con síndrome de DRESS inducido por fármacos antituberculosos, que representaron el 0.2% de los casos atendidos en el Departamento por algún padecimiento inmuno-alérgico (15/7052); 11 de 15 (73.3%) fueron hombres; la mediana de edad fue de 46 años (24-59) y el índice de masa corporal de 23 kg/m² (17-24). Al momento del diagnóstico de síndrome de DRESS todos los pacientes manifestaron exantema, 12 de 15 (80%) fiebre y 9 de 15 (60%) adenomegalia. En cuanto al recuento de leucocitos, los pacientes mostraron valores normales (11,140 cels/mm²), aunque los eosinófilos se encontraban elevados en todos los casos, y 9 de 15 (60%) tenían hipereosinofilia (>1,500 cels/mm²); en cambio, el conteo de eosinófilos de los demás pacientes mostró una mediana de 820 cels/mm² (500-1400 cels/mm²). Respecto al daño a órgano blanco, 9 de 15 (60%) tuvieron afectación de un órgano (hígado o riñón) y solo 1 tuvo afectación simultánea de ambos órganos. Las concentraciones medias de los biomarcadores de daño hepático fueron: AST (Aspartato Aminotransferasa) 27 U/L (16-274), ALT (Alanina Aminotransferasa) 23 U/L (12-165) y creatinina 0.91 mg/dL (0.61-1.32) para daño renal; sin embargo, 5 de 15 (53.3%) pacientes que tuvieron daño hepático reportaron medianas de 340 UI/L para AST y 222 UI/L de ALT. Se observó que 6 de 15 (40%) tuvieron alteración renal (1.3 mg/dL de creatinina). En todos los casos se excluyó infección por VIH y hepatovirus. La media de RegiSCAR fue de 6 puntos.
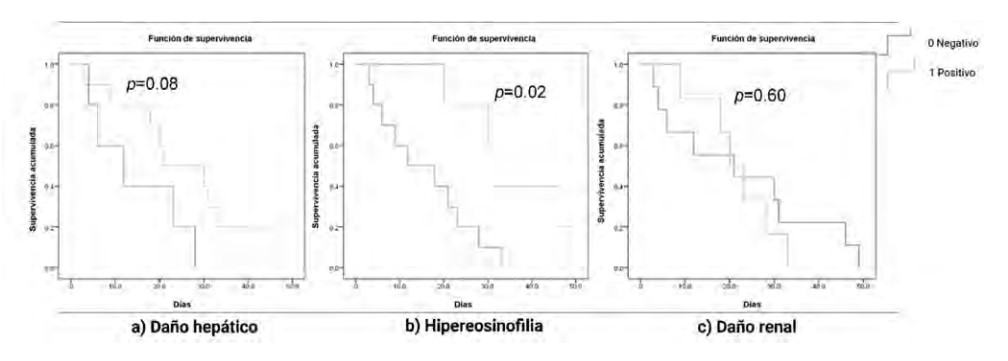
La curva de supervivencia informó que el 50% de los pacientes manifestaron síndrome de DRESS a los 21 días (4-31 días; Figura 2). La transaminasemia se asoció con latencia prolongada (p = 0.02); no obstante, los recuentos elevados de eosinófilos mostraron significación estadística (Figura 3). No hubo correlación ni asociación entre las variables cuantitativas ni cualitativas de RegiSCAR (p > 0.05).

Figura 2 Comparación entre series de casos. *Log-Rank entre series de casos (p < 0.001). A) Pacientes mexicanos vs coreanos (p = 0.006). B) Pacientes mexicanos vs argentinos (p = 0.06). C) Pacientes argentinos vs coreanos (p = 0.14).
Evolución
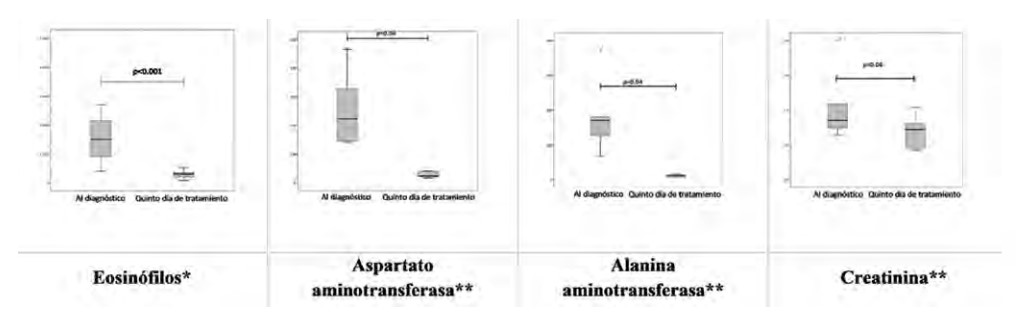
Después de cinco días de tratamiento con corticosteroides sistémicos (prednisona 50 mg), la concentración total de eosinófilos disminuyó cinco veces, de 1500 a 300 cels/mm³ (p < 0.001). De igual forma, en los pacientes que tuvieron daño a órgano blanco (hepático o renal), los valores de AST, ALT y creatinina disminuyeron significativamente (p = 0.04, para cada uno; Figura 4). Durante el período de tratamiento fueron desapareciendo la fiebre, la linfadenopatía y las manifestaciones cutáneas. Los biomarcadores implicados en la puntuación RegiSCAR se mantuvieron dentro de l o s límites de referencia 28 días posteriores a la finalización del tratamiento (p > 0.05). No se reportaron defunciones por síndrome de DRESS ni complicaciones inherentes a la suspensión de los antifímicos, como la hemoptisis.
Medicamentos antituberculosos
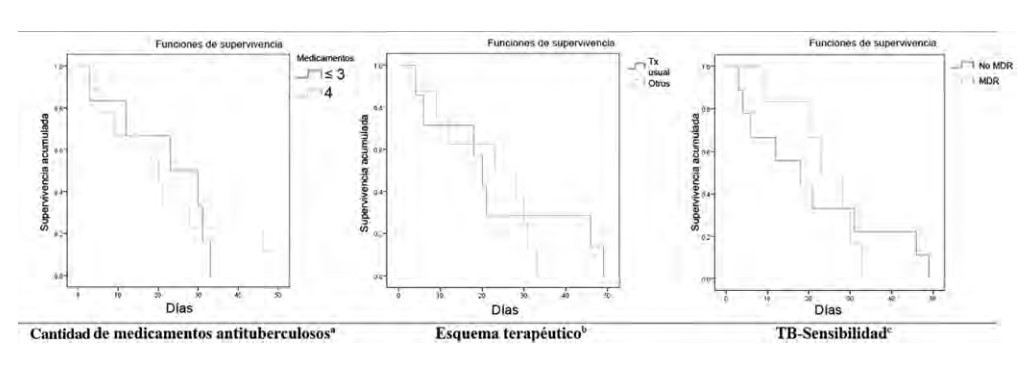
La mayoría de los pacientes diagnosticados con síndrome de DRESS recibían al menos dos medicamentos, 8 de 15 (53.3%) fueron tratados con el régimen DoTBal (rifampicina, isoniazida, pirazinamida, etambutol, SILANES, México); específicamente, 11 de 15 (73.3%) recibía etambutol, 10 de 15 (66.6%) isoniazida, 9 de 15 (60%) pirazinamida, 8 de 15 (53%) de rifampicina, 3 de 15 (20%) capreomicina y 2 de 15 (13.3%) moxifloxacina. Además, se encontró que 8 de 15 (53.3%) tenían Mycobacterium tuberculosis sin patrón de resistencia. No encontramos asociación estadística entre la latencia de DRESS y el esquema terapéutico, la catidad de medicamentos antituberculosos ni el patrón de resistencia (p > 0.05; Figura 5).
DISCUSIÓN
Este estudio describe el patrón clínico del síndrome de DRESS inducido por fármacos antituberculosos, caracterizado por hipereosinofilia y menor frecuencia de daño orgánico. El síndrome de DRESS no es una reacción frecuente, se estima que 1 de cada 1000 exposiciones a cualquier medicamento puede inducir esta enfermedad.9 La mayor parte de la evidencia del síndrome de DRESS inducido por fármacos antituberculosos proviene de informes de casos (34 de 37), con un promedio de 1.12 por artículo, y escasos reportes en la bibliografía describen series de casos (3 de 37). En este contexto, la prevalencia de síndrome de DRESS inducido por fármacos antituberculosos reportada es muy baja [Argentina 0.7%10 y Corea 1.2%1], lo que coincide con nuestro estudio.
Los hallazgos clínicos y de laboratorio reportados fueron similares a los de otras series de síndrome de DRESS inducido por fármacos antituberculosos.1,5,10 Sin embargo, los pacientes mexicanos fueron más jóvenes, tuvieron concentraciones de eosinófilos más bajas y latencia más corta comparados con sujetos de series de Corea y Argentina (Figura 2, Cuadro 2). Este patrón clínico y de laboratorio del síndrome de DRESS inducido por fármacos antituberculosos es diferente al reportado en la bibliografía respecto de otros medicamentos asociados con el síndrome. Por ejemplo, los recuentos elevados de eosinófilos no es tuvieron en proporción similar a los reportados con alopurinol (<62%), fármacos antiepilépticos (<72%) o abacavir (9%), y el deterioro hepático y renal fueron menores a los descritos con carbamazepina (100%) y alopurinol (91%).11,12
Los hallazgos de esta investigación sugieren que la latencia observada es probablemente la real para este grupo de fármacos, aunque se desconocen los detalles específicos del tratamiento antituberculoso en las otras series. El hallazgo se encuentra dentro del intervalo de tiempo descrito con otros fármacos causales, sobre todo los antiepilépticos (~30 días).13 La identificación de este periodo es relevante para el personal de salud, porque la latencia prolongada se asocia con mayor daño hepático.5 La mayor parte de las series de síndrome de DRESS inducido por fármacos antituberculosos establecieron el diagnóstico con puntaje RegiSCAR menor de 5 y los reportes de casos (n = 1) demostraron un valor de 4 puntos (caso probable para ambos puntajes). En cambio, este estudio demostró una mediana de 6 puntos, condición necesaria y suficiente para confirmar el diagnóstico.7
La prescripción de corticosteroides sistémicos demostró un efecto favorable en nuestros casos, con disminución de los síntomas y de las concentraciones de eosinófilos y aminotransferasas después de la administración, pues se ha observado que disminuye la producción de células T, se inhibe la reactivación del herpesvirus y previenen las respuestas autoinmunes en el síndrome de DRESS.14 Sin embargo, a diferencia de otras enfermedades, como la gota o epilepsia, la tuberculosis es una enfermedad infecciosa, por lo que la prescripción de corticosteroides se considera una estrategia controvertida15,16 (pues se dispone de escasa evidencia acerca del tema), al igual que la suspensión de fármacos antituberculosos asociados con el síndrome de DRESS. En nuestra experiencia, la administración de corticosteroides sistémicos y la suspensión de fármacos antituberculosos no representaron ningún riesgo, por lo que estas estrategias terapéuticas son seguras para los pacientes; sin embargo, se ha descrito que en los escenarios clínicos más agresivos inducidos por la tuberculosis (como en casos de hemoptisis), se reportan después de cinco años.17 Asimismo, en el presente estudio no se encontró que el síndrome de DRESS inducido por fármacos antituberculosos se relaciona con la cantidad de medicamentos antituberculosos ni el patrón de resistencia a Mycobacterium tuberculosis. No obstante, se requieren estudios multicéntricos para confirmar estas aseveraciones.23 Es importante aclarar que esta enfermedad es una reacción tipo B provocada por medicamentos,1,22 y no se asocia con ninguna marca de medicamento o esquema terapéutico específico.24
En este estudio no pudimos desarrollar un método diagnóstico para investigar el tipo de fármaco responsable. La prueba de parche es cuestionable, a pesar de haberse utilizado en otros reportes, porque su sensibilidad varía dependiendo del fármaco causal, concentración del medicamento implementado, falta de estandarización de las concentraciones, uso de vehículos, preparaciones y estabilidad, además del conocimiento del fármaco. Con base en esto, se recomienda retirar los corticosteroides para mejorar la sensibilidad de la prueba, lo que sería un problema en pacientes con esta enfermedad.18 Estas pruebas se indican para evaluar los alérgenos asociados con dermatitis alérgica de contacto.19 Asimismo, la falta de evaluación de herpes virus tipo 6 (HHV-6) y linfocitos atípicos en los pacientes fueron dos de las limitaciones del estudio. En el primer caso, la reacción en cadena de la polimerasa para HHV-6 no es un estudio habitual para enfermedades de la piel, debido a la dificultad para identificarlo por factores inherentes a su triada ecológica, así como la limitación de algunos centros de salud para la obtención de esta prueba.20 Además, la determinación de linfocitos se reserva para cierto tipo de enfermedades, como el linfoma.21 En ambos casos, estas enfermedades fueron desestimadas en los pacientes con base en el interrogatorio.
Cuadro 2 Comparación de características clínicas y hallazgos de laboratorio entre series de síndrome de DRESS inducido por fármacos antituberculosos
| Variable | Serie de casos | México vs Corea | México vs Francia | México vs Argentina | Francia vs Corea | ||||
|---|---|---|---|---|---|---|---|---|---|
| Global | México | Corea | Francia | Argentina | p | ||||
| n | 108 | 15 | 15 | 67 | 11 | ||||
| Género masculino n (%) | 64 (59) | 11 (73.33) | 8 (53.33) | 40 (59) | 5 (45) | .44 | .38 | .3 | .38 |
| Edad | 50 (24-74) | 46 (24 - 59) | 65 (48 - 74) | 61 (41 - 74) | 31 (27 - 35) | - | - | - | - |
| Eosinófilos cels/mm³ | 1190 (1137 - 2872) | 1500 (900 - 2300) | 2270 (1680 - 4920) | SD | 3080 (2500 - 4200) | - | - | - | - |
| ≥ 1,500 cels/mm³ | 63 (64)* | 8 (53.3) | 12 (80) | 43 (68.3) | SD | 1 | .73 | - | .36 |
| AST UI/L | 39 (21 -149) | 27 (16 - 274) | 53 (33 - 139) | SD | SD | - | - | - | - |
| > 100 n (%) | 10 (30) | 5 (33) | 5 (33) | SD | SD | 1 | - | - | - |
| ALT UI/L | 26 (17 - 41) | 23 (12 - 165) | 34 (19 - 123) | SD | SD | - | - | - | - |
| > 100 n (%) | 10 (30) | 5 (33) | 5 (33) | SD | SD | 1 | - | - | - |
| Daño hepático n (%) | 56 (57) | 5 (33) | 5 (33) | 46 (68.7) | SD | 1 | .017 | - | .017 |
| Creatina mg/dL | .80 (.61 - 1.44) | .91 5 (.61 - 1.32) | .80 (.60 - 2.10) | SD | SD | - | - | - | - |
| Daño renal n (%) | 37 (38) | 6 (40) | 5 (33) | 26 (38.8) | SD | 1 | 1 | - | .77 |
| Fiebre n (%) | 87 (80) | 12 (80) | 14 (93) | 61 (91) | SD | .59 | .35 | - | 1 |
| Linfadenopatía (%) | 44 (45) | 9 (60) | 7 (77) | 28 (41.8) | SD | .71 | .25 | - | .77 |
| Exantema n (%) | 30 (100) | 15 (100) | 15 (100) | 65 (97) | SD | .48 | 1 | - | 1 |
| Lactencia en días | 29 (9 - 71) | 21 (9 - 31) | 42 (28 - 71) | 24 (16 -36) | 30 (21 - 40) | .006 | .01 | .06 | SD |
| AST-asparto aminotransferencia; ATL-alanina aminotranferencia; SD-sin datos | |||||||||
CONCLUSIONES
El síndrome de DRESS inducido por fármacos antituberculosos tiene un perfil clínico y de laboratorio específico, caracterizado por hipereosinofilia y baja proporción de daño hepático-renal, con latencia similar a la de otros fármacos implicados en el síndrome de DRESS, y su evolución no está asociada con la cantidad de antifímicos prescritos ni patrones de resistencia. Los pacientes con este síndrome reaccionan favorablemente al tratamiento con corticosteroides sistémicos por vía oral en pocos días, y la evolución es adecuada en pacientes que padecen tuberculosis.











 nueva página del texto (beta)
nueva página del texto (beta)