INTRODUCCIÓN
Desde 1915, Fritz Rohrer, un pionero de la mecánica pulmonar, postuló (a partir de sus estudios en cadáveres) que la vía aérea superior contribuye, en condiciones normales, con el 90% de la resistencia al flujo aéreo, mientras que el sistema broncolobular lo hace con el 10% restante;1 sin embargo, no consideró el efecto del flujo turbulento de la resistencia al paso del aire. Durante muchos años estos hallazgos permanecieron en el olvido, hasta que Weibel, en 1970, publicó el modelo de división dicotómica bronquial. Más tarde, en la misma década, los fisiólogos: Pedley, Schroter y Sudlow consideraron el efecto de la turbulencia y la disposición anatómica de la vía aérea en la resistencia al flujo de aire.2 De esta manera se documentó que la resistencia en la vía aérea está en función de la generación o división bronquial y que la Vía Aérea Pequeña o Periférica (VAP) aporta una fracción menor a la resistencia total. De manera casi paralela, en 1967, Macklem y Mead realizaron mediciones funcionales en animales y demostraron que la vía aérea menor de 2 mm de diámetro aportaba entre el 10-25% de la resistencia total al flujo aéreo, y posteriormente postularon que era el principal sitio de obstrucción en los pulmones afectados por enfisema. Estos hallazgos dieron paso a términos como “enfermedad de la vía aérea pequeña”, considerando que la afección posiblemente inicia en los bronquios “pequeños” y “zona silente”, aludiendo al hecho de que los incrementos de resistencia, aún moderados, son difíciles de detectar por métodos convencionales.2,3
Desde entonces se han descrito varios métodos para medir la resistencia de la VAP, con la finalidad de detectar oportunamente los cambios incipientes en esta región anatómica. Debido a la falta de un método de referencia para evaluar la vía aérea pequeña y las posibles implicaciones terapéuticas, es necesario efectuar una revisión actualizada del tema.
Anatomía e histología de la vía aérea
A partir de la tráquea, el aire debe transitar por ~23 generaciones de ramificaciones de la vía aérea hasta alcanzar los alvéolos. Puesto que las primeras 16 generaciones no contienen alvéolos, son conocidas como zona de conducción, en donde no existe intercambio de gases entre el aire ambiental y la sangre. De la generación 17 a la 19, llamada zona de transición, los alvéolos aparecen en las paredes de los bronquiolos respiratorios. Por último, las generaciones 20 a 22 están llenas de alvéolos formando conductos alveolares, mientras que en la última generación se encuentran los sacos alveolares. Ambas estructuras conforman la zona respiratoria y es aquí donde ocurre el intercambio de gases, entre el aire alveolar y la sangre desoxigenada.4,5
En adultos se define la VAP como los bronquiolos menores de 2 mm de diámetro; sin embargo, esta definición no es universal. Como puede apreciarse en el Cuadro 1, el diámetro de 2.1 mm corresponde a la generación 3 de la vía aérea en un niño de 7 meses de edad; por tal motivo, es mejor considerar que la VAP es la vía de conducción que puede iniciar a partir de la generación 8 y que histológicamente es diferente a la vía aérea central o grande.6
Los bronquios tienen la misma histología que la tráquea. Sin embargo, en cuanto se convierten en estructuras intrapulmonares, los anillos de cartílago en C se reemplazan por placas cartilaginosas irregulares alrededor de la circunferencia de la pared de los bronquios. Conforme disminuyen su calibre, estas placas se tornan más pequeñas y menos abundantes, y desaparecen en el sitio donde la vía aérea alcanza un diámetro de ~1 mm, convirtiéndose en bronquiolos.5,7
Dentro de las características histológicas de la VAP resalta poco o ningún cartílago que sostiene su estructura, por lo que es fácilmente colapsable durante la espiración forzada o la contracción del músculo liso.3,8,9
Así mismo, la VAP posee una proporción relativamente mayor de músculo liso y menos células caliciformes secretoras de moco en la capa epitelial, comparada con la vía aérea central.9
En la mucosa de la VAP existen plicaturas que forman valles y crestas, cuya función es mantener el área de superficie luminal constante durante el ciclo respiratorio, y estas se ensanchan o estrechan conforme cambia el diámetro de la vía respiratoria.10Figura 1
El área de sección transversal de la vía aérea está constituida, en su mayor parte, por la VAP, lo que representa el 98.8% (aproximadamente 4500 ml) del volumen pulmonar total; y puesto que las resistencias en esa región se encuentran en paralelo, la VAP ofrece solo el 10 al 25% de la resistencia pulmonar total; sin embargo, en enfermedades donde se afecta principalmente esta zona, la resistencia ofrecida por la VAP puede alcanzar, incluso, el 90% de la resistencia total.6,8
Otro factor importante en la VAP es el flujo de aire laminar comparado con el de la vía aérea central, que corresponde a flujo de alta velocidad y turbulento. Estas características permiten una ventilación homogénea de las unidades alveolares al tiempo que se mantiene una baja resistencia al flujo de aire y un trabajo respiratorio mínimo.6
Además, la VAP contiene gran cantidad de receptores para corticosteroides, adrenérgicos beta 2 y receptores muscarínicos M3.11-156,9,11-15 La obstrucción de la vía aérea pequeña puede originarse por la reducción de la cantidad de bronquiolos, estrechamiento de su lumen u oclusión por tapones de moco,16 lo que genera heterogeneidad en la ventilación y atrapamiento de aire.9
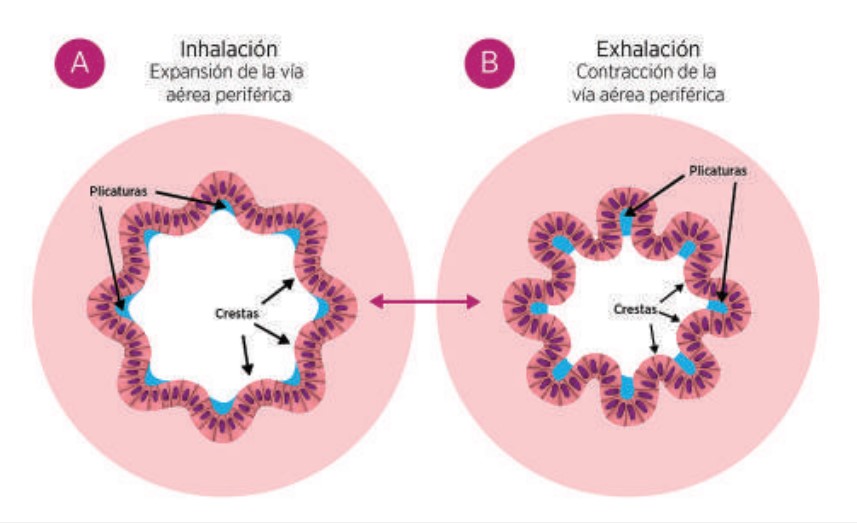
Figura 1. Cambios estructurales de la vía aérea pequeña durante el ciclo respiratorio. A) Vía aérea pequeña expandida por el aumento de las fuerzas de tracción que acompañan a la inhalación durante el ciclo respiratorio. B) Contracción de la vía respiratoria que acompaña a la exhalación. Obtenido de Quinton PM.10
Cuadro 1 Desarrollo traqueobronquial en la vía aérea según la edad
| Dimensiones de la vía aérea | ||||||||
|---|---|---|---|---|---|---|---|---|
| Vía aérea central | Generación (G) | D | L | D | L | D | L | |
| G3 | 2.1 | 3 | 3.3 | 4.4 | 5.4 | 7.2 | ||
| G4 | 1.7 | 4.9 | 2.7 | 7.3 | 4.3 | 12 | ||
| G5 | 1.3 | 4.2 | 2.1 | 6.2 | 3.3 | 10.1 | ||
| G6 | 1.1 | 3.5 | 1.7 | 5.2 | 2.7 | 8.5 | ||
| Vía aérea periférica | G9 | 0.6 | 2.1 | 0.9 | 3.1 | 1.4 | 5.1 | |
| G10 | 0.5 | 1.8 | 0.8 | 2.6 | 1.2 | 4.3 | ||
| G11 | 0.4 | 1.5 | 0.7 | 2.2 | 1.1 | 3.7 | ||
| G12 | 0.4 | 1.3 | 0.6 | 1.9 | 1 | 3.1 | ||
| 7 meses | 4 años | 20 años | ||||||
| Longitud (L,mm), Diámetro (D,mm). | ||||||||
| Adaptado de Deng Q, Ou C, Chen J, Xiang Y. Particle deposition in tracheobronchial airways of an infant, child and adult. Sci Total Environ. 2018 Jan 15;612:339-346. doi: 10.1016/j.scitotenv.2017.08.240 | ||||||||
Embriología y desarrollo del sistema respiratorio
El desarrollo intrauterino del sistema respiratorio consta de 5 estadios: embrionario, pseudoglandular, canalicular, sacular y alveolar. Las zonas de conducción suelen formarse durante los estadios embrionario y pseudoglandular. En el estadio canalicular (semana 16 de gestación) inicia la formación de la zona de transición y de intercambio gaseoso. Finalmente, alrededor de la semana 24 de edad gestacional (estadio sacular y alveolar) ocurre el crecimiento de los espacios aéreos y la septación alveolar, e inicia la producción de surfactante. El crecimiento alveolar y de la vía aérea confieren disminución de la resistencia al paso del aire.17
La Figura 2 muestra los estadios del desarrollo pulmonar. Donde la VAP es considerada a partir de la generación 8, que histológicamente corresponde a los bronquiolos terminales, bronquiolos respiratorios, conductos alveolares y los propios alvéolos.17
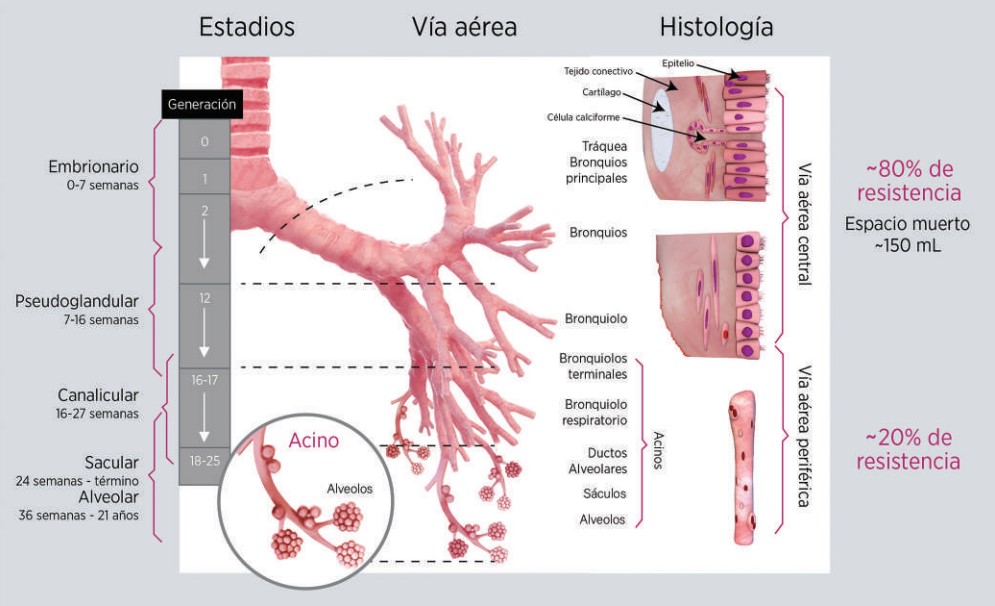
Figura 2. Generaciones del sistema respiratorio y estadios del desarrollo pulmonar. A la izquierda se muestran los estadios del desarrollo intrauterino, que se correlacionan con las generaciones de la vía respiratoria, los diferentes patrones histológicos y la resistencia aproximada que aporta la vía aérea central vs vía aérea periférica pequeña. Adaptado de Schittny JC.17
Fisiología de la vía aérea pequeña
Los estudios iniciados por Rohrer y colaboradores, con las propuestas morfológicas de Weibel y los hallazgos de Macklem y Mead, permitieron demostrar que la mayor parte de las resistencias al flujo aéreo provienen de la vía aérea de conducción.4
La VAP, debido a sus características intrínsecas, es la zona más vulnerable del sistema respiratorio. El incremento exponencial en la cantidad de bronquios y bronquiolos después de la generación 8 reduce la resistencia total al flujo, debido al incremento del área total de sección transversal. De esta forma, la disminución en la resistencia de la VAP se explica por su comportamiento, que es similar a una resistencia eléctrica en paralelo y no en serie (Figura 3). La permeabilidad de la VAP depende de las fuerzas retráctiles elásticas intratorácicas, del surfactante y del volumen pulmonar.10
Las características morfológicas y funcionales de la VAP generan que la disfunción pase inadvertida antes de que pueda identificarse por métodos convencionales, como la espirometría. A continuación se citan las alteraciones más prevalentes que afectan la VAP y los métodos diagnósticos más utilizados para su evaluación.
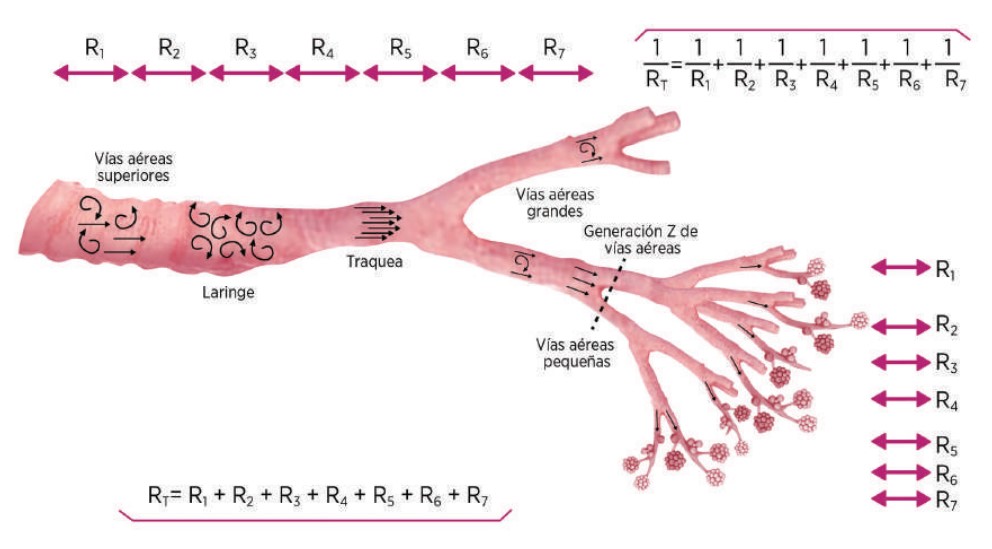
Figura 3. Resistencia en la vía aérea. La resistencia al flujo aéreo en la vía aérea central tiene distribución en serie (la resistencia se suma), mientras que la resistencia en la vía aérea pequeña tiene un comportamiento en paralelo, debido al incremento progresivo del área de sección transversa (figura adaptada de los autores).
Enfermedades de la vía aérea pequeña
Asma
El asma es un síndrome caracterizado por obstrucción bronquial reversible de origen inflamatorio, relacionado con hiperreactividad bronquial por diversos estímulos. Puede provocar tos, opresión torácica, sibilancias y disnea.18 Históricamente se ha definido como una alteración propia de la vía aérea central; sin embargo, diversas autopsias de individuos con asma fatal señalan que también está implicada la VAP.4,19-20 Hamid y sus colaboradores identificaron un proceso inflamatorio en la vía aérea pequeña caracterizado por elevada producción de linfocitos T, eosinófilos activados y proteína básica mayor (MBP, por sus siglas en inglés), similar a los hallazgos en la vía aérea central.20 Además, Synek y su grupo compararon, mediante inmunohisto química cuantitativa y morfometría, las características celulares del asma fatal y no fatal, y encontraron que la inflamación crónica que distingue al asma puede afectar toda la vía aérea.21
Los factores que contribuyen con la disminución del diámetro de la vía aérea en sujetos con asma incluyen: excesiva cantidad de moco, células inflamatorias (eosinófilos, mastocitos o linfocitos) que obstruyen la luz bronquial, aumento del grosor de la capa submucosa secundario al proceso inflamatorio, fibrosis, aumento de la masa de músculo liso y pérdida de las uniones alveolares. Además, se ha demostrado que las anormalidades de la matriz extracelular (principalmente la disminución en la expresión de decorina en la pared de la vía aérea) contribuyen con la fibrosis, posiblemente a través de la regulación positiva del factor de crecimiento transformante β (TGF-β).22
Hamid Q y colaboradores examinaron la distribución de las células inflamatorias en todo el árbol bronquial de pacientes asmáticos y no asmáticos, y documentaron mayor concentración de linfocitos T CD3+, MBP y eosinófilos distribuidos de manera uniforme en la vía aérea pequeña y la vía aérea central. Además, en esta misma cohorte se observó un incremento de células con ARNm IL-5 e IL-4 positivos en la VAP.19,23 Existe evidencia que demuestra cambios en la matriz extracelular en todo el tejido pulmonar de pacientes con asma fatal. Estos cambios se observan principalmente en la región de la pared de la VAP e incluyen: depósito de fibronectina, colágeno tipo I y tipo III y aumento en la expresión de diversas metaloproteinasas (MMP, por sus siglas en inglés), sobre todo MMP-1, MMP-2 y MMP-9, lo que genera remodelación de la VAP.19,24
Postma y sus coautores informaron que la prevalencia de enfermedad de la VAP en pacientes con asma, independientemente de la gravedad, es del 91%.25
In't Veen y colaboradores informaron que los pacientes con asma y exacerbaciones frecuentes tienen volúmenes pulmonares más altos y cierre más temprano de la vía aérea comparados con controles asmáticos estables. Por lo tanto, el incremento del volumen y desplazamiento de la capacidad de cierre en la vía aérea es un factor de riesgo para sufrir exacerbaciones graves.26
Macklem y su grupo,27 y posteriormente Bates y colaboradores,28 demostraron que aunque la VAP contribuye poco a la resistencia del flujo de aire en los pulmones sanos, es el principal responsable en la limitación del flujo de aire en pacientes con asma y EPOC. El óxido nítrico (NO) se ha propuesto como un marcador implicado en la VAP de pacientes con asma, incluso se ha demostrado que la fracción exhalada de NO (FeNO) se asocia positivamente con la pendiente de la fase III (dN2) de la curva del lavado de nitrógeno, lo que indica relación entre el FeNO y la función de la VAP, es decir, a mayor FeNO mayor inflamación de la VAP y mayor heterogeneidad en el vaciamiento pulmonar.29
Algunos pacientes con asma no controlados pueden tener resultados de espirometría normales, con anormalidades de la VAP detectada por otros métodos.30 El fenotipo de asma de VAP puede sospecharse si el sujeto tiene FEV1 normal o mayor del 80% del predicho y con evidencia de flujo espiratorio forzado 25-75% (FEF25-75, por sus siglas en inglés), de menos del 60% del predicho. Hay que recordar que el FEF25-75 es un valor poco reproducible si se compara con el FEV1, debido a que es una medida dependiente de la capacidad vital.30-31
Desde el punto de vista funcional, la propuesta para evaluar la VAP en pacientes con asma consiste en una combinación de estudios, los más importantes son la espirometría y oscilometría, que han demostrado gran capacidad para diferenciar entre individuos con asma leve y moderada-grave.25
Enfermedad pulmonar obstructiva crónica (EPOC)
La EPOC es una enfermedad frecuente, prevenible y tratable, caracterizada por síntomas respiratorios y limitación persistente al flujo aéreo, provocada por anormalidades de la vía aérea o del parénquima pulmonar, principalmente por exposición a partículas o gases nocivos (GOLD 2022).32 Esta exposición afecta la VAP, con engrosamiento de las paredes, infiltración de células inmunológicas, fibrosis, hiperplasia de la mucosa y exudados luminales.33-35 Este proceso inflamatorio, amplificado y continuo, provoca enfisema, lo que a su vez reduce las zonas ventiladas y la perfusión en las unidades alveolares. El enfisema favorece el atrapamiento aéreo e hiperinflación, que son causa de disnea en pacientes con EPOC.32,34 Comparados con personas sanas, los pacientes con EPOC tienen menor cantidad de bronquiolos terminales (diámetro <0.55 mm) y aun en pacientes fumadores sin EPOC se han documentado cambios en la VAP, sobre todo reducción del diámetro de los bronquiolos.33-37 En pacientes con EPOC, el mayor daño morfológico y funcional analizado hasta el momento, a través de tomografía endobronquial óptica, ha sido a partir de la octava a novena generación bronquial.38
De acuerdo con los estudios fisiopatológicos, una de las hipótesis que explica la transición entre la enfermedad de la VAP y la EPOC se distingue por la limitación al flujo aéreo espiratorio y el volumen de cierre; factores que evidencian la heterogeneidad de la ventilación y que se han evaluado a través de diferentes técnicas, por ejemplo: medición de la pendiente de fase III en el lavado de nitrógeno de respiración única, relacionada con los diferentes estadios de GOLD y de FEV1.39 De igual forma, el lavado de nitrógeno de múltiples respiraciones y el índice de aclaramiento pulmonar (LCI, por sus siglas en inglés Lung Clearance Index) son útiles para cuantificar la heterogeneidad de la ventilación en fumadores sin y con EPOC en estadios leves.34
En 2017, Crisafulli y colaboradores informaron que en pacientes con EPOC existe disfunción progresiva de la VAP entre los estadios de clasificación GOLD. Además, demostraron asociación positiva entre las anormalidades encontradas en la oscilometría de impulso y la extensión tomográfica de la enfermedad.40
Pruebas de función pulmonar en la evaluación de la VAP
A través de los años se han sugerido y adoptado diversos procedimientos para el estudio de la VAP, incluidas técnicas complejas e invasivas, que proporcionan información funcional respecto al grado y extensión de la heterogeneidad de la ventilación, el atrapamiento aéreo, el proceso inflamatorio y de remodelación.41
Espirometría
Es el estudio de referencia para la evaluación funcional de la mecánica pulmonar en individuos con enfermedades respiratorias. Las principales variables a medir son la capacidad vital forzada (FVC), que es el máximo volumen de aire, medido en litros, que puede exhalarse por la boca con el máximo esfuerzo después de una inspiración completa; y el volumen espiratorio forzado en el primer segundo de la exhalación (FEV1), que indica la cantidad de aire espirado forzadamente durante el primer segundo de la maniobra de FVC.42-46
La relación o cociente FEV1/FVC es la cantidad de aire (expresado en porcentaje) que un individuo puede exhalar en el primer segundo de una maniobra de capacidad vital forzada. Este cociente define obstrucción bronquial al flujo de aire, y cuando se encuentra disminuido significa que el paciente no puede espirar la cantidad de aire esperado durante el primer segundo de su exhalación. Por tanto, la relación FEV1/FVC por debajo del límite inferior de la normalidad (LIN) implica estrechamiento de las vías aéreas durante la exhalación. El inconveniente más importante es que este parámetro refleja, principalmente, lo que ocurre en la vía aérea central.45 Existe evidencia que el diagnóstico de obstrucción exclusivo por FEV1/FVC puede subestimar la enfermedad en pacientes sintomáticos y con factores de riesgo significativos. Por este motivo se han estudiado variables espirométricas adicionales, con la finalidad de evaluar la VAP. Tal es el caso de los mesoflujos (FEF25-75); sin embargo, estos dependen de la capacidad vital forzada, lo que les confiere gran variabilidad y poca sensibilidad,8,46 por lo que su utilidad aún se discute y no se recomienda como estudio de rutina en la toma de decisiones clínicas.47-48 El algoritmo diagnóstico basado en la relación FEV1/SVC (SVC, capacidad vital lenta, Slow-Vital Capacity), en lugar del cociente tradicional FEV1/FVC, es otro protocolo en estudio. Los sujetos sin obstrucción muestran mínimas diferencias en la capacidad vital obtenida de manera lenta (SVC) respecto a la forzada (FVC); sin embargo, en sujetos con obstrucción el colapso de la vía aérea pequeña y el atrapamiento aéreo en la maniobra forzada condicionan que la FVC sea menor que la SVC. Un análisis retrospectivo de 2710 espirometrías, realizado entre 2011 y 2015 en un centro médico de Texas, reportó un incremento en la prevalencia de obstrucción del 26.1 al 45% al implementar la relación FEV1/SVC; 54% de los sujetos identificados con obstrucción mediante este cociente tenían antecedente de tabaquismo y 67.4% había recibido algún fármaco broncodilatador.44,49-50 No obstante, falta evidencia para aclarar la utilidad clínica de este parámetro funcional.
Pletismografía
Fue una de las primeras pruebas para evaluar la función de la VAP. El aumento en el volumen residual (RV) o en el índice de volumen residual-capacidad pulmonar total (RV/TLC, por sus siglas en inglés) por encima del percentil 95 indica hiperinflación o atrapamiento aéreo debido a la obstrucción de la vía aérea. Una de las manifestaciones más tempranas de disfunción de la vía aérea pequeña es el incremento del volumen residual o RV/TLC por el cierre prematuro la vía aérea. Conforme la obstrucción progresa la hiperinflación y el atrapamiento se reflejan con incrementos en la capacidad funcional residual (FRC) y FRC/TLC o TLC. El incremento en FRC/TLC sugiere una capacidad inspiratoria (IC) disminuida, que es una característica de EPOC y se asocia con intolerancia al ejercicio y disnea. Es importante señalar que la relación RV/TLC también puede incrementarse cuando existe debilidad muscular o esfuerzo subóptimo, incluso en algunos procesos restrictivos, cuando la capacidad pulmonar total se reduce de manera desproporcionada con respecto al volumen residual.51
El cociente IC/TLC es otro parámetro pletismográfico que representa un factor independiente de mortalidad en pacientes con EPOC; por tanto, cuando el índice IC/TLC es igual o menor de 25% se asocia con mayor mortalidad.52
La resistencia de la vía aérea (Raw), así como los parámetros ajustados al volumen, es decir, la resistencia específica (sRaw) o la conductancia específica de la vía aérea (sGaw), no son mediciones de rutina para identificar obstrucción al flujo aéreo, de hecho son más sensibles para detectar obstrucción de la vía aérea central (intra o extratorácica) que de la vía aérea periférica.51
Oscilometría
La oscilometría es una prueba que evalúa la impedancia respiratoria e incluye la resistencia (Rrs) y la reactancia (Xrs) a diferentes frecuencias de oscilación. Es un estudio fácil de realizar y solo requiere la respiración a volumen corriente en estado de reposo.53 Esta prueba es muy sensible para detectar aumento de la resistencia de la vía aérea, por tanto, anormalidades de la vía aérea pequeña, incluso antes de que la espirometría detecte obstrucción.40
Se han propuesto diferentes parámetros oscilométricos para evaluar la VAP: (Figura 4)
Rrs5-Rrs20: si la Rrs 5Hz representa el total de la resistencia respiratoria y la Rrs20Hz la de vía aérea central, se infiere que Rrs5-Rrs20 representa el gradiente de resistencia en la vía aérea pequeña. Se ha propuesto que un Rrs5-Rrs20 > 0.07 kPa/L/s podría significar enfermedad de la vía aérea pequeña,40 esto no necesariamente se aplica para todas las edades, por lo que es anormal cuando rebasa el límite superior de la normalidad (LSN).
X5: Disminución de la reactancia a 5 Hz. Representa la capacitancia y elastancia, principalmente del parénquima pulmonar, incluída la vía aérea pequeña, por lo que valores más bajos (o más negativos) reflejan poca distensibilidad.
AX (área de reactancia): es el área bajo la curva, cuyos puntos son el Xrs5 y la frecuencia de resonancia (Fres), que indirectamente representa la distensibilidad respiratoria y la permeabilidad de la vía aérea pequeña, y se correlaciona con Rrs5-Rrs20.Un aumento en el área de reactancia en conjunto con las alteraciones descritas en los puntos previos nos habla de disfunción de vía aérea pequeña.54-56
La diferencia de X5 entre inspiración y espiración es otro parámetro sugerido, cuyo valor de corte propuesto, en adultos, para definir anormalidad de la VAP es un valor > 0.28 kPa/L/s y se relaciona con disminución en el porcentaje del predicho del FEV1, hiperinflación, atrapamiento aéreo, aumento de los síntomas y reducción de la tolerancia al ejercicio.34
El incremento en Rrs5-Rrs20 en pacientes con EPOC en diferentes estadios se ha correlacionado positivamente con un puntaje mayor de 10 en la escala del Test de Evaluación de la EPOC (CAT, por sus siglas en inglés) y mayor volumen residual.40 Otro estudio informó que la diferencia entre Rrs5-Rrs20 se encontró incrementada en pacientes con EPOC comparada con sujetos sanos.55 Figura 4
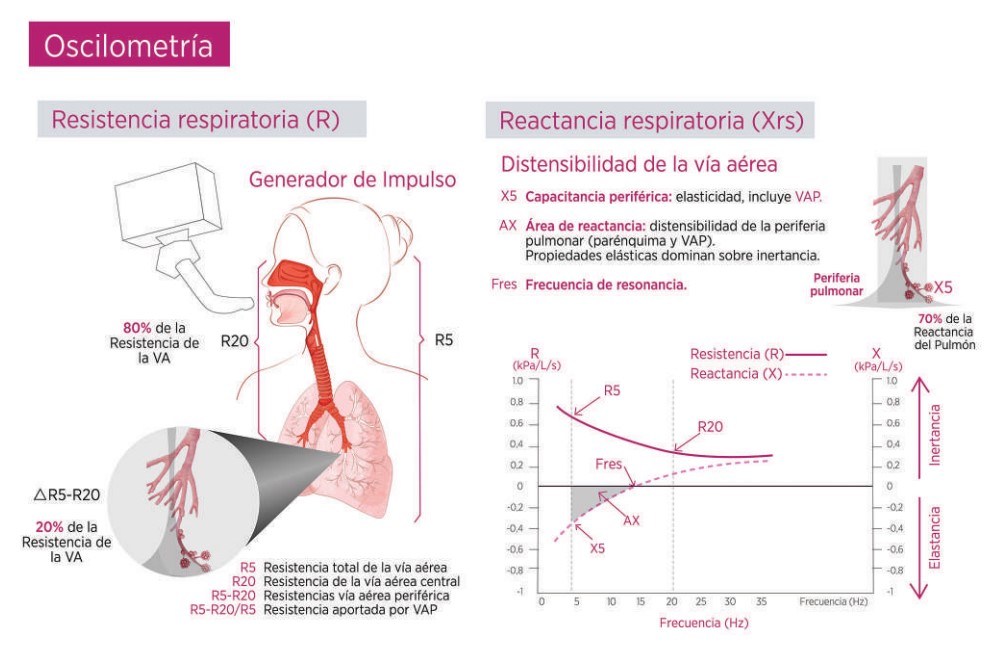
Figura 4. Oscilometría. Mediante una bocina o pistón se generan ondas de presión a diferentes frecuencias que se sobreponen al flujo respiratorio del individuo y viajan a través del sistema respiratorio. Las bajas frecuencias (4, 5, 6 Hz) representan la resistencia y reactancia de todo el sistema respiratorio, mientras que las altas frecuencias (19, 20 Hz) la vía aérea central. En la figura (abajo a la derecha) se muestra un esquema de resultados durante una medición de oscilometría, donde se observa la resistencia medida a diferentes frecuencias (R5, R20), así como la reactancia (X5). Se señala la frecuencia de resonancia (Fres), es decir, la frecuencia en la que dos componentes de la reactancia (elastancia e inertancia) se equilibran. El área de reactancia (AX) representa la sumatoria de la reactancia (elastancia). Adaptado de Oppenheimer BW, et al.53
Lavado de nitrógeno
En los pulmones, los gases se transportan por convección (también llamado “transporte de masa”) en la vía respiratoria grande, o por difusión en la vía respiratoria acinar (vía aérea pequeña); el borde anatómico entre ambos mecanismos corresponde al extremo de los bronquiolos respiratorios terminales.57
La prueba de lavado con nitrógeno en respiración única permite distinguir entre la heterogeneidad de la ventilación, que se origina en la vía aérea periférica y en la vía aérea conductora proximal. La distribución de gas en los pulmones se analiza al medir el cambio en la concentración de nitrógeno durante la fase de espiración de una maniobra de capacidad vital, seguido de una sola respiración con oxígeno al 100%. Las mediciones que pueden realizarse incluyen: capacidad de cierre (CC), volumen de cierre (CV, por sus siglas en inglés), pendiente de la fase III y volúmenes pulmonares. Se ha demostrado que el aumento del volumen o de la capacidad de cierre indican el atrapamiento de aire debido al estrechamiento o cierre de la vía aérea pequeña.58
Existe otra técnica que evalúa el lavado de nitrógeno en la vía aérea a volumen corriente, en la que se inhala oxígeno al 100% en múltiples respiraciones normales hasta eliminar la mayor parte del nitrógeno que habitualmente existe en la vía aérea (concentración 1/40). La tasa y la extensión de la exhalación de nitrógeno del árbol traqueobronquial permite la evaluación de la heterogeneidad de la ventilación, distinguiendo entre contribución de los compartimentos de la vía aérea conductora proximal y la de las regiones acinares distales.59
En la prueba de lavado de nitrógeno múltiple se derivan dos parámetros: 1) índice de aclaramiento pulmonar (LCI) que es el volumen de gas espirado (CEV) requerido para lavar un gas inerte (cantidad de respiraciones empleadas por espacio muerto), dividido por la capacidad residual funcional (FCR) (Figura 5). Se ha sugerido que el incremento del índice de aclaramiento pulmonar se correlaciona con los hallazgos tomográficos (TACAR) de afección en vía aérea pequeña.60 Figura 6 De manera análoga, se ha utilizado como indicador de la heterogeneidad ventilatoria y predictor de la hiperreactividad bronquial.47

Figura 5. Lavado de nitrógeno. Prueba de lavado de nitrógeno de respiración única (Panel A) y múltiples respiraciones (Panel B). En el lavado de nitrógeno de única respiración se observan las cuatro fases, que ocurren durante la exhalación y el registro de la concentración de nitrógeno. En el estudio de múltiples respiraciones se observa como disminuye la concentración de nitrógeno conforme el individuo va “lavando” el nitrógeno al estár inhalando oxígeno al 100%.6
Óxido nítrico exhalado
La determinación de óxido nítrico exhalado (FeNO) es un método para medir la inflamación eosinofílica de la vía respiratoria, mediante la espiración prolongada con un flujo constante (habitualmente 50 mL/seg). No obstante, es incapaz de diferenciar el óxido nítrico proximal del distal, por lo que se ha propuesto que la técnica de medición de FeNO, a diferentes flujos espiratorios (100 mL/s y 200 mL/s), estima la concentración de NO alveolar (Calv).47 Este último se considera un marcador de inflamación en la vía aérea pequeña. Se ha demostrado que el FeNo y 8-isoprostano en el aire exhalado se asocian con la función de la vía aérea pequeña en pacientes con asma leve.29
Otras técnicas para evaluación de la vía aérea pequeña
La tomografía computada de alta resolución (TAC-AR) es un método no invasivo que proporciona detalles anatómicos de la vía aérea; sin embargo, solo puede estimar el grosor de la pared de los bronquios, con 1 a 2 mm de diámetro.61 Aunque este método permite solo la evaluación directa de las anomalías de la vía aérea pequeña, se ha cuantificado el atrapamiento de aire y la heterogeneidad de la ventilación para apoyar de forma indirecta los parámetros funcionales.62
La tomografía de tórax en fase espiratoria e inspiratoria es un marcador de atrapamiento aéreo en pacientes con enfermedad de la vía aérea pequeña, y la cantidad de voxeles para definirlo es de -950 y -856 HU.34
Otros hallazgos que indican enfermedad de la vía aérea pequeña son: bronquioloectasias, engrosamiento de la pared bronquiolar, obstrucción bronquiolar, nódulos centrilobulillares y patrón en mosaico. Figura 6
Las medidas de la vía aérea pequeña mediante tomografía se definen por los siguientes índices:62
Espiración (E-856) o "porcentaje de atrapamiento aéreo": cantidad porcentual de voxeles en el parénquima pulmonar con atenuación inferior -856 UH en la fase espiratoria, denominado porcentaje de atrapamiento aéreo.
Relación de Espiración a Inspiración de la Atenuación Pulmonar Media (E/I APM): es la relación de la atenuación pulmonar media del histograma de densidad en los rastreos inspiratorios y espiratorios.
Volumen pulmonar relativo: se calcula con la fórmula de volumen pulmonar con atenuación entre -856 y -950 UH/volumen pulmonar sin enfisema. Mientras que el volumen pulmonar sin enfisema muestra atenuación superior a -950 UH. Tomando en cuenta ambos conceptos, la variable cambio de volumen relativo (CVR -856-950) se refiere al delta entre los valores obtenidos en la fase inspiratoria y espiratoria de esta fórmula.
Otras técnicas que se encuentran en investigación son la resonancia magnética de pulmón después de la inhalación de helio hiperpolarizado y xenón;63 la tomografía computada de emisión monofotónica (SPECT) y la tomografía por emisión de positrones (PET).64 También existen pruebas moleculares y celulares para evaluar la VAP. La determinación de N-carboximetil lisina (CML) se han correlacionado inversamente con FEF25-75 y con las concentraciones alveolares de óxido nítrico.65
La proteína surfactante D (SP-D) en saliva se relaciona con R5-R20 en la oscilometría.66
Tratamiento
El tratamiento de elección de pacientes con enfermedades respiratorias que cursan con daño de la VAP consiste en fármacos inhalados. Esta vía no es invasiva ni dolorosa y tiene buen perfil de bioseguridad; sin embargo, para que el tratamiento sea efectivo, el medicamento debe depositarse adecuadamente en los pulmones, lo que es determinante en los pacientes con enfermedades respiratorias crónicas.67-68 Los mecanismos de depósito pulmonar son: impactación, sedimentación y difusión de los fármacos; sin embargo, existen factores que no permiten su adecuado depósito. Cuadro 2
Los dispositivos para inhalación utilizados en la práctica clínica actual incluyen: inhaladores de polvo seco (DPI, por sus siglas en inglés), inhaladores de dosis medida (pMDI, por sus siglas en inglés) con o sin cámaras espaciadoras, y nebulizadores. Sin embargo, debido a los factores que afectan el depósito pulmonar, se ha observado que solo 10 al 50% de la dosis del fármaco llega a los pulmones, y la mayor parte de las dosis permanece en la orofaringe, lo que puede generar efectos adversos locales y sistémicos.69
Para aumentar el depósito pulmonar existen diferentes acciones: mejorar la maniobra de inhalación del fármaco, es decir, explicar que debe realizarse una exhalación inicialmente, después hacer una inhalación con el flujo inspiratorio sugerido por el fabricante del fármaco y, finalmente, efectuar una apnea de aproximadamente 10 segundos. También se han diseñado dispositivos con diferentes tipos de dispensadores y resistencias. Otro factor en el que se ha trabajado es el tipo de formulación en solución del dispositivo, que permite producir aerosoles extrafinos con una distribución homogénea en todo el árbol bronquial y de esta forma lograr un buen suministro, sin necesidad de agitar.70
Dentro de los factores más importantes que pueden mejorar la eficiencia de la administración del medicamento inhalado se encuentra el tamaño de partícula y su dinámica como aerosol. Es bien conocido que las partículas de 5-10 µm se depositan, preferentemente, en la orofaringe por impactación; las que se encuentran entre 2 y 5 µm se dirigen a los pulmones por sedimentación (partículas finas o convencionales); y las menores de 2 µm alcanzan la vía aérea pequeña, que son partículas extrafinas o ultrafinas.71-72
En este sentido, las partículas extrafinas han demostrado contundentemente alcanzar la vía aérea pequeña comparadas con partículas de mayor tamaño.67
En el mercado existen fármacos con estas características (partículas extrafinas), ya sea en monoterapia, terapia dual o triple, e incluyen: broncodilatadores β-2 agonistas, anticolinérgicos y corticosteroides inhalados. Estas formulaciones permiten que las partículas del fármaco lleguen a la vía aérea central y periférica, optimizando el tratamiento del proceso inflamatorio, con aumento del depósito pulmonar periférico (33% en promedio para pMDI, 41-45% con pMDI con aerocámara y 55% en promedio para DPI), independientemente de la enfermedad subyacente del paciente, con una cantidad insignificante de partículas exhaladas.68,71,73-77
La administración de estas formulaciones en pacientes con asma, aumentan la probabilidad de lograr el control con menores exacerbaciones versus fármacos que contienen moléculas convencionales (odds ratio 1.34; IC95%, 1.22-1.46). Al menos así lo demostró una revisión sistemática y metanálisis de estudios observacionales de la vía real que incluyó 33,453 sujetos de 5 a 80 años.77
A su vez, el riesgo de eventos adversos parece ser menor con corticosteroides inhalados de partículas extrafinas, sobre todo la neumonía, complicación ampliamente temida con este grupo de medicamentos. En 2017, Sonnappa y colaboradores reportaron 23,013 pacientes que recibían corticosteroides inhalados extrafinos vs convencionales, con una razón de momios para neumonía de [aOR] 0.60; IC95%: 0.37; 0,97].78
El efecto real de estas formulaciones en la calidad de vida de pacientes con disfunción de la vía aérea pequeña se determinará más adelante, cuando se disponga de mayor cantidad de datos y generalizar su prescripción.
Cuadro 2 Factores implicados en el depósito pulmonar de medicamentos inhalados
| Características del aerosol | Factores del paciente |
|---|---|
| Partícula del fármaco | Técnica de inhalación |
| Tamaño | Flujo inspiratorio |
| Densidad | Volumen inhalado |
| Carga | Pausa para contener la respiración |
| Formulación | Vía aérea |
| Lipofilicidad | Enfermedad |
| Higroscopicidad | Gravedad |
| Solución vs suspensión | |
| Nube del aerosol | Dispositivo |
| Velocidad | Aceptación |
| Duración | Uso correcto |
| Adherencia |
CONCLUSIÓN
Las pruebas clásicas de función pulmonar fallan en la identificación oportuna de pacientes con anormalidades en la vía aérea pequeña. Existe desarrollo biotecnológico de elevada sensibilidad y en los últimos años ha mejorado la evaluación funcional de la vía aérea pequeña. Entre estos métodos destaca la oscilometría, FeNO compartimental e índice de aclaramiento pulmonar. Los estudios de imagen han demostrado avances prácticos y relativamente accesibles, y pueden ser complementarios a la evaluación funcional de la vía aérea pequeña. Desde el punto de vista terapéutico, la disponibilidad de dispositivos para inhalación de partículas extrafinas abre nuevos campos de investigación clínica y sus indicaciones actuales para el asma y EPOC ofrecen resultados prometedores.











 nueva página del texto (beta)
nueva página del texto (beta)




