Introducción
La alergia alimentaria es la reacción adversa a los alimentos, reproducible, mediada por mecanismos in- munológicos.1 Es un padecimiento común en niños y diferentes reportes señalan que la prevalencia se ha incrementado en los últimos años, del 7 al 8% de los niños en Estados Unidos y Canadá.2 Puede aparecer desde los primeros meses de vida y los alimentos implicados con mayor frecuencia son la leche de vaca, el huevo y el trigo.
Las manifestaciones clínicas varían, desde síntomas leves e inespecíficos, similares a trastornos funcionales digestivos, hasta manifestaciones sistémicas con reacciones graves que ponen en peligro la vida de los pacientes.1
La prevención de reacciones adversas es el mejor método para el control de la enfermedad y se han propuesto diferentes estrategias, relacionadas principalmente con la promoción de la lactancia materna, el retraso en la introducción de alimentos potencialmente alergénicos y la identificación oportuna de factores de riesgo que propician la enfermedad en niños susceptibles.1,2,3Sin embargo, en los últimos años se ha demostrado que algunas recomendaciones (dietas de exclusión durante el embarazo y la lactancia, retraso en la introducción de alimentos sólidos y el tipo de alimentos que se ofrecen al lactante) no han frenado el incremento de casos de alergia alimentaria. Aunque el retraso en la introducción de alimentos complementarios previene la aparición de reacciones alérgicas, no existe evidencia que sugiera que previene las alergias y podría únicamente retardar su aparición,3 por lo que se ha propuesto una conducta opuesta a la que tradicionalmente se utilizaba respecto al momento de introducción de alimentos considerados alergénicos. Diferentes estudios han planteado que existe una “ventana" entre los 4 y 6 meses de edad, en que la introducción gradual de estos alimentos no sería un riesgo de alergia alimentaria, sino que funcionaría como factor protector en la aparición de estos padecimientos.10,11,12,13 Así, los criterios de algunos organismos internacionales recomiendan la introducción temprana (entre los 4 y 6 meses) de alimentos, principalmente el huevo y cacahuate, y sugieren que su introducción tardía se asocia con alergia en etapas posteriores de la vida.1
Con base en lo expuesto, el objetivo de este estudio fue: revisar la evidencia disponible relacionada con la introducción temprana de alimentos alergénicos y la posible protección en la aparición de alergia alimentaria en etapas posteriores.
Metodología
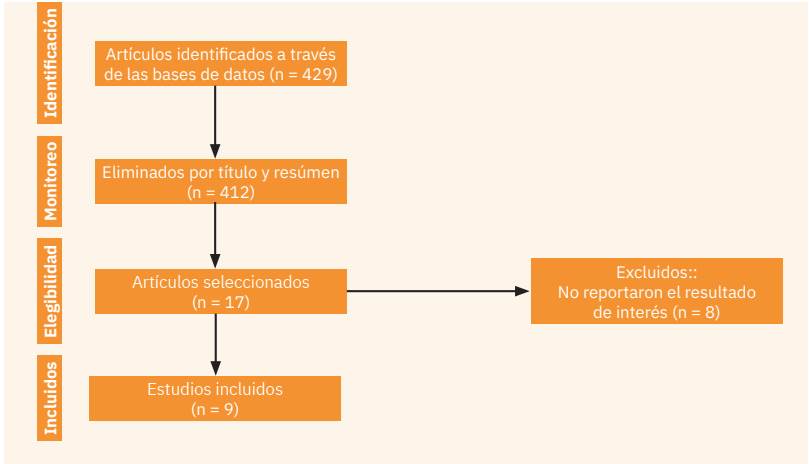
Entre agosto y diciembre de 2021 se consultaron las bases de datos de Medline, EBSCO, OVID, Science Direct, JSTOR (Journal Storage), Scielo, LILACS, Redalyc e Imbiomed. Se incluyeron ensayos clínicos aletaorizados, cuya población de estudio comprendiera lactantes menores de 6 meses de edad al momento del reclutamiento, con o sin diagnóstico de alergia alimentaria. Para efecto de la revisión, solo se incluyeron alimentos potencialmente alergénicos: huevo, cacahuate y trigo, por considerarse de mayor consumo en la población mexicana, comparados con otros como: soya, ajonjolí, mariscos, pescado u otro tipo de oleaginosas. La definición de “introducción temprana de alimentos" se consideró a la que apareció entre los 4 y 6 meses de edad. Los criterios de inclusión fueron: ensayos clínicos aleatorizados (ECA) con introducción temprana de alimentos potencialmente alergénicos (huevo, cacahuate y trigo), que tuvieran un grupo control y que la variable de desenlace el desarrollo de alergia alimentaria de alergia alimentaria (diagnosticado mediante pruebas de IgE en sangre, de punción cutánea o prueba de reto). Después de establecer el objetivo principal y los criterios de inclusión se elaboró una lista de palabras clave y sus distintas combinaciones que informaron la mayor cantidad de resultados (Cuadro 1). Criterios de exclusión: estudios con metodología distinta a los ensayos clínicos aleatorizados y los que informaran que la edad de exposición a los alimentos potencialmente alergénicos fuera mayor de 6 meses de edad.
Cuadro 1 Palabras clave, combinación de palabras y artículos identificados
| Alimento | Palabras Clave | Combinaciones | Resultados |
|---|---|---|---|
| Huevo | Egg, allergy, early introduction, infant, child | Egg allergy (+ filtros)* | 210 |
| Egg allergy early introduction | 123 | ||
| (sin filtros) | 33 | ||
| Egg allergy early introduction (+ filtros)* | 10 | ||
| Resultados potencialmente útiles | |||
| Artículos incluidos | 6 | ||
| Cacahuate | Peanut, allergy, early introduction, infant, child | Peanut allergy early introduction | 180 |
| (sin filtros) | 96 | ||
| Peanut allergy (+filtros)* | 7 | ||
| Peanut allergy early introduction (+ filtros)* | 4 | ||
| Resultados potencialmente útiles | |||
| Artículos incluidos | 2 | ||
| Trigo | Wheat, allergy, early introduction, infant, child | Wheat allergy (+ filtros)* | 39 |
| Wheat allergy early introduction | 23 | ||
| Wheat allergy early introduction (+ filtros) | 3 | ||
| Resultados potencialmente útiles | 3 | ||
| Artículos incluidos | 1 |
* En todas las búsquedas se aplicaron los filtros de RCT y age (child 0-18 years).
Para el análisis de la información se elaboró una matriz de sistematización de cada alimento por separado con los artículos previamente seleccionados, además de realizar un algoritmo para presentar el resultado final de los artículos seleccionados. Con base en estos criterios, se incluyeron un total de 9 ensayos clínicos aleatorizados para la revisión. Figura 1
Resultados
Huevo
La proteína del huevo es uno de los alérgenos alimentarios de consumo más frecuente en la población pediátrica. Algunos reportes señalan que la prevalencia mundial de alergia al huevo es del 0.5 y 9%, en Australia y Reino Unido, respectivamente. Esta diferencia depende del contexto geográfico, edad y frecuencia de exposición a los alimentos, además de los criterios diagnósticos.3,4,5,6 De forma similar, en México algunos estudios estiman que la prevalencia de alergia a la proteína del huevo varía de 0.4 a 25%; sin embargo, no se han realizado estudios representativos de la población, por lo que se desconoce la prevalencia real.7,8,9
Las recomendaciones para iniciar la introducción de proteína del huevo se ha modificado en los últimos años. Existe evidencia que señala que la introducción temprana de huevo en la alimentación de los lactantes (entre 4 y 6 meses de edad) puede tener mayor beneficio que la introducción tardía como estrategia de prevención primaria de alergia alimentaria. Sin embargo, la posibilidad de reacciones alérgicas de la introducción temprana aún se discute.1
En la revisión de datos se identificaron seis ensayos clínicos controlados que exploran si la introducción temprana y gradual de la proteína de huevo previene la alergia alimentaria al cumplir el primer año de edad.6,7,8,9,10,11,12,23,14Todas las intervenciones incluyeron un grupo control. En la mayor parte de los estudios, el arroz se eligió como placebo, porque el cereal de arroz es uno de los primeros alimentos que se introducen en la alimentación complementaria y las reacciones alérgicas mediadas por IgE son poco comunes. Por el contrario, las características de introducción de huevo fueron distintas. El común denominador fue la introducción de huevo en polvo; sin embargo, el tipo de cocción y la cantidad fueron distintas en todas las intervenciones. Cuadro 2
Cuadro 2 Variables de intervención y resultados
| Ensayo | Edad de introducción del huevo* | Tipo de población | Intervención | Resultados y conclusiones |
|---|---|---|---|---|
| STAR, 201312 (Australia) | 4 meses | Lactantes de término con síntomas de eczema moderado a grave | Intervención: 1 cucharada diaria (0.9 g) de huevo entero en polvo, crudo pasteurizado (n = 49). Control: 1 cucharada diaria de harina de arroz en polvo (n = 37). | En el grupo de intervención, 31% de los participantes tuvo reacción alérgica al huevo en polvo, la mayoría (10/15) en la primera exposición, incluido un caso de anafilaxia. A los 12 meses, una proporción menor de lactantes del grupo de intervención (33%) se diagnosticaron con alergia al huevo mediada por IgE, comparados con el grupo control (51%; p = 0.11). Del mismo modo, una proporción menor tuvo prueba cutánea positiva, aunque tampoco fue significativa (45 vs 63%; p = 0.12). Del grupo total, 33% tuvo reacción alérgica durante la prueba de reto oral a los 12 messes. La introducción temprana de huevo en el grupo de intervención se asoció con elevadas concnetraciones de IgG4 durante el estudio (p < 0.001). Existe menor incidencia de alergia al huevo en el grupo de intervención, con inducción de tolerancia inmunológica en lactantes con eczeman moderado a grave. |
| HEAP, 201610 (Alemania) | 4-6 meses | Lactantes con edad gestacional mayor de 34 semanas y peso al nacimiento mayor de 2.5 kg. No se incluyeron lactantes con anticuerpos IgE específicos vs huevo. | Intervención: huevo blanco en polvo (2.5 g), pasteurizado (1½ cda. 3 veces por semana) (n = 142). Control: Polvo de arroz (n = 156). | A los 12 meses de edad 5.6% de los lactantes del grupo de intervención y 2.6% del grupo control tuvieron sensibilidad al huevo (p = 0.24); mientras que 2.1 y 0.6%, respectivamente, se diagnosticaron alérgicos al huevo (p = 0.35). Se reportaron síntomas de alérgia relacionada con la ingestión del polvo en 7.1% del grupo de intervención y 0.5% del grupo control (p = 0.001). La exposición temprana al huevo de gallina pasteurizado no fue segura ni efectiva en la prevención de alergia al huevo. |
| BEAT, 201613 (Australia) | 4 meses | Se incluyeron madres de recién nacidos de término, con al menos un familiar de primer grado con antecedente de enfermedad atópica. Se citaron a los 4 meses y se excluyeron por prueba cutánea positiva al huevo. | Intervención: huevo entero en polvo, pasteurizado (0.35 g proteína de huevo) (n = 165)** Control: arroz en polvo (n = 154). | La proporción de lactantes sensibilizados al huevo (prueba cutánea positiva) a los 12 meses de edad fue menor en el grupo de intervención versus placebo (10.7 vs 20.5%; p = 0.03). Los lactantes del grupo de intervención tuvieron mayores valores de IgG4 y de la relación IgG4/IgE específica a huevo, ovoalbúmina y ovomucoide al compararlo con el grupo control (p < 0.001). No se reportaron efectos adversos graves durante el estudio. La “probable” alergia al huevo a los 12 meses no fue diferente entre los grupos (p = 0.20). La introducción de huevo entre los 4 y 6 meses de edad en lactantes con riesgo se asoció con reducción en la sensibilización al huevo e inducción de respuesta IgG4 significativa a los 12 meses. |
| PETIT, 201611 (Japón) | 6 meses | Pacientes de 4-5 meses de edad, con dermatitis atópica, antecedente de embarazo de término, que no hubieran consumido huevo de gallina. | Intervención: polvo de calabaza y huevo cocido en polvo (n = 60).*** Control: polvo de calabaza (n = 61). | El riesgo de alergia al huevo (prueba de reto oral a los 12 meses) fue menor en el grupo de intervención que en el grupo control (8 vs 38%; p = 0.0001). La concentración de IgE específica vs ovomucoide fue menor en el grupo de intervención; mientras que las concentraciones de IgG1, IgG4 e IgA fueron mayores en el grupo de intervención. No hubo diferencias en los efectos adversos y en ningún caso fueron graves. La introducción progresiva de huevo reduce la prevalencia de alergia en lactantes con riesgo. |
| STEP, 201712 (Australia) | 4-6.5 meses | Lactantes menores de 6.5 meses, con madres con atopia. Sin antecedente de enfermedad alérgica ni alteraciones sistémicas. Sin consumo previo de huevo ni que iniciaran el consumo de alimentos complementarios antes de los 4 meses. | Intervención: polvo de zanahoria, piña y arroz, y 0.9 g de polvo de huevo entero crudo pasteurizado (n = 407). Control: polvo de zanahoria, piña y arroz (n = 413). | No hubo diferencias entre los grupos respecto al porcentaje de lactantes con alergia al huevo mediada por IgE (intervención 7.0%, control 10,3%; p = 0.20). No se encontraron diferencias en el porcentaje de lactantes con sensibilidad al huevo (prueba cutánea positiva) a los 12 meses de edad (intervención 10.8%, control 15.1%; p = 0.15). Tres lactantes (dos en el grupo de intervención) tuvieron anafilaxia durante la prueba de reto oral con huevo crudo a los 12 meses; ninguno al inicio de la intervención (4-6.5 meses). Una mayor proporción de participantes del grupo de intervención dejó de consumir el polvo, debido a una reacción alérgica confirmada (6.1 vs 1.5% en el grupo control; p = 0.0004). Las concentraciones de IgE específica para el huevo fueron más altas en el grupo de intervención a los 12 meses (p = 0.03). No existe evidencia que el consumo regular de huevo, entre los 4 y 6.5 meses de edad, altere el riesgo de alergia al huevo a los 12 meses de edad en lactantes con riesgo de enfermedad alérgica. |
| EAT, 2016 y 201914 (Reino Unido) | 3 meses (3.5 meses) | Lactantes sanos de 3 meses de edad, alimentados solo con lactancia materna. | Intervención: & introducción al azar de seis alimentos potencialmente alergénicos: leche de vaca (yogurt), cacahuate, huevo cocido, ajonjolí, pescado y trigo (n = 567). Control: introducción estándar de alimentos a partir de los 6 meses de edad (n = 595). | La alergia al huevo (prueba de reto oral) entre los 12 y 36 meses fue menor en el grupo de introducción temprana que en el grupo control, pero la diferencia no fue significativa (3.7 vs 5.4%; p = 0.17). Cualquier tipo de alergia se asoció con eczema al ingreso al estudio, tener hermanos y no ser de raza blanca. Se obtuvieron resultados similares con las pruebas cutáneas, con menor cantidad de reacciones positivas en el grupo de intervención, pero sin diferencia significativa. La prevalencia de alergia y pruebas cutáneas positivas al huevo disminuyó conforme incrementó el consumo. No se comprobó la eficacia de la introducción temprana de alimentos en la prevalencia de alergia. El análisis secundario de los datos demostró que la introducción temprana de huevo fue eficaz para prevenir la alergia en lactantes con sensibilidad al huevo o eczema al ingreso al estudio (p = 0.01). |
*Promedio de edad al inicio de la intervención; **conversión a gramos por criterios de uniformidad; ***0.05 g de 6 a 9 meses y 0.25 g de 9 a 12 meses; & la leche de vaca fue el primer alimento en todos los casos
La edad promedio de introducción de la proteína del huevo en los ensayos clínicos fue de 4.7 meses, excepto en el estudio HEAP,10llevado a cabo en Japón, que informó una edad promedio de 3.5 meses. Es importante definir la edad de introducción, pues las características fisiológicas e inmunológicas de los lactantes difieren considerablemente si se considera el límite inferior (4 meses) y superior (6 meses), debido a que este último periodo coincide con el recomendado por la mayor parte de las guías internacionales respecto al inicio de la alimentación complementaria.15,16
Una de las principales diferencias en los ensayos clínicos aleatorizados es el tipo de población incluida: algunos seleccionaron lactantes con riesgo de alergia alimentaria asociado con el antecedente familiar de atopia o coexistencia de eczema o dermatitis atópica; mientras que otros no manifestaron esta alteración.
Por tanto, los resultados de la intervención fueron diferentes entre estos dos grupos de lactantes: con o sin riesgo de alergia alimentaria. En este sentido, la introducción temprana de huevo en la dieta de los lactantes con riesgo se asoció, en general, con tendencia a la disminución del riesgo de sensibilización al huevo a los 12 meses de edad (Cuadro 2). Sin embargo, un aspecto fundamental a considerar en estos ensayos es el riesgo elevado de efectos adversos durante la exposición temprana al huevo. Todos los estudios reportaron casos con efectos adversos, algunos leves y otros graves, incluso ciertos ensayos informaron anafilaxia. El protocolo STAR12 se suspendió, debido al elevado porcentaje de efectos adversos entre los participantes. El porcentaje de efectos adversos reportado en los estudios analizados varió de 8 a 30%.6,10,11,12,13,14
La introducción temprana de huevo en la dieta de los lactantes no considerados con riesgo, no parece ser efectiva para prevenir la alergia al huevo; no obstante, solo se han efectuado dos estudios en este tipo de población.6,10
Es importante recalcar que existen factores externos al individuo considerados protectores o de riesgo asociados con la enfermedad alérgica. El Cuadro 3 expone la frecuencia de estas variables en los ensayos clínicos aleatorizados. La frecuencia de cesáreas fue superior en los grupos de intervención (31.2%) versus control (24.6%), sin diferencias estadísticamente significativas, excepto lo reportado en el estudio HEAP,10 que informa una diferencia significativa (43.5 vs 23.3%; p = 0.03), con cifras superiores en el grupo de intervención.
Cuadro 3 Antecedentes de cesárea, lactancia y alergia maternas en estudios relacionados con introducción temprana de huevo durante la alimentación complementaria.
| Estudio*** | Cesáreas (%) | Lactancia materna (%) | Alergia materna (%) | ||||
|---|---|---|---|---|---|---|---|
| Intervención | Control | Intervención | Control | Intervención | Control | ||
| STAR, 2013 (4) | 35 | 30 | 82 | 84 | 76 | 68 | |
| HEAP, 2016 (10)* | 43.5 | 23.2 | 64.4 | 69.6 | 78.3 | 67.6 | |
| PETIT, 2016 (11) | 14 | 11 | 95 | 93 | 62 | 60 | |
| STEP, 2017 (12) | 35.9 | 36 | 67.5 | 65 | 47.1 | 57 | |
| EAT, 2019 (14) | 27.6 | 22.7 | NA** | NA** | 21.8 | 16.9 | |
| Promedio | 31.2 | 24.6 | 77.4 | 77.9 | 57 | 53.9 | |
p = 0.03; **no aplica: alguno de los criterios de inclusión fue solo lactancia materna; ***se excluyó el estudio BEAT,13 porque no inlcuyó ninguna de estas variables.
Respecto a la lactancia materna, la mayoría de los participantes la recibió en algún momento de su vida; el porcentaje de lactantes alimentados con leche humana al momento del reclutamiento fue de 77.4 vs 77.9% en el grupo de casos versus control, respectivamente, sin diferencias estadísticamente significativas.
Cacahuate
El cachuate se encuentra dentro de los primeros seis alimentos con potencial alergénico.17La prevalencia de alergia al cacahuate a nivel mundial varía del 1.4-3%18,19,20,21y es la causa más frecuente de anafilaxia y mortalidad secundaria por alergia alimentaria. En México, algunos estudios estiman que la prevalencia en la población pediátrica varía del 0.4 al 1.8%; incluso existen reportes que informan 5.9% cuando ésta se obtiene por auto-reporte de los padres de familia en niños de edad escolar, lo que indica que esta alergia alimentaria es más prevalente que en otros países.17,22,23
Comparados con otros reportes de alergia alimentaria, son pocos los ensayos clínicos aleatorizados que informan la introducción temprana (4-6 meses de edad) de cacahuate y su función protectora en la alergia. En este rubro se seleccionaron dos ensayos clínicos que cumplieron con los criterios: The Learning Early about Peanut Allergy (LEAP), y el ensayo Enquiring About Tolerance (EAT), ambos publicados en 2016.
The Learning Early about Peanut Allergy (LEAP)24
El objetivo del estudio fue determinar si la introducción temprana de cacahuate es estrategia efectiva de prevención primaria y secundaria. El estudio se realizó en una sola sede en el Reino Unido.
Se incluyeron 640 lactantes de entre 4 y 11 meses, con antecedente de eccema grave, alergia al huevo, o ambos. Los pacientes se dividieron en dos cohortes, con base en los resultados de la prueba cutánea para alergia al cacahuate (positiva o negativa), y posteriormente en dos subgrupos cada uno: con o sin consumo de cacahuate. Se realizó una prueba de reto oral antes de la intervención en los pacientes asignados al consumo de cacahuate, y en quienes no tuvieron reacción se indicó el consumo de 6 g de proteína de cacahuate a la semana hasta cumplir los 60 meses de edad. Los pacientes asignados al grupo control evitaron el consumo de cacahuate hasta los 60 meses de edad. Se realizó la evaluación clínica al momento del reclutamiento y a los 12, 30 y 60 meses. El resultado primario fue la proporción de niños con alergia al cacahuate a los 60 meses, estimado en 617 participantes mediante la prueba de reto oral.
La edad promedio al ingreso al estudio fue de 7.8 ± 1.7 meses. De los pacientes con prueba cutánea negativa al momento de ingreso al estudio, 530 se evaluaron para alergia al cacahuate a los 60 meses de edad, con una diferencia significativa en quienes recibieron o no cacahuate (1.9 vs 13.7%; p < 0.001). El grupo con prueba cutánea positiva al momento del ingreso al estudio (n = 98) tuvo un comportamiento similar, con mayor prevalencia de alergia en quienes evitaron el consumo de cacahuate (35.3 vs 10.6%; p = 0.004).
Se registraron más efectos adversos en el grupo de consumo de cacahuate (p = 0.02), y mayor frecuencia de infecciones de la vía respiratoria superior, infecciones virales de la piel, gastroenteritis, conjuntivitis y urticaria. Los eventos fueron de intensidad leve a moderada, sin diferencia entre los grupos.
Es importante considerar el reporte de respuestas sistémicas de los participantes. Al inicio del estudio, 7 pacientes tuvieron respuesta positiva al reto alimentario, con síntomas predominantemente cutáneos. Seis recibieron antihistamínico y uno glucocorticoide por vía oral. De los 57 (9 asignados al consumo y 48 a su exclusión) participantes que tuvieron respuesta positiva al reto alimentario oral a los 60 meses, 14 tuvieron manifestaciones respiratorias o cardiovasculares y 9 recibieron epinefrina intramuscular, debido a la gravedad de la reacción alérgica, lo que representa el 10.5% de la población de estudio. El ensayo concluye que los lactantes con alto riesgo de enfermedad atópica, el consumo sostenido de cacahuate, que inicia en los primeros once meses de vida, genera una proporción significativamente menor de niños con alergia al cacahuate a los 60 meses, comparado con la exclusión de este alimento en la dieta.
Enquiring About Tolerance (EAT)25
Este estudio también se llevó a cabo en el Reino Unido e incluyó a 1303 lactantes de 3 meses de edad, que recibieron solo lactancia materna, independientemente de su estatus de atopia y el antecedente familiar de alergia. Los pacientes se asignaron al azar al protocolo de introducción temprana (n = 567) o estándar (n = 595) de seis alimentos potencialmente alergénicos (cacahuate, huevo, leche de vaca, ajonjolí, pescado blanco y trigo). El grupo de introducción estándar recibió solo lactancia materna durante 6 meses y posteriormente se introdujeron los alimentos complementarios, incluidos los potencialmente alergénicos. El resultado primario fue la evolución a alergia alimentaria para uno o más de los seis alimentos a los primer y tercer años de edad, mediante la prueba de reto oral a los alimentos.
La frecuencia de alergia al cacahuate fue de 1.2% en el grupo de introducción temprana y de 2.5% en el estándar, lo que representa 51% menos riesgo, aunque la diferencia no fue estadísticamente significativa (p = 0.11). Este ensayo no mostró la eficacia de la introducción temprana de alimentos alergénicos versus estándar; la frecuencia de alergia alimentaria en general no fue diferente entre los grupos de introducción temprana y estándar de alimentos potencialmente alergénicos (5.6 vs 7.1%; p = 0.32).
Se observó un patrón similar en los resultados de la prueba de punción cutánea; la proporción de resultados positivos fue menor en el grupo de intervención temprana, pero la diferencia no fue estadísticamente significa tiva a los 12 (p = 0.07) y 36 meses de edad (p = 0.47).
Trigo
El trigo es uno de los granos más consumidos en todo el mundo y también figura dentro de los alimentos potencialmente alergénicos. La alergia al trigo ha cobrado especial relevancia, porque a diferencia de otras enfermedades alérgicas, puede expresar dos espectros patológicos específicos: 1) sensibilidad al gluten sin enfermedad celiaca y 2) enfermedad celiaca. La importancia de la prevención y diagnóstico adecuados radica en que la disminución o eliminación del gluten de la dieta forma parte primordial del tratamiento.26,27
La prevalencia de trastornos relacionados con el gluten en la población general se estima en 3 al 5%; sin embargo, estas cifras suelen basarse en auto-reportes de la manifestación de síntomas. Se estima que la prevalencia de alergia al trigo, diagnosticado mediante la prueba de reto alimentario, es del 0.3%.28,29En México se han publicado estudios en pacientes pediátricos, realizados en poblaciones específicas, que reportan del 20 al 30% de reacciones alérgicas quizá relacionadas con el consumo de cereales, que pueden incluír la exposición al gluten7,30
Aunque se trata de una de las alergias con más reportes en la bibliografía, la evidencia de la introducción temprana como factor protector es escasa. Identificamos 3 ensayos clínicos aleatorizados, pero se descartaron dos. El primero porque no cumplió con el criterio de exposición temprana, en este caso al trigo;31 y en el segundo (PreventADALL), aunque incluye un grupo de lactantes expuestos de manera temprana a alimentos potencialmente alergénicos, la variable de desenlace fue la prevención de dermatitis atópica y no propiamente la alergia alimentaria25,31,32
Se incluyen los resultados de "EnquiringAbout Tolerance (EAT)”, previamente reportado en el apartado de huevo y cacahuate.
Enquiring About Tolerance (EAT)25
Se incluyeron 1303 lactantes de 3 meses de edad, alimentados solo con leche materna. Se asignaron al azar a la introducción temprana o estándar de seis alimentos potencialmente alergénicos (cacahuate, huevo, leche de vaca, ajonjolí, pescado blanco y trigo; grupo de introducción).
Se comentó anteriormente que este ensayo no mostró la eficacia de la introducción temprana de alimentos alergénicos versus introducción estándar. La prevalencia de alergia al trigo fue muy baja entre los participantes, tanto en la introducción temprana como estándar (0 vs 0.2%; p = 0.49).
Sin embargo, la prevalencia de resultado positivo en la prueba cutánea fue significativamente menor a los 12 (3.2 vs 1.3%; p = 0.03) y 36 meses de edad (3.2 vs 1.4%; p = 0.04) en el grupo de introducción temprana.
Discusión
Una proporción pequeña de alimentos es responsable de la mayor parte de las reacciones alérgicas a alimentos en pacientes pediátricos: leche de vaca, huevo, cacahuate, nuez, soya y trigo; donde el momento de la exposición a estos alérgenos representa uno de los factores fundamentales de la alergia alimentaria. Históricamente, las recomendaciones se enfocaban en retrasar, incluso evitar la introducción de estos alérgenos en la dieta de un lactante.3 Sin embargo, eliminar de forma estricta el consumo de este grupo de alimentos no ha mostrado resultados satisfactorios respecto a la prevención de la alergia alimentaria y puede asociarse con el consumo insuficiente de nutrimentos clave.33,34,35,36,37Hace poco se informó que, por el contrario, la introducción temprana (antes de los 6 meses de edad) puede prevenir la alergia alimentaria hacia el final del primer año de vida y llevar a una mejor tolerancia de estos alimentos.3 No obstante, hasta la fecha son pocos los estudios que avalen o no esta postura y difieren entre sí respecto a las condiciones en que fueron realizados, por lo que no puede señalarse que la introducción temprana de estos alimentos ofrezca ventajas en la población general.
Respecto al momento de la introducción del huevo en la dieta de un lactante, existe nueva evidencia que plantea dudas del beneficio de retrasar su con- sumo.10,14Desde el punto de vista nutrimental, el huevo es de especial interés, porque reúne en un solo alimento sustancias clave: proteínas de buen valor biológico, lípidos indispensables, vitaminas, minerales y oligoelementos, con un aporte promedio de 140 kcal/100 g. Para un lactante de entre 7 y 12 meses de edad, un huevo (50 g) proporciona 57% de la ingesta dietética recomendada de proteína, 88% de vitamina B12, 98% de colina, entre 25 y 50% de ácido pantoténico, vitamina B6, ácido fólico, fósforo y selenio, y aproximadamente 20% del requerimiento de zinc. Además de su diversidad culinaria y bajo costo, representa la fuente animal de menor costo de proteínas, vitamina A, hierro, vitamina B12, riboflavina y colina.38,39En México, el consumo percapita promedio de huevo en adultos es de 358 piezas al año, lo que coloca al país como el primer consumidor a nivel mundial y el cuarto productor.40 De ahí la importancia por definir el momento adecuado de su introducción en la dieta de un lactante.
Son pocos los ensayos clínicos aleatorizados que exploran la introducción temprana de huevo como medida de prevención de alergia; la mayor parte efectuados en Europa o Asia, en condiciones diferentes a lo que sucede en el contexto de Latinoamérica. Además, existen características propias del individuo y su entorno: sensibilización temprana, antecedente de alergia en familiar de primer grado, lactancia materna, vía de nacimiento, incluso la sensibilización mediante aeroalérgenos, que pueden funcionar como factores de riesgo o protección. Algunos estudios muestran resultados alentadores, particularmente en la población de riesgo de alergia, pero estos hallazgos deben tomarse con cautela, porque algunas intervenciones reportaron reacciones alérgicas. La cantidad, el método de preparación y la cocción en la que se proporcionó el huevo también puede ser un factor que influye en los distintos resultados; por tanto, al ser un entorno controlado puede no apegarse a lo que sucede en la vida cotidiana al iniciar la alimentación complementaria. Con base en la evidencia científica publicada, no recomendamos iniciar la introducción de huevo antes de los 6 meses de edad, como medida preventiva de alergia, y tampoco diferirla por su potencial capacidad de alérgeno. Es importante evaluar individualmente este tipo de intervenciones en lactantes con riesgo de alergia, en quienes la introducción temprana puede prevenir su padecimiento; considerando siempre la posibilidad de reacciones adversas a la proteína de huevo. Además, debe recomendarse la cocción del huevo, como estrategia para reducir la posibilidad de reacciones adversas.
La NOM-04341 recomienda su introducción entre los 8 y 12 meses, pero consideramos que puede ofrecerse antes (6 a 8 meses) para aprovechar las cualidades nutrimentales del alimento; idealmente con una cocción adecuada para prevenir los efectos adversos reportados con el consumo de huevo crudo.
Se requieren estudios adicionales en la población mexicana para evaluar la posibilidad de efectos adversos en la introducción temprana y la efectividad de esta medida de prevención de alergia alimentaria.
Respecto al cacahuate, es uno de los alimentos más comunes con potencial alergénico, que puede relacionarse con alergia a otro tipo de nueces o semillas. Es probable que este hecho contribuya con los reportes de bajo consumo en el primer año de edad. Mc Andrew y sus colaboradores reportaron que de los 8 a los 10 meses de edad, 8% de los lactantes habían sido expuestos al cacahuate o productos derivados.42,43
México es uno de los principales productores de cacahuate a nivel mundial; por tanto, es un alimento ampliamente disponible, económico y con características nutrimentales con beneficios para la población. Cien gramos de cacahuate aportan 8.5 g de fibra, 25.8 g de proteína, 240 pg de ácido fólico y 8.33 mg de alfa-toco- ferol; es buena fuente alimentaria de calcio, magnesio, zinc y hierro. Además, contiene un perfil de antioxidantes y ácidos grasos equilibrados, que brinda protección contra sustancias nocivas, especialmente radicales libres; también se han encontrado fitonutrientes: resveratrol, isoflavonoides, ácidos fenólicos y fitoesteroles, que pueden influir positivamente en la salud y el bienestar en general. La Food and Drug Administration aprobó una declaración calificada de propiedades saludables, y sugiere que el consumo de 43 g por día reduce el riesgo de cardiopatía coronaria, supuestamente a través de la reducción del colesterol LDL.33,34,36,38,44
La importancia del consumo de cacahuate radica en que se ha observado que la alergia a éste también puede relacionarse con alergia a otras nueces y semillas, y además se ha sugerido evitar el consumo de este tipo de alimentos debido al peligro de asfixia en pacientes menores de tres años. Sin embargo, durante los últimos años la popularidad de las mantequillas o cremas a base nuez y semillas ha aumentado considerablemente. Anteriormente la crema de cacahuate era la única alternativa, pero a lo largo de los años y con el desarrollo de tecnología y la conciencia del consumidor, se han producido diversas variedades de mantequillas o cremas con diferentes nueces y semillas. En el caso de los lactantes, es una de las formas más seguras de integrarlas en la dieta habitual. Las mantequillas a base de nuez y semillas suelen prepararse mediante el procedimiento de tostado, molienda y refrigeración para su consumo cuando aún están frescas. Se ha observado que el proceso de tostado puede disminuir la alergenicidad de las nueces en general.45,46,47,48
Existen solo dos ensayos clínicos aleatorizados que exploran la introducción temprana como factor protector para desencadenar la alergia, ambos con resultados negativos a corto plazo. Debe evitarse el consumo antes de los 6 meses de edad, especialmente en pacientes que no reciben alimentación exclusiva con leche materna, además de postergar su introducción hasta los 8 meses de edad.24,25No recomendamos la eliminación del consumo de cacahuate durante la alimentación complementaria, como se mencionó anteriormente, pues se trata de la oleaginosa más económica en México y representa una fuente concentrada de lípidos saludables, proteína de origen vegetal, antioxidantes y algunos micronutrimentos clave.
Respecto del trigo, es uno de los cereales más cultivados en todo el mundo, debido a su gran adaptabilidad y potencial de alto rendimiento, y también a la fracción de proteína de gluten que le confiere las propiedades viscoelásticas que permiten que la masa se procese en pan, pasta, fideos y otros productos alimenticios.49,50Además de su gran palatabilidad y versatilidad, es fuente importante de algunos nutrimentos indispensables. Su principal aporte energético es a través de los hidratos de carbono, que al consumirse del grano entero, pueden aportar fibra. Si bien el perfil de aminoácidos no es completo para considerarlo una proteína de alto valor biológico, contiene algunos aminoácidos indispensables.49 Los granos de trigo son fuente importante de vitamina E (principalmente a-tocoferol) y B, especialmente tiamina (B1), riboflavina (B2), niacina (B3), ácido pantoténico (B5), piridoxina (B6) y folatos (B9), incluso contiene minerales: potasio, fósforo, calcio y zinc, y en menor cantidad manganeso y hierro.51,52Algunos de estos nutrimentos pueden eliminarse durante el proceso de refinación, por lo que se han implementado programas de biofortificación de cultivos de trigo, especialmente de zinc, hierro y selenio. En México, la Secretaría de Salud (SSA) inició un programa para promover la adición de nutrimentos a las harinas de trigo procesadas industrialmente, con el objetivo de añadir las vitaminas y minerales que se pierden durante el procesamiento de los granos y la obtención de las harinas, específicamente ácido fólico, vitamina B1, vitamina B2, vitamina B3, hierro y zinc.49,53
El consumo de gluten, un complejo heterogéneo de proteínas del trigo, se ha relacionado con enfermedad celíaca, alergia al trigo y, recientemente, sensibilidad al gluten no celíaca o síndrome de intolerancia al trigo. En los últimos años el trigo ha recibido una imagen negativa debido a una serie de publicaciones no científicas y artículos de prensa, que recomendaban evitar su consumo en la población en general. Como consecuencia, una cantidad cada vez mayor de personas en países occidentales decidió adoptar una dieta libre de gluten-trigo autoprescrita, a pesar de que la mayoría no han sido previamente confirmados mediante el diagnóstico médico.54,55,56
En cuanto a la población pediátrica, se ha sugerido no introducir el trigo para prevenir alergias; sin embargo, se ha observado que no es necesario evitarlo ni retrasarlo. Los Pediatras, Alergólogos y Gastroenterólogos están implicados en el tratamiento de estas alteraciones y se requieren protocolos de diagnóstico apropiados. Los estudios al respecto no mostraron un claro efecto protector para alergia al introducirlo antes de los 6 meses, pero puede incluirse desde el inicio de la alimentación complementaria, en forma de pan, pastas y especialmente cereal fortificado con hierro para prevenir la anemia por deficiencia de este nutrimento.41
Conclusiones
No existe evidencia que la introducción temprana de alimentos revisados en este estudio ofrezca ventajas en los lactantes. Es probable que en pacientes con riesgo de alergia alimentaria, su introducción temprana reduzca la posibilidad de evolución a alergia hacia al final del primer año de vida. Es necesario contar con mayor evidencia científica, particularmente estudios clínicos aleatorizados, en la población mexicana.











 nueva página del texto (beta)
nueva página del texto (beta)