Introducción
Las inmunodeficiencias primarias, actualmente denominadas errores innatos de la inmunidad, son trastornos genéticos poco frecuentes, crónicos y severos del sistema inmunitario, caracterizados por aumento de la susceptibilidad a infecciones, reacciones inflamatorias, autoinmunidad, malignidad y alergias, y se clasifican en: inmunodeficiencias de la inmunidad celular y humoral, deficiencias predominantes de anticuerpos, defectos congénitos del número o función de fagocitos entre otras deficiencias.1,2
Dentro de los defectos de fagocitos se describe una enfermedad con incidencia aproximada de 1:100,000 nacidos vivos denominada deficiencia de adhesión leucocitaria (LAD, de “Leucocyte adhesion deficiency”, por sus siglas en inglés), caracterizada por alteración en la migración de los leucocitos desde los vasos sanguíneos al sitio de inflamación, manifestándose clínicamente con retraso en la caída del cordón umbilical, onfalitis e infecciones bacterianas recurrentes de la piel y las mucosas,3,4además de leucocitosis persistente en la sangre periférica, debido a la incapacidad de los leucocitos para adherirse al endotelio vascular y migrar al tejido.5,6
La deficiencia de adhesión leucocitaria se clasifica en tipo 1 (LAD-1), tipo 2 (LAD-2) y tipo 3 (LAD-3). La LAD-1 es un desorden autosómico recesivo provocado por mutaciones en el gen ITGβ2 que codifica para la cadena β (CD18) de las integrinas β2, esenciales para la adhesión de los leucocitos al endotelio vascular y la extravasación.7 La LAD-2 es causada por mutaciones en el gen SLC35C1, que conduce a la expresión defectuosa de glicanos fucosilados, como el ligando de selectinas SLeX (CD15), que interviene en el rodamiento de los leucocitos sobre el endotelio vascular.8 La citometría de flujo es una técnica útil en el diagnóstico de la enfermedad, donde se observa disminución o ausencia de CD18 (LAD-1) o CD15 (LAD-2) en la superficie de los leucocitos.9,10 La confirmación molecular es importante para el consejo genético a la familia; no obstante, presentaría mayor dificultad de implementación en países de escasos recursos.
La mayor parte de los estudios asociados con deficiencia de adhesión leucocitaria provienen de países como India, Irán y Turquía,5,6,11 y son escasos en Latinoamérica.12-14 El primer caso en América del Sur fue reportado en 2012.15 La Sociedad Latinoamericana para Inmunodeficiencias (LASID) registra actualmente 0 casos de LAD-1 y 2 de LAD-2.16 En general, son alteraciones poco sospechadas y diagnosticadas. En Paraguay, el Instituto de Investigaciones en Ciencias de la Salud (IICS), de la Universidad Nacional de Asunción (UNA), es el único centro que ofrece pruebas para la detección de inmunodeficiencias primarias; sin embargo, el método para diagnosticar la deficiencia deficiencia de adhesión leucocitaria no se encuentra disponible y no existen casos reportados hasta la fecha.
El objetivo de este estudio fue implementar la técnica diagnóstica para LAD-1 y LAD-2, mediante la evaluación de las moléculas CD18 y CD15 por citometría de flujo en pacientes pediátricos sanos y con sospecha clínica de deficiencia de adhesión leucocitaria.
Métodos
Estudio observacional, descriptivo y de corte transversal, llevado a cabo en pacientes menores de 18 años, aparentemente sanos, y en pacientes con sospecha clínica de deficiencia de adhesión leucocitaria.
Pacientes pediátricos sanos
Este grupo se estudió con el propósito de obtener los valores de referencia (normales) para las moléculas CD18 y CD15 en sangre periférica por citometría de flujo, lo que representó la estandarización y puesta a punto de la técnica diagnóstica para deficiencia de adhesión leucocitaria en nuestro laboratorio. En 2017 se incluyeron los pacientes pediátricos aparentemente sanos, según los siguientes criterios: 2 a 17 años, ambos géneros, que acudieron al centro de investigación (IICS-UNA) con indicación médica para el análisis de rutina por control general de salud o motivo prequirúrgico y buen estado general de salud los siete días previos al análisis. Se excluyeron los pacientes que refirieron fiebre, resfriado, infecciones, consumo de antibióticos, analgésicos o antigripales siete días previos al análisis, hospitalización tres meses previos al estudio, y quienes contaban con diagnóstico de alguna enfermedad inmuno-hematológica.
Pacientes con sospecha clínica de deficiencia de adhesión leucocitaria
Los pacientes fueron seleccionados por médicos especialistas (infectología y asma, alergia e inmunología pediátricas) del Instituto de Medicina Tropical-IMT (Ministerio de Salud Públca y Bienestar Social-MSPyBS) y del Hospital de Clínicas (Facultad de Ciencias Médicas de la Universidad Nacional de Asunción-UNA). Se remitieron al centro de investigación (IICS-UNA) entre 2017-2019 y se incluyeron considerando los siguientes criterios: edad menor de 18 años, ambos géneros, coexistencia de leucocitosis persistente en sangre periférica (≥15000/mm3 en ausencia de infección y/o fiebre) y al menos una manifestación clínica sugerente de deficiencia de adhesión leucocitaria: retraso en la caída del cordón umbilical (>15 días de nacido), onfalitis, infecciones bacterianas o fúngicas recurrentes en la piel o las mucosas, abscesos en la piel o los órganos, infecciones recurrentes de la vía respiratoria inferior (bronquitis, neumonías), periodontitis u osteomielitis recurrentes. Se excluyeron los pacientes con diagnóstico de enfermedad inmunológica y/o hematológica.
Evaluación de las moléculas CD18 y CD15 por citometría de flujo
El análisis de expresión de CD18 y CD15 se realizó por adquisición de los tubos procedentes de la marcación previa con anticuerpos monoclonales y el control negativo, utilizando un citómetro de flujo de tres colores (FACSCalibur, Becton Dickinson, USA) y mediante el programa CellQuest. Se evaluó la población ranulocitos (neutrófilos), delimitando la región donde se ubicaron en el gráfico de FSC (dispersión frontal de luz) vs SSC (dispersión lateral de luz), contando un mínimo de 10,000 eventos por tubo analizado, y mediante un histograma de fluorescencia se determinó el porcentaje de células que expresaron CD18 y CD15 en dicha región, valores que correspondieron al grado de expresión de las moléculas de adhesión leucocitaria estudiadas. Previamente se ajustaron los voltajes requeridos para los detectores de FSC, SSC, FL-1 (fluorescencia de FITC) y FL-2 (fluorescencia de PE), con la finalidad de optimizar el análisis.
Caracterización clínico-demográfica de pacientes y definición de LAD
En el grupo de pacientes con sospecha clínica de deficiencia de adhesión leucocitaria se aplicó un cuestionario para recolectar los datos de: edad, género, procedencia, situación escolar, infección recurrente, edad de inicio de las infecciones, cantidad de infecciones y hospitalizaciones (último año), recuento de leucocitos y porcentaje de neutrófilos en sangre periférica (último hemograma en la ficha clínica), y antecedentes familiares de inmunodeficiencias primarias. Se estableció el diagnóstico de deficiencia de adhesión leucocitaria en pacientes con leucocitosis persistente en sangre periférica e historia clínica de complicaciones del cordón umbilical (separación tardía y/u onfalitis) y/o infecciones recurrentes-severas de la piel o las mucosas luego de registrarse la disminución de la expresión de CD18 para LAD-1 o de CD15 para LAD-2.1,2,17
Consideraciones éticas
Los procedimientos se efectuaron en apego a las normas éticas, Reglamento de la Ley General de Salud en Materia de Investigación para la Salud y la Declaración de Helsinki. Se obtuvo el consentimiento informado del responsable (padre, madre o encargado) de cada paciente pediátrico, y se respetó en todo momento la confidencialidad de los datos. Los pacientes con valores bajos de CD18 o CD15 fueron remitidos con un médico especialista en inmunodeficiencias primarias para establecer el diagnóstico y tratamiento (IMT-MSPyBS) de la enfermedad. El protocolo de investigación fue aprobado por el Comité de Ética del IICS-UNA (Código P04/2017).
Análisis estadístico
Los datos se analizaron con el programa SPSS versión 21 (IBM Corp. NY, US). Se aplicó estadística descriptiva utilizando medianas y rangos para las variables continuas, mientras que para las variables categóricas se emplearon frecuencias absolutas (n) y porcentajes (%). En el grupo de pacientes sanos se calculó el intervalo de referencia (normal) para el porcentaje de expresión de CD18 y CD15 mediante los percentiles P2,5 (límite inferior) y P97,5 (límite superior); en pacientes con sospecha clínica de deficiencia de adhesión leucocitaria, los valores por debajo de este límite se consideraron compatibles con la manifestación de la enfermedad.
Resultados
Caracterización de los pacientes
Se evaluaron 60 pacientes pediátricos: 20 aparentemente sanos y 40 con sospecha clínica de deficiencia de adhesión leucocitaria. En el grupo de pacientes sanos, estudiado para poner a punto la técnica diagnóstica de deficiencia de adhesión leucocitaria por citometría de flujo, el 60% fueron hombres y la mediana de edad fue de 14 años (rango: 7-15). En el grupo de pacientes con sospecha de deficiencia de adhesión leucocitaria, evaluado con la finalidad de detectar casos de la enfermedad, predominó el género femenino (68%), la mediana de edad fue de 2 años y la mayoría provenía de la ciudad de Asunción (Capital del país) o del Departamento Central (ciudades no muy distantes de la Capital). En estos últimos se observó leucocitosis en sangre periférica y predominaron las infecciones de la vía respiratoria inferior (32%) y de la piel (25%), con mediana de 1 año de edad para el inicio de las infecciones (Cuadro 1).
Moléculas de adhesión leucocitaria en los pacientes pediátricos evaluados
Los niveles de expresión (%) de las moléculas CD18 y CD15 en la superficie celular de los neutrófilos se evaluaron por citometría de flujo. En los pacientes pediátricos sanos se observó un intervalo de 96 a 100% para CD18 y de 95 a 100% para CD15. En los sujetos con sospecha de deficiencia de adhesión leucocitaria, el rango fue de 0 a 100% para ambas moléculas. En el Cuadro 2 se enlista la expresión de CD18 y CD15 de la población de estudio. El intervalo establecido por los percentiles P2,5 y P97,5 en los pacientes sanos se consideró el rango de referencia (normal) para la expresión de estas moléculas.
Detección de deficiencia de adhesión leucocitaria tipo 1 y tipo 2
En los pacientes pediátricos con sospecha de deficiencia de adhesión leucocitaria se encontró 1 caso de un paciente de género femenino con 0% de expresión de la molécula CD18 y 1 paciente de género masculino con 0% de la molécula CD15, es decir, ausencia total de las moléculas en la superficie de los neutrófilos en sangre periférica. Estos hallazgos indicaron la presencia de LAD-1 y LAD-2, respectivamente. En la Figura 1 se muestran los resultados obtenidos por citometría de flujo para la expresión de CD18 y CD15 en un paciente pediátrico sano (Figura 1A), en la niña con LAD-1 (Figura 1B) y en el niño con LAD-2 (Figura 1C). En el paciente sano se observó expresión normal de CD18 y CD15, evidenciada por la señal (pico) de fluorescencia desplazada a la derecha en los histogramas; sin embargo, este desplazamiento de fluorescencia no se observó para la expresión de CD18 en la paciente con LAD-1 ni para la expresión de CD15 en el paciente con LAD-2, lo que indica ausencia total de las moléculas en los neutrófilos periféricos, y permite establecer el diagnóstico de deficiencia de adhesión leucocitaria en ambos paciente
Caracterización de los pacientes con deficiencia de adhesión leucocitaria
En el Cuadro 3 se observan las características demográficas, clínicas e inmuno-hematológicas de los pacientes con LAD-1 y LAD-2. La edad al momento del diagnóstico de la paciente con LAD-1 fue de 3 meses, en cambio, el retraso en el diagnóstico se observó en el paciente con LAD-2 de 12 años. Ambos tuvieron leucocitosis en sangre periférica (superior a 30,000/mm3), además de infecciones recurrentes-severas de la piel y de la vía respiratoria inferior. En el paciente con LAD-2 se documentó periodontitis, retraso del crecimiento y retardo mental, necesidad de cuidados intensivos (UTI), reacción postrasfusión sanguínea y evidencia de fenotipo Bombay por ausencia del antígeno-H en los eritrocitos
Discusión
La deficiencia de adhesión leucocitaria es un desorden excepcional de los leucocitos, caracterizada por migración defectuosa de los vasos sanguíneos al sitio de inflamación.18 Se describen tres tipos: LAD-1, LAD2 y LAD-3, este último supone la forma más rara. Cada subtipo se distingue por expresión genética, inmunológica y clínica específicas, aunque todos cursan con infecciones recurrentes y severas.19 En este estudio se determinó la expresión de CD18 y CD15 en pacientes sanos y se estandarizó la técnica diagnóstica para deficiencia de adhesión leucocitaria por citometría de flujo, estableciendo un intervalo normal de 95 a 100% para las moléculas. Este rango normal es el primero reportado en nuestro medio. Los estudios efectuados en Chile15 y México14,20 reportaron valores próximos a 100% de CD18 y CD15 en controles sanos. Es importante que cada laboratorio establezca sus valores de referencia, porque pueden variar según la población evaluada, la metodología y los equipos utilizados, incluso la interpretación de los resultados permite tomar decisiones diagnósticas y terapéuticas.21
La evaluación de pacientes con sospecha clínica de deficiencia de adhesión leucocitaria, como parte del proceso de implementación de la técnica diagnóstica, permitió detectar dos casos de la enfermedad. En una niña de 3 meses de edad, con leucocitosis periférica persistente e infecciones recurrentes-severas, se observó 0% de expresión de CD18 y fue diagnosticada con LAD-1. La deficiencia de adhesión leucocitaria tipo 1 se clasifica en severa, moderada o leve, según niveles de CD18, y en la forma severa existe <2% de expresión,3 subtipo al que corresponde el caso detectado en este estudio. Para LAD-1 se reporta la separación tardía del cordón umbilical, onfalitis, infecciones bacterianas recurrentes de la piel o las mucosas, leucocitosis periférica persistente, gingivitis y periodontitis,4,6,22 que en su mayor parte se observaron en la paciente con LAD-1 de este estudio.
De 1975 a 2017 se han reportado cerca de 323 casos de LAD-1, principalmente en la India, Irán y Estados Unidos.3 Si bien el primer caso en América del Sur fue reportado en 2012,15 en Paraguay no existía información de casos detectados al respecto. En caso de sospecha clínica importante de LAD-1, es indispensable llevar a cabo la determinación de la expresión de CD18 y CD11, seguido de la confirmación molecular;23,24 no obstante, en países con limitado acceso a los recursos para el diagnóstico e investigación, la detección molecular presenta dificultades de implementación y la citometría de flujo constituye una herramienta valiosa para establecer el diagnóstico. Es importante sospechar y diagnosticar oportunamente la enfermedad, con la intención de ofrecer un tratamiento profiláctico para las infecciones, y de esta forma mejorar el pronóstico de los pacientes.17 Una alternativa de tratamiento definitivo en pacientes con deficiencia de adhesión leucocitaria es el trasplante alogénico de células madre hematopoyéticas,4,7 pero esta opción no se encuentra disponible aún en Paraguay.
En este estudio se detectó un paciente de 12 años con LAD-2, cuya característica clínico-inmunológica permitió establecer el diagnóstico, observándose 0% de expresión de CD15 por citometría de flujo. LAD-2 se origina por un defecto en el transportador de fucosa del Golgi y la fucosilación de glicoproteínas se encuentra alterada, sobre todo SLeX (CD15), un ligando de selectinas que interviene en el rodamiento de los leucocitos sobre el endotelio vascular.8,25 En todo el mundo se han reportado menos de 20 casos de LAD2.4,8,25,26 Para esta deficiencia se describen infecciones pulmonares y periodontitis severa, rasgos faciales característicos (punta nasal ancha, lengua protuberante y mandíbula prominente), malformaciones físicas, baja estatura y retraso psicomotor,25,27 así como retraso mental y del crecimiento.17 La mayor parte de estas características clínicas fueron observadas en el paciente con LAD-2 de este estudio. También se han reportado complicaciones autoinmunitarias en sujetos con deficiencia de adhesión leucocitaria;28 en el paciente con LAD-2 se documentó artritis idiopática juvenil.
La citometría de flujo es una técnica útil en la detección de LAD-2, para demostrar la ausencia de la molécula SLeX (CD15) en la superficie de los leucocitos; además, los pacientes carecen del antígeno-H en la superficie de los eritrocitos, resultando en el fenotipo Bombay.4 En el paciente con LAD-2 de este estudio no se detectó el antígeno-H; por tanto, fue compatible con el fenotipo Bombay, y corresponde al primer caso detectado en Paraguay. Este hallazgo supone un dato relevante para trasfusiones sanguíneas, pues los pacientes con fenotipo Bombay solo pueden recibir sangre del mismo fenotipo,8 debido a la posibilidad de reacción severa postrasfusión, que fue observada en nuestro paciente con LAD-2, en un episodio de hospitalización previo al diagnóstico y evaluación del antígeno-H.
Las limitaciones de este estudio se asocian con el tamaño reducido de la muestra (solo se estudiaron 40 pacientes con sospecha clínica de deficiencia de adhesión leucocitaria); sin embargo, se detectaron dos casos de la enfermedad, lo que resulta relevante considerando su baja frecuencia, e indica que los criterios de selección fueron robustos y mejoraría la sospecha y el diagnóstico. Otra limitante fue no evaluar la molécula CD11, porque se han reportado algunos casos de LAD-1 (mutación ITGβ2) con expresión normal de CD18, pero funcionalmente defectuoso, donde la molécula CD11 funciona para establecer el diagnóstico.11,23 La detección de LAD-3 debería incluirse para estudiar el gen FERMT3, porque no puede detectarse por citometría de flujo. Es importante mencionar que el diagnóstico definitivo se establece mediante el análisis de los genes ITGβ2 para LAD-1 y SLC35C1 para LAD-2; no obstante, el estudio de CD18 y CD15 por citometría de flujo, además de las manifestaciones clínicas del paciente, es de gran ayuda para el diagnóstico, sobre todo en centros donde la confirmación genética no está disponible, y de esta forma pueda Iniciarse el tratamiento profiláctico, encaminado a reducir la frecuencia y severidad de las infecciones. Por último, los pacientes estudiados tuvieron leucocitosis persistente e infecciones recurrentes-severas, por tanto, deben evaluarse otros componentes del sistema inmune en busca de otras inmunodeficiencias primarias en sujetos con CD18/CD15 normales, además, pueden considerarse las enfermedades alérgicas, hemato-oncológicas u otras alteraciones, según las manifestaciones clínicas observadas en todos los casos.
Cuadro 1 Características demográficas y clínicas de los pacientes pediátricos con sospecha clínica de deficiencia de adhesión leucocitaria (n=40).
| Características | Mediana (rango total) |
|---|---|
| Edad al momento del estudio (en años) | 2 (0,1 - 16) |
| Edad de inicio de infecciones (en años) | 1 (0,1 - 7) |
| N° de infecciones (último año) | 3 (2 - 6) |
| N° de hospitalizaciones (último año) | 2 (1 - 4) |
| Recuento de leucocitos en sangre periférica (x103 /mm3) | 19 (16 - 65) |
| % neutrófilos en sangre periférica (de la fórmula leucocitaria) | 73 (48 - 79) |
| Género | n (%) |
| Femenino / masculino | 27 (68) / 13 (32 |
| Procedencia | |
| Asunción o Departamento Central | 23 (58) |
| Ciudades del interior del país | 17 (42) |
| Situación escolar (n=11)* | |
| Asiste de forma irregular** por infecciones recurrentes | 6 (54) |
| Abandonó la escuela por infecciones recurrentes | 1 (9) |
| Tipo de infección | |
| Infecciones de la vía respiratoria inferior (bronquitis y/o neumonía) | 13 (32) |
| Infección de piel | 10 (25) |
| Abscesos en piel/órganos | 7 (18) |
| Adenopatías | 5 (12) |
| Complicaciones del cordón umbilical† | 5 (12) |
| Antecedente familiar relacionado con inmunodeficiencia primaria | |
| Muerte infantil temprana† | 4 (10) |
| Caso de inmunodeficiencia primaria en la familia† | 2 (5) |
| *: niños de 5 a 12 años de edad; **: ausencias frecuentes; †: separación tardía y/u onfalitis. | |
Cuadro 2 Expresión (%) de las moléculas de adhesión leucocitaria en pacientes pediátricos sanos y con sospecha clínica de deficiencia de adhesión leucocitaria (n=60).
| Molécula de adhesión leucocitaria | Pacientes sanos (n=20) | Pacientes con sospecha de LAD (n=40) | |
|---|---|---|---|
| Mediana (Rango total) | P2,5 - P97,5 | Mediana (Rango total) | |
| % CD18 | 100 (96 - 100) | 96 - 100 | 99 (0 - 100) |
| % CD15 | 99 (95 - 100) | 95 - 100 | 97 (0 - 100) |
| %: porcentaje; P: percentil | |||
Cuadro 3 Caracterización de los pacientes con LAD-1 y LAD-2.
| Características | Paciente con LAD-1 | Paciente con LAD-2 |
|---|---|---|
| Demográficas | ||
| Edad de inicio de infecciones | 1 mes | 6 meses |
| Edad al diagnóstico | 3 meses | 12 años |
| Género | Femenino | Masculino |
| Procedencia | Depto. Central | Depto. Central |
| Situación escolar | - | Abandonó por infecciones |
| Inmunológicas-hematológicas | ||
| Nivel de expresión de CD18 | 0% | 100% |
| Nivel de expresión de CD15 | 92% | 0% |
| Leucocitos /mm3 (% neutrófilos) | 65000 (78) | 34200 (79) |
| Hemoglobina (g/dL)/Hematocrito (%) | 11,4/36 | 9,2/33 |
| Grupo sanguíneo”0” RH (antígeno-H) | Positivo (H+) | Positivo (H-), Bombay |
| Clínicas | ||
| Infecciones de piel/abscesos | +/+ | +/+ |
| Infecciones de la vía respiratoria inferior (bronquitis, neumonías) | + | + |
| Osteomielitis y periodontitis | - | + |
| Hospitalizaciones frecuentes/UTI | +/- | +/+ |
| Complicaciones del cordón umbilical | + | - |
| Reacción postrasfusión de sangre | - | + |
| Retraso del crecimiento y mentala | - | + |
| Autoinmunidad (AIJ) | - | + |
| Antecedente familiar de IDPb | - | + |
| Depto.: Departamento; UTI: unidad de terapia intensiva; AIJ: artritis idiopática juvenil; IDP: inmunodeficiencia primaria; a: con rasgos faciales distintivos; b: muerte infantil temprana en la familia | ||
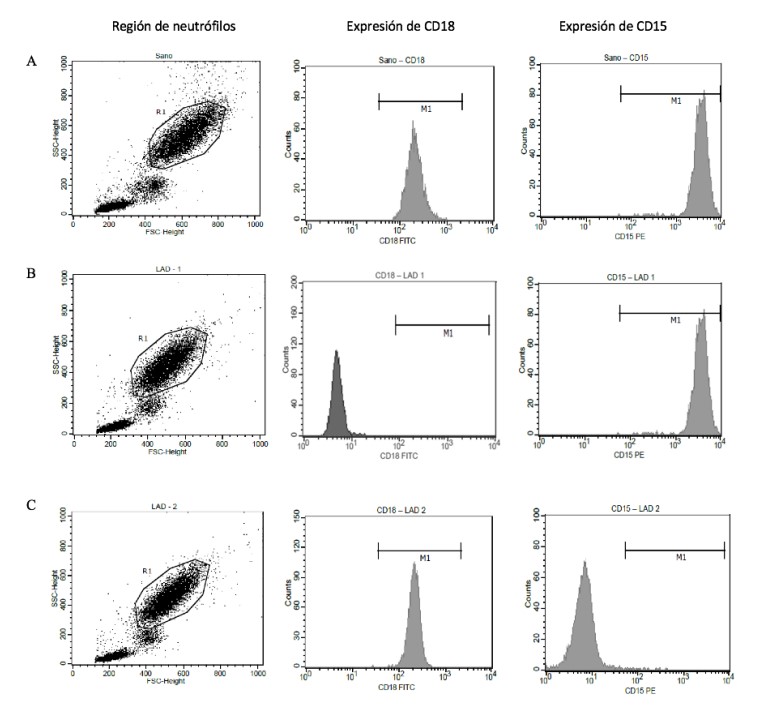
Figura 1 Diagramas de puntos e histogramas de fluorescencia por citometría de flujo para la expresión (%) de las moléculas CD18 y CD15 en la superficie de neutrófilos de sangre periférica: (A) Desplazamiento normal de la señal (pico) de fluorescencia en los histogramas de CD18 (99% de expresión) y CD15 (98% de expresión) de un paciente pediátrico sano; (B) sin desplazamiento del pico de fluorescencia para la molécula CD18 (0% de expresión) en la paciente con LAD-1; (C) sin desplazamiento de fluorescencia para la molécula CD15 (0% de expresión) en el paciente con LAD-2. R1: región evaluada de granulocitos neutrófilos; M1: señal (pico) de fluorescencia que indica el porcentaje de expresión de las moléculas CD18 y CD15.
Conclusiones
Este estudio implementó una nueva técnica diagnóstica, mediante la evaluación de las moléculas CD18 y CD15 por citometría de flujo en pacientes sanos, lo que permitió su estandarización para establecer el diagnóstico de deficiencia de adhesión leucocitaria. La evaluación de las moléculas también permitió detectar los primeros casos de deficiencia de adhesión leucocitaria en Paraguay, lo que sirve de precedente y pone a punto la técnica para el diagnóstico de la enfermedad a nivel local.
Agradecimientos
Los autores agradecen a la Dra. Marisel Maldonado del Departamento de Medicina Tropical del IICS-UNA, por su colaboración con la traducción al inglés del resumen del artículo científico. Este estudio fue apoyado por los fondos de investigación del Rectorado de la Universidad Nacional de Asunción (UNA), en su convocatoria 2017.











 nueva página del texto (beta)
nueva página del texto (beta)



