Introducción
Las lesiones cutáneas por SARS-CoV-2 suelen presentarse en niños y adolescentes saludables, rara vez en niños menores de 10 años y aparecen en los pies en 74 a 100 % de los casos, si bien también han sido descritas en manos y dedos.1,2,3,4,5,6,7 Suelen ser múltiples, redondas y varían de tamaño, de pocos milímetros a centímetros, afectando a todo el dedo del pie, con una clara demarcación a nivel del metatarso-falange. Se han observado manchas, edema y lesiones eritematosas, violáceas o purpúricas, que pueden parecer infiltrantes. La piel periungueal y subungueal suele verse afectada. En la evolución posterior, las lesiones pueden tornarse vesiculobullosas o presentarse con costras de color púrpura oscuro o negro. La región plantar y la cara lateral de pies y talones también pueden estar afectadas con lesiones gruesas, equimóticas e infiltradas. Las manifestaciones “similares al sabañón”o al pernio, descritas en una serie de pacientes franceses, presentaron similitudes con las lesiones observadas en interferonopatías tipo I, como el síndrome de Aicardi-Goutières y la vasculopatía de la infancia asociada a genes del estimulador del interferón.8
Pruebas
El SARS-CoV-2 pertenece a la familia Coronaviridae, subfamilia Cornidovirinae, género beta, linaje B; tiene un diámetro de 60 a 140 nm con picos de 9 a 12 nm y dos proteínas de membrana de envoltura M y E. En imágenes electromicroscópicas, sus picos se asemejan a una corona solar, lo que le da el nombre de “coronavirus”. Los coronavirus (CoV) son virus de ARN monocatenario de sentido positivo envueltos con una nucleocápside de simetría helicoidal, que pueden infectar a seres humanos, aves y otros animales. La prueba de SARS-CoV-2 mediante PCR de hisopos nasofaríngeos ha sido negativa en casi todos los niños y adolescentes con perniosis relacionada con COVID-19. En 11 % de niños ingresados en el hospital por sospecha de COVID-19, la PCR para SARS-CoV-2 se informó positiva. Desde la clínica, las lesiones como sabañones o perniosis pueden constituir una manifestación tardía cuando el ARN viral ya no es detectable por laboratorio.9,10,11
Posibles causas, manifestaciones clínicas, lesiones cutáneas
La hipótesis de interferonopatía tipo I inducida por virus ha demostrado que los pacientes con COVID-19 grave tienen una respuesta alterada al interferón (IFN) tipo I, aumento del factor de necrosis tumoral y producción de interleucinas. No obstante, los pacientes pediátricos con lesiones en piel como vesículas exhiben una fuerte respuesta de IFN-I, lo que atenúa la replicación viral.12,13,14 Sin embargo, esta respuesta temprana de IFN-I podría inducir cambios microangiopáticos, produciendo una erupción similar al eritema pernio del lupus eritematoso. Curiosamente, la perniosis es la característica más constante de las interferonopatías tipo I; los hallazgos histológicos observados en el eritema pernio ocasionado por COVID-19 son similares a los de la interferonopatía tipo I inducida por virus. La producción de IFN-α es mayor en niños y adultos jóvenes.6 La respuesta innata, en particular la producción de IFN tipo I (IFN-α e IFN-β), constituye la primera línea de defensa contra múltiples infecciones virales. La perniosis rara vez se observa en pacientes con COVID-19 grave, lo que indica una buena respuesta inmunitaria, como en la infección por el virus de influenza.15,16
La hipótesis de trombosis/coagulopatía señala que los pacientes con infección por SARS-CoV-2 tienen un mayor riesgo de tromboembolismo, con niveles elevados de dímero D, presencia de trombos de fibrina en vasos pequeños y capilares distendidos en pulmón y corazón, así como desarrollo de isquemia acral, la cual se ha observado en autopsias. Las manifestaciones trombóticas complican la enfermedad solo en una minoría de pacientes con COVID-19.17,18
En la hipótesis de la vasculitis se postula que en la perniosis por COVID-19 se observa endotelitis o vasculitis linfocítica.19 Se ha propuesto la enzima convertidora de angiotensina (ACE-2) como receptor de membrana del SARS- CoV-2. Las células endoteliales tienen una expresión muy débil de ACE-2, no obstante, los pericitos tienen uno de los niveles de expresión más altos, por lo que son un buen candidato para explicar la inflamación secundaria microvascular e hipercoagulopatía por SARS-CoV-2.20 La inmunotinción positiva para SARS-CoV-2 en células epiteliales de glándulas ecrinas puede explicarse por la presencia de ACE-2 en estas células.21 La expresión de la ACE-2 ocurre en diferentes células: neumocitos tipo 2, enterocitos, macrófagos, células linguales, epitelio respiratorio ciliado, células claras, endotelio, túbulo renal proximal, adipocitos, queratinocitos y células de la epidermis; aumenta significativamente con la edad y es mayor en hombres. La distribución celular de ACE-2 es muy importante y ayuda a explicar la mayoría de los síntomas: anosmia, alteraciones del gusto, síntomas respiratorios, cardiovasculares, renales y cutáneos, entre otros.22
La primera y más frecuente manifestación cutánea en niños con infección por COVID-19 es la perniosis, la cual fue reportada en el mundo durante el primer pico de la pandemia; las lesiones fueron descritas en pacientes afectados con PCR positiva, en aquellos con sospecha de COVID-19 y en aquellos con un contacto SARS-CoV-2 positivo, con base únicamente en el contexto epidemiológico de la enfermedad. La relación definitiva entre COVID-19 y lesiones como eritema pernio no fue completamente establecida, pero se interpretó como probable. La infección en humanos puede causar un espectro de condiciones médicas, desde resfriado común estacional hasta infecciones mortales. La presentación clínica general, resultado de la infección y manifestaciones cutáneas por SARS-CoV-2, difiere importantemente entre niños y adultos.23
Si bien las manifestaciones como urticaria, erupción maculopapular o erupción vesicular pueden ocurrir en personas de todas las edades, ciertas manifestaciones como la perniosis, el eritema multiforme (EM) y las manifestaciones cutáneas del síndrome multisistémico inflamatorio pediátrico asociado temporalmente a SARS-CoV-2 (PIMS/MISC) se observan con mayor frecuencia en niños y jóvenes. El pernio clásico se define como lesiones cutáneas inflamatorias de las regiones acrales que persisten más de un día. Se caracteriza por máculas eritematosas y edematosas, nódulos y, a veces, placas ulceradas en la superficie dorsal de dedos, manos y pies. Las lesiones cutáneas se desencadenan por frío y rara vez se asocian a enfermedades del tejido conectivo o trastornos hematológicos malignos. Los pacientes generalmente informan dolor y picazón. El tratamiento es conservador y en general ocurre una resolución espontánea.24
Las manifestaciones similares a perniosis durante la pandemia de COVID-19 difieren del pernio clásico al mostrar distribución semejante por sexos, ausencia de otros factores desencadenantes y afectación de los pies y, a veces, del tercio distal de las piernas. Los pacientes con perniosis asociada a COVID-19 fueron en su mayoría jóvenes, confinados en casa sin antecedentes de pernio.25 Curiosamente, la infección por SARS-CoV-2 se manifestó como una enfermedad menos grave en pacientes con pernio, manifestación cutánea acral diferente a las lesiones isquémicas acrales descritas en adultos con enfermedad pulmonar grave asociada a hipercoagulabilidad.26,27
Otras manifestaciones cutáneas incluyen EM, urticaria y síndrome multisistémico inflamatorio similar a la enfermedad de Kawasaki (EK). El EM es una afección aguda de hipersensibilidad autolimitada, caracterizada clínicamente por erupción cutánea distintiva con lesiones eritematosas simétricas, denominadas iris o lesiones en diana (Figura 1)28,29.30,31 En niños, los patógenos implicados con mayor frecuencia en la EM son el virus del herpes simple (VHS) y Mycoplasma pneumoniae. 32 Se ha observado una erupción similar a EM por SARS-CoV-2 en adultos y niños, con pápulas acrales y lesiones en diana. En pacientes con lesiones similares a los pernios también se han observado erupciones asociadas como EM. En los niños, las lesiones similares a EM en talones de ambos pies se consideraron como pernios con lesiones purpúricas centrales y eritema periférico.33,35
Urticaria
Las lesiones cutáneas se presentan típicamente como urticaria o angioedema y pueden definirse como un exantema papular eritematoso ligeramente elevado seguido de prurito intenso que dura menos de 24 horas (Figura 2). Las causas más comunes son alérgenos, pseudoalérgenos alimentarios, picadura de insectos, fármacos e infecciones. Los virus son causa común de urticaria en niños, incluidos el parvovirus, rinovirus, rotavirus, virus de Epstein-Barr, virus de las hepatitis A, B y C y virus de la inmunodeficiencia humana. Infecciones bacterianas (del tracto urinario, por Streptococcus, Mycoplasma y Helicobacter pylori) y algunos parásitos también pueden asociarse a urticaria.
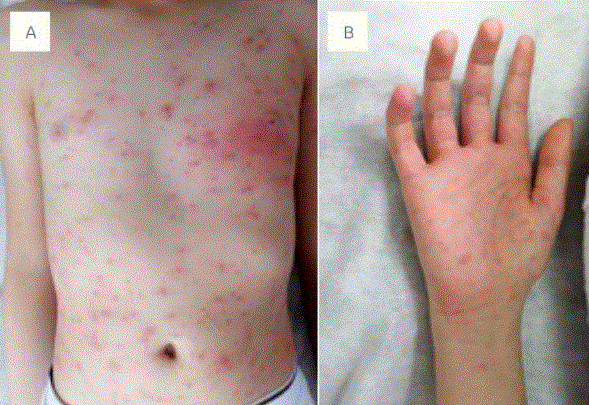
Figura 2 Exantema papular eritematoso en dos pacientes con COVID-19 (A y B). Crédito de la imagen: Mauricio Torres Pradilla.
La urticaria representa de 10 a 20 % de las manifestaciones cutáneas en pacientes con COVID-19. La mayoría de los casos notificados fueron adultos; los niños con urticaria y COVID-19 parecen en su mayoría asintomáticos, aparte de la erupción. La mayoría de los pacientes no fueron evaluados con pruebas de laboratorio, pero tuvieron contacto directo domiciliario con pacientes confirmados o sospechosos de COVID-19. Se realizó biopsia de piel a una minoría de pacientes, todos adultos.32
Galván Casas et al. informaron prurito en 92 % de los pacientes con lesiones de urticaria asociada a COVID-19 más grave. La urticaria aguda, definida como lesión autolimitada que dura menos de seis semanas, afecta a 20 % de la población. La urticaria crónica se describe como una lesión recurrente presente por más de seis semanas, que parece afectar a 5 % de la población. Estas lesiones fueron frecuentes en pacientes de mediana edad.31 No obstante, el estudio retrospectivo realizado en Francia informó una mediana de tres años en pacientes con lesiones urticarianas distribuidas en el tronco o las extremidades. En algunos casos, las erupciones se generalizaron en todo el cuerpo o se localizaron en la cara.8
Las infecciones virales pueden causar urticaria no inmunológica o vasculitis por activación de mastocitos a través del complemento. Dado que SARS-CoV-2 se une a los receptores de la ACE-2 en los vasos sanguíneos, los anticuerpos pueden depositarse en las paredes vasculares con la consiguiente reacción inmunitaria. La urticaria puede estar asociada a la bradicinina en el sistema cinina-calicreína y el sistema del complemento, la cual es un potente vasodilatador y productor de edema por aumento de permeabilidad vascular; clínicamente se traduce en erupciones eritematosas, edema y lesiones urticariformes, y explicaría el “COVID toes”, al igual que el dolor y prurito como efecto proinflamatorio. Los receptores de bradicinina aumentan la quimiotaxis de neutrófilos y estos activan a su vez el sistema cinina-calicreína para abrir la barrera endotelial en inflamación aguda.34 La activación de los receptores de bradicinina aumenta los niveles de interleucina 6, citocina inflamatoria que aparece para correlacionar con la gravedad de la enfermedad. Estos efectos aumentan la tendencia hacia la inflamación que ya existe, secundaria al aumento de producción de citocinas por COVID-19.33,36
Exantema vesicular
El exantema informado en pacientes con COVID-19 es semejante al de la varicela. Puede parecerse a una erupción papulovesicular; es más frecuente en mujeres de mediana edad, pero también se ha informado en hombres adultos y niños. Las lesiones vesiculares aparecen en las primeras etapas de COVID-19 y, en ocasiones, antes del inicio de otras manifestaciones. Las erupciones son monomórficas diseminadas y aparecen después de una latencia mediana de tres días, posteriores a los primeros síntomas respiratorios, persisten alrededor de ocho días y se correlacionan con la gravedad de la infección. Virus como HSV-1, HSV-2, herpesvirus humano HHV-6 y HHV-7, virus de la varicela Zóster, parvovirus y virus de Epstein-Barr se han detectado simultáneamente en algunos pacientes con COVID-19.36
Síndrome inflamatorio similar a la enfermedad de Kawasaki
La EK es la vasculitis más frecuente en la infancia y su diagnóstico se basa en criterios clínicos y de laboratorio. Se ha observado una asociación temporal y espacial entre COVID-19 y una afección multisistémica grave en niños de varios países. Esto se ha denominado síndrome inflamatorio multisistémico pediátrico (PIMS), asociado temporalmente a infección por SARS-CoV-2 en Europa y síndrome inflamatorio multisistémico en niños (MISC) en Estados Unidos.37,38,39 El diagnóstico de tipos incompletos de EK o EK atípica se basó en fiebre mayor de cinco días, presencia de más de dos o tres criterios clásicos, considerando anomalías de laboratorio o ecocardiográficas (aneurismas coronarios, depresión ventricular izquierda, insuficiencia valvular mitral, derrame pericárdico) como criterios adicionales asociados. En comparación con la EK, los niños con PIMS/MISC muestran una sobrerrepresentación de síntomas gastrointestinales, miocarditis y síndrome de choque.
Recientemente se ha descrito un choque hiperinflamatorio que muestra características similares al Kawasaki atípico, al que se ha denominado síndrome de choque tóxico por enfermedad de Kawasaki. Las manifestaciones cutáneas en este momento de la patología parecen inespecíficas, siendo similares a las descritas habitualmente en la EK o en infecciones virales. Las manifestaciones cutáneas y mucosas son frecuentes en niños con PIMS. La semiología de las lesiones cutáneas no presentó especificidad aparente. En el laboratorio, los marcadores inflamatorios: PCR, velocidad de sedimentación globular, recuento de neutrófilos y ferritina estaban ele- vados en casi todos los casos. Se describieron pancitopenias junto con otras alteraciones bioquímicas. Se demostró que el nivel medio de interleucina-6 estaba elevado. El síndrome de choque tóxico por enfermedad de Kawasaki es raro, afecta de 1.5 a 7 % de los pacientes con enfermedad de Kawasaki atípica, presenta disfunción miocárdica con disminución de la resistencia vascular periférica y síndrome inflamatorio severo con niveles elevados de IgE, PCR y procalcitonina.40,41
Otras erupciones vasculopáticas
Se han descritos otras erupciones vasculopáticas como púrpura trombocitopénica purpúrica, exantema tipo dengue, acroisquemia, erupciones livedoides, exantema maculopapular, erupciones tipo pitiriasis rosada y hallazgos orales.42
Conclusiones
Las manifestaciones cutáneas por COVID-19 se describen principalmente como autolimitadas, incluyen lesiones acrales, erupción urticariana, erupción maculopapular eritematosa, erupciones vasculares y vesiculares. Las erupciones urticarianas no se informan como el síntoma de presentación inicial de COVID-19, es más común al inicio o poco después de otros síntomas no cutáneos, pero es muy poco común antes. El manejo de las manifestaciones cutáneas que afectan la calidad de vida no ha sido bien documentado. La terapia con antihistamínicos está recomendada, sin embargo, es necesario evaluar más a fondo la función de la terapia antiviral para los casos graves de exantema. La presencia de urticaria durante las primeras fases de la infección por SARS-CoV-2 corresponde con las líneas de tiempo observadas en los adultos, lo que respalda la idea de que mecanismos inductores del desarrollo de la urticaria pueden ser similares en los niños y los adultos.
En la historia clínica del COVID-19 aún no está claro el papel de las manifestaciones cutáneas. El resultado clínico de COVID-19 no parece estar influido por la presencia de las lesiones cutáneas, el patrón de las lesiones ni el estado general de salud de los pacientes. Los grupos de Manalo y Jiménez Cahue argumentaron que podría haber una correlación entre las comorbilidades de los pacientes y el tipo de lesiones cutáneas, debido a un mecanismo de regulación negativa de inmunidad.43,44
La presentación y frecuencia de las manifestaciones cutáneas de COVID-19 continuarán en observación y estudio a medida que transcurre la historia natural de la enfermedad.
Conflicto de Interés
No hay ningún conflicto de interés.











 nueva página del texto (beta)
nueva página del texto (beta)




