Introducción
La encefalitis por anticuerpos contra el receptor N-metil-D-aspartato (anti-NMDAr) es una entidad clínica recientemente descrita, con un número creciente de casos reportados que señalan su importancia epidemiológica.1 En esta se demuestran anticuerpos IgG contra la subunidad NR1 del NMDAr, que han sido asociados con la presentación de los síntomas neuropsiquiátricos característicos de la enfermedad.2 Durante el primer mes del padecimiento, aproximadamente 90% de los pacientes experimenta al menos cuatro de los seis grupos clínicos característicos: alteraciones de comportamiento o disfunción cognitiva, trastornos del habla, crisis epilépticas, trastornos del movimiento, compromiso del nivel de conciencia, síntomas autonómicos e hipoventilación.3
Aunque la encefalitis anti-NMDAr fue inicialmente descrita en mujeres jóvenes como un síndrome paraneoplásico asociado a teratomas ováricos, estudios subsecuentes han demostrado que también ocurre en hombres y niños, con y sin la presencia de una neoplasia concurrente.4 A pesar de la severidad de esta condición, más de 75% de los pacientes logra una recuperación sustancial con el tratamiento adecuado y oportuno.5
El predominio de síntomas neuropsiquiátricos en etapas tempranas provoca que un elevado porcentaje de pacientes con encefalitis anti-NMDAr busquen evaluación psiquiátrica como un primer contacto con el sistema de salud.6 Por esto, es vital que los médicos psiquiatras y demás personal médico reconozcan esta entidad como un diagnóstico diferencial importante en los pacientes que se presentan por primera vez con síntomas neuropsiquiátricos complejos. Su identificación es el primer paso para instaurar un tratamiento dirigido a la enfermedad de forma oportuna.
El objetivo del presente trabajo es realizar una revisión bibliografía de la encefalitis anti-NMDAr, con énfasis en los siguientes temas: epidemiología, fisiopatología, manifestaciones clínicas, diagnóstico y tratamiento.
Contexto histórico
La encefalitis por anti-NMDAr forma parte de un grupo de entidades inmunomediadas secundarias a la producción de anticuerpos contra proteínas sinápticas.7 Roberta Vitaliani et al., en 2005, describieron cuatro mujeres jóvenes que desarrollaron síntomas neuropsiquiátricos agudos, crisis epilépticas, alteraciones de la memoria, disminución del nivel de conciencia e hipoventilación asociados a teratoma ovárico y cambios inflamatorios en el líquido cefalorraquídeo (LCR).8 Posteriormente, Dalmau et al. identificaron la producción de anticuerpos contra el NMDAr en 12 pacientes con características clínicas similares. En este primer reporte se pensaba que la enfermedad correspondía a un fenómeno paraneoplásico asociado principalmente a teratomas ováricos y, por lo tanto, ocurría predominantemente en mujeres.9 No obstante, un año después Eker et al. reportaron el primer caso de encefalitis anti-NMDAr en presencia de un teratoma testicular y seminoma metastásico.10 Más recientemente, se ha encontrado que la encefalitis por anti-NMDAr no es necesariamente un fenómeno paraneoplásico y puede ocurrir en ausencia de tumores, tanto en mujeres como hombres.11
Frecuencia de la enfermedad
El descubrimiento de la encefalitis anti-NMDAr es reciente, por lo cual su incidencia persiste indeterminada.11 Sin embargo, con base en estudios recientes y en un incremento de los casos reportados mundialmente, es posible sospechar que se trata de una entidad relativamente frecuente.1 Un estudio multicéntrico prospectivo realizado en el Reino Unido que identificó a 203 pacientes con encefalitis por diferentes causas, mostró que la encefalitis anti-NMDAr era la segunda etiología más frecuente de encefalitis autoinmune (después de la encefalomielitis aguda diseminada) y la primera causa de encefalitis mediada por anticuerpo.12 Entre septiembre de 2007 y febrero de 2011, el California Encephalitis Project evaluó a 716 pacientes diagnosticados con encefalitis. De los casos con etiología identificada, la encefalitis anti-NMDAr fue la forma más frecuente, aun por encima de enterovirus, virus herpes simple-1, virus de la varicela Zóster y virus del Oeste del Nilo.13
Características demográficas de los pacientes con encefalitis anti-NMDAr
Las personas que padecen encefalitis anti-NMDAr suelen ser jóvenes, con una edad media de presentación de 21 años.5 Sin embargo, el intervalo de edad de presentación comprende un espectro de edades amplio, desde los pocos meses de edad (el más joven de los pacientes hasta ahora estudiados tenía dos meses) hasta más de 85 años.5,11 En un estudio de cohorte, aproximadamente 40 % de los pacientes tuvo menos de 18 años de edad, mientras solo 5 % fue mayor de 45 años.5 Si bien existe una importante predilección hacia el sexo femenino (4:1), los hombres también pueden afectarse de forma relevante y corresponden a entre 25 y 30 % de los afectados.1,5 En población pediátrica, la media de edad es de aproximadamente los 8 años y la relación de los sexos es de 1:1.14
Factores desencadenantes de la enfermedad
Aunque la encefalitis anti-NMDAr fue descrita como un síndrome paraneoplásico asociado a teratomas ováricos, estudios subsecuentes demostraron que también ocurre en hombres y niños, con y sin evidencia de una neoplasia concurrente.15 Cerca de 50 % de las mujeres jóvenes con encefalitis anti-NMDAr tiene un teratoma ovárico que contiene tejido nervioso indiferenciado. En niños y hombres, la frecuencia de tumores es menor y la histología distinta.5 Tanto hombres y mujeres mayores de 45 años que presentan un tumor muestran una mayor asociación a carcinoma.5,15
Teratoma de ovario
Cerca de la mitad de las mujeres jóvenes con encefalitis anti-NMDAr presenta un teratoma ovárico demostrable, que contiene tejido nervioso indiferenciado.5 Los antígenos liberados por estas células tumorales son capturados por las células presentadoras de antígeno, luego procesadas y presentadas a las células B en los ganglios linfáticos, donde inician la producción de anticuerpos. Al cruzar la barrera hematoencefálica o llegar al cerebro vía plexos coroideos, las células B se someten a una reestimulación y maduran hacia células plasmáticas productoras de anticuerpos.16 Estas células plasmáticas tienen vidas media largas y un papel primordial en la patogénesis y en las manifestaciones clínicas de la enfermedad.17 Se ha demostrado que una alta concentración de anticuerpos en el LCR por meses o años después de la recuperación clínica.16
Encefalitis herpética
Por otra parte, la encefalitis por el virus del herpes simple (VHS) se ha descrito como otro disparador frecuente de las encefalitis autoinmunes.18 Aproximadamente 20% de los pacientes con encefalitis por VHS desarrollan anticuerpos contra el NMDAr. Estos pacientes pueden ser diagnosticados como una secuela de la infección viral y, de ser identificados, tienen una menor tasa de respuesta al tratamiento.18 Cabe señalar que en más de la mitad de los casos puede no encontrarse ningún disparador de la enfermedad.11
Interacción anticuerpo-receptor
El NMDAr está compuesto por cuatro subunidades (dos subunidades GluN1 y dos subunidades GluN2) y actúa como receptor ionotrópico, tanto a nivel presináptico como postsináptico. Las subunidades GluN1 están siempre presentes, mientras que el tipo de subunidad GluN2 (A,B, C, D) varía de acuerdo con la región cerebral, la localización sináptica o extrasináptica y la etapa del desarrollo cerebral.19 Si bien el NMDAr tiene un papel crucial en los mecanismos de plasticidad sináptica necesarios para el aprendizaje, la memoria y la cognición, también se ha relacionado con procesos de excitotoxicidad y muerte neuronal.20 Un estado de hiperfunción y regulación a la alta del NMDAr se puede asociar a actividad epiléptica,21 mientras que la hipofunción o inhibición de este receptor puede estar asociada a psicosis.22
En la encefalitis anti-NMDAr, los anticuerpos van dirigidos específicamente contra una región extracelular de la subunidad GluN1.16,17,18,19,20,21,22,23 Estos tienen efectos patogénicos demostrados, tanto en modelos in vitro como in vivo, que resultan en un síndrome potencialmente reconocible.16 Estas características los diferencian de los anticuerpos descritos en una amplia variedad de procesos (lupus eritematoso sistémico, neurodegeneración, procesos víricos, entre otros), en los que la diana son las subunidades GluN2.24 Estos anticuerpos no se asocian a ningún síndrome clínico específico y su valor clínico es incierto en la mayoría de los casos.25
Antagonistas del receptor NMDA como un modelo farmacológico
Los pacientes con encefalitis anti-NMDAr desarrollan un síndrome que evoluciona en estadios semejantes a los observados con la administración de antagonistas no competitivos del NMDAr, como fenilciclidina o ketamina.16 A continuación, planteamos dos escenarios mostrando las semejanzas entre estas dos entidades:
A bajas dosis, los antagonistas no competitivos del NMDAr producen alteraciones sensoperceptivas (ilusiones), ideas paranoides y de referencia, además de déficits en el desempeño de las funciones ejecutivas.26 Clínicamente, esto corresponde con la presentación prominente de síntomas neuropsiquiátricos en etapas iniciales o residuales de encefalitis anti-NMDAr y en formas leves de la misma.
A dosis más altas de fenciclidina o ketamina puede presentarse psicosis, agitación, alteraciones de la memoria, comportamientos estereotipados y poca respuesta al dolor.27 Finalmente, a dosis muy altas suele desarrollarse anestesia disociativa, estados de catatonia y coma.28 Estos efectos corresponden con las formas graves de la encefalitis anti-NMDAr caracterizados por discinesias, respuestas paradójicas, catatonia y disfunción autonómica.16
No obstante, algunos autores buscan refutar el constructo de la encefalitis anti-NMDAr como una hipofunción global del NMDAr mediante modelos que demuestran hiperfunción del receptor durante etapas tempranas de le enfermedad, para luego alcanzar un estado de hipofunción global. En este caso, los anticuerpos pueden actuar como agonistas o antagonistas del NMDAr y provocar un cambio de señalización en los sitios con mayor actividad del receptor, explicando ciertas características clínicas de la enfermedad que no logran ajustarse en forma satisfactoria al modelo de hipofunción global del NMDAr, por ejemplo, las crisis epilépticas, las discinesias y la catatonia.29
Alteraciones neuroanatómicas relevantes para entender la presentación neuropsiquiátrica
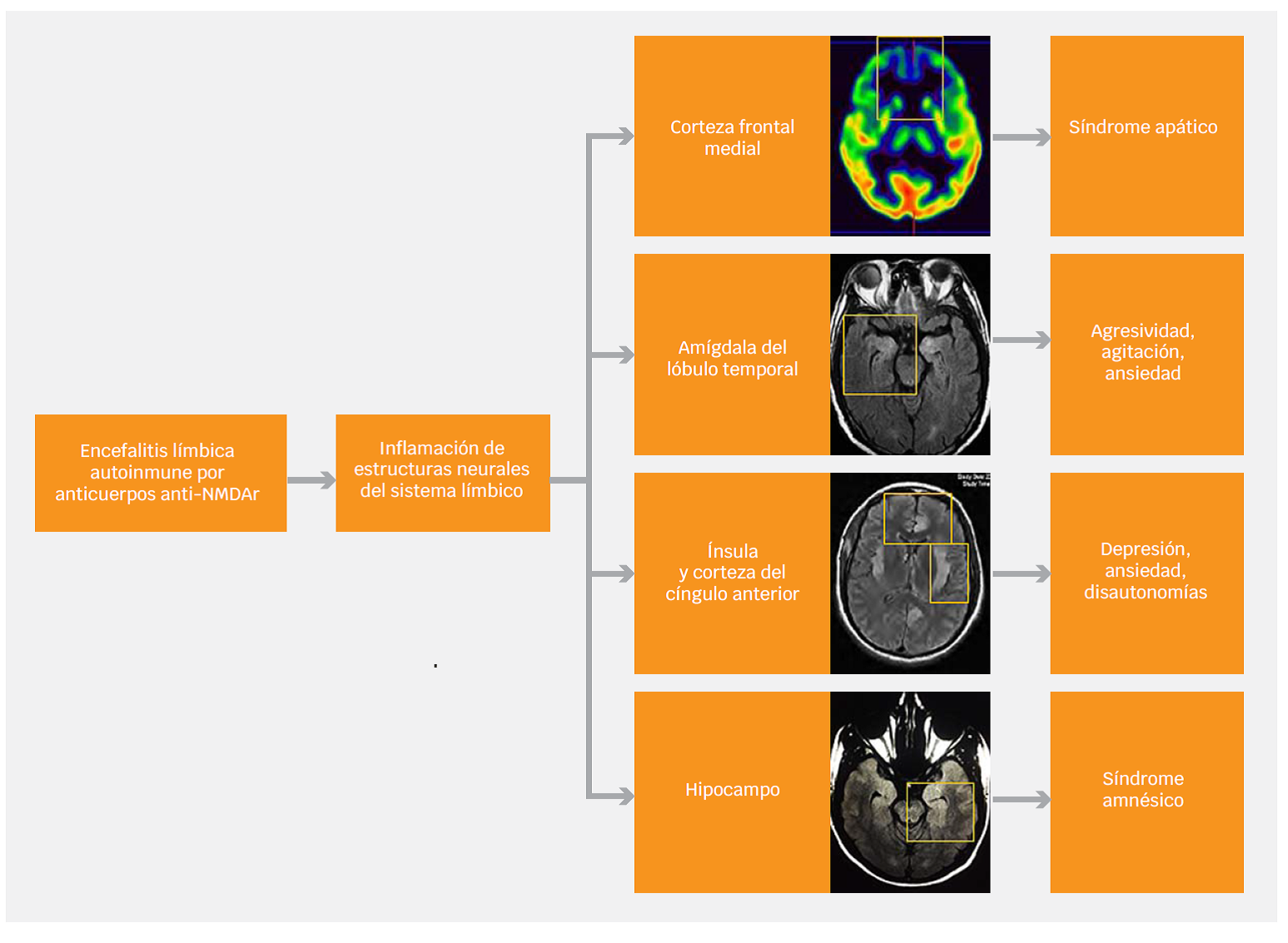
La encefalitis anti-NMDAr se asocia a anormalidades observables en los estudios de resonancia magnética. Un 50 % de los pacientes cursa con hiperintensidades en la secuencia FLAIR en regiones elocuentes para la regulación del comportamiento: lóbulo temporal medial (amígdala e hipocampo), ínsula, ganglios basales, corteza del cíngulo y corteza frontal.2,30 Estas estructuras se asocian a procesos cognitivos y emocionales, así como a la regulación del comportamiento en general, lo cual es clave para entender la formación de síntomas psiquiátricos prominentes en esta enfermedad31 (Figura 1). Algunos fenómenos, como la catatonia, son difíciles de explicar como resultado de anormalidades focales de la anatomía cerebral, por lo cual se proponen modelos de desequilibrio entre la vía directa y la vía indirecta en los circuitos frontoestriatales.32 En estos modelos, la internalización del receptor NMDA que resulta de la acción de los anticuerpos genera una desactivación de neuronas GABAérgicas en el estriado, lo cual, a su vez, provoca disregulación de la liberación de dopamina y de las proyecciones glutamatérgicas del tálamo.32 En el largo plazo, el daño hipocampal estructural se asocia a secuelas cognitivas, en particular mnésicas.33
Manifestaciones clínicas
La encefalitis anti-NMDAr suele instaurarse de forma subaguda, comprometiendo diferentes dominios sintomáticos en un espectro amplio de gravedad.34 Las manifestaciones neuropsiquiátricas ocurren en etapas iniciales de la enfermedad en la mayoría de los casos, pudiendo semejar un trastorno mental primario.35,36,37,38
Se ha propuesto una presentación clínica por estadios, que Maneta et al. dividen en temprano, medio y tardío6 (Cuadro 1). Muchos pacientes comienzan con un cuadro prodrómico pseudoviral con cefalea o fiebre; en una serie de 100 individuos con encefalitis, en las semanas previas a la presentación, 86% tuvo cefalea, fiebre o síntomas semejantes a los de una infección viral.4 Graus, Dalmau et al.3 dividen las manifestaciones clínicas de los pacientes con encefalitis anti-NMDAr en seis dominios clínicos que se describirán a continuación, con especial énfasis en las manifestaciones neuropsiquiátricas:
Cuadro 1 Estadios clínicos de la encefalitis anti-NMDAr6,11
| Estadio | Características clínicas |
| Temprano | Semana 1: pródromo viral con cefalea y fiebre |
| Medio | Semana 1-3: síntomas neuropsiquiátricos como ideas delirantes, alucinaciones, manía, agitación, cambios en el discurso, desorganización (frecuente crisis epilépticas). |
| Tardío | Semanas a meses: complicaciones neurológicas como crisis epilépticas, trastornos del movimiento, disautonomía, hipoventilación central. |
| Recuperación | Meses a años: se da en un orden inverso al visto durante la instauración de la enfermedad. |
| Residual | Déficits a largo plazo: disfunción ejecutiva, impulsividad, desinhibición, trastornos del sueño. |
Disfunción cognitiva o comportamiento anormal
Cerca de 80% de los pacientes con encefalitis anti-NMDAr desarrolla síntomas psiquiátricos prominentes,4 incluyendo ansiedad, irritabilidad, agresividad, insomnio, paranoia, alucinaciones visuales o auditivas, desinhibición sexual, manía, depresión, psicosis y catatonia.4,39,40 En ambos sexos, los síntomas psiquiátricos son las manifestaciones iniciales más frecuentes, 54% en hombres y 67% en mujeres.39 La presencia de estos síntomas hace que la mayoría de los pacientes, 62% en algunas cohortes, sean referidos a servicios psiquiátricos durante los primeros días de la enfermedad.41
Los síntomas psicóticos se han descrito como “profundamente fragmentados”, con ideas delirantes pobremente sistematizadas, cuando se comparan con los encontrados en personas con trastornos psicóticos.35 Un estudio reportó que aproximadamente 20% de los pacientes con alteraciones comportamentales nunca desarrollan síntomas psicóticos.42 A diferencia de los pacientes con el primer episodio de psicosis (PEP), las personas con encefalitis anti-NMDAr son predominantemente mujeres jóvenes, incluso menores de 18 años, que reportan altas tasas de agitación, agresividad y catatonia;42,43,44 adicionalmente, pueden verse otras presentaciones como risa o llanto patológico, predominio de alucinaciones visuales e inicio rápido de déficit mnésico, escasamente reportado en sujetos con primer episodio de psicosis.42,45
La catatonia parece ser un síndrome que puede ayudar en la identificación temprana de la encefalitis anti-NMDAr. Recientemente, Warren et al. reportaron que aproximadamente 32% de los paciente presentó catatonia durante el curso de la enfermedad.42 Sin embargo, en estudios prospectivos con uso sistemático de instrumentos específicos se ha reportado una frecuencia más alta (72%) de catatonia, la cual, en la mayoría de casos, se puede asociar con delirium.46 Interesantemente, la catatonia puede fluctuar entre una agitación psicomotriz grave y periodos de retraimiento, estupor y mutismo.42,47 El reconocimiento de síntomas catatónicos asociados a síntomas de delirium (fluctuación) podría ayudar a sospechar esta entidad, evitando que se catalogue como una psicosis primaria, lo que habitualmente retrasa el tratamiento.
Aunque los síntomas psiquiátricos aislados son raros (aproximadamente en 4%), pueden ocurrir al inicio de la enfermedad o durante recaídas y suelen corresponder a ideas delirantes, alteraciones afectivas (usualmente manía) y agresividad.43 En un estudio que incluyó a 23 pacientes con síntomas psiquiátricos aislados, 74% presentaba ideas delirantes, 43 % alucinaciones auditivas o visuales, 57% agresividad y 70% un componente afectivo. Un reporte de caso demostró que los síntomas psiquiátricos sin compromiso neurológico pueden persistir por 14 años.48 Interesantemente, 83% de los pacientes con episodios psiquiátricos aislados durante el curso de esta enfermedad tuvo buen pronóstico con respuesta a inmunoterapia y resección tumoral.48
La disfunción cognitiva también se ha descrito como síntoma de presentación,40 incluyendo la presencia de dificultades en memoria de corto plazo y concentración. Sin embargo, estos síntomas no han sido tomados en cuenta para ser parte de los criterios diagnósticos, dada la dificultad para valorarse en los pacientes con psicosis o agitación.3 Otros autores han observado que los individuos con encefalitis anti-NMDAr pueden manifestar alteraciones en la percepción del tiempo.49 Los síndromes afásicos como presentación inicial de esta enfermedad también ha sido reportada.50
Alteraciones del habla
Las anormalidades del habla suceden hasta en 70% de los pacientes. Algunos presentan presión del habla (pressured speech) en fases tempranas de la enfermedad, aunque característicamente el discurso disminuye de forma progresiva hasta llegar al mutismo.2,42
Crisis epilépticas
Las crisis epilépticas pueden presentarse en la fase aguda en 80.7% de los pacientes y suelen ser más frecuentes en hombres.51,52 Estas crisis pueden ser únicas en 19%, repetidas en 30% o, incluso, llevar a estatus epiléptico en 25%. La presencia de tumor se asoció a la posibilidad de recurrencia de las crisis, desarrollo de estado epiléptico, coma e ingreso a unidad de cuidados intensivos (UCI). No obstante, generalmente los pacientes se encuentran libres de crisis a lo largo de dos años de seguimiento.51
Trastornos del movimiento
Las alteraciones del movimiento pueden variar en gravedad, desde discinesias orolinguales hasta el mantenimiento de posturas anormales y opistótonos; las más frecuentes son las discinesias orofaciales, si bien también se han documentado movimientos coreicos, balismo, atetosis, rigidez y miorritmia.39 Kleinig et al. describieron movimientos repetitivos y cuasirrítmicos de músculos deglutorios y de las extremidades, que persisten durante periodos de ausencia de respuesta al medio, los cuales consideraron característicos de la enfermedad.53
Alteración del nivel de conciencia
En los pacientes puede presentarse todo el espectro de trastornos del estado de conciencia, desde somnolencia y estupor hasta coma. Es relevante señalar que también pueden no presentarse y solo existir fallas cognitivas. Los episodios de agitación pueden alternarse con estados catatónicos y el cuadro clínico puede evolucionar hacia el coma.2
Disfunción autonómica e hipoventilación central
Las alteraciones autonómicas como hipertermia, taquicardia, sialorrea, fluctuaciones de la presión arterial y bradicardia pueden presentarse con distintas frecuencias y etapas de la enfermedad; 50 % de los pacientes necesita soporte ventilatorio mecánico debido a hipoventilación central.5
Si bien los síntomas cognitivos y comportamentales son las manifestaciones iniciales más frecuentes en los adultos, en los niños suelen presentarse predominantemente con síntomas neurológicos (crisis epilépticas, movimientos anormales). La alteraciones mnésicas, estatus epiléptico, hipoventilación central, alteraciones del sueño y neumonía se han observado con mayor frecuencia en los adultos, lo cual se correlaciona con un peor pronóstico en esta población.14,54
Diagnóstico
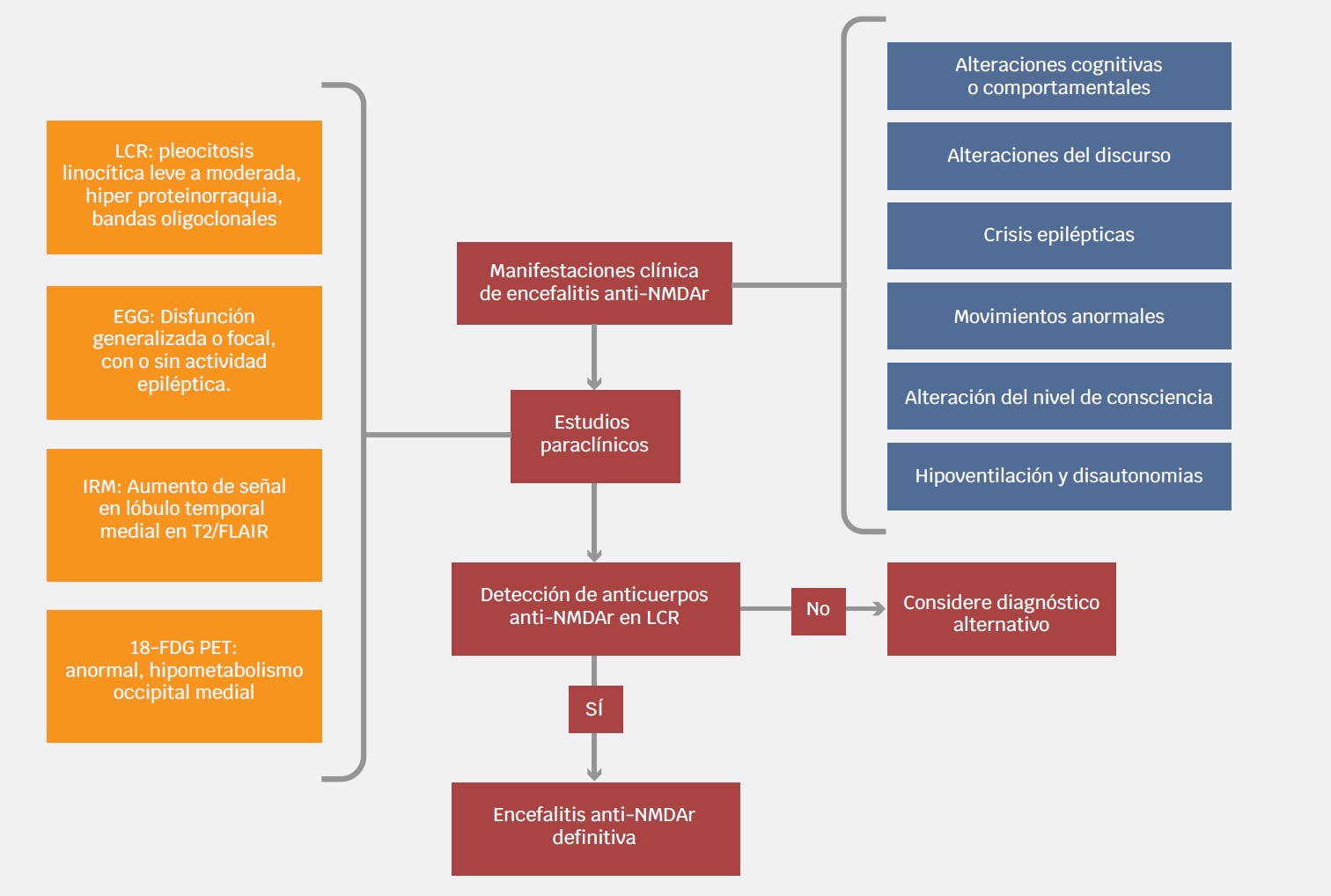
En año 2016, Graus et al. desarrollaron un procedimiento clínico para el diagnóstico de las encefalitis autoinmunes, orientado a seleccionar a los pacientes de tal forma que reciban tratamiento oportunamente. Estos criterios incluyen diferentes niveles de certeza (posible, probable y definitiva) para diferentes entidades inmunomediadas, incluyendo la encefalitis anti-NMDAr. Este abordaje considera una encefalitis autoinmune y antiNMDAr probable cuando los pacientes cumplen los criterios clínicos y paraclínicos expuestos en el Cuadro 2. El diagnóstico de encefalitis anti-NMDAr es definitivo en presencia de uno o más de los seis grupos mayores de síntomas y la demostración de anticuerpos IgG anti-GluN1 en LCR, considerando la exclusión razonable de otros trastornos.3
Cuadro 2 Describe los criterios diagnósticos que se deben cumplir para los diferentes grados de certeza (probable o definida) de la encefalitis antirreceptor NMD3
| Encefalitis anti-receptor NMDA probable |
|
1. Inicio rápido (menor a tres meses) de al menos cuatro de los siguientes seis grupos principales de síntomas: |
|
2. Al menos uno de los siguientes resultados de estudios de laboratorio: |
| 3. El diagnóstico también puede realizarse en presencia de tres de los grupos de síntomas anteriores, acompañados de un teratoma sistémico. |
| 4. Excluir de historia reciente de encefalitis por virus herpes simple o virus de la encefalitis Japonesa B, los cuales pues resultar en recaída de síntomas neurológicos recurrentes mediados por el sistema inmunitario. |
| Encefalitis antirreceptor NMDA definida |
| 1. El diagnóstico se puede realizar en presencia de uno o más de los seis grupos principales de síntomas y anticuerpos IgG anti-GluN1; si solo se dispone de suero, deben incluirse pruebas de confirmación (por ejemplo, neuronas vivas o inmunohistoquímica tisular, además del ensayo basado en células). |
| 2. Excluir historia reciente de encefalitis por virus herpes simple o virus de la encefalitis japonesa B, los cuales pues resultar en recaída de síntomas neurológicos recurrentes mediados por el sistema inmunitario |
EEG = electroencefalograma, LCR = líquido cefalorraquídeo.
En el contexto de un cuadro clínico compatible, algunos estudios paraclínicos comúnmente disponibles pueden apoyar el diagnóstico de encefalitis anti-NMDAr. La imagen por resonancia magnética (IRM) cerebral puede demostrar hiperintensidades en la secuencia FLAIR en el lóbulo temporal medial, ínsula, tallo cerebral, ganglios basales o corteza (Figura 2). Ahora bien, hasta 50 % de los pacientes puede tener IRM normal.2

Figura 2 Imagen de resonancia magnética cerebral en secuencia T2 FLAIR con cortes axiales a nivel del lóbulo temporal medial. Se observa incremento bilateral en la intensidad de señal de las cabezas de los hipocampos. Mujer de 22 años, con diagnóstico de encefalitis anti-NMDAr definitiva.
El electroencefalograma (EEG) es anormal en la mayoría de los pacientes (en 85 a 90 %); no obstante, sus hallazgos suelen ser inespecíficos (actividad lenta y desorganizada). En algunos casos, los registros pueden mostrar actividad epiléptica focal o generalizada.2 Treinta por ciento de los pacientes con encefalitis anti-NMDAr presenta un patrón conocido como delta brush extremo (extreme delta brush), asociado a cuadros clínicos más graves y prolongados55,56 (Figura 3).
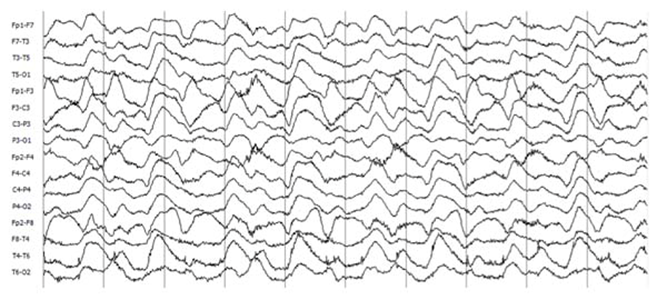
Figura 3 EEG con patrón extreme delta brush. Montaje bipolar longitudinal doble banana, filtro de baja 1Hz (0.3 CT), filtro de alta 50Hz, filtro de Notch 60Hz. Sensibilidad en 7μV/mm. El estudio pertenece a una mujer de 16 años con cuadro grave de encefalitis anti-NMDAr.
El análisis del LCR es anormal en 80% de los pacientes al inicio de la enfermedad y cerca de 90% en etapas posteriores.2,57 Este porcentaje podría ser menor: una revisión sistemática de casos reportados estimó que solo 58% de los pacientes presentaba LCR anormal.1 En las fases iniciales de la enfermedad, los estudios de rutina del LCR pueden ser normales, salvo por la presencia de anticuerpos anti-NMDAr. Espinola Nadurille et al., reportan que la presencia de LCR no inflamatorio representa retraso en el diagnóstico correcto y en el inicio de tratamiento inmunomodulador.58
La tomografía por emisión de positrones con 18-fluorodesoxiglucosa (18-FDG PET) debe ser considerada para el diagnóstico de encefalitis límbica cuando la IRM resulta ser normal.3 En la encefalitis anti-NMDAr puede mostrar metabolismo cerebral con gradiente frontooccipital disminuido en regiones mediales de los lóbulos occipitales.59 La utilización de esta herramienta ha sido defendida por algunos autores puesto que puede ser útil para el diagnóstico y en la búsqueda de tumores asociados. Si bien la detección del anticuerpo anti-NMDAr en el LCR es el biomarcador de elección, el hipometabolismo occipital medial puede ayudar en el abordaje y seguimiento de los pacientes59 (Figura 4). La Figura 5 resume cómo realizar el procedimiento diagnóstico de los pacientes con sospecha de encefalitis anti-NMDAr.
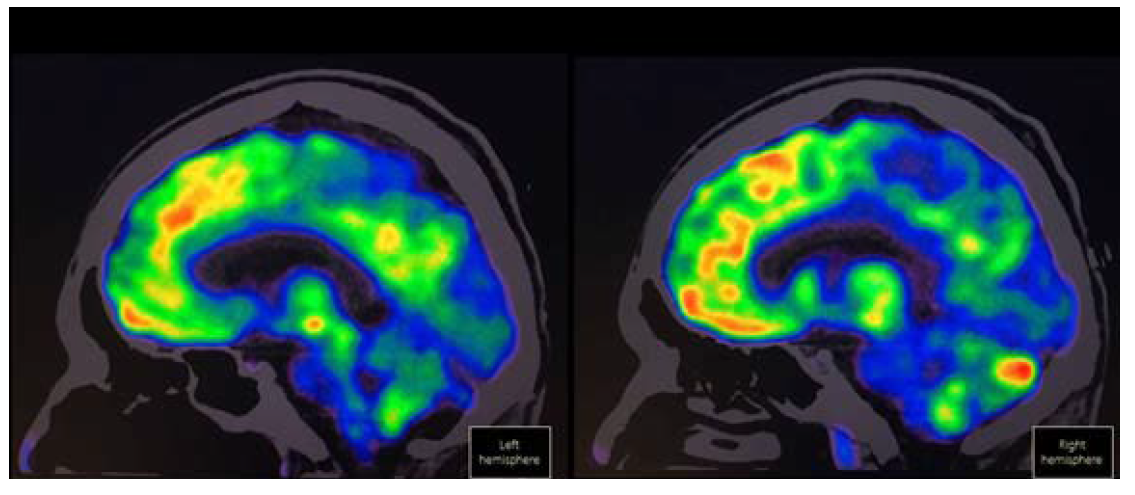
Figura 4 18-FDG PET en un hombre de 37 años con encefalitis anti-NMDAr definitiva, manifestada por cuadro clínico de predominio psicótico con síntomas nihilistas y catatónicos, quien muestra hipometabolismo occipital medial.
Presencia de anticuerpos anti-NMDAr en pacientes con síntomas psiquiátricos
El advenimiento de encefalitis anti-NMDAr ha significado un cambio en la forma de lleva a cabo el diagnóstico de los pacientes que se presentan a los servicios médicos con síntomas psicóticos, alteraciones del comportamiento y síntomas catatónicos de instauración aguda o subaguda. Estos pacientes son abordados inicialmente por el servicio de psiquiatría y es solo ante el desarrollo de crisis epilépticas o discinesias que se advierte la posibilidad de encefalitis.6 Sin embargo, aproximadamente 4 % de los casos de encefalitis anti-NMDAr puede presentarse con síntomas psiquiátricos aislados.48
Algunos autores han recomendado la medición de anticuerpos anti-NMDAr en pacientes con manifestaciones psiquiátricas.60,61,62 Maneta et al. propusieron factores clave para considerar la posibilidad de encefalitis anti-NMDAr en un primer episodio de psicosis: sexo femenino, pródromo de síntomas gripales, psicosis y catatonía de inicio súbito, crisis epilépticas, presencia de malignidad, disfunción autonómica grave y empeoramiento de síntomas con el uso de antipsicóticos.6
Diagnóstico diferencial
La encefalitis anti-NMDAr puede presentarse en la práctica clínica de neurólogos o psiquiatras, por lo que los diagnósticos diferenciales de esta condición transitan en el campo de ambas especialidades. En las etapas tempranas de la enfermedad, las alteraciones conductuales llevan a que los diagnósticos diferenciales psiquiátricos sean los primeros en considerarse.40,63
El diagnóstico de primer episodio psicótico es el diagnóstico inicial más común reportado en la literatura en presencia de delirios, alucinaciones o manifestaciones catatónicas. La presencia de rigidez y alteración del estado de consciencia es frecuente en los pacientes con encefalitis anti-NMDAr y puede confundirse con síndrome neuroléptico maligno, especialmente cuando se han prescrito neurolépticos.35,40 Los diagnósticos diferenciales neurológicos incluyen encefalitis viral, vasculitis del sistema nervioso central, además de otras formas de encefalitis autoinmunes. Las discinesias o movimientos estereotipados pueden confundirse con crisis epilépticas y, en ocasiones, pueden ser diagnosticados como un estado epiléptico.40,63
Búsqueda de tumores
Los pacientes con diagnóstico de encefalitis anti-NMDAr deben ser evaluados para detectar tumores al inicio de la enfermedad. Si el cribado tumoral inicial es negativo, se recomienda el seguimiento durante un plazo de dos a tres años, particularmente en mujeres jóvenes.11 Para la búsqueda de neoplasias ováricas se recomienda el uso de ultrasonido transvaginal, seguido preferentemente de IRM o tomografía abdominopélvica. Si se sospechan neoplasias en hombres es recomendable el uso de ultrasonido o de tomografía abdominopélvica.5,11
Tratamiento encefalitis anti-NMDAr
Aún no existen guías para el tratamiento de la encefalitis anti-NMDAr, Las decisiones respecto a este deben ser individualizadas, teniendo en cuenta la edad del paciente, la presencia o ausencia de tumor y la gravedad de la enfermedad.39 Estas intervenciones están basadas en estudios observacionales y en la experiencia clínica de grupos de expertos. Las recomendaciones sugeridas por los grupos expertos estratifican el tratamiento en primera y segunda línea. El tratamiento de primera línea involucra el uso temprano de bolos de metilprednisolona (1g) vía intravenosa durante cinco días (en adultos), asociado con inmunoglobulina humana (2g/kg dosis total) vía intravenosa o terapia de recambio plasmático (cinco sesiones).64 La resección quirúrgica del tumor, cuando está presente, se considera el tratamiento definitivo de la enfermedad y debe ser acompañado de intervenciones inmunomoduladoras.5 De no obtener una respuesta favorable, se recomienda terapia inmunosupresora de segunda línea con rituximab, ciclofosfamida o su combinación.51 Una conducta cada vez más utilizada, no solo en casos graves, sino de forma sistemática en todos los pacientes, es la adición de rituximab en la terapia de primera línea orientado a la disminución del riesgo de recurrencias a largo plazo.5
Tratamiento de síntomas neuropsiquiátricos
La literatura es escasa en cuanto al manejo de los síntomas neuropsiquiátricos de estos pacientes. Frecuentemente se describen como resistentes al tratamiento y existe la necesidad de utilizar múltiples psicotrópicos. Ante la presencia de síntomas psicóticos se ha reportado el uso tanto de antipsicóticos típicos como atípicos.35,40,65 Los antipsicóticos típicos, especialmente los de mayor bloqueo D2 (haloperidol), pueden causar acatisia, distonía, temblor y empeorar la agitación, además de su potencial para precipitar un síndrome neuroléptico maligno.66,67 En casos de agitación severa, ha sido reportado el uso de benzodiacepinas y antipsicóticos de segunda generación con diferentes tasas de éxito.65
En cuanto a los síntomas afectivos, los estabilizadores de ánimo como el litio y el ácido valproico han sido utilizado para el manejo de los síntomas maniformes: el ácido valproico podría ser de mayor beneficio por provocar sedación y podría ser de utilidad en el tratamiento y profilaxis de crisis epilépticas.36,56 En casos de insomnio, las benzodiacepinas, la trazodona, la melatonina y la clonidina son prescritas con relativa frecuencia.65
Ante los síntomas catatónicos, las benzodacepinas permanecen como la primera línea. El uso de antipsicóticos en este subgrupo de pacientes continúa siendo controversial, especialmente cuando se trata de antipsicóticos típicos.68 En los casos con respuestas inadecuadas o parciales a otras opciones de tratamiento, la terapia electroconvulsiva (TEC) ha tenido buenos desenlaces en relación con los síntomas catatónico, psicóticos y afectivos.69 La TEC debe garantizarse en los pacientes que se presenten con catatonia maligna o refractaria a otras modalidades terapéuticas. De igual forma, la TEC ha resultado efectiva en diferentes reportes de casos en pacientes críticos con estados epilépticos refractarios, además de utilizar ketamina.65,70
Evolución y pronóstico
Globalmente el pronóstico es favorable en los pacientes con encefalitis anti-NMDAr que responden a manejo inmunomodulador de primera línea, así como en aquellos con inicio temprano del tratamiento de segunda línea.5,71 El curso de la recuperación sigue un orden inverso a la presentación de los síntomas. Primero se presenta reemergencia del coma junto con la estabilización de las funciones autonómicas, disminución del requerimiento de soporte ventilatorio y el cese de los trastornos del movimiento. A medida que la recuperación avanza, el nivel de conciencia y la interacción con el medio mejoran.5,11 Los síntomas cognitivos, relacionados con la interrupción de las funciones ejecutivas (atención, planeación y memoria de trabajo) y del comportamiento social (impulsividad, apatía y desinhibición) suelen ser los últimos en mejorar.72,73 Luego del tratamiento y en la fase de recuperación, los pacientes pueden ser monitoreados periódicamente en su nivel de funcionalidad y cognición para la detección de recaídas. Los anticuerpos pueden seguir detectándose en el LCR durante meses después del cuadro agudo y no deben utilizarse aisladamente para decidir manejo con inmunoterapia a largo plazo.4,74
El inicio precoz de la inmunoterapia y la ausencia de ingreso a unidades de cuidados intensivos son de buen pronóstico.75 No obstante, existe un riesgo estimado de recidiva de 10 a 25% incluso años después de la resolución del primer episodio.5 Este riesgo es mayor en los pacientes en quienes no se detectan tumores o en quienes reciben inmunoterapia de forma tardía. En caso de recidiva, el manejo terapéutico debe ser similar al del primer episodio, en el entendido que los cuadros de recaída suelen ser de menor gravedad que los primeros episodios, predominando los síntomas cognitivos.5
Conclusiones
A una década del descubrimiento de la encefalitis anti-NMDAr y la publicación de la primera serie de 100 casos,63 podemos concluir lo siguiente:
A pesar del desconocimiento exacto de la frecuencia de la enfermedad, se sabe que ocupa una prevalencia alta entre las encefalitis.12,13
El debut con síntomas neuropsiquiátricos requiere una alta sospecha clínica que se fortalece con la realización de una historia clínica detallada y con el soporte de auxiliares diagnósticos como análisis de citoquímico y citológico de líquido cefalorraquídeo, realización de IRM, EEG y, cuando sea posible, 18-FDG PET para evitar la equivocación de clasificar el caso como una psicosis primaria. La utilización de neuroimagen estructural y citoquímico de LCR como únicos paraclínicos no descarta la enfermedad, ya que ambos estudios pueden ser normales en un porcentaje considerable de pacientes.2,51
En caso de un cuadro de encefalitis en donde no se compruebe el origen infeccioso, se debe pensar en esta entidad y ofrecer inmunoterapia a pesar de no contar con el estudio de anticuerpos anti-NMDAr o, bien, si la obtención de resultados de estos es tardada.3
Principalmente en mujeres adolescentes y adultas jóvenes debe descartarse, por los medios indicados, la presencia de teratoma ovárico, y en caso de encontrarse se debe proceder a su resección inmediata.3
Las manifestaciones de la enfermedad llaman a la colaboración inter y multidisciplinaria de disciplinas dentro la medicina general, medicina interna, ginecología, inmunología, neuropsicología y especialmente de especialidades y subespecialidades de la psiquiatría y neurología. Lo anterior apoyaría tanto el diagnóstico temprano como el tratamiento óptimo del episodio de encefalitis, así como la rehabilitación en caso de secuelas.











 nueva página del texto (beta)
nueva página del texto (beta)