Introducción
A finales de diciembre de 2019, un brote de neumonía de origen desconocido en pacientes de Wuhan, China, llevó a la identificación de un nuevo coronavirus (CoV) con implicaciones alarmantes en la salud humana.1 Una vez aislado y analizado filogenéticamente, el nuevo CoV fue llamado CoV de tipo 2 causante del síndrome respiratorio agudo severo (SARS-CoV-2).2 En algunos casos, la infección por SARS-CoV-2 puede ser asintomática; sin embargo, entre los pacientes que desarrollan síntomas (enfermedad del CoV 2019, COVID-19), aproximadamente 20 % presenta enfermedad severa o crítica que requiere cuidados intensivos y que en determinados casos ocasiona la muerte.3 De acuerdo con la Universidad Johns Hopkins, al 10 de septiembre de 2021, este virus ha infectado a más de 223 millones de personas y provocado más de 4.6 millones de decesos alrededor del mundo.4
A pesar de los avances en el conocimiento del curso clínico de esta enfermedad y en la investigación terapéutica, se dispone de resultados limitados sobre la eficacia de fármacos antivirales, antiinflamatorios e inmunomoduladores.5 Así también, aunque los programas de inmunización por vacunación han dado inicio y mostrado una buena eficacia para prevenir infecciones y casos graves, existe desigualdad internacional en la distribución de las vacunas para COVID-19.6
Por lo anterior, además de las estrategias preventivas de contagio que incluyen el distanciamiento físico y el uso rutinario de cubrebocas, se propone la adopción o mantenimiento de un estilo de vida saludable puesto que es esencial para una respuesta inmune favorable.7
Entre las medidas de prevención relacionadas con un estilo de vida saludable, la nutrición es fundamental. En particular, se reconoce que el estado subóptimo de micronutrimentos conduce a una alteración de la respuesta inmune innata y adaptativa que impacta negativamente en la resistencia a infecciones.7,8 Las vitaminas y minerales actúan complementariamente en la respuesta inmune; por lo tanto, actualmente se han desarrollado investigaciones para evaluar el efecto terapéutico adyuvante de micronutrimentos en COVID-19, dentro de los cuales, la vitamina D y vitamina C destacan debido a sus efectos inmunomoduladores y antioxidantes, respectivamente.5 No obstante, otra de las vitaminas sugeridas como tratamiento profiláctico o adyuvante de COVID-19 es la vitamina A.9
El ácido retinoico (AR) es el metabolito activo de la vitamina A encargado de ejercer efectos inmunomoduladores. En particular, el AR interactúa con sus receptores nucleares para reprimir o activar la transcripción de genes en diferentes células del sistema inmune, por ejemplo: en células dendríticas, macrófagos, células T y células B.9,10 Además, se ha descrito que esta vitamina es necesaria para la homeostasis de los tejidos epiteliales. 10 Por lo tanto, tomando en cuenta el mecanismo de ingreso del SARS-CoV-2, la presente revisión tiene como objetivo abordar la participación de la vitamina A en la producción de la inmunoglobulina A secretora en el epitelio del tracto respiratorio para resaltar su potencial función protectora contra la infección por SARS-CoV-2.
Infección por SARS-CoV-2
Los CoV son virus envueltos que se caracterizan por tener un genoma de ARN monocatenario de sentido positivo de 29 a 32 kilobases.11 Existen cuatro géneros de CoV que pertenecen a la subfamilia Coronavirinae; sin embargo, los que infectan a mamíferos son los α-CoV y β-CoV. Antes de la identificación del SARS-CoV-2, únicamente se conocían seis especies dentro de estos géneros con relevancia en la salud humana.11,12 Cuatro (229E, OC43, NL63 y HKU1) ocasionan síntomas leves como el resfriado común. En contraste, el síndrome respiratorio agudo severo (SARS)-CoV, el síndrome respiratorio de Oriente Medio (MERS)-CoV y el actual SARS-CoV-2 causan daño pulmonar que puede ser fatal.1,11
Los CoV se conforman de cuatro proteínas estructurales: espiga (S), membrana (M), envoltura (E) y nucleocápside (N)11,12,13 La proteína S es la encargada del ingreso del SARS-CoV-2 a las células del huésped. En la subunidad S1 de la proteína S se encuentra ubicado el dominio de unión al receptor (RBD) que utiliza a la enzima convertidora de angiotensina 2 (ACE2) como receptor de entrada.11,13,14 Tras la unión de la proteína S con la ACE2, la proteasa de serina transmembrana 2 (TMPRSS2) ocasiona la escisión de la proteína S que da como resultado la fusión de las membranas viral y celular.12,15 Finalmente, el genoma viral se libera en el citoplasma de la célula huésped y aprovecha los recursos celulares para replicarse. En consecuencia, se puede desencadenar una respuesta inmune exacerbada caracterizada por una producción incontrolada de citocinas proinflamatorias, responsable del síndrome de dificultad respiratoria aguda y disfunción multiorgánica.11,12
Aun cuando la ACE2 se expresa en diferentes tejidos, Zou, et al. reportaron que el tracto respiratorio inferior, esófago, pulmón, corazón, íleon, riñón y vejiga tienen un mayor porcentaje de células positivas a ACE2. Por lo tanto, estos órganos son de alta vulnerabilidad a la infección por el SARS-CoV-2.16 No obstante, la principal ruta de transmisión de este virus es por vía aérea, por lo que infecta principalmente la vía respiratoria de los individuos expuestos a gotículas y aerosoles expedidos por sujetos infectados.12,17 En este sentido, el epitelio del tracto respiratorio es fundamental en la primera línea de defensa contra agentes patógenos, ya que además de formar una barrera física, las células epiteliales regulan la respuesta inmune innata y adaptativa.18
Absorción y metabolismo de la Vitamina A
El término vitamina A incluye varias moléculas liposolubles que al ser metabolizadas ejercen funciones biológicas esenciales. Esta vitamina se obtiene a través de los alimentos ya sea como vitamina A preformada o provitamina A.19,20 La vitamina A preformada corresponde al retinol y sus ésteres que se encuentran en fuentes animales como hígado de res, huevo, lácteos y pescado.19,21 Por su parte, la provitamina A engloba a los carotenoides (β-caroteno, α-caroteno y β-criptoxantina) que provienen de fuentes vegetales de color naranja y amarillo como zanahoria, calabaza, papaya y mango; sin embargo, los carotenoides deben ser convertidos a retinol para llevar a cabo sus funciones fisiológicas.21,22,23
La absorción tanto de la vitamina A preformada como de la provitamina A ocurre principalmente en las células epiteliales del duodeno.20 Una vez que la vitamina A ingresa a los enterocitos, la enzima lecitina retinol aciltransferasa (LRAT) convierte a ambas clases de esta vitamina en ésteres de retinilo.10,24 Los lípidos en la dieta facilitan la absorción de la vitamina A, aunque también son necesarios para la formación de quilomicrones, puesto que los ésteres de retinilo son empaquetados en ellos para su incorporación a la circulación.10,20,25 Los hepatocitos captan hasta el 78 % de estos quilomicrones para su hidrólisis a retinol por acción de la hidrolasa de ésteres de retinilo o por la lipoproteína lipasa.20,26 Posteriormente, en condiciones de suficiencia, el retinol es transferido a las células estelares hepáticas que, por acción de la LRAT se vuelven a formar en ésteres de retinilo para su almacenamiento en gotas lipídicas.20,27 Cuando los tejidos periféricos requieren retinol, los ésteres de retinilo se hidrolizan nuevamente y son enviados hacia los hepatocitos en donde el retinol es incorporado a su proteína de transporte, la proteína de unión a retinol (RBP).9,10,20
A pesar de que se ha sugerido que el retinol libre puede cruzar por sí mismo las bicapas fosfolipídicas, el principal mecanismo de ingreso del retinol a los tejidos periféricos es a través del reconocimiento de la RBP por la proteína estimulada por ácido retinoico 6 (STRA6); sin embargo, la expresión de este receptor se limita en ciertos tejidos.9,10,20,28 Después de la incorporación del retinol en el citosol, este es oxidado a retinal por medio de una enzima de expresión ubicua, la alcohol deshidrogenasa (ADH).29,30 Finalmente, el retinal es oxidado por la reacción catalítica irreversible de la retinal deshidrogenasa (RALDH) para la formación de AR.24 No obstante, la expresión de las isoformas de la RALDH se limita en ciertos tipos celulares, particularmente, en células del epitelio intestinal y en células dendríticas (DC) y macrófagos de los ganglios linfáticos mesentéricos y de las placas de Peyer.30,31,32 Por lo tanto, las células del epitelio intestinal pueden metabolizar vitamina A inmediatamente después de su absorción.10
Existen múltiples formas del AR; sin embargo, el AR all-trans es el fisiológicamente más abundante.10,33,34 El AR sintetizado se une a la proteína celular de unión a ácido retinoico 2 (CRABP2) para ser llevado al núcleo; o bien, a la CRABP1 para su degradación por la CYP26A1 o CYP26C1.35 Cuando el AR es transferido al núcleo interactúa con el receptor de ácido retinoico (RAR) perteneciente a la superfamilia de receptores de hormonas nucleares.36,37 El RAR forma heterodímeros con el receptor X retinoide (RXR) para unirse a los elementos de respuesta al ácido retinoico (RARE) en el ADN.9,30,36 Este complejo se desempeña como un factor de transcripción a través del reclutamiento de correpresores o coactivadores para la regulación de más de 500 genes involucrados en el crecimiento y diferenciación celular.22,24,37 Cabe destacar, que además de ejercer funciones autocrinas, el AR puede ser liberado del citoplasma para desempeñar señalizaciones paracrinas35 (Figura 1).
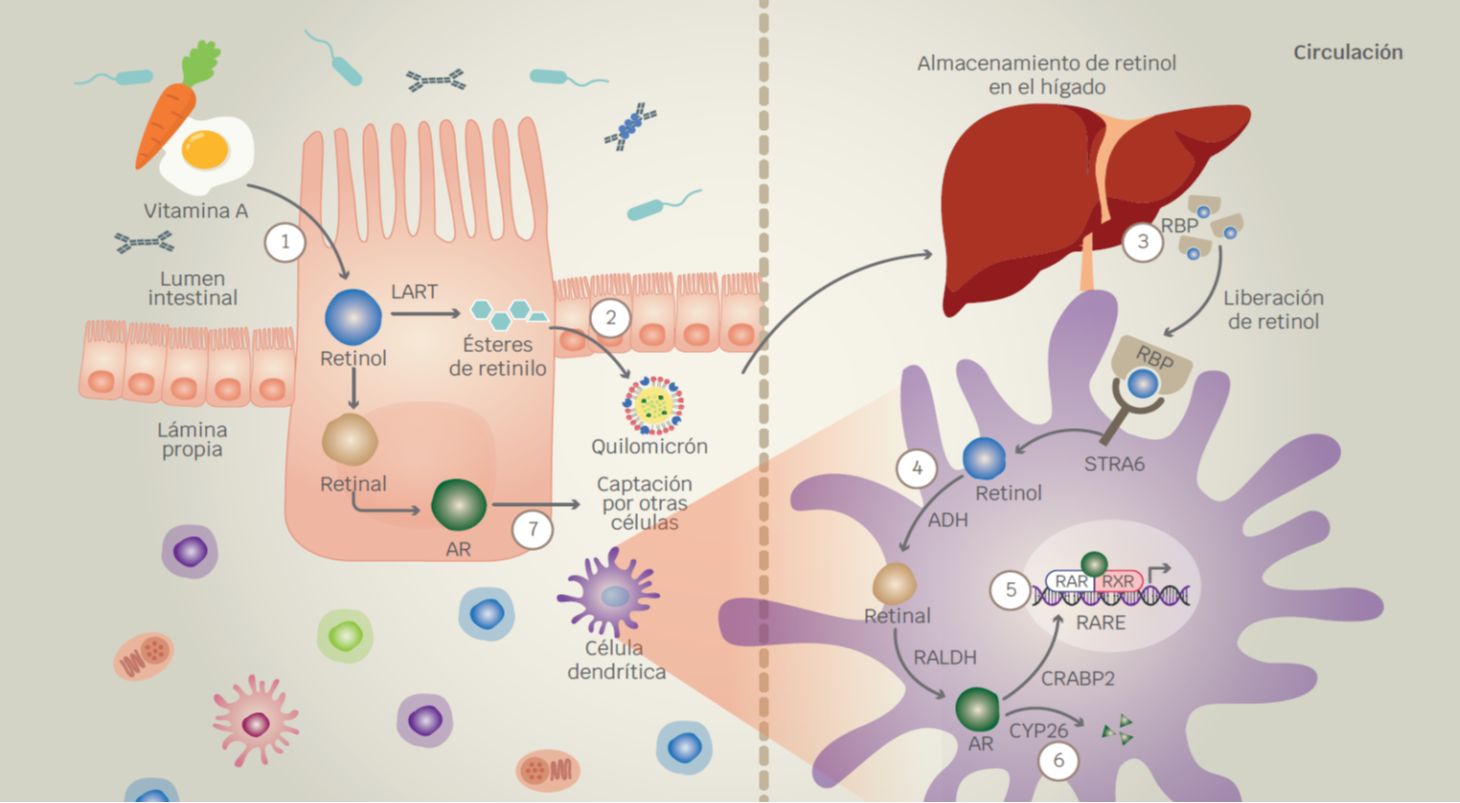
Figura 1 Metabolismo de la vitamina A y señalización del ácido retinoico. 1) La vitamina A proveniente de la dieta es absorbida en las células epiteliales del duodeno. La lecitina retinol aciltransferasa (LRAT) convierte a ambas clases de vitamina A en ésteres de retinilo. 2) Los lípidos apoyan la absorción de vitamina A y la formación de quilomicrones en donde los ésteres de retinilo son empaquetados para ser llevados a la circulación. 3) Los ésteres de retinilo son almacenados en las células estelares hepáticas. Posteriormente, los ésteres de retinilo son hidrolizados a retinol para incorporarse a la proteína de unión a retinol (RBP) y ser transportado a los tejidos periféricos. 4) La RBP es captada por la proteína estimulada por ácido retinoico 6 (STRA6). El retinol es liberado en el citoplasma y oxidado por la alcohol deshidrogenasa (ADH) para la formación de retinal. La siguiente reacción consiste en la oxidación del retinal por la retinal deshidrogenasa (RALDH) para la síntesis de ácido retinoico (AR). 5) El AR es llevado al núcleo por la proteína celular de unión a ácido retinoico 2 (CRABP2). Subsecuentemente, el AR se une al receptor de ácido retinoico (RAR) y forma un complejo con el receptor X retinoide (RXR). El complejo AR-RAR-RXR se une a los elementos de respuesta al ácido retinoico (RARE) en el ADN para la regulación de la transcripción de genes. 6) La concentración intracelular de AR es controlada por la CYP26A1 y la CYP26C1. 7) Los enterocitos son capaces de metabolizar vitamina A inmediatamente después de su absorción en donde inclusive el AR puede ser liberado y captado por otras células por mecanismos aún desconocidos.
Vitamina A e infecciones virales
Entre las funciones biológicas de la vitamina A, las más conocidas son aquellas relacionadas con la salud visual. No obstante, esta vitamina es esencial para el crecimiento, reproducción, diferenciación celular, mantenimiento de las barreras epiteliales y respuesta inmune.38 En 1928, los investigadores británicos Harry N. Green y Edward Mellanby identificaron que las ratas sometidas a una dieta deficiente de vitamina A fallecían por lesiones infecciosas; por lo tanto, denominaron a la vitamina A como un “agente antiinfectivo”.39 A pesar de los efectos prometedores de esta vitamina en la salud humana, la introducción de antibióticos en el tratamiento de infecciones en la década de los 40 detuvo el interés por esta línea de investigación.40 Cuarenta años después, luego de demostrarse en estudios epidemiológicos el papel de la vitamina A en la prevención de la mortalidad por infecciones y debido a la identificación de los receptores nucleares del AR, el interés por la investigación de sus efectos biológicos fue retomado.41
En 1932 se documentó por primera vez el efecto protector de la vitamina A en el sarampión; sin embargo, hasta 1987 la Organización Mundial de la Salud (OMS) reconoció su administración oral para el tratamiento de esta enfermedad.42 La suplementación con 200 000 unidades internacionales (UI) de vitamina A durante dos días consecutivos reduce 82 % el riesgo de mortalidad por sarampión en niños menores de dos años.42 Por otra parte, estudios en adultos han reportado que los pacientes con tuberculosis presentan una menor concentración sérica de retinol en comparación con sujetos sanos.43,44 Asimismo, la concentración sérica baja de retinol se asocia con la presencia de enfermedades infecciosas en adultos mayores.45 Desafortunadamente, las infecciones severas ocasionan un incremento en la excreción de retinol a través de la orina y la depleción de su almacenamiento.46,47
Se ha documentado que los adultos en cuidados intensivos por neumonía pierden hasta tres veces la ingesta diaria recomendada (IDR) de vitamina A.41 De igual forma, la RBP se comporta como un reactante de fase aguda negativo, por lo que el transporte de retinol a los tejidos periféricos se ve comprometido durante los procesos infecciosos.41 Por lo tanto, a la vez que la deficiencia de vitamina A incrementa el riesgo de infecciones y mortalidad, también las infecciones por sí mismas disminuyen la concentración de retinol, por lo que existe una especie de círculo vicioso.48 En este sentido, debido a que las infecciones respiratorias se encuentran dentro de las principales causas de mortalidad a nivel mundial,49 se considera crucial la persistencia en la investigación de los efectos de la vitamina A en las enfermedades virales infecciosas, inclusive en aquellas relacionadas con virus emergentes como el SARS-CoV-2.
Epitelios y vitamina A
Los epitelios son tejidos conformados por una o varias capas de células similares que se encuentran unidas estrechamente. La epidermis, las glándulas y los órganos huecos como los tractos gastrointestinal, reproductor, urinario y respiratorio se constituyen de tejidos epiteliales.50 Estos tejidos tienen distintas funciones que dependen de su morfología y ubicación; sin embargo, se caracterizan principalmente por estar involucrados en procesos de secreción, absorción y protección.51,52 En relación con la función de protección, debido a que los tejidos epiteliales están altamente expuestos a los patógenos ambientales, los epitelios son cruciales en la defensa del huésped.50
El epitelio del tracto respiratorio es fundamental como primera línea de defensa en contra de patógenos de transmisión por vía aérea. La protección es efectuada combinadamente por células secretoras y ciliadas.18 Además de la producción de péptidos antimicrobianos, las células secretoras producen moco para la captura de patógenos que con apoyo de las células ciliadas llevan a la expulsión de los microorganismos del tracto respiratorio. Asimismo, las células epiteliales son capaces de regular la respuesta inmune.18,53 La activación de las células del epitelio incluyen la generación de moléculas antivirales y citocinas proinflamatorias que reclutan y activan a células de la respuesta innata, a la vez que inician la inmunidad adaptativa.18 La vitamina A ejerce un papel crucial en la queratinización, diferenciación y maduración de las células epiteliales. Además, promueve la secreción de mucinas. Por lo tanto, la vitamina A es esencial para el mantenimiento de la integridad de los tejidos epiteliales.54 Se ha reportado que la deficiencia de vitamina A ocasiona metaplasia escamosa en donde las células ciliadas son sustituidas por epitelio escamoso.41 Estos cambios impactan negativamente en la producción de moco; por lo tanto, la deficiencia de vitamina A disminuye la resistencia a infecciones. De igual forma, la activación de células inmunes residentes como macrófagos, neutrófilos, células asesinas naturales (NK), así como la respuesta de anticuerpos son mermadas por la deficiencia de vitamina A.41,46
Inmunidad adaptativa: linfocitos B y anticuerpos
La inmunidad adaptativa es fundamental y actúa complementariamente en la eliminación de agentes infecciosos cuando la inmunidad innata es incapaz de hacerlo.55 Una de las funciones principales de la respuesta inmune adaptativa es la generación de una respuesta efectora específica de patógenos a los que el huésped previamente fue expuesto. Las células inmunes que ejercen esta acción son los linfocitos T y linfocitos B.55 Los linfocitos B se clasifican en células B1 y B2. Las células B1 producen anticuerpos sin ayuda de los linfocitos T. Por otro lado, las células B2 necesitan de la cooperación de los linfocitos T debido a que las citocinas (IL-4, IL-5, IL-6 e IL-10) y la interacción de CD40 con CD40L son necesarias como estímulos para la secreción de anticuerpos.56 Cuando los linfocitos B2 son activados por la presencia de un antígeno extraño, estos proliferan y se diferencian en células B de memoria o en células plasmáticas secretoras de anticuerpos, también conocidos como inmunoglobulinas (Ig).55 En particular, la inmunidad efectuada por los linfocitos B se conoce como respuesta inmune humoral.57 A pesar de que las células plasmáticas tienen relativamente una vida corta, estas producen una cantidad considerable de anticuerpos que entran a la circulación y a los tejidos; por lo tanto, son sumamente necesarios para la protección contra agentes patógenos, puesto que favorecen la eliminación de microorganismos extracelulares y evitan la propagación de las infecciones intracelulares.55,57,58
Existen cinco isotipos principales de anticuerpos (IgA, IgD, IgE, IgG e IgM), dentro de los cuales, algunos se dividen en subclases.55 Los anticuerpos, protegen al huésped por medio de tres maneras principales: 1) neutralización, los anticuerpos interfieren en la adherencia de los patógenos con las células huésped; 2) opsonización, los anticuerpos recubren a los patógenos y facilitan que las células fagocíticas puedan internalizarlos y eliminarlos; 3) activación del complemento, las proteínas que conforman el sistema del complemento potencian la opsonización. Asimismo, el complemento a través del complejo de ataque a la membrana se encarga de la lisis de patógenos.58
La mayoría de la respuesta de anticuerpos requiere la participación de células T. Como se mencionó previamente, algunos linfocitos B se diferencian a células plasmáticas de vida corta; sin embargo, algunos establecen un centro germinal en donde las células B pasan de producir IgM e IgD a otros isotipos como IgG, IgE e IgA a través de un proceso denominado cambio de clase.59 Las células B de memoria se desarrollan en los centros germinales y son necesarias para la producción de anticuerpos de haber reinfección.57 Por otra parte, las células B1 que producen principalmente IgM también pueden experimentar un cambio de clase a células B secretoras de IgA; este cambio de clase ocurre en la lámina propia.56 Cabe señalar, que la IgA es la segunda Ig más abundante en circulación luego de la IgG; sin embargo, la IgA es el isotipo predominante en las secreciones y en el tracto respiratorio superior.60 Por lo tanto, la IgA es esencial para la protección de las superficies mucosas de los epitelios.56,61
Inmunoglobulina A
La IgA se divide en dos subclases (IgA1 e IgA2)56 y predomina principalmente en las secreciones externas de las superficies mucosas. Se estima que el ser humano produce diariamente ~65 mg de IgA por kg de peso corporal.62 Existen múltiples formas moleculares de la IgA; sin embargo, la forma principal en el suero humano es la monomérica, 90 % IgA1 y 10 % de IgA2. En contraste, la principal forma molecular de la IgA en las superficies de las mucosas epiteliales es dimérica y se le conoce como IgA secretora (sIgA). Aunque depende de la ubicación de la mucosa, la distribución de la sIgA es más balanceada en estos tejidos con 40 % de IgA1 y 60 % de IgA2.63
La sIgA se conforma por dos monómeros de IgA que están unidos covalentemente por un polipéptido conocido como cadena J. Este polipéptido es expresado por células productoras de anticuerpos y es incorporado a las IgA antes de su secreción.64 La IgA dimérica es producida localmente en los tejidos linfoides asociados con las mucosas (MALT). Estos tejidos están distribuidos estratégicamente en múltiples regiones de las superficies mucosas.65 El mecanismo de secreción de IgA en el tejido linfoide asociado con el intestino (GALT) es el mayormente descrito. El GALT se encuentra constituido por células M, áreas de células T, folículos de células B y DC.65 La producción de anticuerpos en este tejido ocurre de forma similar que en los órganos linfoides secundarios; sin embargo, a diferencia de estos órganos, el microambiente de los MALT promueve la generación de células B productoras de IgA dimérica, las cuales migran a la lámina propia.65 En la vía de producción de anticuerpos dependiente de células T, las células M asociadas con las placas de Peyer capturan y transfieren patógenos desde el lumen a las DC.66 Las DC migran a las regiones interfoliculares de las placas de Peyer para establecer interacciones con células T CD4+ con el propósito de generar células T cooperadoras foliculares (Tfh).66,67,68 Subsecuentemente, las Tfh arriban a los bordes de los centros germinales en donde interactúan con linfocitos B vírgenes IgM+ a través de MHC-TCR y CD40-CD40L. Asimismo, las Tfh producen factor de crecimiento transformante beta (TGF-β), IL-21 y proteína programada 1 de muerte celular (PD-1), mientras que las DC producen IL-6 y AR. Estos estímulos permiten el cambio de clase de IgM a IgA y, por lo tanto, la generación de células B de memoria y células plasmáticas productoras de IgA que se establecen en la lámina propia.66,67,69
Por otra parte, en la respuesta independiente de linfocitos T, las DC de los folículos linfoides aislados capturan patógenos y producen TGF-β, así como factor activador de células B (BAFF) y ligando inductor de la proliferación (APRIL), las cuales son citocinas reguladoras de la supervivencia y diferenciación de linfocitos B.66 Esto permite la generación de células B IgA+ que se alojan en la lámina propia, las cuales son aptas de diferenciarse en células plasmáticas productoras de IgA.67 Actualmente, se reconoce que las DC de la lámina propia inducen la síntesis de IgA de forma dependiente del AR en presencia de IL-6;31,70 sin embargo, también es necesaria la participación de una subpoblación de DC (CX3CR1) productoras de BAFF y APRIL.67 A pesar de que no está del todo dilucidado, se ha propuesto que esto ocurre de forma semejante en el epitelio del tracto respiratorio, específicamente en el tejido linfoide submucoso de las vías respiratorias superiores, el cual es denominado tejido linfoide asociado con la nariz (NALT).56 Además, el tejido linfoide asociado con los bronquios (BALT) es el MALT que recubre el tracto respiratorio inferior. El BALT está ausente en los humanos; sin embargo, en su lugar se ha descrito el BALT inducible (iBALT), un tejido linfoide ectópico del tracto respiratorio que se forma en respuesta a las infecciones. El iBALT, al igual que el NALT, también es capaz de iniciar una respuesta de células plasmáticas productoras de IgA con apoyo de las DC.71
El receptor de inmunoglobulina polimérico (pIgR) es un receptor polipeptídico con una porción extracelular de ~620 aminoácidos que se encarga de mediar las funciones de la sIgA.72 El pIgR se expresa en la superficie basolateral de las células epiteliales y participa en el transporte de la IgA desde la lámina propia hasta la superficie apical del epitelio a través de un proceso denominado transcitosis. Durante este proceso, el pIgR es escindido para liberar un fragmento conocido como componente secretor (SC) que se asocia con la IgA dimérica a través de puentes disulfuro.63,73 Si bien el SC no le confiere ninguna función biológica de relevancia a la IgA, este sirve de protección contra la degradación proteolítica.73 Una vez que este complejo (IgA dimérica y SC) se establece en la mucosa es denominado sIgA.63 La sIgA se desempeña como una barrera que interfiere la adherencia de microorganismos con los epitelios de las superficies mucosas, proceso conocido como exclusión inmune.56,61 Se ha propuesto que la IgA puede neutralizar patógenos durante su transporte intracelular. Asimismo, la IgA puede llevar a los patógenos a ser fagocitados por macrófagos de las vías respiratorias.56
Generalmente, se ha propuesto que el AR actúa en el desarrollo y diferenciación de células B por medio de la regulación de la expresión de factores de transcripción.74 La proteína de caja pareada 5 (Pax5), proteína 6 del linfoma de células B (BCL-6) y proteína de maduración inducida por los linfocitos B 1 (BLIMP-1), son algunos de los factores de transcripción influenciados por la concentración de AR.74 Además, también se ha sugerido que el AR facilita la hipermutación somática y el cambio de clase al aumentar la expresión de la citidina deaminasa inducida por activación (AID).75 De acuerdo con la evidencia observada principalmente en modelos experimentales, el AR también favorece la formación de centros germinales por medio del aumento de la expresión de CD40 en DC y potencia la eficiencia de las DC foliculares en el proceso de selección de linfocitos B de alta afinidad.74,75,76,77
Rol de la vitamina A sobre la producción de inmunoglobulina A
Con base en los resultados de estudios epidemiológicos que identificaron que la deficiencia de vitamina A incrementa la susceptibilidad a infecciones, se comenzaron a realizar una serie de investigaciones para determinar la relación entre estas variables. En 1979, Sirisinha, et al.78 realizaron un estudio en ratas de la cepa Wistar, las cuales fueron sometidas a una dieta deficiente de vitamina A. El estudio se basó en que, en un estudio previo, este mismo grupo de investigadores habían identificado que los niños con desnutrición proteico-calórica exhibían niveles reducidos de sIgA.79 Las ratas con deficiencia de vitamina A presentaron un menor porcentaje de IgA en muestras intestinales en comparación con el grupo control. Por lo tanto, los autores concluyeron que la deficiencia de vitamina A podría incrementar la susceptibilidad a infecciones de las superficies mucosas debido a un sistema inmune local defectuoso.78 Posteriormente, Davis, et al.80 introdujeron una dieta deficiente de vitamina A en pollos de engorde. A las dos semanas de edad, los pollos fueron inoculados vía intranasal e intraocular con el virus de la enfermedad de Newcastle (un virus mortal en aves). Luego de esto, los pollos fueron suplementados con retinol o AR. Los pollos suplementados con AR mostraron una mayor concentración de IgA en muestras biliares en comparación con los pollos suplementados con retinol.80
De igual forma, Wiedermann, et al.,81 demostraron que las ratas Wistar con una dieta deficiente de vitamina A e inmunizadas con toxinas del cólera desarrollaron menos IgA y células productoras de IgA en muestras de bilis y suero en comparación con las ratas con una dieta control. Igualmente, observaron un menor número de células productoras de IgA en los ganglios linfáticos mesentéricos en las ratas con deficiencia de vitamina A. Debido a que la IgA biliar llega a la mucosa intestinal en forma de sIgA, los autores concluyeron que la ingesta insuficiente de esta vitamina impacta principalmente en la sIgA.81 Este resultado fue replicado por el mismo grupo de investigadores en otro estudio. En donde, además las ratas Wistar deficientes de vitamina A presentaron una menor producción de IgG e IgM dependiente de células T. Estos resultados, llevaron a la conclusión de que la insuficiencia de vitamina A afecta el cambio de clase.82 Por su parte, Morikawa, et al.83 en un cultivo de células B de amígdalas humanas identificaron que hay un incremento considerable en células B CD38 estimuladas con AR. Debido a que la expresión de CD38 es utilizado como un marcador de la diferenciación de linfocitos, los autores concluyeron que el AR podría acelerar la diferenciación de células B en células productoras de anticuerpos.83
Con base en estos antecedentes, Surman, et al.84 decidieron enfocar sus investigaciones a la mucosa del tracto respiratorio. En este estudio, Surman, et al. inocularon a ratones C57BL/6 que previamente habían sido sometidos a una dieta deficiente de vitamina A. La inmunización fue por vía intranasal con el virus Sendai (virus respiratorio que afecta a roedores). Los ratones fueron sacrificados un mes después y se obtuvieron las muestras de lavados y tejidos nasales y bronco alveolares. Los ratones con la alimentación deficiente de vitamina A presentaron una menor concentración de IgA y de células productoras de IgA tanto en los lavados nasales como en el NALT en comparación con los ratones con dieta control. Por lo tanto, los autores concluyeron que la deficiencia de vitamina A no afecta la respuesta de anticuerpos exclusivamente en el intestino, sino que también está implicada en la producción de IgA en el tracto respiratorio superior.84
Un par de años más tarde, con base en las características similares que comparten el tracto gastrointestinal y el tracto respiratorio, Rudraraju et al.85 realizaron un estudio in vitro e in vivo. En este estudio, se aislaron células de los tractos respiratorios de ratones C57BL/6, en donde se identificó que las DC del tracto respiratorio superior expresan ARNm de la RALDH. Asimismo, se reportó que las células epiteliales del tracto respiratorio superior e inferior expresan la proteína RALDH. Por otra parte, Rudraraju et al.,85 demostraron que las células epiteliales activadas con LPS y estimuladas con retinol y en presencia de DC, incrementan considerablemente la producción de IgA. Por último, estos autores también reportaron que la producción de IgA en cultivos de una línea de células epiteliales del tracto respiratorio en presencia de retinol disminuye cuando se adicionan inhibidores de la IL-6 y del GM-CSF. Por lo tanto, los autores concluyeron que la producción de IgA in vivo en el tracto respiratorio es parcialmente dependiente de la vitamina A en presencia de IL-6 y GM-CSF, aunque es probable que aún existan más factores sin identificar que contribuyen en la mejora de la respuesta de anticuerpos IgA85 (Figura 2).
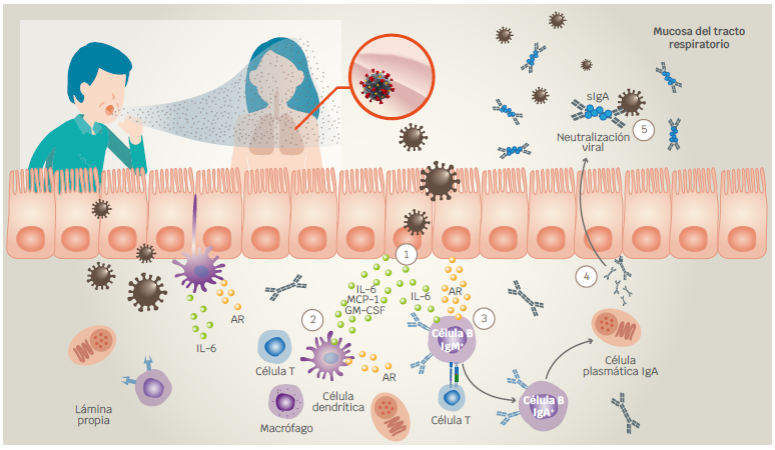
Figura 2 Hipótesis de Rudraraju et al. sobre la inducción de la producción de IgA mediada por células epiteliales en el tracto respiratorio superior. 1) Las células epiteliales del tracto respiratorio reaccionan en contra de patógenos. Debido a que estás células expresan retinal deshidrogenasa (RALDH), su activación conlleva al incremento del metabolismo de vitamina A. 2) Asimismo, la activación de células epiteliales incluye la producción de la proteína quimioatrayante de monocitos 1 (MCP-1), factor estimulante de colonias de granulocitos (GM-CSF) e IL-6, lo que conduce al reclutamiento de células inmunes en el epitelio del tracto respiratorio. La maduración de células dendríticas incrementa el metabolismo de vitamina A. 3) La interacción entre células B y T con apoyo de la IL-6 producida probablemente por células epiteliales, células dendríticas y células T, impulsan la producción de células B IgA+. 4) La diferenciación de células plasmáticas productoras de IgA secretan IgA dimérica para su transcitosis al lumen del tracto respiratorio. 5) La IgA dimérica en su forma secretora (sIgA) se encarga de neutralizar a los patógenos y por lo tanto de prevenir las infecciones respiratorias.
Con base en los resultados anteriores, Surman et al.,86 a través de un modelo en ratón con deficiencia de vitamina A e inoculados con una variante del virus de la influenza, demostraron que la suplementación oral con AR o palmitato de retinilo mejora la concentración de IgA y el número de células productoras de IgA en lavados nasales en comparación con los ratones que no fueron suplementados.86 De igual forma, la aplicación intranasal de retinol o palmitato de retinilo 15 min después de la inoculación de los ratones con el virus Sendai y con deficiencia de vitamina A, mostró resultados positivos en la generación tanto de IgA como de células productoras de IgA en lavados nasales en comparación con los ratones con deficiencia de vitamina A que no recibió ningún tipo de suplementación. Sin embargo, la vitamina A en forma de palmitato de retinilo tuvo efectos más notables puesto que el retinol tiene un comportamiento inestable. Los autores concluyeron que la respuesta de IgA en la mucosa en ratones deficientes de vitamina A puede corregirse tras una dosis única por vía intranasal de vitamina A.87
A pesar de estos resultados prometedores en modelos experimentales, los estudios clínicos en humanos muestran resultados inconclusos. En particular, un estudio en infantes concluye que la suplementación con vitamina A mejora la respuesta inmune solamente en niños con deficiencia de esta vitamina al momento de la vacunación contra la influenza.88 No obstante, debido a la alta deficiencia de vitamina A, sobre todo en países en vías de desarrollo y a la falta de estudios en personas adultas, se sugiere continuar con la exploración de esta línea de investigación con el fin de determinar las dosis adecuadas en humanos para mejorar la respuesta inmune. Uno de los estudios más recientes indica que la concentración de RBP se correlaciona positivamente con los títulos de IgA (r = 0.47, p = 0.0009) y con los anticuerpos neutralizantes (r = 0.52, p = 0.015) en muestras de suero de pacientes con antecedentes de influenza.89 En este sentido, bajo el argumento de que la IgA tiene una función crucial en la protección viral de las mucosas como la del tracto respiratorio, es recomendable realizar ensayos clínicos que tengan como propósito corregir la deficiencia de vitamina A para la prevención de infecciones respiratorias y para mejorar la eficacia de las vacunas.
Deficiencia de vitamina A y recomendaciones
Los grupos más vulnerables que presentan deficiencia de vitamina A, especialmente en países en vías de desarrollo, son los niños menores de 5 años y las mujeres embarazadas o en periodo de lactancia.38 No obstante, la deficiencia de esta vitamina es un problema de salud pública mundial en donde inclusive, se ha reportado que más del 20 % de las poblaciones de países desarrollados no satisface la IDR de vitamina A.46 Algunos de los reportes más recientes indican que la ingesta promedio de vitamina A en la población adulta china es de 307.2 μg de equivalentes de actividad de retinol (RAE).90 Similar, el consumo de vitamina A en Corea es de 531.84 ± 226.42 μg RAE.91 Por otra parte, las poblaciones de países occidentales como México también han presentado ingestas en promedio deficientes de vitamina A (553.1 ± 352.3 μg RAE), en donde solamente el 40 % de la población adulta satisface la IDR.92 De acuerdo con un reporte reciente en donde se evaluó la ingesta de micronutrimentos en pacientes mexicanos positivos a SARS-CoV-2, se reportó que ~55 % tiene una ingesta insuficiente de vitamina A.93 Asimismo, aunque países como Estados Unidos han implementado programas de fortificación de alimentos con vitamina A, uno de los reportes más recientes indican que la población estadounidense consume en promedio 639.36 ± 7.45 μg RAE.94 En el caso de otros países como España y Australia, la ingesta promedio de vitamina A es de 716.4 μg de equivalentes de retinol (RE)95 y 815 μg RE,96 respectivamente; sin embargo, de acuerdo con la actualización más reciente, los RE ya no se utilizan debido a que se determinó que la actividad de retinol que proviene de los carotenoides es la mitad de lo que se creía anteriormente.97 Por lo tanto, la ingesta de vitamina A reportada por España y Australia en RAE es menor.
La principal causa de deficiencia de vitamina A es la ingesta insuficiente.98 Aun así, existen otros factores de relevancia especialmente en países de ingresos bajos. Por ejemplo, las infecciones gastrointestinales y la diarrea afectan la absorción de vitamina A.99 Por otro lado, aunque en países desarrollados también puede haber una ingesta insuficiente de vitamina A, las principales causas de deficiencia son la enfermedad inflamatoria intestinal, enfermedad hepática crónica y la insuficiencia pancreática. Estas enfermedades afectan la absorción de los ésteres de retinilo ya sea por una disminución en la producción de ácidos biliares o de hidrolasas.99 De igual forma, la ingesta insuficiente de lípidos y el consumo excesivo de alimentos procesados impactan negativamente la absorción de las fuentes de vitamina A.97 Además, debido a que el retinol y el etanol son alcoholes, el consumo alto de bebidas alcohólicas puede interferir en el metabolismo de la vitamina A.97 En contraste, se ha sugerido que la ingesta adecuada de zinc es necesaria para la síntesis de la RBP y por lo tanto para el transporte de retinol. Asimismo, se ha propuesto que este elemento traza participa en el metabolismo del retinol debido a que es cofactor de la ADH.97,100
Entre las manifestaciones clínicas más comunes de la deficiencia de vitamina A, la ceguera nocturna es la principal; sin embargo, debido a la diversidad de funciones biológicas de los metabolitos de esta vitamina, su deficiencia también puede ocasionar xeroftalmia y metaplasia que incrementa la susceptibilidad de las infecciones de los tejidos epiteliales de las mucosas.46 El biomarcador del estado de vitamina A considerado el estándar de oro es la reserva hepática. Este análisis consiste en un método de dosis-respuesta en donde se administra acetato de vitamina A2 junto con un refrigerio lipídico. Luego de un periodo de 4 a 7 horas se obtiene una muestra de suero para su análisis por cromatografía líquida de alta eficacia.101 Sin embargo, debido a las dificultades principalmente de factibilidad, la determinación de retinol o el análisis de la RBP4 como sustituto del retinol, son los indicadores más utilizados para la cuantificación de las concentraciones séricas de vitamina A.102
De acuerdo con la OMS, el punto de corte de deficiencia de vitamina A es una concentración sérica o plasmática de retinol < 0.70 µmol/L (< 20 µg/dL), mientras que el punto de corte de deficiencia severa es una concentración < 0.35 µmol/L (10 µg/dL).98 En el caso de la RBP4, no existe un punto de corte establecido aunque puede obtenerse a partir de un análisis de regresión lineal. Debido a que la RBP4 se encuentra en una concentración 1:1 con el retinol, es común su utilización como biomarcador de suficiencia de vitamina A. Además, la RBP4 es más estable a la luz y fácil de determinar por su estructura proteica.103 A pesar de la factibilidad de la RBP4 para la determinación del estado de vitamina A, se deben considerar factores que pueden alterar su concentración como la obesidad, en donde los adipocitos incrementan la síntesis de RBP o los procesos de infección puesto que la RBP4 actúa como un reactante de fase aguda negativo.101
Como se abordó anteriormente, la vitamina A se encuentra en los alimentos ya sea como vitamina A preformada o provitamina A. Las fuentes alimentarias principales de vitamina A preformada son el hígado de res y el aceite de hígado de bacalao.104 De acuerdo con información del Departamento de Agricultura de los Estados Unidos (USDA), el consumo de 85 g de hígado de res contiene 6582 μg RAE, mientras que una cucharada pequeña de aceite de hígado de bacalao suministra 1350 μg RAE.104,105 Otras fuentes importantes de vitamina A preformada son los huevos y los lácteos y cereales fortificados.22
Por otro lado, la provitamina A que corresponde a los carotenoides (Cuadro 1) se encuentra en las verduras de color amarillo y naranja (zanahorias, calabazas y camote), así como en las frutas no cítricas de estos mismos colores (mangos y papayas), de igual forma, los carotenoides se encuentran en vegetales de hoja verde (espinacas y brócoli).22,105,106 Conforme al Consejo de Alimentación y Nutrición (FNB) del Instituto de Medicina (IOM) de Estados Unidos, la IDR de vitamina A para hombres mayores a 19 años es de 900 μg RAE por día. En el caso de las mujeres, la IDR es de 700 μg RAE por día para aquellas mayores de 19 años, mientras que para las mujeres mayores de 19 años embarazadas y en periodo de lactancia la IDR es de 770 μg RAE y 1300 μg RAE, respectivamente.104,105 Con base en estudios previos sobre anormalidades hepáticas en humanos, se identificó que las dosis superiores a 14 000 μg RAE/día causan hepatotoxicidad, esto permitió establecer los niveles máximos de ingesta tolerables (UL) de vitamina A que corresponden a 3000 μg RAE/día.97 De ser necesaria la suplementación por riesgo de deficiencia en la población adulta sana, la suplementación diaria con 800 a 1500 μg RAE puede ser de ayuda para regular las concentraciones recomendadas de vitamina A y para mejorar la respuesta inmune.38
Cuadro 1 Equivalencia nutrimental de los carotenoides
| Consejo Nacional de Investigación (NRC, 1989) | Instituto de Medicina (IOM, 2001)* |
| 1 μg RE | 1 μg RAE |
| = 1 μg de retinol | = 1 μg de retinol |
| = 2 μg de β -caroteno suplementario | = 2 μg de β -caroteno suplementario |
| = 6 μg de β -caroteno en alimentos | = 12 μg de β -caroteno en alimentos |
| = 12 μg de α -caroteno y β -criptoxantina | = 24 μg de α -caroteno y β -criptoxantina |
*Unidad nutrimental actual de vitamina A. 1 μg RAE = 3.33 unidades internacionales (UI).106
A pesar de lo anterior, se debe poner atención en no rebasar los UL especialmente en adultos sanos puesto que además de ocasionar toxicidad, la ingesta excesiva de vitamina A tiene efectos teratogénicos.22 En contexto con COVID-19, Midha, et al., proponen la suplementación con vitamina A como una posible intervención terapéutica. Estos autores proponen megadosis de hasta 90,000 a 150 000 μg RAE para pacientes con enfermedad severa durante la fase crítica de COVID-19. Por otra parte, en pacientes con enfermedad leve, sugieren la suplementación recomendada para niños con deficiencia que corresponde a 60 000 μg RAE durante dos días consecutivos. Finalmente, como tratamiento profiláctico se sugiere alcanzar la IDR.9
Conclusiones
La investigación de los efectos de la vitamina A sobre la producción de sIgA en el tracto respiratorio se encuentra mayormente en fase preclínica. Sin embargo, algunos estudios epidemiológicos indican que la deficiencia de vitamina A se asocia con mayor mortalidad por infecciones. En este sentido, con base en los efectos inmunomoduladores atribuidos al AR, resaltamos la imperante necesidad de realizar ensayos clínicos para determinar el efecto de esta vitamina sobre la producción de anticuerpos después de una inmunidad natural o artificial.
Debido a la limitada eficacia de los fármacos actuales propuestos para el tratamiento de COVID-19, es importante considerar el potencial de los inmunonutrientes como terapia coadyuvante contra esta enfermedad. La vitamina A podría tener un impacto positivo como tratamiento profiláctico y en la inmunización por vacunas. Por lo tanto, en espera de ensayos clínicos, la recomendación se mantiene en asegurar la suficiencia de vitamina A ya sea a través de la alimentación o suplementación.











 nueva página del texto (beta)
nueva página del texto (beta)



