Antecedentes
En la práctica clínica, es necesario mantenerse al día, a fin de mejorar o mantener la calidad de la atención de los pacientes que habitualmente se tratan. Este proceso de actualización incluye, además de los cursos de educación médica continua, la lectura crítica de estudios clínicos de investigación publicados, en los cuales se describe la capacidad diagnóstica de nuevos métodos, la evaluación de tratamientos, así como el reconocimiento de factores pronósticos o de factores de riesgo. Generalmente, en estos estudios de investigación se utilizan análisis estadísticos para informar los resultados, sin embargo, frecuentemente (por la falta de capacitación) los médicos clínicos no los comprenden, por lo cual se evita leer el apartado de resultados, incluyendo las tablas o gráficas, y solamente se enfocan a las conclusiones.
Una parte fundamental de la medicina basada en evidencias es que los clínicos puedan analizar críticamente los estudios de investigación, para que determinen la conveniencia de incorporar sus resultados a los pacientes que atienden.1 Este análisis incluye interpretar los resultados de las investigaciones, así como tener la capacidad de anticipar si la incorporación de esa información logrará beneficiar a sus pacientes. Al respecto, desde hace años se ha reconocido que cuando se presentan resultados “estadísticamente significativos” (generalmente basados en valores de p < 0.05), quienes no son expertos en estadística los toma como verdaderos y entonces los aplican en sus pacientes, esperando observar los mismos efectos que se señalan en las investigaciones; sin embargo, se tiene que reconocer que no necesariamente tienen ese significado.
Por esta razón, como parte del aprendizaje de la medicina basada en evidencias, se ha establecido que para tratar de aplicar los hallazgos de la investigación en la clínica tienen mayor utilidad las medidas de efecto, como el riesgo relativo (RR), la razón de momios (RM) y el número necesario por tratar (NNT), porque será más fácil trasladar la información a un paciente en particular. 1,2
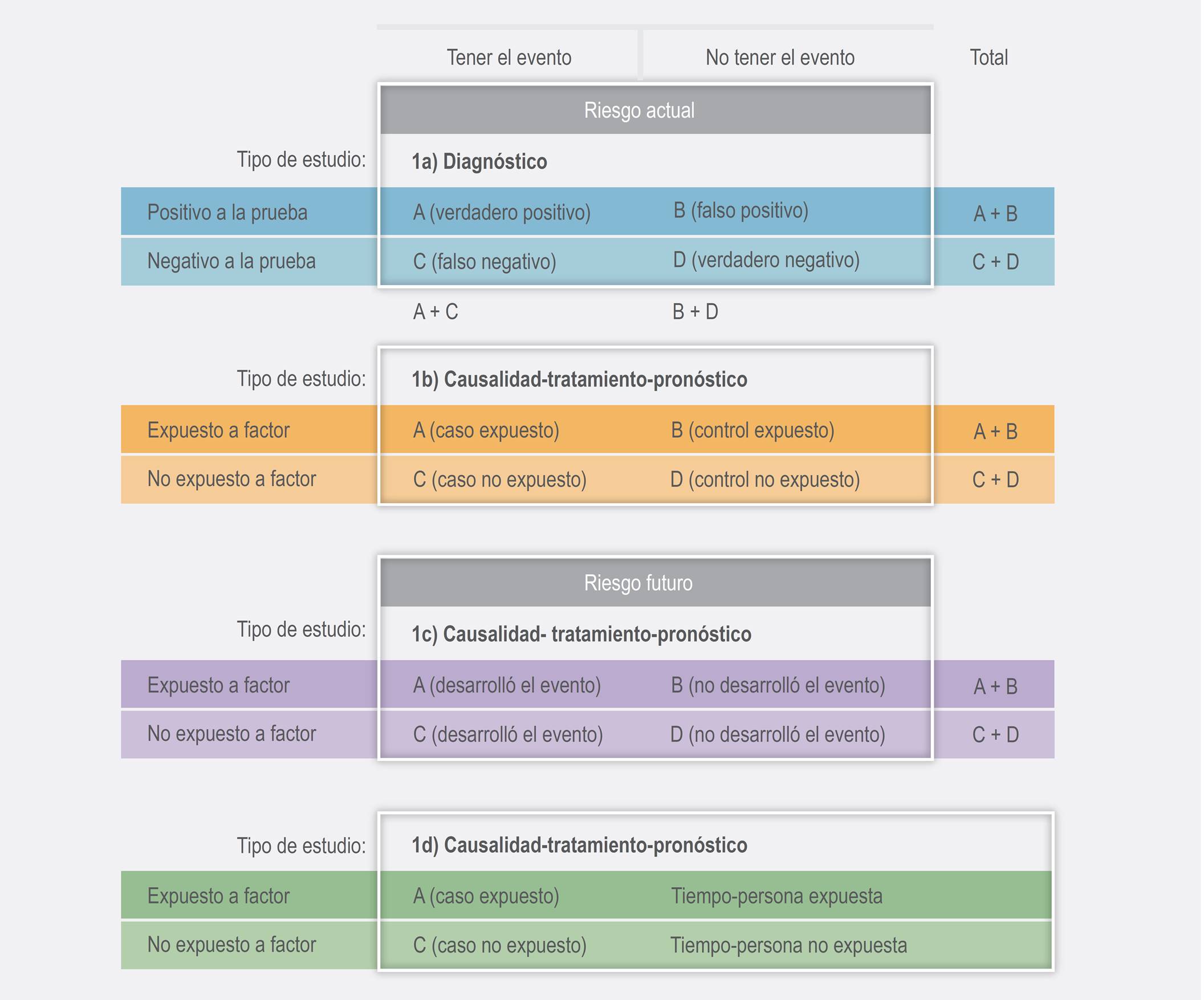
Partiendo de que, en el ámbito clínico, los ejes de la atención son el diagnóstico, tratamiento, pronóstico y la búsqueda de factores de riesgo para el desarrollo de enfermedades, este artículo tiene como objetivo mostrar, mediante ejemplos, los conceptos necesarios para la compresión y uso de las medidas de riesgo, de asociación y de impacto. Para hacer el discurso más amigable, en los ejemplos se trató de evitar la utilización de fórmulas, las cuales pueden ser consultadas en textos especializados,1,3 pero también están sintetizadas en la Figura 1.
Medidas de riesgo y asociación1,3,4,5
Como parte del proceso de atención de cualquier paciente, los médicos buscan conocer si una persona tiene o no una enfermedad (proceso diagnóstico), si es posible tomar medidas para revertir el problema (ofrecer tratamiento), o bien, prever el desenlace a futuro (pronosticar qué le sucederá al paciente, como la curación). En estos dilemas, los médicos lidian con cierto grado de incertidumbre, misma que definimos como “riesgo”. Al respecto, la Real Academia de la Lengua Española define el riesgo como “contingencia o proximidad a un daño”; precisamente, la condición en la atención médica implica esto. Prácticamente, la forma de estimar el riesgo es a través de probabilidades, las cuales pueden ser emitidas por el método frecuentista (porcentaje o número de veces que sucede un evento, dividido entre el número de intentos) o bayesiano (percepción o proporción de veracidad).6 Debido a que la forma frecuentista es la más usada en la literatura médico-científica, es la que se presentará a continuación.
Existen dos formas de analizar el riesgo en los estudios: riesgo actual y riesgo futuro. El riesgo actual implica que las personas ya tienen la condición no deseada, pero la ignoran. Los estudios para determinar este riesgo se conocen como “de pruebas diagnósticas”. En estos estudios se calcula la capacidad de una prueba diagnóstica, mediante la sensibilidad y la especificidad, que se definen como la proporción o porcentaje de enfermos positivos a una prueba (sensibilidad) y la proporción o porcentaje de sujetos sanos negativos a la prueba (especificidad), Cuadro 1.
Cuadro 1. Medidas de riesgo y fórmulas de cálculo
| Nombre | Fórmula | Unidad | |
| Riesgo actual | |||
| Figura 1a | Prevalencia | Número de casos con la condición/total de personas | Casos por cantidad preestablecida (cien, mil, millón...) |
|
| |||
| Figura 1a | Sensibilidad | Número de positivos a una prueba/total de enfermos analizados | Porcentaje |
|
| |||
| Figura 1a | Especificidad | Número de negativos a una prueba/total de sano o controles sin la enfermedad | Porcentaje |
|
| |||
| Riesgo futuro | |||
| Figura 1c | Incidencia acumulada (riesgo absoluto) | Número de eventos nuevos en un periodo preestablecido/población ingresada a un estudio | Porcentaje (acepta otras unidades de población: mil, etcétera) |
|
| |||
| Figura 1d | Densidad de incidencia(riesgo absoluto) | Número de eventos nuevos/sumatoria del tiempo aportado por cada individuo al inicio del estudio. | Eventos por tiempo-persona(por ejemplo, días-persona) |
|
o | |||
• Ejemplo: En un estudio llevado a cabo por Santos et al.7 se determinó que la sensibilidad de la prueba de activación de basófilos para establecer alergia a cacahuates fue de 97.6 %, es decir, 42 de sus 43 pacientes con alergia al cacahuate fueron positivos a la prueba. Mientras que la especificidad se estableció en 96.7 % (59 de 61 sujetos sin alergia fueron negativos). En este mismo estudio, el riesgo en esta población de ser alérgico (prevalencia) al cacahuate fue de 41.3 % (43/104), lo cual indicó que, independientemente de si una prueba fuera positiva o negativa, el riesgo en el momento de tener alergia al cacahuate en ese grupo era de 41.3 % (Figura 1).
Por otro lado, el riesgo a futuro se refiere a la probabilidad de una persona para desarrollar algún evento a un tiempo previamente definido. Este riesgo se utiliza en estudios de tratamiento y pronóstico, y se calcula como la proporción ajustada por tiempo, por lo cual se denomina tasa de incidencias. Existen dos formas de estimar esta tasa: incidencia acumulada y densidad de incidencia (Cuadro 1). La tasa de incidencia acumulada analiza el riesgo del evento en personas que están expuestas a uno o más factores, con la suma de todos los eventos ocurridos en un periodo predeterminado de tiempo, pero sin tomar en cuenta el momento exacto de su ocurrencia. Por su parte, la densidad de incidencia analiza el número de eventos y el tiempo en que ocurren por individuo.
Cabe señalar que estas incidencias también se conocen como riesgo absoluto (RA) en los estudios en los cuales se buscan las causas de las enfermedades y en los estudios de pronóstico. Sin embargo, para los estudios de tratamiento el término acuñado ha sido tasa de eventos en el grupo experimental (TEE) o tasa de eventos en el grupo control (TEC).
• Ejemplo: Pei-Chia Lo et al.8 investigaron si el uso de medicina herbolaria reducía el riesgo de hospitalización de niños con asma. Encontraron que de una población de 1364 niños con asma que la utilizaron por más de 180 días al año, 68 fueron hospitalizados, es decir, tuvieron un RA o TEE (dado que es un estudio pronóstico) de 4.9 % al año.
Uno de los problemas de las dos tasas descritas es que solamente representan el riesgo de presentar o desarrollar un evento (una enfermedad, para los fines de este artículo), dentro de un grupo o población, pero no informan sobre el riesgo cuando no se encuentra en ese grupo. Por lo anterior, se disponen de los estimadores de asociación: diferencia de riesgos, RR y RM (Cuadro 2).
Cuadro 2. Medidas de asociación y fórmulas de cálculo
| Nombre | Fórmula | Unidad | |
| Estudios: Causalidad, Pronóstico, Tratamiento | |||
| Diferencia de riesgos (DR) | Incidencia acumulada o tasa de eventos en el grupo experimental o expuesto - incidencia acumulada o tasa de eventos en el grupo control o no expuesto | Proporción o porcentaje | |
|
| |||
| Densidad de incidencia grupo experimental o expuesto - densidad de incidencia del grupo control o no expuesto. | Número por unidad (por ejemplo, por mil) | ||
|
| |||
| Figura 1c | Riesgo relativo (RR) | Incidencia acumulada del grupo experimental o expuesto/incidencia acumulada grupo control o no expuesto. | 1 hasta ∞ (riesgo) < 1 (protección) |
|
| |||
| Razón de incidencia(HR) | Densidad de incidencia del grupo experimental o expuesto/densidad de incidencia del grupo control o no expuesto. | 1 hasta ∞ (riesgo) < 1 (protección) | |
|
| |||
| Figura 1b | Razón de momios | Razón exposición y no exposición en sujetos con el evento de interés (resultado) entre la razón de exposición y no exposición en sujetos libres del dicho evento. | 1 hasta ∞ (riesgo)< 1 (protección) |
|
| |||
Diferencias de riesgos
La diferencia de riesgos, que también se conoce como riesgo atribuible, es el riesgo de un evento o enfermedad que específicamente ocurre por el factor de interés. Se calcula mediante la sustracción en el RA basal (o sin el factor de estudio) menos el RA en la población con la exposición. Un valor de cero implica no asociación y entre mayor sea la diferencia, existirá más asociación. Aunque matemáticamente es una fracción, se expresa en porcentajes para su mejor comprensión. Este estimador de asociación se usa particularmente en estudios de causalidad y pronóstico. Conviene señalar que para su interpretación debe considerarse todo un grupo y no a cada individuo.
• Ejemplo: En el estudio sobre medicina herbolaria y riesgo de hospitalización8 se encontró un RA de 0.049 o 4.9 % en quienes recibían este tratamiento. En el mismo estudio se reportó que el RA en los niños que no recibieron el tratamiento (n = 1447) fue de 0.059 o 5.9 %. Entonces, al calcular la diferencia de riesgos se concluye que la medicina herbolaria se asocia con reducción de 1 % de los casos hospitalizados (5.9 a 4.9 %).
Riesgo relativo
El RR es la probabilidad de la ocurrencia de una enfermedad después de haber estado expuesto a un factor, en comparación con la probabilidad de ocurrencia en un grupo control, es decir, sin el factor de exposición. El RR se calcula con las incidencias acumuladas (Cuadro 2), lo cual corresponde a una razón en la cual se divide el RA del grupo expuesto entre el RA del grupo no expuesto. En cambio, si se usa densidad de incidencia se obtiene la razón de posibilidades (que en inglés se denominan hazard ratio, HR).
Cuando el RR es igual a 1.0 implica que no hay riesgo (o bien, que no hay asociación) de presentar la enfermedad dada la presencia del factor de riesgo. Entre más grande sea el valor de RR (> 1.0), el grado de la asociación será mayor; por el contrario, cuando el RR es < 1.0, se considera que el factor previene o protege para que no se desarrolle la enfermedad. Contrario a la diferencia de riesgos, el RR se interpreta individualmente y no en forma grupal.
• Ejemplo: Continuando con el estudio anterior,8 el RR (o HR) encontrado fue 0.83 (0.49/0.59); es decir, el tratamiento tuvo un efecto o asociación protectora para evitar la hospitalización.
Razón de momios
La RM (odds ratio, OR) tiene la misma interpretación que el RR, pero se calcula diferente.3 De manera general, la RM se utiliza en estudios donde no se pueden calcular los riesgos absolutos, como los de casos y controles. El estimador resulta del cálculo de la razón de los momios de la exposición/no exposición en los pacientes con el desenlace, entre la razón de momios de la exposición/no exposición en los controles (Cuadro 2).
• Ejemplo: Para determinar si el antecedente de rinitis alérgica influía en el riesgo de púrpura trombocitopénica idiopática, un estudio9 comparó niños con y sin púrpura trombocitopénica idiopática y su antecedente de rinitis. Los niños con púrpura trombocitopénica idiopática tuvieron un momio de 0.62:1 de tener el antecedente de rinitis (23 contra 37), mientras que en los controles fue 0.27:1 (13 contra 47). Con estos datos, la RM o el OR fue 2.29 (resultado de dividir 0.62/0.27), lo que significa que un niño con antecedentes de rinitis alérgica tiene 2.29 veces más probabilidad de presentar púrpura trombocitopénica idiopática, que si no tiene ese antecedente.
Existen otros estimadores que ayudan a los médicos a tomar decisiones en la práctica clínica diaria, los cuales están relacionados directamente con las actividades que se realizan con los pacientes (por lo cual se conocen como medidas de utilidad o de impacto): diagnóstico, tratamiento, pronóstico o causalidad.
Estimadores para diagnóstico
Para el diagnóstico, los estimadores más usados son los valores predictivos (positivo y negativo) y las razones de verosimilitud o probabilidad (positiva y negativa). Las primeras corresponden a la probabilidad de estar enfermo o sano (riesgo actual), dado se tiene un resultado positivo (valor predictivo positivo, VP+) o negativo (valor predictivo negativo, VP−) de una prueba diagnóstica (Cuadro 3). Por su parte, las razones (también llamados cocientes) de probabilidad representan la posibilidad (o las veces) de tener una enfermedad dado que la prueba diagnóstica fue positiva (razón de probabilidad positiva, RV+), o bien, cuántas veces es esa probabilidad, dado que la prueba diagnóstica fue negativa (razón de probabilidad negativa, RV−).
Cuadro 3. Medidas de uso o impacto y fórmulas de cálculo
| Nombre | Fórmula | Unidad | |
| Estudios | |||
| Pruebas diagnósticas (Figura 1a) | Valor predictivo positivo (VP+) | Verdaderos positivos/todos los positivos | Porcentaje |
|
| |||
| Valor predictivo negativo (VP−) | Verdaderos negativos/todos los negativos | Porcentaje | |
|
| |||
| Razón de verosimilitud positiva (RV+) | Razón de proporción de positivos enfermos contra positivos sanos. | 1 hasta ∞ | |
|
| |||
| Razón de verosimilitud negativa (RV−) | Razón de proporción de positivos enfermos contra positivos sanos. | 0 a 1 | |
|
| |||
| Causalidad y pronóstico(Figura 1b) | Porcentaje de riesgo atribuible (PRA) | Diferencia de riesgo entre el riesgo absoluto por 100 | Porcentaje |
|
| |||
| Porcentaje de riesgo atribuible poblacional (PRAP) | Diferencia de riesgo entre la prevalencia del factor en la población | Porcentaje | |
|
| |||
| Tratamiento (Figura 1c) | Reducción riesgo absoluto (RRA) | Incidencia acumulada o tasa de curados en el grupo control o no expuesto - incidencia acumulada o tasa de curados en el grupo experimental o expuesto por 100 | Porcentaje |
|
| |||
| Reducción del riesgo relativo (RRR) | Incidencia acumulada de curados del grupo experimental o expuesto/incidencia acumulada de curados del grupo control o no expuesto menos uno por 100 | Porcentaje | |
|
| |||
| Efecto absoluto del tratamiento (EAT) | Incidencia acumulada o tasa de eventos benéficos en el grupo experimental o expuesto - incidencia acumulada o tasa de eventos benéfico en el grupo control o no expuesto por 100 | Porcentaje | |
|
| |||
| Efecto relativo del tratamiento (ERT) | Incidencia acumulada de eventos beneficiosos del grupo experimental o expuesto/incidencia acumulada de eventos beneficiosos en el grupo control o no expuesto menos uno por 100 | Porcentaje | |
|
| |||
| Número necesario por tratar (NNT) | Recíproca del RRA | 1 hasta ∞ | |
|
| |||
| Incremento riesgo absoluto (IRA) | Incidencia acumulada o tasa de curados en el grupo control o no expuesto - incidencia acumulada o tasa de curados en el grupo experimental o expuesto por 100 | Porcentaje | |
|
| |||
| Número necesario por dañar (NNH) | Recíproca del IRA | 1 hasta ∞ | |
|
| |||
• Ejemplo: Nuevamente, en el estudio de Santos et al.7 la probabilidad de ser alérgico dado que la prueba de activación de basófilos fue positiva es de 95.4 % (VP+ = 42/44), mientras la probabilidad de no tener alergia dado que la respuesta negativa fue de 98.3 % (VP− = 59/60).
Lo anterior también puede ser expresado mediante las razones de probabilidad: la posibilidad de ser alérgico si la prueba fue positiva (RV+) es de 24 a 1, mientras que si la prueba fue negativa (RV−), la posibilidad de ser alérgico corresponde de 0.02 a 1, lo cual, en términos más sencillos, podría traducirse como de 50 a 1.
Estimadores para tratamiento
En los estudios de tratamiento, es decir, en los que se evalúa la eficacia y seguridad de una maniobra terapéutica (por ejemplo, fármacos, cirugía, terapia de rehabilitación, etcétera) se tienen varios estimadores de acuerdo con los objetivos del análisis: reducción en un resultado adverso, incremento en un resultado benéfico e incremento en un resultado adverso.10,11,12
I. En la reducción de un resultado adverso se busca ofrecer evidencia sobre el efecto curativo de un tratamiento, mediante la comparación en la disminución de la proporción de pacientes enfermos entre un grupo en el que se administra la maniobra en estudio (experimental) y otro grupo (control) al que se le ofrece una maniobra distinta, que puede ser el tratamiento habitual o placebo.
Para el análisis, se contrasta la tasa de sujetos que persisten enfermos (riesgo absoluto) posterior a recibir el tratamiento, entre el grupo experimental y el grupo control. Con esta comparación entre grupos se pueden obtener tres estimadores: reducción del riesgo absoluto (RRA), reducción del riesgo relativo (RRR) y el número necesario por tratar (NNT).
Reducción del riesgo absoluto
La RRA informa del porcentaje de reducción de enfermos (es decir, los que lograron curación de la condición a tratar) con el tratamiento en estudio, con respecto al grupo control (Cuadro 3). Específicamente, este indicador compara proporcionalmente cuántos pacientes seguían enfermos después de usar la nueva terapia, con el número de pacientes a los que se les otorgó la maniobra habitual o placebo. Entre más grande sea el porcentaje, el nuevo tratamiento se considerará más eficaz o efectivo que la maniobra control.
• Ejemplo: En el trabajo de Nahm et al.13 se determinó la eficacia de dar IgG autóloga intramuscular durante ocho semanas, con el objetivo de reducir los síntomas en dermatitis atópica. Después de este periodo, en el grupo experimental 13 de los 25 pacientes incluidos continuaban con síntomas (TEE = 0.52 o 52 %), en comparación con 21 de 24 controles que recibieron placebo (TEC = 0.87 o. 87 %). Con estos datos, hubo una reducción de 35 % (resultado de TEC − TEE: 87 % − 52 %) en favor del tratamiento en evaluación (IgG intramuscular).
Reducción del riesgo relativo
Por su parte, la RRR indica la reducción porcentual en el riesgo individual de un participante de continuar enfermo si recibió el nuevo tratamiento, relativo al riesgo de no recibirlo. El RRR resulta de mucha utilidad para las decisiones personales en la práctica clínica. Como se muestra en el Cuadro 3, se calcula de la siguiente forma: 1 (división de la incidencia acumulada del grupo experimental, entre la incidencia de grupo control [que es igual al RR]), multiplicado por 100. Así, el nuevo tratamiento será más eficaz cuanto más grande sea el porcentaje, en comparación con el tratamiento administrado en el grupo control.
• Ejemplo: Tomando los datos del estudio de Nahm et al.,13 el RR calculado fue de 0.59 (TEE/TEC), mientras que el RRR fue 1 - 0.59 = 41 %. Entonces, el tratamiento con IgG reduce (relativamente al grupo control) en 41 % la probabilidad de continuar con síntomas después de ocho semanas de tratamiento.
Número necesario por tratar
El NNT es un estimador que se construye con el propósito de eliminar la interpretación porcentual obtenida del RRA y del RRR. El resultado se obtiene en números concretos de personas. A diferencia de los dos previos, el NNT tiene una lógica más sencilla para su posible aplicación clínica, ya que permite estimar el número de personas que deberían recibir el nuevo tratamiento para lograr que un paciente ya no presente la sintomatología inicial respecto al tratamiento en comparación. Un punto importante que debe tomarse en cuenta es que entre más pequeño sea el NNT, el nuevo tratamiento será más eficaz que el comparativo. De tal forma, que el “mejor tratamiento” será aquel con NNT igual a 1, lo que significa que cada persona tratada obtendrá el beneficio de ese tratamiento.
• Ejemplo: Con los datos del estudio de Nahm et al.13 y tomando como base la fórmula del Cuadro 3 (1/RRA = 1/0.35) se calculó un NNT de 2.8 (que se puede redondear a 3). Lo anterior implica que, por cada tres pacientes tratados con IgG autóloga se logrará que en un paciente se eliminen los síntomas.
II. En cuanto al incremento de un resultado benéfico, el análisis se realiza considerando la proporción de pacientes que se curan o en quienes se previene alguna enfermedad o complicación (por ejemplo, al aplicar una vacuna). Para este grupo también hay tres estimadores: efecto absoluto del tratamiento (EAT), efecto relativo del tratamiento (ERT) y número necesario por tratar (NNT).
Efecto absoluto del tratamiento
El EAT expresa el porcentaje extra de pacientes con un resultado benéfico respecto al comparador (Cuadro 3). Como en el RRA, entre más grande sea el porcentaje, el tratamiento en estudio (o el nuevo tratamiento) ofrecerá una mejor alternativa que el tratamiento en comparación, por lo cual podría aplicarse en poblaciones con características semejantes a las que se incluyeron en la investigación.
• Ejemplo: Sampson et al.14 investigaron el efecto de la inmunoterapia epicutánea con parches para lograr la tolerancia a la ingesta de cacahuates en pacientes de seis a 55 años. Uno de los grupos experimentales fue tratado inicialmente por tres horas con parches con 250 μg de proteína de cacahuate; después siguió una permanencia de los parches al día de seis, 12 y 24 horas, por cada semana. Al año del tratamiento se observó que 28 de los 56 tratados con el parche respondieron a la inmunoterapia (TEE = 50 %), a diferencia de 14 de 56 pacientes (TEC = 25 %) en quienes se colocó parches con placebo. Entonces, en el cálculo del EAT (TEE − TEC) se obtiene que es de 25 %, es decir, con la inmunoterapia se obtuvo incremento de 25 % de pacientes con respuesta benéfica.
Efecto relativo del tratamiento
El ERT informa sobre la ganancia del efecto benéfico deseado que ofrece un nuevo tratamiento, desde el punto de vista porcentual, relativa al grupo control (Cuadro 3). Es un estimador del impacto individual del tratamiento en estudio con respecto a un comparador. Entre más grande el resultado, el efecto favorable es más evidente.
• Ejemplo: En el estudio de Sampson et al.,14 el RR fue 2.0 (0.50/0.25), por lo cual, el riesgo de responder se incrementó a 100 %. Este resultado se obtuvo al despejar la siguiente fórmula
Número necesario por tratar
El NNT para este objetivo informa sobre el número de sujetos que es necesario dar el tratamiento para lograr éxito o beneficio en un participante más, comparando con los casos de éxito observados en el grupo de referencia. Como se comentó, para definir que un tratamiento es mejor, lo deseable son valores cercanos a 1, pero se puede inferir alta eficacia con valores ≤ 4.
• Ejemplo: Retomando el estudio de inmunoterapia epicutánea para alergia a cacahuate,14 el NNT fue de 4. Este resultado se obtuvo al despejar la fórmula señalada en el Cuadro 3 (100/RRA), 100/25. La interpretación debería ser que por cada cuatro pacientes que reciben inmunoterapia, un paciente estará libre de la alergia al cacahuate.
III. Cuando se considera el incremento de un resultado adverso, se evalúa la seguridad del nuevo tratamiento, es decir, la frecuencia de efectos secundarios o indeseables que se registraron durante el tiempo de duración que los pacientes lo recibieron. Por supuesto, un tratamiento se considerará seguro cuando estos eventos se presenten en menor proporción que el grupo control con el tratamiento o la maniobra en comparación. Los estimadores son dos: el incremento de riesgo absoluto (IRA) y el número necesario por dañar (NNH).
Incremento de riesgo absoluto
El IRA compara la proporción de efectos secundarios observados entre el grupo experimental y el grupo control. En la fórmula descrita en el Cuadro 3 se señala que corresponde a la resta de la incidencia acumulada del grupo con el nuevo tratamiento menos la del grupo del tratamiento habitual o placebo. Cuando el resultado es mayor para el grupo experimental, entonces se considera que el nuevo tratamiento tiene mayor riesgo de presentar efectos adversos en contraste con el grupo control.
• Ejemplo: Retomando el estudio de Nahm et al.,13 en el grupo que recibió IgG, 13 de los 25 tratados presentaron eventos adversos (52 %), mientras que los eventos adversos en el grupo placebo se observaron en 18 de 25 (72 %); por tanto, se encontró un IRA 20 % mayor en el grupo placebo.
Número necesario por dañar
El NNH, al contrario que el NNT, estima el número de sujetos que al recibir el nuevo tratamiento o el tratamiento en comparación presentarán un efecto adverso respecto al otro grupo. Este estimador ofrece una visión más amplia cuando se pretende usar un nuevo tratamiento en la práctica clínica; así, la decisión de utilizarlo se deberá basar en que este nuevo tratamiento ofrezca mayor proporción de mejoría y una proporción similar de efectos adversos, en comparación con el grupo que recibió la maniobra control.
• Ejemplo: Continuando con el estudio de Nahm et al.,13 en el estudio se informó que a pesar de que no hubo eventos adversos graves, el NNH fue de 5 (100/RRA = 100/20). Esto significa que por cada cinco pacientes tratados con placebo hubo un evento adverso más en comparación con el grupo experimental.
Estudios de causalidad y pronóstico
En estos estudios, los estimadores de impacto son el porcentaje de riesgo atribuible (PRA) y el porcentaje de riesgo atribuible poblacional (PRAP).
Porcentaje de riesgo atribuible
El PRA señala sobre el porcentaje de casos en la población de riesgo o en población expuesta, qué es específicamente atribuible al factor de riesgo de interés (Cuadro 3). Suele usarse para decisiones de tipo preventivo.
• Ejemplo: En el estudio de medicina herbolaria,8 la diferencia de riesgos fue de 0.01 o 1 %, con un riesgo absoluto en el grupo con este tratamiento de 0.049 o 4.9 %. Con estos datos, el PRA sería de 0.204 o 20.4 % (0.01/0.049), lo cual significa que 20 % de la reducción en la hospitalización se explica por el uso de la medicina herbolaria. Aunque el resultado parece bueno, hay que considerar que en esta población alrededor de la mitad (51.4 %, 1447 pacientes de un total de 2811) estaba recibiendo esta maniobra.
Porcentaje de riesgo atribuible poblacional
El PRAP estima el porcentaje de casos en la población general en los que sucedió el evento, lo cual específicamente es atribuible al factor de riesgo de interés. Se expresa como el porcentaje de casos que pudieran ser excluidos en una población si es que el factor considerado fuera eliminado (Cuadro 3).
• Ejemplo: Siguiendo con el ejemplo de la medicina herbolaria,8 podría preguntarse cuánto impactaría en un país donde solamente uno de cada 500 habitantes de la población tuviera este tipo de tratamiento. El PRAP sería de 0.00002, o bien, 0.01 × 0.002 = 0.02 %. Lo anterior significa que menos de 1 % de las hospitalizaciones por asma serían reducidas con este tratamiento, por lo cual es evidente su bajo impacto en esta población.
Por último, es necesario señalar que, para la incorporación de los resultados de una investigación, en este caso de todos los estimadores señalados, en primer lugar deberá establecerse la validez de los estudios de investigación, es decir, si se respetaron los aspectos metodológicos que definen los estudios de buena calidad.15,16 Además, cada estimador puede variar en relación con el cumplimiento de los supuestos estadísticos de la captura de los datos, así como por el tamaño de muestra de cada estudio. Por lo anterior, cada uno de los estimadores deberán ser analizados e interpretados junto con sus intervalos de confianza o intervalos de credibilidad (dependiendo de la estadística utilizada),6 para determinar su precisión y significación, tanto clínica como estadística.17











 nueva página del texto (beta)
nueva página del texto (beta)