Antecedentes
La Organización Mundial de la Salud define las reacciones adversas a medicamentos (RAM) como una respuesta nociva y no intencional que ocurre a dosis normalmente usadas para profilaxis, diagnóstico o tratamiento de una enfermedad. Las RAM se clasifican de la siguiente forma:
Tipo A, reacciones dependientes de la dosis y predecibles, consecuencia de la acción farmacológica del medicamento y que dan cuenta de 80 % de los casos.
Tipo B, reacciones independientes de la dosis e impredecibles; se consideran como las verdaderas reacciones de hipersensibilidad (RHS).
Tipo C o crónicas, que se relacionan con efectos secundarios a la dosis acumulada del medicamento en el tiempo.
Tipo D, relacionadas con la aparición de teratogénesis y carcinogénesis.
Tipo E, relacionadas con la suspensión del fármaco.
Tipo F, relacionados con falla terapéutica, con frecuencia por interacciones medicamentosas.1,2,3
Las reacciones tipo B ocurren en sujetos genéticamente predispuestos e incluyen reacciones causadas por liberación de mediadores vasoactivos, sin mediación inmunológica y reacciones asociadas a la activación de mecanismos inmunológicos. Gell y Coombs sugieren cuatro tipos de hipersensibilidad mediada por mecanismos inmunológicos:
Las reacciones tipo B o RHS representan aproximadamente 15 % de todas las reacciones adversas a fármacos, afectan a 7 % de la población general y a entre 10 y 20 % de todos los pacientes hospitalizados. Estas reacciones constituyen un problema importante de salud pública debido al riesgo de ocasionar reacciones potencialmente fatales, como la anafilaxia y las reacciones adversas cutáneas graves, que pueden requerir hospitalizaciones prolongadas y la necesidad de cambios en el tratamiento de una enfermedad específica. Se ha estimado que la mortalidad causada por RAM en pacientes hospitalizados es de 0.32 %.6,7 Es por esto por lo que implican un reto para el médico, ya que requieren un reconocimiento oportuno, manejo adecuado y, finalmente, la toma de decisiones terapéuticas que incluye definir un medicamento alternativo seguro y eficaz.8
Reacciones de hipersensibilidad a antibióticos betalactámicos
Las reacciones alérgicas a los antibióticos betalactámicos (BL) son la causa más frecuente de reacciones adversas a fármacos mediadas por un mecanismo inmunológico específico; de los BL, las penicilinas son el grupo más involucrado y mejor estudiado, debido a su alto consumo y a la estabilidad química de los conjugados que se forman. Los BL son antibióticos naturales y semisintéticos con acción bactericida. Producen su efecto principalmente a través de dos mecanismos: inhibición de la síntesis de la pared bacteriana e inducción de la autolisis bacteriana. Los primeros BL solo eran activos contra bacterias grampositivas, pero las últimas generaciones muestran actividad contra un amplio espectro de bacterias, incluidos bacilos gramnegativos.9
En los últimos años, se ha mejorado el proceso de producción de los BL: se ha limitado la cantidad de productos contaminantes y, con ello, ha disminuido su alergenicidad e inmunogenicidad. Sin embargo, el número de reacciones alérgicas no ha disminuido de forma paralela, probablemente por el aumento en el número de pacientes expuestos a estos fármacos y a las variaciones de la estructura química de los BL, que tienen como objetivo aumentar el espectro antibiótico, lo cual implica la aparición de nuevos determinantes antigénicos.10
Los BL son reconocidos como una de las causas más frecuente de reacciones a medicamentos, tanto inmediatas como no inmediatas. Se desconoce la prevalencia de hipersensibilidad a penicilina en la población general, probablemente debido a la falta de estudios prospectivos. En pacientes hospitalizados, la frecuencia de alergia definida por autorreporte es mayor a 20 %, pero solo 1 a 10 % de los pacientes tiene evidencia de reacción de hipersensibilidad tipo I en las pruebas diagnósticas.9,11,12 En Latinoamérica, en una encuesta a 862 pacientes con antecedente de reacciones de hipersensibilidad, se encontró que los antibióticos BL explicaron 13.8 % de las reacciones, mientras que los antiinflamatorios no esteroideos ocuparon el primer lugar (52.3 %).13
Los factores de riesgo para reacciones de hipersensibilidad inmediata y para severidad de la reacción no están completamente entendidos. Se ha observado un mayor riesgo para el sexo femenino (11 % versus 6.5 %), probablemente en relación con un mayor número de prescripción de estos antibióticos; la vía de administración tópica tiene mayor capacidad de sensibilizar al igual que los cursos frecuentes de antibióticos, principalmente parenterales. Por otra parte la atopia no predispone al desarrollo de reacciones alérgicas a penicilina.9,12,14
Hallazgos clínicos y diagnóstico
Las manifestaciones clínicas aparecen inmediatamente después de la administración del medicamento (como máximo, una hora) y varían desde reacciones leves, como la urticaria, a graves y potencialmente fatales, como la anafilaxia. Estos síntomas se producen por una liberación rápida de histamina y otros mediadores inflamatorios. Las reacciones no inmediatas involucran todas aquellas reacciones que no están mediadas por la IgE, que ocurren con un intervalo superior a una hora tras la toma del fármaco. Las manifestaciones clínicas incluyen exantema maculopapular, urticaria, eritema multiforme, síndrome de Stevens-Johnson, necrólisis epidérmica tóxica, exantema fijo medicamentoso, dermatitis exfoliativa, reacción a medicamentos con síntomas sistémicos y eosinofilia, púrpura, vasculitis leucocitoclástica, dermatosis liquenoide y fotosensibilización, entre otras.15
En ambos tipos de reacciones, las aminopenicilinas son los fármacos más frecuentemente implicados, aunque las reacciones pueden estar producidas por cuadros virales y parecer reacciones alérgicas verdaderas durante un tratamiento con una aminopenicilina; estas últimas son reproducibles al readministrar el fármaco implicado.16,17,18
Los protocolos de estudio de las reacciones alérgicas a BL necesitan ser simples y seguros y usar materiales que estén disponibles en el consultorio, ya que a nivel mundial millones de personas necesitan ser evaluadas. Una historia clínica detallada y exacta es requerida como el primer paso para un diagnóstico correcto, por lo que debe incluir detalles sobre el tiempo transcurrido desde la reacción, el BL que se asoció a la reacción y su indicación, la dosis y vía de administración del BL, los signos y síntomas que el paciente presentó y el tratamiento recibido durante la reacción. El valor predictivo positivo de la historia clínica para realizar diagnóstico de hipersensibilidad a BL es tan bajo como de 19 % y cerca de 33 % de los pacientes con pruebas cutáneas positivas tienen historias clínicas poco precisas.19,20
Pruebas in vivo e in vitro
Las pruebas cutáneas proveen información útil tanto para el estudio de reacciones de hipersensibilidad tipo I como de las tipo IV; sin embargo, se requiere de experiencia clínica para realizarlas e interpretar sus resultados. Aunque en la práctica clínica estas pruebas se llevan a cabo después del periodo refractario, es decir, seis semanas después de la reacción (para evitar resultados falsos negativos), es poca la evidencia que soporta esta conducta, por lo que pueden llevarse a cabo antes si están clínicamente indicadas.
Por otra parte, las pruebas cutáneas deben realizarse en un periodo de tiempo corto después de la reacción, debido a que solo 20 a 30 % de los pacientes con pruebas cutáneas positivas continúan siendo reactivos a los 10 años; cinco años posterior a una prueba cutánea positiva para amoxicilina, 100 % de los pacientes pierden su reactividad, en comparación con 40 % de los pacientes que previamente reaccionaron a un determinante de BL.
En cuanto a las cefalosporinas, aproximadamente una tercera parte de los pacientes con pruebas cutáneas positivas mantiene la reactividad a los cinco años. No está claro si la pérdida de la reactividad en la prueba cutánea corresponde a pérdida de la alergia como tal.21,22
Respecto a la sensibilidad y especificidad de las pruebas cutáneas con penicilina, se considera que hasta 75 % de los pacientes reaccionan solo al determinante mayor (PPL) y 10 % es positivo solo a los determinantes menores (MDM). La sensibilidad total, usando los cuatro haptenos: MDM, PPL, amoxicilina y bencilpenicilina es de 70 %; por lo tanto, 30 % de los pacientes realmente alérgicos no puede ser diagnosticado por pruebas cutáneas. La especificidad de las pruebas cutáneas no se puede calcular debido a que las pruebas de exposición controlada no se pueden usar como estándar de oro. Las pruebas cutáneas para cefalosporinas están menos validadas que para las penicilinas, debido a que los alérgenos de los productos de degradación de las cefalosporinas no están completamente identificados.23,24,25,26
Cuando los determinantes mayores y menores no se encuentran disponibles para la realización de pruebas cutáneas, el rendimiento diagnóstico puede llegar a ser mucho menor. Los algoritmos diagnósticos pueden orientar la conducta del clínico y llegar a ser importantes, especialmente en algunos países de Latinoamérica, donde dichos determinantes no se encuentran disponibles. El Grupo de Alergología Clínica y Experimental de la Universidad de Antioquia, en Colombia, ha propuesto algoritmos básicos para el diagnóstico y manejo de las reacciones adversas a betalactámicos, tanto inmediatas como tardías (Figuras 1 y 2).
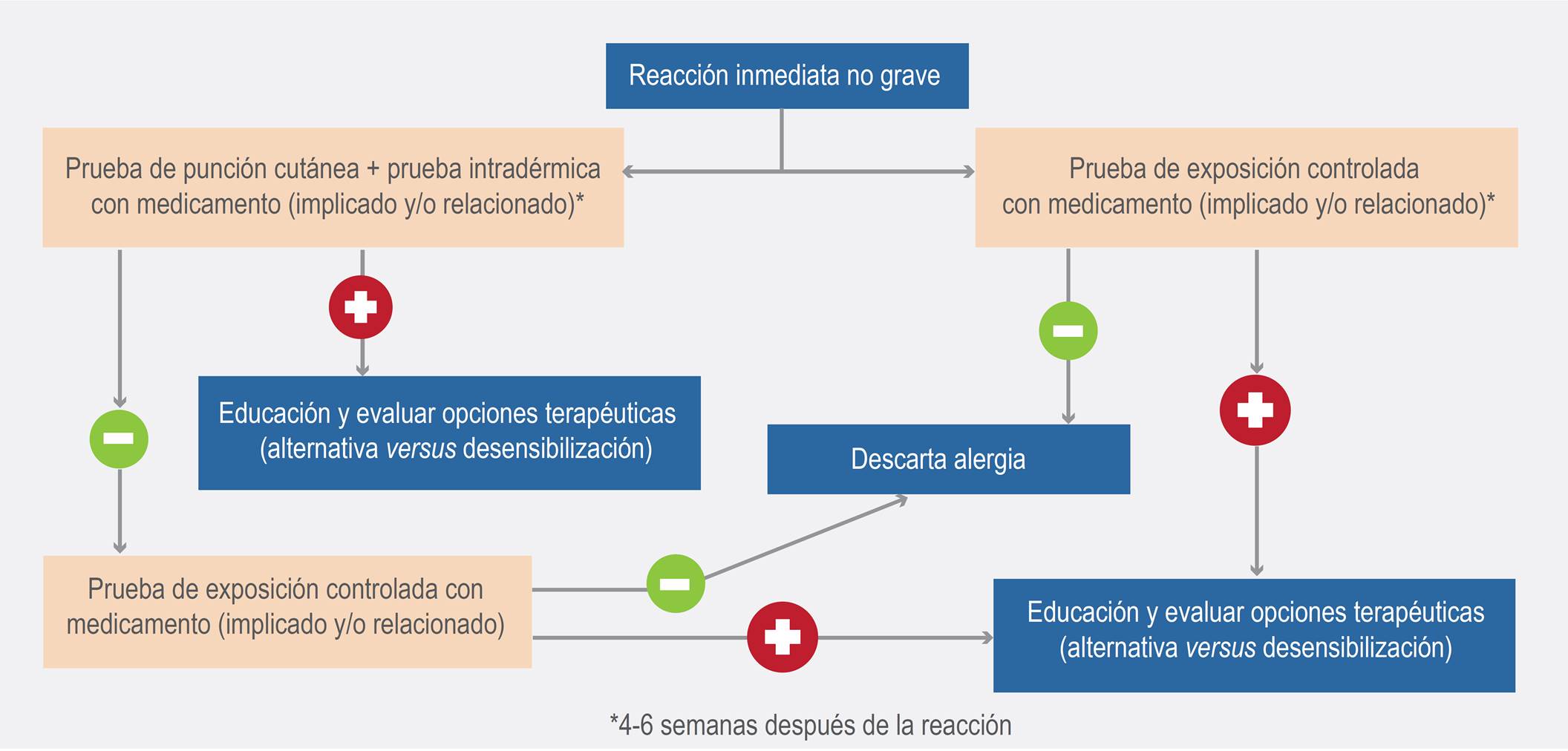
Figura 1. Algoritmo diagnóstico y terapéutico de reacciones adversas inmediatas no graves a betalactámicos.
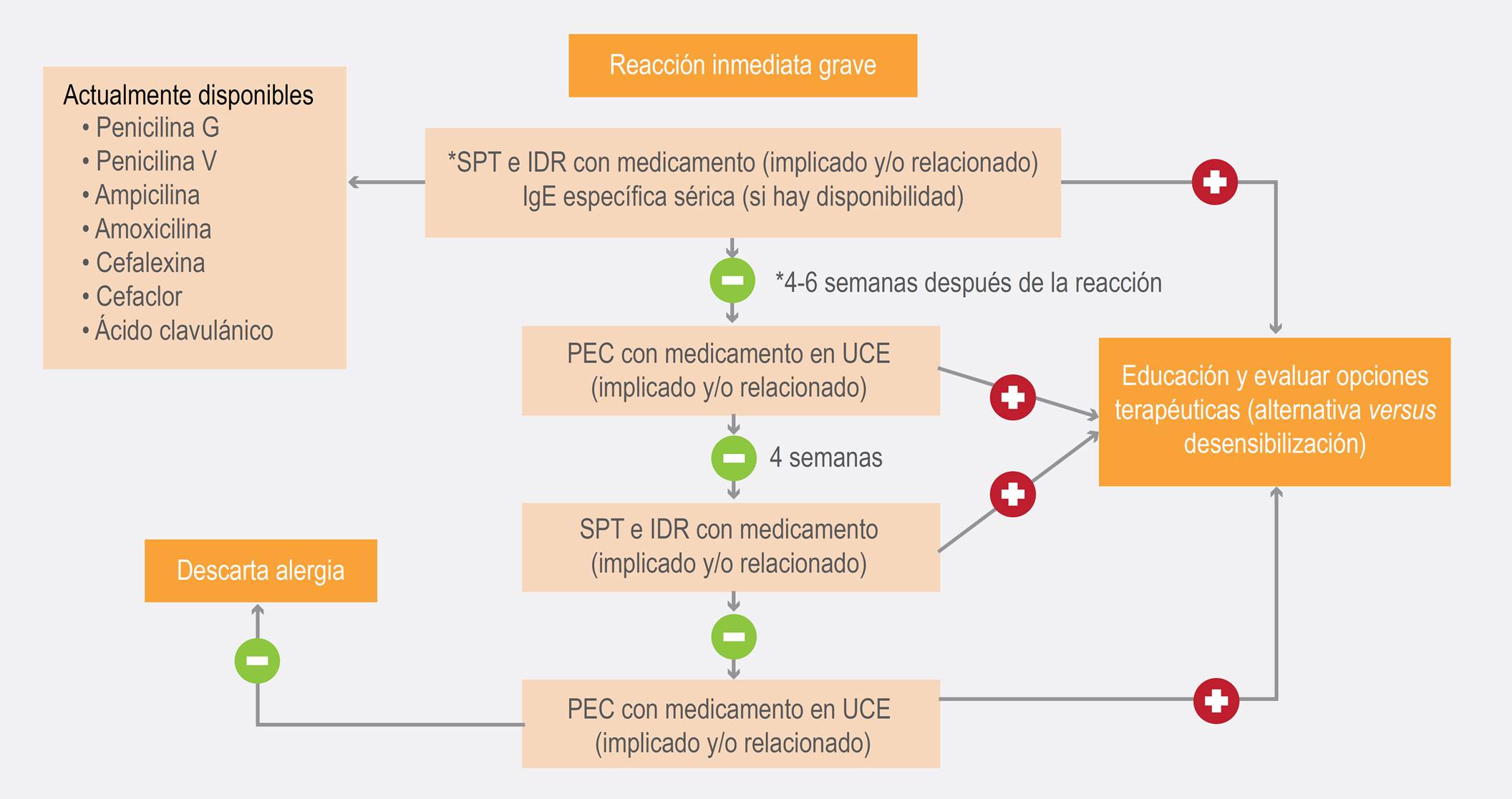
Figura 2. Algoritmo diagnóstico y terapéutico de reacciones adversas inmediatas graves a betalactámicos. IDR = prueba intradérmica, PEC = prueba de exposición controlada, SPT = prueba de punción cutánea, UCE = urticaria crónica espontánea.
El diagnóstico de las reacciones tardías puede llegar a ser un reto, debido a que las manifestaciones clínicas pueden imitar enfermedades autoinmunes e infecciosas. Tanto la prueba de parche como las pruebas intradérmicas con lecturas tardías pueden usarse para diagnóstico de reacciones mediadas por células, siendo más sensibles las pruebas intradérmicas con lecturas tardías, pero menos específicas que las pruebas de parche. Sin embargo, estas pruebas cutáneas no han sido estandarizadas y su sensibilidad no está completamente validada. Los resultados negativos pueden ocurrir en reacciones no mediadas inmunológicamente, en ausencia de cofactores y debido a la pobre penetración del fármaco en la piel. La especificidad, por el contrario, es muy buena, con pocas posibilidades de encontrar una respuesta falsamente positiva.27,28,29 En la Figura 3 se plantea un algoritmo diagnóstico y terapéutico para reacciones adversas tardías.
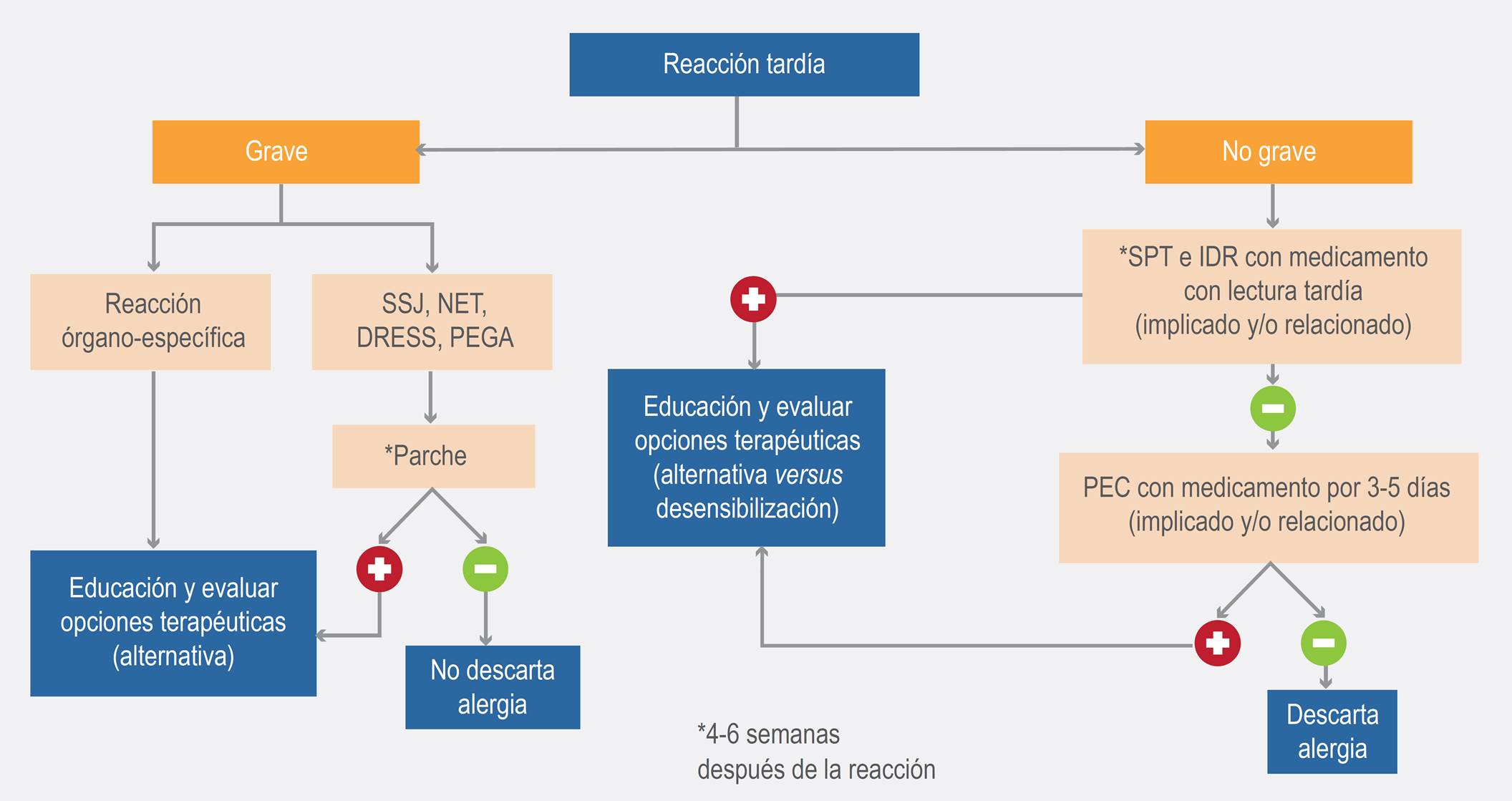
Figura 3. Algoritmo diagnóstico y terapéutico de reacciones adversas tardías a betalactámicos. DRESS = reacción a fármacos con eosinofilia y síntomas sistémicos, IDR = prueba intradérmica, NET = necrólisis epidérmica tóxica, PEC = prueba de exposición controlada, PEGA = pustulosis exantemática aguda generalizada, SPT = prueba de punción cutánea, SSJ = síndrome de Stevens-Johnson, UCE = urticaria crónica espontánea.
Pruebas de provocación
Si las pruebas cutáneas y las pruebas in vitro son negativas y persiste la sospecha de reacción de hipersensibilidad, se debe hacer una prueba de provocación. Estas prueba tienen como objetivo confirmar el diagnóstico; cruzada y establecer alternativas terapéuticas seguras. Idealmente debe realizarse bajo cegamiento simple controlado con placebo, a dosis escalonadas. En niños y pacientes de bajo riesgo (síntomas aislados no alérgicos como prurito sin lesiones en piel o síntomas gastrointestinales, historia familiar de alergia a penicilina, reacciones desconocidas remotas de más de 10 años sin manifestaciones sugestivas de reacción mediada por IgE), se indica realizar prueba de provocación oral sin pruebas cutáneas previas,30,31 ya que la mayoría de las reacciones no son alérgicas o se deben a exantemas virales (Figura 4).
Tratamiento inicial de las reacciones de hipersensibilidad a antibióticos betalactámicos
El tratamiento de pacientes con reacciones de hipersensibilidad inmediatas y no inmediatas a antibióticos es principalmente la evitación y el uso de antibióticos alternativos.32 Con el propósito de facilitar la elección de alternativas seguras se han diseñado herramientas móviles (Allergologypedia ® en Play Store y App Store) que permiten evaluar la reactividad cruzada de betalactámicos de acuerdo con la similitud de sus cadenas laterales, cuyos resultados se obtienen en milisegundos.33 Sin embargo, hay situaciones que reducen en gran medida las alternativas terapéuticas, por ejemplo, las complicaciones relacionadas con comorbilidades del paciente, las interacciones farmacológicas, la disponibilidad y costo de antibióticos y el perfil de resistencia microbiológica. La desensibilización está indicada cuando no hay una alternativa razonable a un medicamento.32,34
Desensibilización como tratamiento vital y tipos
El tratamiento de las RHS en pacientes sin alternativas de tratamiento está basado en el procedimiento de desensibilización, el cual induce un estado temporal de hiporrespuesta mediante la administración incremental de dosis subóptimas del medicamento que ocasiona la hipersensibilidad, hasta alcanzar la dosis requerida.35 Los protocolos de desensibilización conceptualmente están diseñados para pacientes en quienes un mecanismo mediado por IgE ha sido demostrado mediante pruebas cutáneas o medición de IgE específica sérica frente al medicamento responsable; sin embargo, pacientes que sufrieron reacciones inmediatas a taxanos y otros agentes quimioterápicos en las cuales mecanismos IgE no pueden ser demostrados también se han sometido a desensibilización de forma exitosa.36
Existen dos tipos de protocolos de desensibilización: la desensibilización rápida, que se utiliza en pacientes con historia de reacción adversa de tipo inmediata, cuyo mecanismo involucra a mastocitos, basófilos e IgE; y la desensibilización lenta, generalmente utilizada en pacientes con reacciones no inmediatas tipo IV, cuyo mecanismo es mediado por células T.37
Mecanismos de desensibilización
El mastocito y el basófilo tienen un papel preponderante en las reacciones inmediatas, independiente de si está involucrado o no un mecanismo mediado por IgE.
Se postula que las dosis subterapéuticas incrementales del medicamento usado durante la desensibilización provee una cantidad suficiente de determinantes antigénicos, que se unen a la IgE que se encuentra en el receptor de alta afinidad del mastocito, pero sin hacer entrecruzamiento con esta IgE, induciendo una hiporrespuesta celular, que parece ser parcialmente atribuible a la abolición de la movilización de calcio intracelular, la cual es un determinante crítico de la degranulación y la producción de citoquinas en estas células.35,36
La desensibilización parece impactar en otras células, además del mastocito, pues se ha utilizado de forma satisfactoria en reacciones mediadas por células T. En un caso de erupción fija inducida por alopurinol, Teraki et al. demostraron que la desensibilización produce una migración de células T reguladoras CD25+ CD4+ a la lesión, y estas a su vez tienen un efecto supresor de la función efectora de las células T CD8+ en las lesiones del exantema fijo por el medicamento.38 También se ha observado un incremento en los niveles de IL-10, citoquina que tiene una importante función reguladora y antiinflamatoria. La IL-35 ha mostrado acción en el sistema inmunitario, tanto efectos inmunosupresores como antiinflamatorios. Un paciente desensibilizado a infliximab mostró que los niveles de IL-35 se incrementaban con cada desensibilización.36
La desensibilización es un proceso antígeno-específico y se ha observado la inducción de células T reguladoras específicas del medicamento. Aydogan et al. reportaron el caso de un adolescente sometido a desensibilización, en quien se documentó un incremento en células T reguladoras CD4+ CD25+ y CD4+ CD25+ FoxP3, que podría tener un papel en el mecanismo de desensibilización a rituximab.39
Desensibilización a antibióticos betalactámicos
Los antibióticos se encuentran entre los medicamentos más comúnmente prescritos; particularmente, los betalactámicos están frecuentemente involucrados en reacciones de hipersensibilidad. Los pacientes con alergia a antibióticos algunas veces son tratados con otros antibióticos menos efectivos, más tóxicos, con un mayor espectro antimicrobiano, más efectos secundarios y más costosos que el medicamento de primera elección. La desensibilización le permite al paciente acceder al tratamiento antimicrobiano de elección. Se han publicado múltiples protocolos de desensibilización a penicilina, el más conocido y utilizado es el propuesto por Sullivan40,41 (Cuadro 1).
Cuadro 1. Desensibilización a penicilina: 15 minutos de intervalo entre dosis40
| Dosis | Unidades | Ruta |
| 1 | 100 | Oral |
| 2 | 200 | Oral |
| 3 | 400 | Oral |
| 4 | 800 | Oral |
| 5 | 1 600 | Oral |
| 6 | 3 200 | Oral |
| 7 | 6 400 | Oral |
| 8 | 12 800 | Oral |
| 9 | 25 000 | Oral |
| 10 | 50 000 | Oral |
| 11 | 100 000 | Oral |
| 12 | 200 000 | Oral |
| 13 | 400 000 | Oral |
| 14 | 200 000 | Subcutánea |
| 15 | 400 000 | Subcutánea |
| 16 | 800 000 | Subcutánea |
| 17 | 1 000 000 | Intramuscular |
La desensibilización a antimicrobianos se realiza mediante la administración de dosis incrementales, iniciando típicamente con diluciones de 1:100 a 1:1000 de la dosis terapéutica total; se puede utilizar la vía oral, intravenosa o subcutánea. En general, la dosis administrada se duplica cada 15 a 60 minutos, hasta que se alcanza la dosis terapéutica.34 Este procedimiento permite alcanzar dosis terapéuticas completas en un tiempo relativamente corto, típicamente entre cuatro y 12 horas.8,42 Una vez completada la terapia, el estado de desensibilización durará hasta por cuatro vidas media del medicamento. Luego de este tiempo se asume que la sensibilidad ha regresado y, en caso de requerir un nuevo esquema antibiótico, sería necesario repetir el protocolo de desensibilización.43 La ruta oral parece ser más segura, debido a que hay una menor exposición a los conjugados multivalentes de penicilina, los cuales tienen un papel importante en las reacciones mediadas por IgE.44
En pacientes con sífilis gestacional, donde el único compuesto no relacionado estructuralmente con la penicilina es la doxiciclina, la cual está contraindicada debido a los riesgos potenciales para el feto, la desensibilización a penicilina ha mostrado ser segura y efectiva.34 En el Cuadro 2 se presenta un protocolo de desensibilización a penicilina benzatínica. Durante la desensibilización pueden ocurrir reacciones alérgicas que representan un riesgo para la gestante y el feto, por lo cual es necesaria una vigilancia estrecha para realizar un diagnóstico y tratamiento temprano de la reacción, si llegase a suceder.45 Debido a que la penicilina benzatínica es de larga acción, las pacientes parecen ser capaces de mantener el estado de desensibilización hasta por tres semanas, por lo cual no es necesario repetir el procedimiento en dosis subsecuentes, siempre y cuando no se supere este tiempo.46
Cuadro 2. Desensibilización a penicilina a través de rutas oral, subcutánea e intramuscular para una dosis meta de 2 400 000 UI
| Dilución | Penicilina V (tableta 500 mg) | Agua (mL) | Concentración final (mg/mL) |
| Dilución 1 | 1 tableta | 10 | 50 |
| Dilución 2 | Dilución 1 | 10 | 5 |
| Dilución 3 | Dilución 2 | 10 | 0.5 |
| Dilución 4 | Dilución 3 | 10 | 0.05 |
| Dilución | Penicilina benzatínica (ampolleta 2 400 000 UI) |
Agua destilada o SSN (mL) |
Concentración final (UI/mL) |
| Dilución 5 | Liofilizado | Llevar a 10 mL | 240 000 |
Si la desensibilización es exitosa, puede continuar la administración de la dosis completa de forma semanal. SSN = solución salina normal.
Los principios de la desensibilización a penicilina pueden ser aplicados a otros antibióticos. Se han realizado protocolos de desensibilización a la mayoría de las diferentes clases de antibióticos, incluyendo cefalosporinas, monobactámicos, carbapenémicos, aminoglucósidos, sulfonamidas, vancomicina, quinolonas y macrólidos. Si el antibiótico está disponible en presentación intravenosa y oral, esta última debería ser la ruta preferible para el procedimiento.47
Debido a los cursos antibióticos frecuentes y repetidos, hay una mayor prevalencia de alergia a cefalosporinas en pacientes con fibrosis quística, inmunodeficiencias y espina bífida.48 Los pacientes con alergia confirmada a penicilina requieren evaluaciones separadas para cada cefalosporina; se han reportado protocolos de desensibilización a cefazolina, cefotaxime, ceftazidime, ceftriaxona, cefepime y ceftaroline. En el Cuadro 3 se presenta un protocolo de desensibilización a ceftriaxona.
Cuadro 3. Ejemplo de protocolo de desensibilización intravenosa para 2 g de ceftriaxona. Intervalo entre cada dosis de 15 minutos47
| Paso | Ceftriaxona (mg/mL) |
Velocidad (mL/h) |
Dosis (mg) |
Dosis acumulada (mg) |
| 1 | 0.01 | 6 | 0.015 | 0.015 |
| 2 | 0.01 | 12 | 0.03 | 0.045 |
| 3 | 0.01 | 24 | 0.06 | 0.105 |
| 4 | 0.1 | 5 | 0.125 | 0.23 |
| 5 | 0.1 | 10 | 0.25 | 0.48 |
| 6 | 0.1 | 20 | 0.5 | 1 |
| 7 | 0.1 | 40 | 1 | 2 |
| 8 | 0.1 | 80 | 2 | 4 |
| 9 | 0.1 | 160 | 4 | 8 |
| 10 | 10 | 3 | 7.5 | 15 |
| 11 | 10 | 6 | 15 | 30 |
| 12 | 10 | 12 | 30 | 60 |
| 13 | 10 | 25 | 62.5 | 123 |
| 14 | 10 | 50 | 125 | 250 |
| 15 | 100 | 10 | 250 | 500 |
| 16 | 100 | 20 | 500 | 1 000 |
| 17 | 100 | 40 | 1000 | 2 000 |
Por la similitud del anillo betalactámico, estudios iniciales sugirieron altas tasas de reactividad cruzada de los carbapenémicos con penicilina; sin embargo, estudios prospectivos han mostrado tasas de reactividad cruzada tan bajas como de 0.9 % entre penicilina y meropenem y entre penicilina e imipenem/cilastatina. Debido a la estabilidad farmacológica de los carbapenémicos, son pocos los protocolos reportados; uno de ellos se realizó con imipenem/cilastatina, incrementando 3.3 veces la dosis cada 10 minutos.34
El aztreonam es un monobactámico con un único anillo betalactámico, sin el anillo bicíclico característico de los otros betalactámicos; es menos inmunogénico que las penicilinas y las cefalosporinas. Por lo general, los pacientes con alergia a betalactámicos toleran el aztreonam, pero son pocos los protocolos intravenosos reportados con este medicamento.34
Los pacientes con fibrosis quística presentan con frecuencia reacciones de hipersensibilidad a betalactámicos, lo cual representa un gran reto en el tratamiento de estos pacientes. Algunos estudios reportan que hasta 20 % de los adultos con fibrosis quística ha tenido múltiples reacciones a antibióticos betalactámicos. Las reacciones usualmente son de tipo no inmediatas.49 En este escenario se han utilizado con éxito protocolos de desensibilización, tanto rápida como lenta; en el Cuadro 4 se muestra un ejemplo de desensibilización rápida a betalactámico, para una dosis meta de 1 g.50
Cuadro 4. Ejemplo de protocolo de desensibilización intravenosa para 1 g de antibiótico antilactámico50
| Bolsas | Suero (mL) | Dosis (mg) | Concentración | |||
| 1 | 250 | 10 | 0.04 | |||
| 2 | 250 | 100 | 0.4 | |||
| 3 | 250 | 1 000 | 4 | |||
| Pasos | Bolsas | Minutos | Ritmo (mL/h) | mL | mg | Dosis acumulada |
| 1 | 1 | 15 | 2 | 0.5 | 0.02 | 0.02 |
| 2 | 1 | 15 | 5 | 1.25 | 0.05 | 0.07 |
| 3 | 1 | 15 | 10 | 2.5 | 0.1 | 0.17 |
| 4 | 1 | 15 | 20 | 5 | 0.2 | 0.37 |
| 5 | 2 | 15 | 5 | 1.25 | 0.5 | 0.87 |
| 6 | 2 | 15 | 10 | 2.5 | 1 | 1.87 |
| 7 | 2 | 15 | 20 | 5 | 2 | 3.87 |
| 8 | 2 | 15 | 40 | 10 | 4 | 7.87 |
| 9 | 3 | 15 | 10 | 2.5 | 10 | 17.87 |
| 10 | 3 | 15 | 20 | 5 | 20 | 37.87 |
| 11 | 3 | 15 | 40 | 10 | 40 | 77.87 |
| 12 | 3 | 172.9 | 80 | 172.9 | 922.13 | 1 000 |
Contraindicaciones de la desensibilización
La desensibilización debería considerarse contraindicada en situaciones en las que los riesgos superan en gran medida los beneficios. Debido a que las causas primarias de muerte en las RHS son la falla respiratoria y el colapso cardiovascular, los pacientes en alto riesgo de ellas no deberían someterse a desensibilización.
Son contraindicaciones absolutas de desensibilización, la presencia de asma no controlada, enfermedad pulmonar obstructiva crónica no controlada, inestabilidad hemodinámica y enfermedad cardiovascular pobremente controlada. El tratamiento con betabloqueadores, la historia de anafilaxia grave, enfermedad renal crónica y enfermedad hepática son contraindicaciones relativas; en estos casos es fundamental evaluar la relación riesgo-beneficio antes de someter al paciente a desensibilización.
Respecto a las reacciones adversas no inmediatas, la desensibilización está contraindicada en las reacciones cutáneas graves como síndrome de Stevens-Johnson, necrólisis epidérmica tóxica, pustulosis exantemática aguda generalizada y reacción a fármacos con eosinofilia y síntomas sistémicos.8
Desensibilización, más allá de un dilema médico
Los reportes estadísticos realizados en la última década muestran un incremento de las reacciones de hipersensibilidad a medicamentos, lo que lleva a que este dilema médico sea mucho más frecuente de lo que esperamos. Adicionalmente, cada vez hay mayor claridad respecto al uso de medicamentos irremplazables en ciertas condiciones clínicas, o en casos en los que usar un tratamiento de segunda línea representa una disminución en la eficacia terapéutica. Estas situaciones obligan a pensar en procedimientos como la desensibilización para garantizar el tratamiento adecuado para el paciente. Dentro de estos medicamentos indispensables se encuentran terapias biológicas, fármacos citorreductores, agentes quimioterápicos, antibióticos en condiciones especiales, medicamentos antituberculosis, ácido acetilsalicílico para las enfermedades cardiovasculares, entre otros. A esta situación se suma el grave problema de resistencia antimicrobiana en el mundo, de ahí la importancia de dar un tratamiento oportuno y efectivo que garantice la erradicación de la infección con el menor número de efectos adversos, incluida la generación de resistencia.
Puntos claves
Las reacciones alérgicas a BL son frecuentes, por lo que el entendimiento de sus mecanismos básicos facilita un mejor enfoque clínico.
El conocimiento y aplicación de los procedimientos de desensibilizaciones lleva a una mejor calidad de vida de los pacientes alérgicos y mejora el pronóstico de la enfermedad en ellos.
En los países latinoamericanos no se cuentan con todas las herramientas para un óptimo diagnóstico, por esto se proponen algunos algoritmos que pudiesen ser de utilidad clínica.
Los especialistas en alergia o inmunología clínica deben estar bien capacitados para implementar las medidas de retos y procedimientos de desensibilización que pudiesen salvar vidas.
Los procedimientos de desensibilización han dejado de ser un dilema médico, porque han demostrado su seguridad y efectividad, permitiendo el empleo de medicamentos que podrían desencadenar efectos nocivos o fatales para el paciente.











 nova página do texto(beta)
nova página do texto(beta)




