Antecedentes
El síndrome hemofagocítico (SHF), descrito inicialmente como linfohistiocitosis hemofagocítica en 1939,1 es un conjunto de signos y síntomas derivados de la hiperactivación descontrolada del sistema inmunitario que puede presentarse como un problema clínico primario de naturaleza genética o como una complicación grave asociada a diversas patologías sistémicas adquiridas, incluyendo neoplasias, padecimientos infecciosos y enfermedades autoinmunes. En estas últimas se le conoce como síndrome de activación de macrófagos, síndrome del histiocito activado o tormenta de citocinas.2,3 De acuerdo con el criterio diagnóstico propuesto por la Sociedad del Histiocito en 2004,4 el síndrome se identifica cuando un paciente presenta alteraciones moleculares genéticas específicas o cuando el paciente presenta cuando menos cinco de ocho criterios clínicos y de laboratorio ( Cuadro 1). Su diagnóstico preciso y tratamiento oportunos son muy importantes, ya que el desarrollo de este síndrome en cualquier paciente ensombrece claramente el pronóstico determinando alta mortalidad.5 Dada la gravedad del SHF, existe, por un lado, la tendencia a sobrediagnosticarlo y, por otro, su desconocimiento determina que no se diagnostique oportunamente (subdiagnóstico). Ambos fenómenos tienen un impacto negativo sobre el costo, la calidad y la eficiencia de la atención médica pediátrica.
Cuadro 1. Criterios diagnósticos de síndrome hemofagocítico (SHF)*
|
|
|
|
*Sociedad del Histiocito 20044
Nota: Los requisitos 7 y 8 no son estudiados en el Hospital de Especialidades Pediátricas, Tuxtla Gutiérrez, Chiapas.
En el Hospital de Especialidades Pediátricas de Tuxtla Gutiérrez, Chiapas (HEP) no existe información acerca de las características clínicas y de laboratorio ni de los padecimientos primarios relacionados con el SHF; también se desconoce qué tanto se ha sub y sobrediagnosticado. El conocimiento de estas variables es esencial para la mejora de su tratamiento y pronóstico.
Objetivos
Determinar los aspectos relativos a la realidad clínica del SHF en el estado de Chiapas, México, haciendo énfasis en conocer su incidencia real, la fracción de pacientes sub y sobrediagnosticados, las frecuencia de SHF primario y secundario, sus características clínicas y de laboratorio, los diagnósticos asociados, tratamiento y mortalidad. Esta información nos permitirá difundir los requerimientos diagnósticos, los criterios clínicos y de laboratorio, así como el entorno patológico, para que el médico se familiarice con las peculiaridades del SHF y contribuya al diagnóstico preciso y tratamiento oportuno de esta entidad y así coadyuvar a disminuir su mortalidad.
Métodos
El presente estudio observacional retrospectivo se realizó con los pacientes admitidos de enero de 2011 a mayo de 2019 en el HEP, para lo cual se empleó un modelo de serie de casos. El universo de estudio fueron todos los casos que pudieron identificarse y validarse en el HEP en el periodo referido.
Para reunir y analizar el mayor número posible de casos de SHF en esas fechas, se elaboró inicialmente una relación de “casos probables” a partir de tres fuentes:
Registros hospitalarios electrónicos de casos en los cuales se estableció formalmente el diagnóstico de SHF, linfohistiocitosis hemofagocítica o síndrome de activación de macrófagos.
Registros similares en los cuales aparecía cualquiera de los mismos términos en alguna parte del expediente, pero que no se consignara alguno de ellos como diagnóstico definitivo.
Registro electrónico de las determinaciones de ferritina en el laboratorio con resultado superior a 500 μg/L en el mismo periodo.
A continuación, se revisó el expediente clínico de cada caso probable para validar, rechazar o calificar cada uno como SHF conforme los criterios diagnósticos establecidos.
Las fuentes primarias de los datos fueron los expedientes clínicos electrónicos del Sistema de Gestión Hospitalaria del HEP y las bases de datos electrónicas de los exámenes de laboratorio que se efectúan en el HEP (Athenea).
Casos validados (criterio diagnóstico)
Para validar el diagnóstico de SHF y dado que dos de los parámetros (sCD25R y actividad citotóxica de las células natural killer) incluidos en los criterios diagnósticos establecidos en 2004 por la Sociedad del Histiocito4 no se determinan en el HEP, en lugar de requerir cinco de ocho criterios, se empleó el criterio modificado de satisfacer cuando menos cuatro de los mismos parámetros en un paciente hospitalizado con un padecimiento sistémico grave.
Casos sobre y subdiagnosticados
Los casos previamente diagnosticados como SHF que fueron rechazados como tales en la validación constituyeron los casos sobrediagnosticados y los casos que no habían sido reconocidos previamente como SHF, pero que cumplían los criterios diagnósticos, fueron calificados como casos subdiagnosticados. Estos últimos se sumaron a los validados para efecto del análisis.
Variables incluidas en el análisis
De los expedientes de todos los casos identificados y validados como SHF, se recabaron, entre otros, los datos demográficos, los del cuadro clínico en términos genéricos y específicos relacionados con los criterios diagnósticos de SHF, los parámetros sanguíneos y bioquímicos correspondientes al momento del diagnóstico, los diagnósticos primarios y secundarios asociados, el tratamiento y el resultado de este (motivo del alta). Los datos se recolectaron en una hoja electrónica de Excel® (Microsoft Corp.).
Resultados
Casos probables
La relación de casos probables quedó integrada por 214 casos, 26 casos diagnosticados con SHF durante la hospitalización y 188 en los que el diagnóstico se propuso como posibilidad, sin que se le hubiera dado seguimiento o con cuantificación de ferritina > 500 μg/L asociada a un padecimiento sistémico grave.
Casos validados
La relación final de casos validados quedó constituida por 35 casos que cumplían con el criterio diagnóstico: 14 de la relación original con diagnóstico de SHF, nueve que se habían reconocido como probable SHF, a quienes incluso se había indicado tratamiento, pero no se registró el diagnóstico; y 12 casos adicionales identificados como resultado de la presente pesquisa a través de una determinación de ferritina > 500 μg/L.
Casos sobrediagnosticados
Doce de los 26 casos (46.2 %) diagnosticados originalmente como SHF en el periodo de estudio no cumplieron con el criterio diagnóstico. El diagnóstico en cinco de los 12 casos se basó principalmente en la presencia de hemofagocitos en médula ósea o un valor de ferritina > 500 μg/L (sin considerar las transfusiones concurrentes); cinco tenían esplenomegalia y bicitopenia, pero solo dos cursaban con neutropenia. Únicamente uno tenía triglicéridos > 265 mg/dL y ninguno tenía fibrinógeno < 100 mg/dL.
Casos subdiagnosticados
Los 21 casos validados a partir de los casos probables y aquellos con ferritina superior a 500 μg/L constituyeron los casos subdiagnosticados. Todos cumplieron con el criterio diagnóstico establecido, no eran receptores crónicos de transfusiones y cursaban con un proceso inflamatorio/infeccioso severo. Es posible que en los casos con ferritina elevada también se haya pensado en la posibilidad de SHF y por ello se solicitaran las demás pruebas necesarias para diagnóstico. Sin embargo, la posibilidad diagnóstica no se anotó en el expediente.
Cumplimiento de los criterios diagnósticos
En el grupo final de 35 casos de SHF, siete pacientes cumplieron con cuatro criterios (20 %), 22 con cinco (63 %) y seis con seis (17 %). El grado de cumplimiento de la serie con cada criterio varió desde 47 a 100 % (Cuadro 2). Se presentan los criterios de bicitopenia y de fibrinógeno y triglicéridos desglosados para apreciar la diferencia de frecuencia entre los subcomponentes.
Cuadro 2. Cumplimiento de cada criterio diagnóstico de síndrome hemofagocítico
| Criterio | % | n |
| Fiebre | 100 | 35/35 |
| Ferritina (> 500 μg/L) | 100 | 33/33 |
| Bicitopenia | 94.3 | 33/35 |
| Anemia (< 9.0 g/dL) | 80.0 | 28/35 |
| Trombocitopenia (< 100 000/μL) | 94.3 | 33/35 |
| Neutropenia (< 1000/μL) | 57.1 | 20/35 |
| Fibrinógeno o triglicéridos | 94.3 | 33/35 |
| Triglicéridos (≥ 3.0 mmol/L; ≥ 265 mg/dL) | 82.0 | 27/33 |
| Fibrinógeno (< 150 mg/dL) | 47.1 | 16/34 |
| Esplenomegalia | 74.3 | 26/35 |
| Hemofagocitos en médula ósea | 58.3 | 14/24 |
Incidencia
El diagnóstico de SHF se ha sospechado con creciente frecuencia a partir de 2008, año en que el HEP inició operaciones regulares, hasta alcanzar un máximo de 30 sospechas en 2018. La tasa promedio de sospechas por cada 1000 egresos entre 2011 y 2018 fue de 8.4 (mín.-máx. 5.0-15.6). La incidencia anual de sospechas entre estos años siguió una curva polinómica ascendente con R2= 0.7651, p < 0.05 (Figura 1). A la par del aumento en sospechas se observó un incremento de casos validados (a posteriori, a través del presente estudio), constituidos por la suma de casos diagnosticados y no diagnosticados durante el internamiento (Figura 2). La tasa promedio de casos verificados por cada 1000 egresos por año para el mismo periodo fue de 2.0 (mín.-máx. 0.4-5.2). La incidencia anual de casos verificados también siguió una curva polinómica ascendente con R2= 0.6907 (p < 0.05), muy similar a la observada con las sospechas ( Figura 2).

Figura 1. Incidencia anual de casos en los que se sospechó síndrome hemofagocítico por 1000 egresos. Hospital de Especialidades Pediátricas, Tuxtla Gutiérrez, Chiapas, 2011-2018.
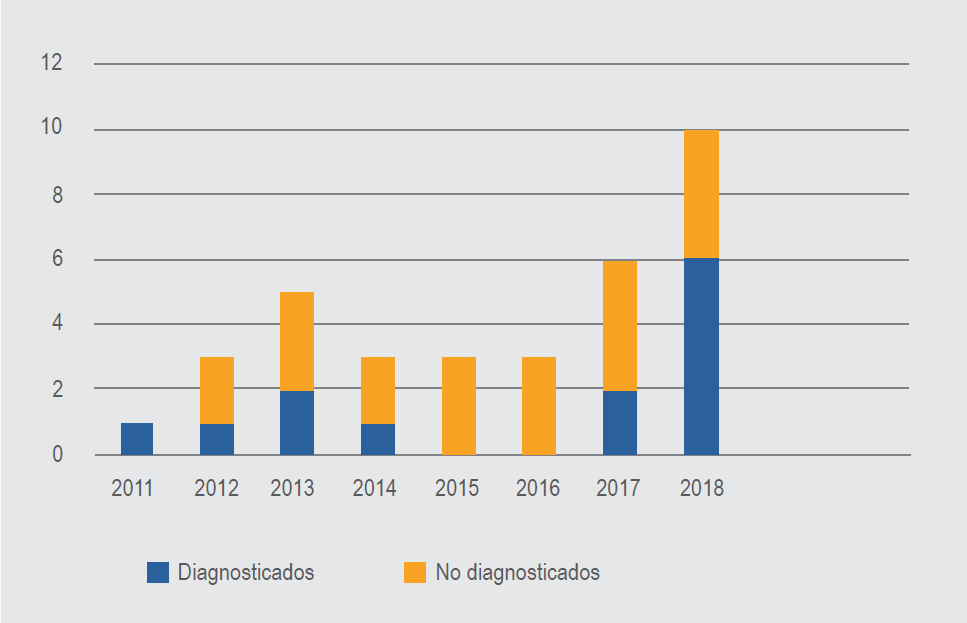
Figura 2. Incidencia anual de casos validados de síndrome hemofagocítico. Hospital de Especialidades Pediátricas, Tuxtla Gutiérrez, Chiapas, 2011-2018.
El incremento en la sospecha también trajo consigo el sobrediagnóstico de casos, ya que solo 46 % de los casos diagnosticados de 2011 a 2018 como SHF cumplían con los criterios diagnósticos. La sospecha no ha sido un fenómeno generalizado en la comunidad médica, ya que a la par del sobrediagnóstico se identificó un número significativo de casos no diagnosticados (subdiagnóstico 12/35 casos, 34 % de la serie), a pesar de haber existido elementos clínicos y de laboratorio para su diagnóstico (Figura 2).
Características generales
Sexo. Se observó un predominio de casos del sexo femenino sobre el masculino, con una relación M:F de 0.84, comparada con la relación observada en egresos hospitalarios de 1:1.7, sin embargo, la diferencia no fue significativa.
Edad. La media para los casos fue de 5.4 años (IC 95 % = 3.7-7.1) y no existió diferencia de edad entre hombres y mujeres.
Tiempo de evolución. El tiempo promedio de evolución para los casos fue de 30.7 días (IC 95 % = 31-40). A pesar de lo restringido del IC, el tiempo de evolución varió ampliamente en los casos considerados individualmente, dependiendo de la patología primaria asociada; así, los casos con afecciones agudas (como la sepsis) evolucionaron en menos de 10 días y los casos de infecciones o inflamatorios crónicos estuvieron entre los más tardíos. La mayor parte de los restantes correspondieron a patologías de evolución intermedia (malignidad, autoinmunidad, infecciones subagudas, etcétera).
Características clínicas relacionadas. El 100 % de los pacientes presentó fiebre como manifestación principal del cuadro clínico. No existieron datos suficientes (intensidad, duración, etcétera) en todos los expedientes para caracterizar la fiebre en forma sistemática. Adicionalmente, se registró el aparato o sistema principal involucrado durante el periodo de diagnóstico. Las alteraciones del aparato digestivo fueron las más frecuentes (68.6 %), seguidas de respiratorias (37.1), de hemostasia (22.9 %) y neurológicas (14.3 %). Los pacientes también presentaron esplenomegalia (74.3 %) y sangrado activo (45.7 %).
Exámenes de laboratorio
En el Cuadro 3 se presenta el resultado de los exámenes de laboratorio correspondientes al momento de la sospecha o diagnóstico de SHF. En ellos, además de lo requerido en el criterio diagnóstico, llamó la atención los valores medios de ferritina, muy superiores a > 500 μg/L, y el involucramiento hepático, que conformó un síndrome colestásico.
Cuadro 3. Exámenes de laboratorio para identificar síndrome hemofagocítico
| Examen | n | Media | IC 95 % |
| Hemoglobina (g/dL) | 35 | 8.4 | 7.6-9.2 |
| Leucocitos/μL | 35 | 5771 | 2204-8937 |
| Plaquetas × 103/μL | 35 | 39.7 | 29.4-50.1 |
| INR | 31 | 1.6 | 1.4-1.8 |
| TTP* | 25 | 46.8 | 40.6-52.9 |
| Fibrinógeno (mg/dL) | 34 | 153 | 107-200 |
| Dímero D (μg/mL) | 12 | 2200 | 1329-3071 |
| Ferritina (μg/L) | 33 | 24245 | 15491-32998 |
| Triglicéridos (mg/dL) | 33 | 468 | 382-555 |
| Proteínas totales (g/dL) | 35 | 5.2 | 4.8-5.7 |
| AST (UI/L) | 35 | 827 | 500-1155 |
| ALT (UI/L) | 35 | 287 | 171-404 |
| Fosfatasa alcalina (UI/L) | 35 | 401 | 279-524 |
| Deshidrogenasa láctica (UI/L) | 35 | 3793 | 2210-5375 |
| Bilirrubina total (mg/dL) | 35 | 5.8 | 3.3-8.2 |
| Bilirrubina directa (mg/dL) | 35 | 4.7 | 2.6-6.8 |
| Proteína C reactiva (mg/dL) | 35 | 10.4 | 7.0-13.8 |
IC 95 % = intervalo de confianza de 95 %, INR = relación internacional normalizada de tiempo de protrombina; TTP = tiempo de tromboplastina parcial, AST = aspartato aminotransferasa, ALT = alanino aminotransferasa.
Las alteraciones hepáticas se consideraron como componente de una patología primaria no hepática o como participación del hígado en el mismo SHF, por lo que, con excepción de estudiar la posibilidad de infección por virus de Epstein-Barr (VEB), solo se exploró la posible participación de otros virus hepatotropos en una tercera parte de los casos y únicamente se obtuvo positividad en casos aislados (Cuadro 4).
Diagnósticos asociados
En los 35 casos de SHF se establecieron 82 diagnósticos (2.34 por paciente). En el Cuadro 5 se presentan los diagnósticos asociados a los casos de SHF, tanto específicos o primarios como genéricos o sindromáticos. La infección aguda por VEB fue el diagnóstico específico asociado a SHF más prominente, ya que se observó en 42 % de los pacientes con SHF (dos de ellos con infección crónica activa por VEB). En la mayor parte de los casos asociados al virus VEB, la infección fue el problema primario predominante, pero también se presentó como asociado a hepatitis viral, leucemia aguda linfoblástica (LLA) y salmonelosis.
Cuadro 5. Diagnósticos específicos (primarios) asociados a síndrome hemofagocítico
| n | % | |
| Infección por VEB (todos) | 13/31 | 41.9 |
| + Hepatitis | 8/13 | |
| + Hepatitis + aplasia | 1/13 | |
| + Aplasia | 1/13 | |
| + LLA* + sepsis | 2/13 | |
| + Pancreatitis + salmonela | 1/13 | |
| IDP* o idiopático | 6 | 17.1 |
| + Sepsis | 3 | |
| + Hepatitis | 1 | |
| + Sepsis + hepatitis + CIVD | 1 | |
| Idiopático | 1 | |
| Hepatitis | 4 | 11.4 |
| Hepatitis viral | 2 | |
| + Sepsis | 2 | |
| LLA, LNH, histiocitosis (no VEB) | 3 | 8.6 |
| LLA + CIVD | 1 | |
| LLA + sepsis + CIVD | 1 | |
| LLA + hepatitis | 1 | |
| Tifoidea (no VEB) | 3 | 8.6 |
| + Hepatitis | 3 | |
| Anemia aplásica (no VEB) | 1 | 2.9 |
| + Sepsis | 1 | |
| LES, ARJ, DMIO, enfermedad de Crohn (no VEB) | 2 | 5.7 |
| LES + sepsis + pancreatitis | 2 | |
| Leishmaniasis | 2 | 5.7 |
| Dengue | 1 | 2.9 |
| Genéricos (sindromáticos) | ||
| Hepatitis (cualquier etiología) | 19 | 54.2 |
| Sepsis (incluida tifoidea) | 16 | 45.7 |
| CIVD (cualquier asociación) | 13 | 37.1 |
VEB = virus Epstein-Barr, LLA = leucemia aguda linfoblástica, LES = lupus eritematoso sistémico, ARJ = artritis reumatoide juvenil, CIVD = coagulación intravascular diseminada, LNH = linfoma no Hodgkin, DMIO = dermatomiositis.
El segundo diagnóstico específico relevante fue el de probable inmunodeficiencia primaria (IDP) que se asoció a SHF en 17 % de los casos. En tres lactantes con SHF se encontró evidencia de inmunodeficiencia primaria: en uno de ellos se documentó enfermedad de Griscelli y falleció sin estudios moleculares; el segundo cursó con neutropenia severa, sepsis y coagulación intravascular diseminada (CIVD) y falleció. El tercer paciente presentaba candidiasis oral, alteraciones dentales, desnutrición severa, sepsis y cuadro sugestivo de síndrome Papillon-Lefèvre; el padre solicitó alta voluntaria, por lo cual no se realizaron los estudios moleculares. Otros tres casos se consideraron idiopáticos al no poder establecer una patología primaria. Este grupo constituyó el grupo de SHF primario o de base genética y se asumió que la presunción diagnóstica de IDP fue correcta; la relación de SHF secundario:primario fue de 29:6. Todos estos casos se encuentran incluidos en el Cuadro 5 . Los demás diagnósticos primarios detallados en el cuadro no se asociaron con una frecuencia que llamara la atención, incluyendo los padecimientos autoinmunes, clásicamente asociados a SHF o síndrome de activación de macrófagos.
En cuanto a los diagnósticos genéricos o sindromáticos, es notoria la participación hepática, la sepsis y la CIVD en los pacientes
Tratamiento
La mayor parte de los pacientes con SHF (74.3 %) recibió tratamiento complejo para su condición primaria y en 40 % el tratamiento incluyó esteroides. Al mismo tiempo, en 23 de los 35 pacientes validados (66 %) se proporcionó tratamiento específico para SHF procurando que fuera apegado al protocolo HLH-2004.4
El tratamiento del SHF en los 23 pacientes incluyó gammaglobulina (100 %), etopósido (48 %), dexametasona (40 %) y ciclosporina (30 %). La mitad de los pacientes tratados (52 %) remitió inicialmente, aunque dos (8.7 %) recayeron a los cinco meses y al año del tratamiento inicial.
Tiempo de internamiento y mortalidad
El tiempo promedio de internamiento de los pacientes fue de 26.2 días (IC 95 % = 15.4-37.0; se excluyó del promedio el tiempo registrado en un paciente con infección crónica por VEB, el cual fue de 318 días). El tiempo promedio de los que fallecieron fue de 22 días (IC 95 % = 22-24 días), comparado con el de los que mejoraron que fue de 25 días (IC 95 % = 11-38 días); no existió diferencia significativa entre estos valores (p > 0.05).
De los seis pacientes con probable SHF primario, uno (idiopático) fue dado de alta por mejoría y reingresó seis meses después con recaída leve, cinco fallecieron (cuatro durante hospitalización y uno fue dado de alta para cuidados paliativos). La mortalidad fue de 83.3 %.
De los 29 con SHF secundario, 10 presentaron mejoría, uno de estos casos, asociado a infección aguda por VEB con participación hepática, presentó recaída en dos ocasiones; 19 fallecieron (16 durante la hospitalización y tres que habían sido dados de alta para cuidados paliativos); la mortalidad fue de 65.5 %.
La mortalidad global hasta el momento de este informe era de 24 defunciones en el hospital y cuatro en cuidados paliativos (28/35; 80 %). La causa final del deceso fue falla orgánica múltiple y sangrado.
Discusión
En contraste con lo que se observa en países orientales en donde el SHF es relativamente frecuente,6,7,8 el SHF en Latinoamérica constituye un problema clínico relativamente raro; por ello, solo se localizaron reportes aislados de casos y algunas revisiones generales del tema en la región.9,10,11,12 Sin embargo, los resultados obtenidos en el presente estudio documentan que el SHF se ha presentado en el HEP, ubicado en el sureste de México, cuando menos desde el año 2011 y que, a partir de entonces, los casos sospechados han oscilado en forma cíclica y creciente hasta un máximo de 30 sospechas en 2018.
A la par del crecimiento de la sospecha se ha observado un crecimiento cíclico similar en los diagnósticos validados por 1000 egresos, con una tasa de 2.0 por 1000 egresos promedio para el periodo, lo que permite esperar un mínimo de cinco casos por año en el HEP (Figura 2). El presunto incremento y variación cíclica de esta complicación dentro de la patología observada en el HEP queda por confirmarse dados los números relativamente pequeños de la serie.
En el presente trabajo se empleó un criterio diagnóstico modificado al establecido por la Sociedad del Histiocito en 2004 debido a que dos de los ocho parámetros originales no se determinan en el HEP, disminuyendo el requerimiento de criterios de cinco a cuatro de los seis originales. Este criterio permitió reunir un número significativo de casos. Por tal motivo, la inclusión de los parámetros faltantes (sCD25R y actividad citotóxica de las células natural killler), si bien deseable, no parece ser esencial y requiere elementos (cultivo celular, mantenimiento de líneas celulares, etcétera) que no se encuentran disponibles en todos los hospitales de tercer nivel del país.
Por otro lado, dado que existen alteraciones moleculares que por sí mismas constituyen un criterio diagnóstico y de que la única perspectiva actual para estos casos es el trasplante temprano de médula ósea, es importante incorporar en el protocolo diagnóstico inicial, un panel de estudios moleculares que incluya mínimamente las alteraciones conocidas en los genes FHLH y aquellos relacionados con los padecimientos genéticos conocidos frecuentemente asociados a SHF (síndromes de Chediak-Higashi, Griscelli y Hermansky-Pudlak).8,13
Tomando en cuenta que el criterio diagnóstico empleado en el presente trabajo fue un poco más laxo que el criterio oficial de la Sociedad del Histiocito de 2004, llama la atención que a la par de los casos que se confirmaron haya existido una fracción importante de casos (46 %) que fueron considerados como SHF, sin que existiera un soporte suficiente para dicho diagnóstico o sobrediagnóstico y que al mismo tiempo se identificaran 21 casos (60 %) que no fueron diagnosticados durante la atención médica del paciente (subdiagnóstico).
En la mayor parte los casos sobrediagnosticados, el diagnóstico se basó solo en el reporte de hemofagocitosis no cuantificada en médula ósea, con o sin ferritinemia (> 500 μg/L), lo que sugiere que la comunidad médica da un valor elevado a estos parámetros individuales. Sin embargo, el SHF es una complicación grave que se sobrepone a un padecimiento complejo y por tal motivo es importante que para su diagnóstico se incluyan el mayor número posible de elementos del criterio diagnóstico, no establecerlo con base en menos de cuatro elementos diagnósticos y nunca con base en uno solo, ya que el valor diagnóstico de cada elemento aislado, aun en un contexto clínico similar, es relativamente bajo. Así, por ejemplo, la presencia de hemofagocitos en médula ósea se asoció no solo a SHF, sino también a una variedad de padecimientos cuyo mecanismo patogénico incluye destrucción celular aumentada en médula ósea, como leucemia aguda, anemia megaloblástica, anemia aplásica, anemias hemolíticas hereditarias, púrpuras trombocitopénicas, anemias autoinmunes, dengue, etcétera y, por lo tanto, su especificidad para el diagnóstico de SHF es baja.14 En cuanto a la ferritinemia en suero, el valor de corte establecido > 500 μg/L en el criterio diagnóstico original también tiene muy baja especificidad, ya que incluye muchos pacientes politransfundidos y con otros padecimientos inflamatorios y neoplásicos que cursan con elevación de ferritina.15
El sobrediagnóstico determina tratamientos citotóxicos no indicados (esteroides, etopósido) y el empleo de recursos terapéuticos inmunomoduladores de alto costo o valor intrínseco (ciclosporina, gammaglobulina humana, anti-IL-6, transfusiones, etcétera) sin un beneficio real demostrado para el paciente grave sin SHF y que incluso podrían contribuir a su fallecimiento. Por ello, es importante validar el diagnóstico de SHF mediante supervisión y consenso médico antes de proporcionar el tratamiento recomendado, con lo que se evitaría la mala práctica y el gasto innecesario en perjuicio del paciente y de la institución involucrada.
La identificación paradójica simultánea de un porcentaje importante de casos subdiagnosticado plantea la posibilidad de problemas logísticos institucionales que será necesario atender, incluyendo omisiones, ya que en 9/35 (26 %) el diagnóstico se sospechó y en 12/35 (34 %) los casos se identificaron a partir de las pruebas de laboratorio correspondientes, lo que sugiere que, en su momento, también se sospechó el diagnóstico, pero no se anotó la sospecha o por diversas razones no se le dio seguimiento para confirmarlo (defunción, alta prematura, preeminencia del diagnóstico primario, cambio de médico tratante, transferencia interna de área de hospitalización, entrega tardía de resultados, etcétera). El subdiagnóstico también incide sobre la calidad de la atención médica, la oportunidad del tratamiento y, por ende, sobre el pronóstico del paciente. Por ello, la posibilidad de SHF debe ser considerada una emergencia diagnóstica y médica y debe establecerse un protocolo para abordaje que incluya ferritina y el estudio de la médula ósea, cuyos resultados estén disponibles en menos de ocho horas, las 24 horas de los siete días de la semana (con excepción de las pruebas moleculares).5
Conclusiones
De acuerdo con los resultados obtenidos en la serie de casos depurada, el SHF se presenta en lactantes y preescolares de ambos sexos, con cuadro clínico y tiempo de evolución relacionados con una patología febril primaria subyacente que involucra al tubo digestivo en la mayor parte de los pacientes. Los casos asociados con sepsis aguda, salmonelosis y dengue grave evolucionaron en menos de 10 días. Las inmunodeficiencias, hepatitis agudas, leucemias, infecciones virales subagudas por VEB y leishmaniasis estuvieron en el tiempo de evolución promedio y los casos de autoinmunidad e infecciones virales crónicas por VEB estuvieron entre los casos más tardíos. Cuando se sobrepone el SHF, se trata de un paciente grave, con fiebre continua de intensidad variable, con esplenomegalia y manifestaciones hemorrágicas activas extensas y en quienes los análisis de laboratorio proporcionan elementos que deben considerarse. Así, al margen de cumplir con el criterio diagnóstico establecido, derivado de lo observado en el presente trabajo, los valores en los siguientes parámetros permiten sospechar inicialmente el diagnóstico: grado de plaquetopenia (< 50 000/μL), neutropenia (según edad), ferritina (> 5000 μg/L), deshidrogenasa láctica (> 2200 U/L), aspartato aminotransferasa (> 500 U/L), proteínas sanguíneas (< 5.5 g/dL), bilirrubina directa (> 3.0 mg/dL) y PCR (> 7.0). Estos valores configuran en conjunto una afección inflamatoria/ infecciosa sistémica grave con o sin CIVD y de mal pronóstico, ante la cual hay que actuar con decisión y oportunidad.
El análisis de los casos permite tener una perspectiva más precisa de los padecimientos primarios y condiciones clínicas generales que se asocian al SHF. En primer lugar, el hecho de que los pacientes con SHF cursaran con dos o más condiciones clínicas graves sugiere que la acumulación de patologías favorece o determina el SHF (Cuadro 5). Luego, en más de 40 % de los casos con SHF estuvo involucrado el virus VEB, lo cual coincide con lo observado en otros países7,16,17 y corrobora que el virus VEB es un agente particularmente nocivo e hiperestimulante del sistema inmunitario que puede favorecer e inducir per se el SHF.18,19, 20 En tercer término, se observó que los casos calificados como IDP se presentan con SHF, resultado también congruente con lo informado previamente de existencia de alteraciones genéticas que favorecen o determinan el SHF.8,13 En cuarto término, se observó que los demás diagnósticos: LLA, salmonelosis, aplasia, etcétera -incluyendo enfermedades autoinmunes - estuvieron presentes entre los diagnósticos asociados, habitualmente acompañados de padecimientos igualmente graves como sepsis o afección hepática.
Las observaciones sobre los diagnósticos asociados nos permiten sugerir que existan condiciones primarias (VEB, IDP) que per se determinan SHF, pero que también la sola acumulación de condiciones patológicas graves, incluyendo o no las primarias anotadas, determina el SHF. Inmersos entre estas dos posibilidades se encuentran, además, los factores de tiempo de evolución y gravedad. Esto último se sugiere al analizar los casos autoinmunes (LES y ARJ) -clásicamente asociados al síndrome de activación de macrófagos, en esencia SHF-3,21,22 y los casos de hepatitis; los autoinmunes se encuentran entre los de evolución más prolongada y en los de hepatitis, la lesión/disfunción es objetivamente importante.
En conjunto, el análisis de los diagnósticos asociados establece la posibilidad de que exista un número crítico o umbral de elementos estimulantes del sistema inmunitario (determinantes antigénicos o adyuvantes) de naturaleza diversa, actuando simultáneamente, durante cierto tiempo en el individuo, para que se llegue al “estado de SHF”. Estos elementos pueden ser derivados de un solo ente biológico con múltiples determinantes antigénicos, actuando sobre múltiples células, por ejemplo, VEB, al que pueden sumarse otros más simples o adyuvantes (sepsis) o derivados de diversos entes individuales con menos determinantes antigénicos que actúen en conjunto (por ejemplo, Salmonella, LLA, virus de la hepatitis, etcétera). En el SHF, la poli e hiperactivación del sistema inmunitario rebasaría su propia capacidad natural de autorregulación, dañando al huésped en calidad de “observador inocente”. En este entorno teórico, los casos de SHF primario tendrían un umbral de poliactivación inmunitaria más bajo o un defecto en la autorregulación (modulación, supresión) de la respuesta inmunitaria.13
La infección aguda por COVID-19 a la fecha no se ha relacionado claramente con el SHF en pediatría, tal como lo ha hecho en la población adulta (los síndromes que se han informado en pediatría con vasculitis, trombofilia o Kawasaki-like son fenómenos de hipersensibilidad retardada similares a otras patologías posinfecciosas como el síndrome urémico hemolítico, la púrpura anafiláctica, la púrpura fulminans, la púrpura trombocitopénica aguda, etcétera, cuya fisiopatología es esencialmente diferente del SHF. Sin embargo, planteadas las posibilidades descritas y la agresividad del nuevo coronavirus, es posible que también se presenten casos de COVID-19 con SHF en pediatría, cuando la infección se asocie a otras patologías serias como sepsis, leucemia o inmunodeficiencias.
Los pacientes fueron tratados -en la medida de las posibilidades clínicas-, de acuerdo con los lineamientos establecidos por la Sociedad del Histiocito en 2004.4 Dado que el SHF es una complicación de estados patológicos de por sí graves, es difícil valorar los resultados de su tratamiento en forma aislada. Sin embargo, de acuerdo con los datos obtenidos en el presente estudio, un poco más de dos terceras partes de los pacientes que se incluyeron fallecieron por falla orgánica múltiple con o sin CIVD y aun cuando resulta difícil asignar la contribución específica del SHF a la mortalidad versus la de las causas primarias, es evidente que el SHF incrementa significativamente la posibilidad de fallecer.
El SHF fue definida como una entidad histopatológica descrita por patólogos como linfohistiocitosis hemofagocítica;1 se ha considerado como una entidad citopatológica, como síndrome de activación de macrófagos3,22 o hematológica por sus manifestaciones más evidentes.23 Sin embargo, estudios posteriores han mostrado que se trata de un “estado fisiopatológico de poli e hiperactivación descontrolada del sistema inmunitario (inducido por múltiples causas), que provoca daño orgánico sistémico severo” (un verdadero estado de caos inmunitario). El daño orgánico es inespecífico y se debe a la activación de múltiples células inmunitarias con la subsiguiente liberación de diversas citocinas proinflamatorias.24
Por ello, pareciera más adecuado renombrar al SHF como síndrome de hiperactivación inmunitaria. Esta visión no sólo tendría importancia semántica, sino que empataría con la fisiopatología del proceso y motivaría el abordaje terapéutico más racional confeccionado específicamente para cada causa primaria, basado en la modulación individualizada del sistema inmunitario, empleando los diversos anticuerpos bloqueadores de citocinas proinflamatorias disponibles actualmente.25,26 Ello representaría un intento por mejorar los resultados terapéuticos que se obtienen actualmente, con el empleo de la remoción citotóxica generalizada de las células inmunitarias implícita en el abordaje tradicional.4,24,27
La depuración de los casos sobrediagnosticados y la incorporación de los subdiagnosticados de SHF nos ha permitido obtener conclusiones en cuanto a su verdadera incidencia, cuadro clínico, evolución, padecimientos primarios asociados, alteraciones de laboratorio y demás características en la población pediátrica atendida en el HEP. Si bien los hallazgos pudieran no extrapolarse a otras partes, el presente trabajo constituye un referente nacional del SHF en pediatría, que será muy útil al médico general y al pediatra para abordar esta complicación médica, con la seguridad que da el conocimiento sólido de la realidad clínica en una parte del país. Con ello, se contribuye a la mejora de la calidad y oportunidad de la atención médica. El entendimiento de la fisiopatología del SHF establecerá nuevas posibilidades terapéuticas integrales en el paciente grave en nuestro medio.











 text new page (beta)
text new page (beta)



