Introducción
El síndrome de Stevens-Johnson (SSJ), descrito en 1922,1 es una enfermedad grave acompañada de epidermólisis en menos de 10 % de la superficie corporal total, a menudo asociada a afectación multiorgánica (fiebre, anomalías hematológicas, oftalmológicas y de otros sistemas). Pertenece al espectro más grave de las reacciones adversas a medicamentos mediadas inmunológicamente, entre las que también se encuentran la necrólisis epidérmica tóxica (NET) y la superposición SSJ/NET.2 Un factor pronóstico importante de las reacciones severas a medicamentos es la extensión de la epidermólisis, ya sea espontánea o inducida (signo de Nikolsky).3
Su incidencia anual oscila de uno a seis casos entre un millón de personas y es más común en los individuos de raza asiática y negra.4,5,6,7 Los anticonvulsivantes (fenitoína, fenobarbital y carbamazepina), antibióticos (sulfamidas y cotrimoxazol), antiinflamatorios no esteroideos (AINE), nevirapina y alopurinol son los medicamentos más asociados.8,9 También se han documentado casos por procesos infecciosos (Mycoplasma pneumoniae, virus de la inmunodeficiencia humana, citomegalovirus y virus herpes) y procesos de activación inmune persistente, como el lupus eritematoso sistémico.3
El SSJ se considera una hipersensibilidad retardada de tipo IVc de la clasificación de Gell y Coombs que conduce a citotoxicidad de los queratinocitos.10 La activación de las células natural killer y los linfocitos T CD8+ específicos del fármaco, así como la exocitosis de granzima B, perforina y granulisina son clave para la necrólisis epidérmica. También se ha descrito que la apoptosis de los queratinocitos podría ser inducida por una expresión al alta de Fas desencadenada por TNF-α e IFN-γ derivado de células T activadas.11 Por otro lado, se ha demostrado una relación entre el alelo HLA-B 1502 y el SSJ inducido por carbamazepina, oxcarbazepina, fenitoína y lamotrigina en población china, así como una fuerte relación entre HLA-B 5801 y alopurinol.12
Las manifestaciones iniciales suelen ser fiebre y síntomas inespecíficos como malestar, mialgias, artralgias, disfagia, prurito y ardor conjuntival. La afectación mucocutánea surge uno a tres días después y se caracteriza por máculas con centros purpúricos que posteriormente dan paso a vesículas y ampollas. El desprendimiento epidérmico se presenta tres a cinco días más tarde.13 Los hallazgos histopatológicos corresponden a ampollas subepidérmicas con necrosis generalizada, queratinocitos apoptóticos e infiltrado inflamatorio linfocítico leve.12
El enfoque terapéutico se basa en suspender todos los medicamentos sospechosos. Se ha mantenido interés en el uso de la inmunoglobulina intravenosa, sin embargo, el beneficio de esta terapia aún carece de evidencia sólida; la utilidad de los corticosteroides igualmente parece incierta. Los inmunomoduladores, como la ciclosporina, se han asociado a un resultado prometedor; finalmente, la experiencia con los antagonistas del receptor G-CSF y anti-TNF hasta el momento sigue siendo limitada.2
Dado que la mayoría de los casos de SSJ se debe a medicamentos, es indispensable identificar el fármaco culpable.13,14 El algoritmo de causalidad de fármacos para la necrólisis epidérmica (ALDEN), define la causalidad del medicamento como muy probable, probable, improbable o muy improbable de inducir SSJ/NET15,16 (cuadro 1). Una vez que se identifican los medicamentos sospechosos, se realizan pruebas dirigidas para confirmar el desencadenante. La prueba de parche es la única reexposición medicamentosa que está permitida actualmente, sin embargo, para el SSJ la sensibilidad diagnóstica no supera 25 %. Las pruebas de provocación o pruebas intradérmicas con el fármaco implicado están contraindicadas, por el riesgo de desencadenar nuevamente una reacción.12
Cuadro 1 Algoritmo de causalidad de fármacos para la necrólisis epidérmica (ALDEN)
| Criterio | Valor | Reglas de aplicación |
| Retraso desde la toma del medicamento hasta el inicio de la reacción (día índice) |
Sugestivo +3 | 5 a 28 días |
| Compatible +2 | 29 a 56 días | |
| Probable +1 | 1 a 4 días | |
| Improbable −1 | Más de 56 días | |
| Excluido −3 | En la fecha índice o antes de tomar el medicamento | |
| De presentar una reacción previa con el mismo medicamento, solo hacer cambios para: Sugestivo +3: de 1 a 4 días, Probable +1: de 5 a 56 días | ||
| Droga presente en el cuerpo el día índice (semivida) |
Definido +1 | El fármaco continúa el día índice o se ha detenido en un tiempo inferior a cinco semividas.A |
| Dudoso 0 | El fármaco se ha detenido en un tiempo superior a cinco semividas antes del día índice, pero existe insuficiencia renal o hepática, o hay sospecha de interacción medicamentosaA, B |
|
| Excluyente −3 | El fármaco se ha detenido en un tiempo superior a cinco semividas antes del día índice, pero sin insuficiencia renal o hepática, o si hay sospecha de interacción medicamentosaA, B |
|
| Preexposición/reexposición | Positiva para enfermedad y fármaco +4 |
SSJ/NET después del mismo fármaco |
| Positiva para enfermedad o fármaco +2 |
SSJ/NET después de fármaco similar u otra reacción con mismo fármacoC |
|
| Positiva inespecífica +1 | Otra reacción con fármaco similar | |
| Desconocido 0 | No se conoce exposición previa | |
| Negativo −2 | Exposición previa sin reacción adversa | |
| Retiro del fármaco | Neutral 0 | Fármaco se retira o se desconoce |
| Negativa −2 | Fármaco continúa y reacción mejora | |
| Tipo de medicamento (notoriedad) |
Fuertemente asociado +3 | Fármaco con un elevado riesgo relativo de producir la reacción, respecto a los estudios de casos y controles SCAR |
| Asociado +2 | Fármaco definido, pero con un bajo riesgo relativo de producir la reacción respecto a los estudios de casos y controles SCAR |
|
| Sospechoso +1 | Epidemiología ambigua, pero existen casos descritos | |
| Desconocido 0 | No se conoce relación | |
| No sospechoso −1 | No hay evidencia de asociación | |
| Otras causas | Posible −1 | Si existe un fármaco con puntuación > 3, se resta 1 punto al resto |
Muy improbable < 0; poco probable 0-1; posible 2-3; probable 4-5; muy probable ≥ 6.
AReducción de la vida media de eliminación en suero o tejidos del medicamento o metabolito activo, teniendo en cuenta la función renal y hepática según la vía de eliminación del fármaco.
BSe considera interacción sospechada cuando más de cinco medicamentos estaban presentes al mismo tiempo.
CMedicamento similar: el mismo código ATC (sistema de clasificación de compuestos químicos terapéuticos) hasta el cuarto nivel (subgrupos químicos).
Tomado y traducido de referencia 16.
A continuación se presenta un caso clínico de SSJ con implicación de ibuprofeno y acetaminofén, al cual se le realizó una prueba de provocación con una alternativa antipirética y analgésica.
Caso clínico
Niña de dos años y ocho meses de edad, con antecedente de alergia a la proteína de la leche de vaca y reacción urticarial con el consumo de amoxicilina-clavulanato. Presentó un cuadro clínico de tres días de evolución, caracterizado por síntomas de las vías respiratorias altas, malestar general y fiebre; fue medicada con acetaminofén e ibuprofeno. Al cuarto día de recibir estos fármacos, la paciente presentó máculas eritematovioláceas en cara y extremidades, que desaparecían a la digitopresión, además de lesiones ampollosas en cara (figura 1) y antebrazos; fue hospitaliza por sospecha de síndrome de Dress versus SSJ.
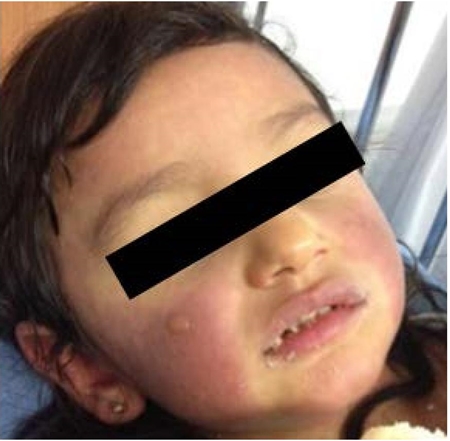
Figura 1 Lesiones confluentes tipo máculas eritematovioláceas en cara, que desaparecían a la digitopresión, además de lesión ampollosa.
Se registraron los siguientes resultados de los exámenes paraclínicos: hemoglobina 15.2 g/dL, hematócrito 43.9 %, leucocitos 9890 células/mm3, neutrófilos 30.6 %, linfocitos 62.5 %, eosinófilos 0.7 %, plaquetas 177 000 células/mm3, proteína C reactiva 0.18 mg/L, alanina aminotransferasa 662 UI/L, aspartato aminotransferasa 386 UI/L, bilirrubina total 0.48 mg/dL, bilirrubina directa 0.43 mg/dL y fosfatasa alcalina 507 UI/L. La ecografía abdominal mostró hígado con aumento de la ecogenicidad como único hallazgo. Se inició manejo con esteroide sistémico, antihistamínico y acetaminofén para el control de la fiebre y se solicitó valoración por alergología y dermatología.
En el segundo día de hospitalización, las lesiones se tornaron generalizadas (figura 2), algunas palpables y que no desaparecían a la digitopresión, se esfaceló la ampolla de la cara (figura 3) y aparecieron úlceras en la mucosa oral. Por la falta de eosinofilia o linfocitos atípicos, las características dermatológicas y extensión de epidermólisis inferior a 10 %, se determinó cuadro compatible con SSJ con posible componente vasculítico, cuyo potenciales desencadenantes fueron el acetaminofén y el ibuprofeno, con una puntuación ALDEN de 0 y 2, respectivamente. Se indicó suspender el acetaminofén, se continuó el manejo con esteroide sistémico y se solicitaron estudios paraclínicos de control y extensión: alanina aminotransferasa 727 UI/L, aspartato aminotransferasa 409 UI/L, lipasa 383 UI/L, gammaglutaril transpeptidasa 201 UI/L, tiempo de protrombina 13.2 segundos (INR: 1), tiempo parcial de tromboplastina 18 segundos, albúmina 3.2 g/dL, creatinina 0.3 mg/dL, C3 85 mg/dL, C4 103 mg/dL, CPK 30 y radiografía de tórax con infiltrados intersticiales pulmonares. Se descartó infección por hepatitis A, B y C, leptospira, micoplasma y citomegalovirus.

Figura 2 En el segundo día de hospitalización, las lesiones se tornaron generalizadas, algunas palpables y que no desaparecían a la digitopresión.
Por persistencia del cuadro clínico, la paciente fue trasladada a la unidad de cuidados especiales y se cambió el manejo a 2 mg/kg de gammaglobulina intravenosa por dos días, además de iniciar protección hepática con N-acetilcisteína. Tras completar el esquema con gammaglobulina se presentó mejoría de la condición clínica, con cierre de lesiones ulceradas de la mucosa oral, lesiones cutáneas con signos de remisión y disminución de las enzimas hepáticas y pancreáticas (aspartato aminotransferasa 103 UI/L, alanina aminotransferasa 318 UI/L, gammaglutaril transpeptidasa 180 UI/L, lipasa 126 UI/L). El reporte de la biopsia de piel indicó toxicodermia sin signos de vasculitis. Después de 10 días de hospitalización, la paciente fue dada de alta, con cuidados de protección e hidratación de la piel y restricción de AINE.
En forma ambulatoria se realizó prueba de parche con ibuprofeno, acetaminofén, naproxeno, dipirona, diclofenaco, ketoprofeno y ácido acetilsalicílico, con resultados negativo. Debido a la restricción total de AINE, el caso se comentó con el equipo de alergología de la IPS Universitaria en Medellín, con el objetivo de establecer alternativas antipiréticas. Inicialmente se consideró retar con acetaminofén, sin embargo, existía riesgo inherente de desencadenar una nueva rección, por lo que se decidió realizar provocación oral con otros fármacos. Se administró dosis usual de nimesulida oral, con la cual no se presentaron reacciones inmediatas ni tardías. Posteriormente se decidió ofrecer una opción parenteral y se realizó prueba de provocación intravenosa con dipirona; se llevó a cabo vigilancia intrahospitalaria por 48 horas en un protocolo de administración de 10, 30, 60 %, separando cada dosis por una hora, para un total de 400 mg de dipirona. La prueba de provocación fue negativa para reacciones inmediatas y tardías. La paciente fue dada de alta por el servicio de alergología y se indicó usar nimesulida oral o dipirona oral o parenteral en caso de requerir medicación analgésica, antiinflamatoria o antipirética.
Discusión
Las enfermedades infecciosas de carácter febril son comunes en la edad pediátrica, particularmente en lactantes y preescolares. El control de la temperatura es parte del manejo médico de estas entidades, tanto para disminuir la morbilidad causada por la fiebre, como para prevenir el riesgo latente de convulsión febril.17 Entre las medidas recomendadas están los fármacos y las medidas físicas, sin embargo, estas últimas tienen eficacia limitada.18 La contraindicación estricta de los AINE limita el arsenal terapéutico, por lo que se justifica la búsqueda de una alternativa antipirética en un paciente pediátrico con reacción cutánea grave.
La baja rentabilidad de la prueba de parche, además de su baja sensibilidad (inferior a 30 %), no permite asegurar la tolerancia a un AINE alternativo, por lo que es imperativo realizar una prueba de provocación oral, cuando no está contraindicada.19 En vista de los pocos casos reportados de SSJ por acetaminofén, se pensó en realizar un reto controlado con este medicamento para descártalo como implicado en la reacción; finalmente no se llevó a cabo ya que implicaba un riesgo innecesario para la paciente. Aunque pudiese existir un riesgo teórico de desencadenar nuevamente la reacción con alternativas farmacológicas, la recurrencia del SSJ es poco común.2 Se realizó una búsqueda en PubMed sin filtros de idioma o año de publicación: ((OFC [Title]) OR Challenge [Title])) AND ((SJS [Title]) OR Stevens* [Title])), sin encontrar artículos relacionados con la recurrencia de SSJ posterior a una prueba de provocación con un AINE alternativo. Considerando la fisiopatología del SSJ y dado que se trata de una reacción específica de antígeno, se decidió realizar una provocación oral con un antipirético estructuralmente diferente.
Se dispone de naproxeno oral para la administración en niños, sin embargo, es estructuralmente similar al ibuprofeno; respecto al meloxicam, no hay estudios de seguridad en menores de 12 años; por su parte, el diclofenaco tiene notoriedad importante en el algoritmo ALDEN.9 La nimesulida se considera un inhibidor COX-1 preferencial y aunque no se especifica su uso en pacientes pediátricos, representa una opción viable. Por otro lado, la dipirona es usada en Colombia intrahospitalariamente en los servicios de pediatría.
Posterior a la realización de las pruebas de provocación con nimesulida y dipirona, y sus respectivos resultados negativos, se reforzó la idea de que las reacciones cutáneas graves inducidas por los fármacos se originan por mecanismos fisiopatológicos altamente selectivos de antígeno, lo que permite sugerir la hipótesis de que las pruebas de provocación con alternativas farmacológicas estructuralmente diferentes son seguras en los pacientes con SSJ.
Conclusiones
El caso descrito es el primero publicado en la literatura acerca de una prueba de provocación negativa con nimesulida y dipirona en un paciente con antecedente de SSJ por AINE, en el que estuvieron implicados acetaminofén e ibuprofeno. Este reporte apoya la hipótesis de que las reacciones alérgicas mediadas por células, como sucede con el SSJ, tienen alta selectividad por su antígeno y pobre reactividad cruzada, lo que sugiere que una prueba de provocación con una alternativa farmacológica estructuralmente diferente puede ser útil para definir los medicamentos seguros para los pacientes con SSJ, sin embargo, se requieren estudios adecuados para confirmar esta observación.











 nueva página del texto (beta)
nueva página del texto (beta)




