Antecedentes
La enfermedad de Kawasaki (EK) es la segunda vasculitis más frecuente en la infancia, de etiología desconocida, que afecta vasos de mediano calibre, particularmente arterias coronarias, y constituye la causa más frecuente de cardiopatía adquirida en la infancia.1
El diagnóstico de EK es clínico conforme los criterios establecidos por la American Heart Association 2004, actualizados en 2017, con la fiebre como criterio mayor y cuatro de los siguientes cinco criterios menores para la forma completa:2
Conjuntivitis bilateral no supurativa.
Cambios en labios y mucosa oral.
Eritema polimorfo.
Adenopatía cervical.
Edema/eritema palmoplantar.
Se considera EK incompleto cuando se presenta la fiebre y menos de cuatro criterios menores, EK atípica cuando existen manifestaciones clínicas no descritas en los criterios diagnósticos. Recientemente se indica el síndrome de choque por enfermedad de Kawasaki (SCEK), que se define por la presencia EK con hipotensión arterial sistólica para la edad, disminución sostenida > 20 % de la presión arterial sistólica, signos clínicos de hipoperfusión tisular y cambios en el estado mental no considerados por otras condiciones. Se ha demostrado que las formas incompletas y atípicas incrementan el riesgo para el desarrollo de lesiones coronarias, con peor pronóstico y mayor mortalidad.3,4
Caso clínico
Lactante de cinco meses de edad con fiebre de una semana de evolución (dos a tres episodios al día), evacuaciones diarreicas de seis a ocho al día, sin moco ni sangre. Tratado con tres dosis de amikacina intramuscular sin mejoría; se sospechó reacción adversa al antibiótico por dermatosis no especificada. El paciente fue ingresado a urgencias por persistencia de fiebre, diarrea, irritabilidad y signos de deshidratación. En la valoración inicial se encontró irritable y con datos de choque: frecuencia cardiaca de 156 latidos/minuto, frecuencia respiratoria de 48 respiraciones/minuto, temperatura de 38.5 ºC y tensión arterial de 68/42 mm Hg, con presión arterial media de 45 mm Hg, llenado capilar de 3 segundos y pulsos débiles.
Se inició reanimación hídrica con 20 mL/kg/dosis de solución cristaloide, cefotaxima, metronidazol e inotrópico por sepsis grave con foco abdominal. Al estabilizar al paciente se observó exantema urticariforme en tórax, abdomen y extremidades inferiores, eritema en zona de aplicación de la vacuna BCG (figura 1), eritema y edema palmoplantar, así como hipoventilación basal bilateral a la auscultación torácica. Los estudios de laboratorio mostraron leucocitosis (18 070 células/mm3), segmentados de 70 %, anemia microcítica normocrómica (hemoglobina de 9.2 g/dL, volumen corpuscular medio de 75.1 fL, MCH de 24.9 pg), trombocitopenia (65 000/mm3), proteína C reactiva (PCR) de 14.62 mg/dL, leucocituria e hipoalbuminemia (2.9 g/dL). En la radiografía de tórax se observó infiltrado intersticial bilateral y con la punción lumbar se obtuvieron los siguientes resultados: 44 células/mm3 (50 % de polimorfonucleares neutrófilos humano), glucosa de 68 mg/dL, proteínas de 41.2 mg/dL, tinción de Gram y coaglutinación negativa.

Figura 1 Eritema polimorfo en tronco y extremidades, confluente, tipo urticariforme. Reacción eritematosa en la zona de aplicacion de la vacuna BCG.
Por los hallazgos clínicos y de laboratorio se sospechó SCEK (cuadro 1), por lo que se administró inmunoglobulina intravenosa (2 g/kg/dosis), 30 mg/kg/dosis de metilprednisolona y 50 mg/kg/día de ácido acetil salicílico. El ecocardiograma demostró dilatación de la arteria coronaria derecha (CD) con índice Z de +3.87, y del origen de la descendente anterior izquierda (DA) con índice Z de +3.47 (figura 2); se apreció taquicardia sinusal. La evolución clínica fue favorable con remisión de la fiebre a las 24 horas.
Cuadro 1 Diagnóstico de la enfermedad de Kawasaki
| Criterios | Enfermedad de Kawasaki | Paciente | |
| Clínicos | Fiebre+ | Al menos 5 días | 7 días |
| Cambios en cavidad oral y labios+ |
Eritema y agrietamiento de labios, lengua aframbuesada, eritema de mucosa oral y faríngea |
No | |
| Conjuntivitis+ | Inyección conjuntival bilateral no exudativa | No | |
| Exantema+ | Maculopapular, eritrodermia difusa o eritema multiforme |
Eritema urticariforme confluente | |
| Manos y pies+ | Edema y eritema en manos y pies o descamación periungueal |
Edema de manos y pies | |
| Adenopatías+ | Adenopatías cervicales (> 1.5 cm de diámetro), usualmente unilateral |
No | |
| Aparato gastrointestinal |
Diarrea, vómito, dolor abdominal, ictericia, hidrops vesicular |
Dolor abdominal, diarrea | |
| Sistema músculo esquelético |
Artritis, artralgia | No | |
| Sistema nervioso central | Irritabilidad, parálisis facial | Irritabilidad | |
| Eritema en el sitio de inoculación de la vacuna BCG/eritema de la zona del pañal |
Eritema e induración | BCGítis | |
| Sistema circulatorio* | Hipotensión | Presente | |
| De laboratorio |
Biometría hemática | Leucocitosis, neutrofilia, trombocitopenia, trombocitosis, hemoglobina < 10 g/dL |
Leucocitosis (18 070), neutrofilia (70 %) anemia (9.2 g/dL), trombocitopenia (65 000/mm3) |
| PCR | > 3 mg/dL | 14.62 mg/dL | |
| VSG | > 40 mm/hora | — | |
| Sodio | Hiponatremia, < 135 mmol/L | 135.5 mmol/L | |
| Albúmina | < 3 g/dL | 2.9 g/dL | |
| Enzimas hepáticas | Elevación de alanina aminotransferasa | Alanina aminotransferasa 65 UI/L (normal 0-41 UI/L) |
|
| Examen general de orina |
Piuria estéril (> 10 leucocitos por campo) | Leucocitos 16-18 por campo | |
| Examen citoquímico de líquido cefalorraquídeo |
Pleocitosis | 44 células/mm3 | |
| Imagen | Radiografía de tórax | Infiltrado intersticial o peribronquial, nódulos pulmonares |
Infiltrado intersticial bilateral |
| Ecocardiograma | Puntuación Z de la DA izquierda o CD ≥ 2.5. Se observa aneurisma de la arteria coronaria o tres o más otras características sugestivas, incluyendo disminución de la función ventricular izquierda, regurgitación mitral, derrame pericárdico |
Ecocardiograma 1: dilatación de arteria CD (índice Z +3.87) y del origen de la coronaria DA (índice Z +3.47). Ecocardiograma 2: origen de la arteria CD (índice Z +16), origen de la coronaria DA (índice Z +9). |
|
+Criterios clínicos en la enfermedad de presentación clásica.
*El síndrome de choque por enfermedad de Kawasaki se diagnostica con hipotensión en el contexto de la enfermedad de Kawasaki.
CD = coronaria derecha, DA = descendente anterior.

Figura 2 En el ecocardiograma se observa dilatación de la arteria coronaria derecha y del origen de la arteria descendente anterior (punta de flecha).
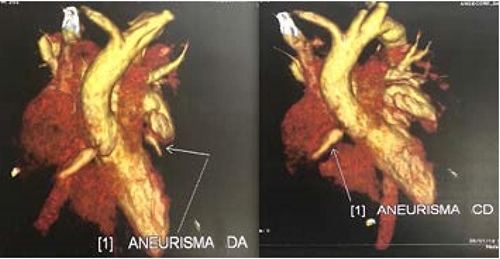
El paciente fue egresado al quinto día con dosis de 0.5 mg/kg/día de prednisona y 5 mg/kg/día de ácido acetil salicílico. El ecocardiograma a las dos semanas reportó incremento de las lesiones en ambas arterias coronarias, CD con índice Z +16, coronaria izquierda (CI) con índice Z +8, DA con índice Z +9 y Cx de 3.1 mm (figura 3). La angiotomografía (figura 4) mostró tres aneurismas, dos de los cuales eran fusiformes localizados en DA (3.5 mm) y de origen en la Cx (2.5 mm), catalogados como medianos; además de un aneurisma gigante de la CD (7 mm). Con estos hallazgos se agregó anticoagulación con 1 mg/kg/día de enoxaparina subcutánea. Actualmente el paciente se encuentra asintomático con persistencia de las lesiones coronarias descritas.
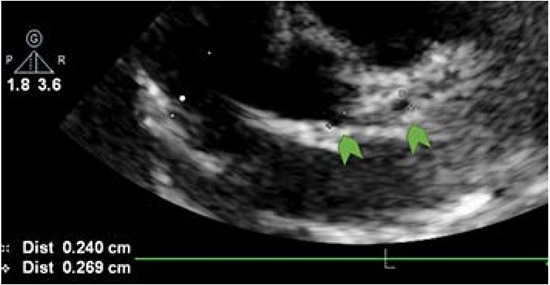
Figura 3 Ecocardiograma de control que evidencía dilatación aneurismática del origen de la arteria coronaria derecha (índice Z +16) y origen de la arteria coronaria descendiente anterior (índice Z +9).
Discusión
El diagnóstico de EK es clínico, con los criterios descritos por Tomisaku Kawasaki, vigentes en la declaración de la American Heart Association de 2017.2 El tratamiento establecido con inmunoglobulina intravenosa reduce el riesgo de lesiones coronarias a menos de 5 %; sin embargo, se han descrito diversas presentaciones que pueden confundir al clínico, como EK incompleta en 10 % de los casos, EK atípica hasta en 20 % (que abarca manifestaciones no descritas en los criterios diagnósticos), EK sin fiebre y SCEK en 5 a 7 % de los casos, que representan un factor de riesgo significativo para el desarrollo de lesiones coronarias.5
La reactivación del sitio de aplicación de la vacuna BCG es considerada una manifestación temprana y específica, observada hasta en 30 a 50 % de los casos de EK en Japón y de 24.3 % en México.6,7
La EK incompleta es más frecuente en menores de seis meses, en quienes la fiebre y la irritabilidad suelen ser las únicas manifestaciones. El riesgo de aneurisma coronario se eleva hasta 43.6 % en comparación con 19.5 % en los infantes mayores de seis meses.8 Por su parte, la EK atípica abarca manifestaciones no incluidas en los criterios diagnósticos: edad menor de un año o adolescentes, fiebre ≥ 9 días, falla renal o hepática, dolor abdominal, hidrops vesicular, hepatitis, colangitis, pancreatitis, meningitis aséptica, uveítis, hipoacusia, artritis, uretritis, derrame pleural, parálisis de nervios faciales, eritema en la zona del pañal o sitio de aplicación de la BCG, este último tiene una fuerte asociación con el diagnóstico.9
En 2009, Kanegaye et al. describieron el SCEK: 7 % de los individuos con EK desarrollaron hipotensión arterial sistólica para la edad, disminución sostenida de la presión arterial sistólica desde el inicio ≥ 20 % o signos clínicos de hipoperfusión.4 Gámez-González et al. realizaron la descripción de los casos y series publicadas hasta 2017; en total registraron 103 pacientes con edad media al diagnóstico de 62.6 meses, EK incompleta (32 %), manifestaciones atípicas (45.6 %), síntomas gastrointestinales (74.6 %), anormalidades en arterias coronarias (72.8 %), con una relación estadísticamente significativa del sexo masculino, resistencia a la inmunoglobulina intravenosa (49 %), uso de inotrópicos, insuficiencia cardiaca, dolor abdominal y manifestaciones neurológicas; respecto a los hallazgos de laboratorio registraron hipoalbuminemia, hiponatremia e insuficiencia hepática. La presencia de aneurismas gigantes se reportó en 4.8 % y la mortalidad, en 6.8 %.10 El cuadro 2 describe los casos de SCEK en menores de 12 meses, 53 % varones, 46.6 % EK incompletos, anormalidades de las arterias coronarias 72.7 % (8/11), leucocitosis, anemia, trombocitopenia, velocidad de sedimentación globular y PCR elevadas e hipoalbuminemia como los hallazgos constantes. También se registraron síntomas neurológicos y gastrointestinales; como manifestaciones iniciales, aneurismas gigantes (> 8 mm), síndrome de activación macrofágica, así como una defunción.3,11,12,13,14,15,16,17,18,19 Los primeros dos casos se registraron antes de que se definiera el SCEK, si bien se cumplieron los criterios diagnósticos.
Cuadro 2 Principales hallazgos de los casos publicados de síndrome de choque por enfermedad de Kawasaki menores de 12 meses
| Autor | Edad (meses) |
Sexo | Criterios EK |
Hallazgos clínicos relevantes |
Alteraciones cardiacas |
Tratamiento | Resistencia a IgIV |
Estudios de laboratorio relevantes |
||
| Gamillscheg et al.11 |
7 | M | Incompleto b, d |
Convulsiones, irritabilidad, pulsos periféricos disminuidos, hepatomegalia, hipotensión arterial y falla respiratoria, edema cerebral y SFOM |
FEVI 30 % Trombo en Cx. Biopsia: pericarditis fibrinoide, panvasculitis y perivasculitis en CI |
gIV, IgIV, CS, aminas |
No | Hemoglobina 9.5 g/dL, leucocitos 38 000/mm3 (PMN 68 %), PCR 14.4 mg/dL, sodio 120 mmol/L, BT 21.5 mg/dL, AST 131 UI/L, CPK 920 UI/L, DHL 2780 U/L, |
||
| Johnson et al.12 |
3 | M | Incompleto b, e |
Vómito, tensión arterial 50/30 mm Hg, Llc 4 s, gangrena de extremidades, |
Aneurisma CD 5 mm y CI 5.5 mm, aneurismas ilíacos y axilar con trombo intraluminal |
LIV, IgIV, aminas epoprostenol, enoxaparina, abciximab, alteplase |
Leucocitos 28,000/mm3 (PMN 66 %), VSG 17 mm Hg, PCR 1.9 mg/dL, |
|||
| Kanegaye et al.4 |
1.6 | F | ND | T/A 74/33 mm Hg | SCEK, AAC (62 %) |
Pleocitosis en líquido cefalorraquídeo (83 %) |
LIV, IgIV | 64 % |
TTPa 46 s, dímero D 1:2, plaquetas 63 000/mm3, fibrinógeno 134 mg/dL |
|
| 4 | M | 45/22 mm Hg | Dímero D positivo | |||||||
| Watanabe et al.13 |
6 | M | Completo a, b, c, d, |
Hiporexia, tos, disfonía, somnolencia, Llc retardado, tensión arterial 87/40 mm Hg, SpO2 80 % |
ND | LIV, IgIV | No | Hemoglobina 10.6 g/dL, leucocitos 30 400/mm3, plaquetas 445 000/mm3, PCR 11.8 mg/dL |
||
| Thabet et al.14 |
5 | F | Incompleto a, b, d |
Hiporexia, hipoactividad, Tensión arterial 70/35 mm Hg, Llc 5 s, BCGítis |
Día 16: Aneurismas gigantes CD, y DA |
LIV, IgIV, CS, aminas, enoxaparina, pulso de CS e infliximab |
Sí | Hemoglobina 9.5 g/dL, leucocitos 21 800/mm3 (PMN 87 %), plaquetas 151 000/mm3, VSG 42 mm Hg, PCR 18.4 mg/dL, TTPa 63s, dímero D 3930 μg/L, AST 77 UI/L, ALT 54 UI/L, BT 1.24 mg/dL, BD 1.06 mg/dL, albúmina 2.6 g/dL |
||
| Gatterre et al.15 |
6 | M | Completo ND |
11 pacientes con irritabilidad (72 %), SFOM (73 %), síntomas gastrointestinales (82 %) |
FEVI 35 % sin AAC |
LIV , ND | Sí |
PMN 18 500/mm3, plaquetas 449 000/mm3 |
||
| 7 | F | Incompleto ND |
FEVI 37 % Con AAC |
LIV , ND | Sí | Leucocitos 12 000/mm3 | ||||
| Gámez- González et al.3 |
3 | F | Completo ND |
Diarrea | Aneurismas CD 6 mm, CI 8 mm. |
LIV, aminas | No | Leucocitos 13 400/mm3, sodio 132 mmol/L, AST 45 U/L, albúmina 3.2 g/dL |
||
| 4 | M | Incompleto ND |
Meningitis aséptica, vómito y diarrea. |
CD 7 mm, CI 8 mm |
IgIV no aplicada |
— | Hemoglobina 9.9 g/dL, leucocitos 30 800/mm3, TP 43 s, TTPa 47 s, sodio 134 mmol/L, albúmina 2 g/dL, BT 4.9 mg/dL, BD 2.9 mg/dL |
|||
| 10 | M | Completo ND |
— | CD 11 mm, CI 9 mm | LIV, aminas | Sí | Leucocitos 18 200/mm3, plaquetas 592 000/mm3, sodio 129 mmol/L, ALT 61 U/L, albúmina 2 g/dL, |
|||
| Chen et al.16 |
1.2 | F | Incompleto b, d, e |
Convulsión, insuficiencia respiratoria, BCGítis, descamación perianal |
9 pacientes con SCEK, hombres (33 %), EK incompleto (22 %), AAC (77.8 %), BCGítis (55.5 %). |
|||||
| 4.8 | M | Completo a, b, d, e |
Sangrado gastrointestinal BCGítis, descamación perianal |
|||||||
| 10.8 | F | Completo a, b, d, e |
Gastroenterocolitis, sepsis, hipotensión |
|||||||
| Del Monte et al.17 |
10 | F | Completo a, b, c, d, e |
Somnolencia, tensión arterial 68/34 mm Hg, Llc 3 s, BCGítis, descamación perianal |
Derrame pericárdico leve, CD con Z +2.98 |
LIV, IgIV, CS | No | Hemoglobina 9.4 g/dL, leucocitos 12 600/mm3, VSG 54 mm Hg, PCR 2.41 mg/dL, albúmina 2.5 g/dL, piuria estéril | ||
| Ma et al.18 | 2 | F | Incompleto e |
Sepsis, fiebre de origen desconocido |
21 pacientes con SCEK, hombres (52.3 %), EK incompleto (23.8 %), LIV, CS e IgIV (100 %), BNP > 400 pg/mL (52 %), SAM (9.5 %) |
|||||
| Lin et al.19 | 5 | M | Completo a, b, d, e |
Tensión arterial 65/35 mm Hg, Llc retardado, hepatoesplenomegalia, SAM |
CD 2.3mm, CI 2.8 mm |
gIV, IgIV, CS, aminas, warfarina, protocolo HLH-04 |
Sí | Hemoglobina 6.7 g/dL, leucocitos 54 230/mm3, PCR 6.9 mg/dL, albúmina 2.6 g/dL, plaquetas 67 000/mm3, ferritina 283.1 ng/mL, fibrinógeno 167 mg/dL, triglicéridos 163.6 mg/dL, actividad NK baja, CD 25 soluble 19765 pg/mL. | ||
EK = enfermedad de Kawasaki, PMN = polimorfonucleares, LIV = líquidos intravenosos, IgIV = inmunoglobulina intravenosa, CS = corticosteroides, BT = bilirrubina total, BD = bilirrubina directa, BNP = péptido natriurético atrial, SAM = síndrome de activación macrofágica, SFOM = síndrome de falla orgánica múltiple, Llc = llenado capilar, CD = coronaria derecha, CI = coronaria izquierda, Cx = coronaria circunfleja, TTPa = tiempo parcial de tromboplastina, AAC = anormalidades de arterias coronarias, PCR = proteína C reactiva, ND = no disponible.
Criterios de enfermedad de Kawasaki: a) Inyección conjuntival bilateral no exudativa. b) Lesiones orofaríngeas con eritema oral o fisura de labios o lengua aframbuesada. c) Adenopatía cervical de 1.5 cm de diámetro unilateral. d) Exantema polimorfo. e) Edema o eritema de manos y pies.
En la fisiopatología se ha propuesto la participación de superantígenos, la sobreexpresión de citocinas proinflamatorias combinada con intensa inflamación, que se traduce en mayor fuga vascular y disfunción miocárdica, así como falla orgánica múltiple.
Conclusión
La enfermedad de Kawasaki en la actualidad tiene un amplio abanico de presentaciones clínicas, desde las formas completas hasta condiciones graves como SCEK, con elevado riesgo de lesiones coronarias, falla multiorgánica y muerte súbita, por lo que la identificación de factores de riesgo constituye un reto diagnóstico para el clínico, para estar en posibilidad de ofrecer un tratamiento oportuno . El caso que presentamos reúne factores de riesgo y criterios de EK incompleta, atípica y SCEK, con desarrollo de aneurismas coronarios gigantes.











 nova página do texto(beta)
nova página do texto(beta)