Antecedentes
El virus de la inmunodeficiencia humana (VIH) es un retrovirus causante del síndrome de inmunodeficiencia adquirida (sida), cuyo cuadro fue descrito hace tres décadas. En 2016, un millón de personas fallecieron en el mundo por causas relacionadas con este virus. A finales de ese año había aproximadamente 36.7 millones de personas infectadas en el planeta y se produjeron 1.8 millones de nuevas infecciones.1,2,3
En México, las cifras de personas con diagnóstico de sida de acuerdo con el Centro Nacional para la Prevención y Control del VIH y el sida desde 1983 a 2019 fue de 207 369 casos. Los estados de la república con mayor índice de casos de VIH fueron Quintana Roo, Campeche Yucatán, Veracruz, Tabasco y los estados con mayor incidencia de sida fueron Campeche, Quintana Roo, Yucatán, Morelos y Baja California Sur.4 Más de 80 % de los adultos infectados en el mundo con VIH-1 se debe a la exposición de las superficies de las mucosas y 20 % a inoculación percutánea o intravenosa.5 Las células infectadas por el virus son los linfocitos; se ha demostrado que los linfocitos T CD8 descienden en paralelo a los linfocitos T CD4 y su reducción está relacionada con la progresión a sida.6 La desaparición de los linfocitos T CD4 TH1 y TH17 responsables de activar macrófagos y neutrófilos permite la adquisición de infecciones intracelulares oportunistas características del sida (fúngicas y bacterianas).7,8.9 Los Centers for Disease Control de Estados Unidos clasifican la infección por VIH según el recuento absoluto de CD4:
Etapa 0, infección temprana.
Etapa 1, CD4 > 500 células/mL.
Etapa 2, CD4 200-499 células/mL.
Etapa 3, CD4 < 200 células/mL.
Las categorías clínicas se agrupan en A, B y C, la última es la de mayor gravedad.10 La profilaxis con trimetoprim-sulfametoxazol (TMP-SMZ) se ha utilizado desde los inicios de la epidemia para prevenir infecciones como la neumonía por Pneumocystis jirovecii en personas infectadas por el VIH y sirve para prevenir y tratar diversas infecciones bacterianas, fúngicas y protozoarias.11 El TMP-SMZ se asocia con reacciones de hipersensibilidad en 1 a 3 % de la población general; existen estudios que reportan que en pacientes con infección por VIH, la frecuencia es mucho mayor, aproximadamente de 30 % en quienes reciben dosis profilácticas y hasta de 50 % en quienes reciben dosis para tratamiento de infecciones oportunistas.12
Diversos estudios epidemiológicos han mostrado que la frecuencia de reacciones de hipersensibilidad al TMP-SMZ en pacientes infectados por VIH varía en relación con los niveles de linfocitos CD4, con un descenso en la incidencia de reacciones asociado a cifras muy altas o extremadamente bajas de linfocitos CD4. El sexo masculino y la raza blanca también parecen incrementar el riesgo de reacciones.12 Se ha encontrado que una relación CD4:CD8 > 0.1 y el tratamiento durante < 14 días pueden ser factores predictivos independientes de hipersensibilidad.13
También se ha descrito que un recuento bajo de células CD4 al inicio del estudio y el uso de terapia antirretroviral antes de comenzar la profilaxis de TMP-SMZ en pacientes infectados por VIH pueden ser predictores de reacciones adversas a medicamento (RAM).14 De igual forma, se menciona que la dosis de TMP-SMZ puede ser un factor de riesgo para el desarrollo de RAM. Sin embargo, el factor de riesgo para presentar reacciones adversas atribuibles a TMP-SMX sigue siendo poco conocido.
El objetivo del presente trabajo es determinar las reacciones adversas a TMP-SMZ y sus factores de riesgo en pacientes con sida.
Métodos
Estudio descriptivo y analítico observacional comparativo, retrospectivo y transversal, en el que se revisaron los expedientes de pacientes con sida atendidos en el Centro Ambulatorio para la Prevención y Atención del Sida de Puebla. Se incluyeron pacientes > 18 años ingresados en el Centro durante 2018 quienes tuvieran diagnóstico confirmado de VIH y que presentaran RAM entre enero de 2018 y mayo de 2019, incluso quienes reportaran específicamente reacciones por TMP-SMZ. Se capturaron las siguientes variables: edad, sexo, conteo de CD4, categoría clínica de infección, preferencia sexual, reacciones adversas a otros fármacos, además de TMP-SMZ, tipo de RAM, temporalidad de la RAM y comorbilidades.
Se obtuvieron promedios, desviación estándar, razón de momios (RM), U de Mann-Whitney, chi cuadrada y regresión logística binaria.
Resultados
Se revisaron 319 expedientes de pacientes > 18 años ingresados durante 2018, en quienes se reportó una frecuencia de reacciones adversas de 13.16 %, que correspondió a 42 pacientes. Los fármacos causantes de dichas reacciones se muestran en la figura 1.
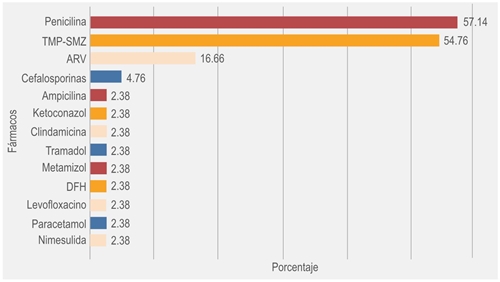
Figura 1 Fármacos asociados con reacciones adversas a medicamentos en pacientes con infección por el virus de la inmunodeficiencia humana. TMP-SMZ = trimetoprima-sulfametoxazol, ARV = antirretroviral, DFH = difenilhidantoínas (n = 42 pacientes).
De los 42 pacientes que presentaron RAM, 23 fueron a TMP-SMZ (54.76 %), todos pertenecientes al sexo masculino, cuatro de ellos (20.83 %) presentaron reacciones adversas a otros fármacos. El promedio de edad en los pacientes que desarrollaron reacciones adversas a TMP-SMZ fue de 29.43 ± 7.1 años, la mediana de 29 años y una tendencia polimodal; 23 años fue la moda más pequeña; el intervalo fue de 22 a 51 años. La distribución de las edades en este grupo fue normal (p = 0.407) con la prueba de normalidad de Shapiro-Wilk. De los 23 pacientes, se registró que 15 (75 %) eran homosexuales, tres pacientes (13 %) heterosexuales, dos pacientes (8 %) bisexuales y uno (4 %) transexual (figura 2).

Figura 2 Preferencia sexual en pacientes con infección por el virus de la inmunodeficiencia humana y reacción adversa a sulfas (n = 23 pacientes).
Las reacciones adversas registradas se presentan en la figura 3, donde se muestra que el rash representó 56.5 %, el angioedema 21.73 % y la urticaria 17.39 %.

Figura 3 Presentación de reacción adversa a sulfas en pacientes con infección por el virus de la inmunodeficiencia humana (n = 23)
De los 23 pacientes que presentaron reacciones adversas por TMP-SMZ, solo 15 fueron incluidos para la valoración de factores de riesgo porque tenían la determinación de los niveles de CD4 en el momento de la reacción adversa; fueron contrastados con 15 pacientes con sida sin reacciones adversos a TMP-SMZ.
Se compararon las características de los grupos con y sin reacciones adversas por TMP-SMZ en casos y controles, respectivamente (cuadro 1), los cuales fueron comparables en sus características; se obtuvo una p > 0.05 en cada variable, lo que mostró la similitud entre los grupos (cuadro 1).
Cuadro 1 Comparación de características de pacientes con sida con y sin reacción adversa a trimetoprima-sulfametoxazol
| Con RAM (n = 15) |
Sin RAM (n = 15) |
p | |
|
|
|||
| Edad en años (promedio) |
29 | 32 | t = 0.234 |
| n | n | ||
| Sexo masculino | 15 | 13 | |
| Sexo femenino | 0 | 2 | EF = 0.483 |
| Homosexual | 12 | 10 | |
| Heterosexual | 3 | 5 | χ2 = 0.409 |
EF = prueba exacta de Fisher.
Se incluyó el conteo de CD4, la comorbilidad infecciosa y la dosis de TMP-SMZ para determinar si eran factores de riesgo para reacciones adversas por TMP-SMZ en los pacientes con sida (cuadro 2).
Cuadro 2 Factores de riesgo para reacciones adversas a trimetoprima-sulfametoxazol en pacientes con sida
| RM | IC 95% | p | |
| Comorbilidades* | 2.6 | 0.521-13.60 | 0.239 |
| CD4 < 100 | 6.9 | 0.542-88.0 | 0.137 |
| Dosis > 160/800 mg | 12.7 | 1.591-102.7 | 0.017 |
*Comorbilidades infecciosas. Regresión logística multivariada binaria. RM = razón de momios.
Las pruebas ómnibus del coeficiente del modelo mediante chi cuadrada indicaron que el modelo como grupo tuvo un aporte significativo en la predicción de reacciones adversas a TMP-SMZ, con p = 0.011. La R2 de Nagelkerke mostró que 41.3 % de este bloque de factores aportó a la predicción de reacciones adversas a TMP-SMZ, aunque solo la dosis > 160/800 mg tuvo significación estadística (p < 0.05).
Discusión
Entre los resultados obtenidos de las RAM en piel, el TMP-SMZ provocó 54.76 % de todas las reacciones en nuestro estudio, ligeramente abajo de las penicilinas; sin embargo, el resultado es muy relevante considerando que el TMP-SMZ es el medicamento de elección en la prevención y tratamiento de enfermedades infecciosas en el paciente con sida y su utilización puede ser muy prolongada. La frecuencia de RAM coincidió con la señalada en la literatura (entre 40 y 60 %).15
Las características epidemiológicas más frecuentes en los individuos con sida fueron el sexo masculino y la homosexualidad, las cuales no se incluyeron en el estudio de factores de riesgo por estar presentes en forma similar en ambos grupos. Los síntomas clínicos más relevantes observados fueron el rash eritematoso, seguido del angioedema y la urticaria; otros estudios también reportan al rash cutáneo como la expresión clínica más frecuente en estos casos.16
En esta investigación se incluyeron dos poblaciones con sida, una con reacciones adversas a TMP-SMZ y la otra sin reacciones adversas a estos medicamentos. Se efectuó un análisis comparativo de características epidemiológicas de ambos grupos en el que se incluyeron edad, sexo y preferencia sexual, sin que se encontraran diferencias estadísticamente significativas entre los grupos, lo que mostró que eran comparables.
La comorbilidad infecciosa mostró una RM = 2.6 y el conteo de CD4 < 100, una RM = 6.9, lo que coincide con los resultados informados en otras publicaciones.12 Estos dos factores no alcanzaron significación estadística, lo cual se relacionó con el pequeño tamaño de la muestra. Para CD4 se calculó que el tamaño necesario mínimo para alcanzar significación estadística, de acuerdo con la exposición (de 46 % en los casos y 26 % en los controles, con IC 95 % y potencia de 80 %) es de 89 pacientes. Los resultados de CD4 concuerdan con los de Rebaud et al. en cuanto a que los niveles bajos se relacionan con más reacciones adversas cutáneas por TMP-SMZ;17 la dosis fue un factor de riesgo con significación estadística (RM = 12.7), lo que expresa que a mayor dosis, mayor riesgo de reacciones adversas. Los resultados concuerdan con los publicados por Chang et al., quienes encontraron una relación de riesgo para reacciones adversas a TMP-SMZ con dosis ≥ 16 mg/kg, con un cociente de riesgo de 3.8 (p = 0.009).18
Conclusiones
El TMP-SMZ en los pacientes con sida fue la causa de 54 % de las reacciones adversas a medicamentos en nuestro estudio, porcentaje alto y acorde con el reportado en la literatura. Las comorbilidades infecciosas y la población de linfocitos CD4 < 100 mostraron un riesgo de 2.6 y 6.9, respectivamente, sin alcanzar significación debido al tamaño de la muestra; sin embargo, podemos considerarlas como factores de riesgo. Se confirmó que la dosis de TMP-SMZ > 160/800 mg es un factor de riesgo (RM = 12.7) con significación estadística. Es importante ampliar el estudio a más años de seguimiento para obtener un tamaño de muestra que permita detectar los factores de riesgo en sida para reacciones adversas a TMP-SMZ.











 nueva página del texto (beta)
nueva página del texto (beta)



