Antecedentes
Las revisiones sistemáticas y los metaanálisis se utilizan cada vez más para la toma de decisiones en medicina, tanto en el proceso diagnóstico-terapéutico de un paciente en particular, como para elaborar un proyecto de investigación o planear políticas de salud. Sin embargo, a pesar de que este tipo de investigación ya tiene varias décadas, su utilización no está ampliamente difundida, probablemente por el desconocimiento de sus alcances, ventajas y confiabilidad.1,2
Existen diferentes definiciones para las revisiones sistemáticas; una de las más aceptadas es “revisión que ha sido preparada mediante un proceso sistemático para minimizar los sesgos y los errores aleatorios, lo cual se documenta en la sección de material y métodos”, cuyos autores son Ian Chalmers y Douglas Altman (dos de los principales pioneros). En esta definición se da a entender que una revisión sistemática es un proyecto de investigación, en el cual se incluyen los estudios primarios u originales de un mismo tema.3,4 Las revisiones sistemáticas son investigaciones secundarias, dado que compilan los resultados publicados que se obtuvieron a partir de estudios en seres humanos.
Por su parte, metaanálisis es el término utilizado para describir el análisis estadístico de la combinación de los resultados de dos o más estudios originales; estos últimos, debieron ser seleccionados a partir de una revisión sistemática. De esta forma, todo metaanálisis constituye una revisión sistemática en sí mismo; en otras palabras, no puede haber metaanálisis sin una revisión sistemática.
Es conveniente mencionar que, en un inicio, las revisiones sistemáticas y metaanálisis se enfocaron en ensayos clínicos controlados para determinar la efectividad y seguridad de intervenciones terapéuticas (tales como medicamentos, cirugías o cambios en estilo de vida). Con el paso del tiempo, este tipo de investigación ha ampliado su espectro, por lo que cada vez más se publican revisiones sistemáticas de estudios observacionales, tanto para establecer las causas o factores de riesgo de las enfermedades, como para estimar el pronóstico de las enfermedades o evaluar las herramientas utilizadas en el diagnóstico.4
¿Por qué surgieron las revisiones sistemáticas/metaanálisis?
Las revisiones sistemáticas surgieron por diferentes las razones, las tres principales son:
Incremento exponencial de la información. Todos los días aumenta el número de estudios de investigación que se publican, lo cual hace necesario disponer de documentos en los que se sintetice, ordenadamente y bajo un criterio científico, el estado del conocimiento sobre un tema específico.
Capacidad para el análisis crítico de la investigación publicada. No todo el personal de salud está capacitado para analizar críticamente los estudios de investigación, a fin de discriminar los que puedan ser útiles en la práctica clínica, o bien, para identificar si la calidad es apropiada para sustentar las conclusiones. Quienes realizan revisiones sistemáticas deben ser expertos en la evaluación de la calidad de las investigaciones.
Aumentar el tamaño de muestra. Al sumar los resultados de varias investigaciones iguales o muy similares, aumenta el número de participantes. En un número importante de estudios, al no comprobar fehacientemente las hipótesis, se argumenta que para alcanzar los resultados deseados “se requieren más estudios…”, o bien “un tamaño de muestra mayor…” Cuando se realiza un metaanálisis, se está en posibilidad de recrear un estudio con mayor número de participantes, para poder comprobar dichas hipótesis.
Tipos de revisiones
A pesar de las décadas que han pasado desde las primeras revisiones sistemáticas, aún existe confusión en los términos. Por este motivo, es necesario señalar que no todos los artículos de revisión corresponden a este tipo de investigación.
Al menos se deben distinguir dos tipos de artículos de revisión: las revisiones narrativas y las sistemáticas. Las revisiones narrativas son documentos que se publican en la mayoría de las revistas de circulación periódica, describen un tema en particular, pero su integración no sigue un orden. Por ejemplo, hay revisiones narrativas similares a un capítulo de un libro, en las que se pueden exponer aspectos históricos de un padecimiento, su epidemiología, datos clínicos, el curso de la enfermedad, así como el proceso para llegar al diagnóstico, o bien, a las recomendaciones terapéuticas.5 Por el contrario, el enfoque es muy específico en las revisiones sistemáticas, en las cuales se resume el estado del arte de la investigación sobre el tratamiento, el diagnóstico, los factores de riesgo o el pronóstico de una enfermedad en particular.6
Además, hay diferencias en cuanto a la selección de los artículos que apoyan las afirmaciones de los autores. En las revisiones narrativas no existe un proceso para decidir cuáles se incluyen; de ahí que se considera que estos artículos apoyan las propuestas de los autores, dado que están acordes con lo descrito en el texto y no sobre todo lo que ha sido publicado del tema. Por ejemplo, no es raro encontrar revisiones narrativas en las cuales el o los autores han realizado con anterioridad investigaciones sobre un fármaco en particular, por lo que posiblemente la información que contiene el artículo estará centrada en los hallazgos que ellos mismos han publicado, a pesar de la existencia de otros estudios con resultados similares o diferentes; en las revisiones sistemáticas, en vista de que se localizan todos los estudios disponibles sobre el tema en la literatura mundial, se pueden incluir investigaciones que están a favor y en contra de la efectividad del fármaco.
Aunado a lo anterior, una revisión sistemática puede agregar estudios de la llamada literatura gris, es decir, resultados de investigaciones no publicados en revistas médicas de circulación periódica, como las tesis o los trabajos presentados en congresos o reuniones científicas.
Proceso para llevar a cabo revisiones sistemáticas
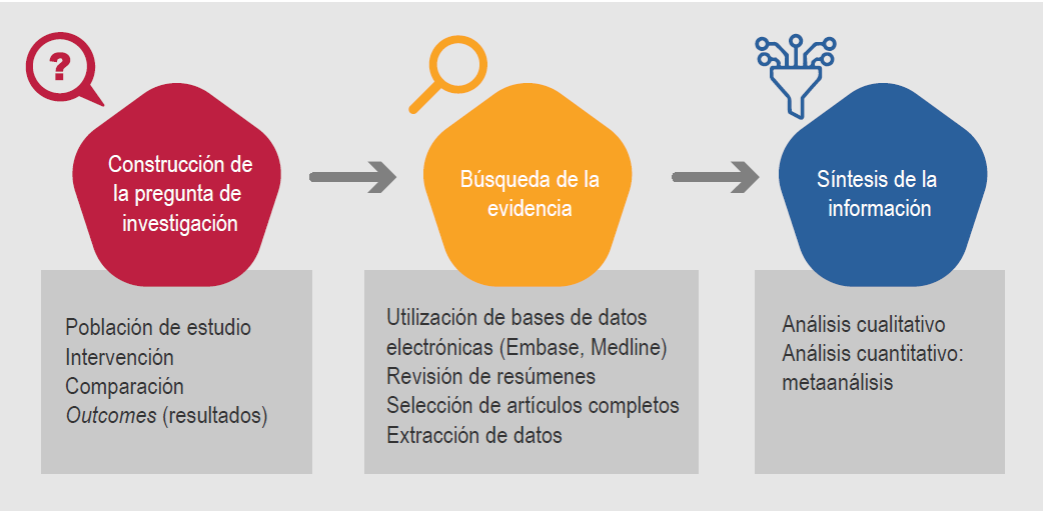
Como toda investigación, para llevar a cabo cualquier revisión sistemática es necesario iniciar con la elaboración de un protocolo. En dicho protocolo se debe describir el proceso para efectuar cada una de las fases y actividades (Figura 1).
Elaboración de la pregunta
El primer paso es enfocar el estudio a una pregunta única y contestable, a partir de la cual se establece el alcance del estudio.5,7,8 La revisión sistemática será más sencilla de realizar entre más específica sea la pregunta. En general se recomienda utilizar el acrónimo PICO para la construcción de la pregunta, en la cual se incluirán los cuatro componentes principales:
P= Población de estudio. Es muy conveniente circunscribir las características de los participantes, como puede ser la edad (adultos, niños o ancianos) o el sexo. Por supuesto, no debe faltar la enfermedad por estudiar y, si fuera necesario, particularizar algún grado, estadio o complicación.
I= Intervención por evaluar. Será diferente si la revisión se enfoca al tratamiento (se debe especificar el fármaco), diagnóstico (puede ser un estudio de laboratorio o de gabinete) o los factores de riesgo o pronóstico.
C= Comparación de la intervención. Se establecen posibles opciones para comparar la intervención, por ejemplo, un tratamiento puede compararse con un placebo u otro fármaco. En los procedimientos diagnósticos, la comparación es con otro método (tomografía en comparación con imagen de resonancia magnética).
O= Outcome measures. Existen diferentes resultados del efecto de la intervención. Por ejemplo, si se trata de un tratamiento, los resultados por evaluar pueden ser la curación, la prevención de complicaciones o los efectos adversos. En los estudios de diagnóstico se deberá especificar la capacidad de las pruebas en evaluación para confirmar (sensibilidad) o descartar (especificidad) la enfermedad en estudio.
Con estos cuatro elementos, la idea es construir una pregunta específica que ayude a resolver un problema particular. Por ejemplo, no es igual la siguiente pregunta general: ¿son efectivos los probióticos para tratar el eccema?, que cuando se utiliza el acrónimo PICO: en niños con eccema grave (P), ¿qué tan efectivos son los probióticos (I) en comparación con placebo (C) para mejorar la calidad de vida (O)?
Búsqueda de los artículos
Tras definir la pregunta de investigación se iniciará la búsqueda de los estudios originales para contestarla. En esta fase se toma en cuenta cada uno los elementos del acrónimo PICO, además de los diseños más apropiados para el tipo de pregunta (por ejemplo, los ensayos clínicos controlados son los mejores estudios para la evaluación de tratamientos). La búsqueda se realizará en las bases de datos electrónicas que concentran las revistas médico-científicas. Aunque existen otras, las tres bases de datos más importantes son Medline, EMBASE y la Biblioteca Cochrane (Cochrane Library), las cuales están disponibles en Internet.
Para ser más eficiente la búsqueda de los estudios, es necesario utilizar los términos o palabras clave particulares en cada una de las bases de datos; por ejemplo, para Medline corresponden los términos MeSH (medical subheadings). Asimismo, es importante que para conectar los términos se usen los operadores boleanos (AND, OR, NOT, ya que las bases mencionadas están en inglés). Para facilitar este proceso se dispone de metodologías probadas que tienen la más alta sensibilidad para la localización de los estudios que resolverán la pregunta de investigación.7,8 Es importante recordar que en estas bases de datos solamente se dispone de títulos y resúmenes de los estudios.
Selección de los estudios
Análisis de títulos y resúmenes
Una vez que se tiene el total de los títulos y resúmenes obtenidos de las bases de datos electrónicas, el paso que sigue es leerlos y determinar cuáles son los artículos que cumplen con los criterios de selección. Así, para esta fase es necesario haber definido previamente que los estudios por incluir deberán estar directamente relacionados con la pregunta de investigación y que se hayan realizado con el mejor diseño de estudio de acuerdo con su propósito (tratamiento, diagnóstico, pronóstico, etcétera).9 Además, se debe considerar el idioma de las publicaciones; la mejor revisión será la que no tenga restricción; sin embargo, al menos deberán seleccionarse estudios publicados en inglés, dado que, en la actualidad, la mayor parte de la producción médico-científica en el mundo se publica en ese idioma.
Para llevar a cabo una buena revisión sistemática, la selección de los estudios mediante la lectura de títulos y resúmenes deberá ser por pares. Es decir, dos o más investigadores participarán para seleccionar los estudios que cumplan con los criterios de selección. Si hay claridad en los criterios, entonces ambos investigadores coincidirán en incluirlos o excluirlos; en casos de discrepancia, ambos investigadores pueden discutir y llegar a una decisión consensuada o solicitar la opinión de un tercer investigador.2,7,8
Análisis de artículos en extenso
Después de haber seleccionado los estudios, a partir de los títulos y resúmenes, se procederá a conseguir los artículos completos. A diferencia del paso previo, al leer la publicación completa se puede determinar con certeza que la información descrita es suficiente y apropiada para responder la pregunta de investigación, a fin de ser incorporada en la revisión sistemática. Por ejemplo, en revisiones sistemáticas en las que se pretende evaluar algún tratamiento, en el apartado de material y métodos se deberá verificar que el estudio sea original (no una revisión), que corresponda a un ensayo clínico controlado y aleatorizado, que los pacientes incluidos en dichos estudios tengan las características descritas en la pregunta de investigación y que en los resultados se describan los desenlaces deseados. Cuando alguno de los estudios no cumpla con uno o más de estos elementos, entonces deberá ser excluido.
Es esencial que la evaluación de los estudios completos sea por al menos dos revisores, quienes de manera independiente decidirán cuáles cumplen los criterios de selección. La forma de dirimir las discrepancias entre los investigadores será revisando nuevamente que el estudio cumpla con los requisitos mencionados.
Extracción de los datos
En esta fase se pretende obtener la información necesaria para contestar la pregunta de investigación a partir de los artículos en extenso que cumplen con los criterios de selección. Los datos que se extraen de cada uno de los estudios conformarán el análisis para el reporte final.10
Para ser más práctico, se diseñan hojas específicas de recolección, en las que se incluyen los datos de cada variable de interés, tanto las de resultado como las independientes y universales.11 En esos formatos se registran los diferentes datos, por ejemplo, el lugar donde se realizó el estudio, las características de los pacientes (edad, sexo, criterios de selección, definiciones utilizadas, número de participantes, entre otras), la intervención realizada (en estudios de fármacos se debe especificar dosis, vías de administración, tiempo de duración de la intervención, cointervenciones, etcétera) y, por supuesto, los resultados obtenidos.
En esta fase también se recomienda que la extracción de los datos y el llenado de los formatos se realice por pares, como ha sido mencionado en los pasos anteriores.7
Calidad de los estudios incluidos
El análisis de la calidad de los estudios incluidos es un aspecto relevante en toda revisión sistemática. El análisis crítico de cada artículo original es determinante para la interpretación de los resultados. Cuando hay fallas en la metodología, los resultados no serán tan confiables que cuando los estudios estuvieron bien realizados. Desde hace años existen criterios o escalas validadas que ayudan a identificar los estudios que fueron ejecutados óptimamente. En la actualidad, la herramienta para la evaluación del riesgo de sesgos (risk-of-bias tool) es la que utiliza la Colaboración Cochrane para ensayos clínicos.12
Como en las fases previas, la evaluación de la calidad también se debe realizar por pares.
Presentación de los resultados de una revisión sistemática
Para determinar la manera como se describirán los resultados, primero es necesario establecer si los diferentes estudios incluidos son similares entre sí, para lo cual se analiza cada uno y se contrasta con el resto, verificando los criterios de selección de los pacientes, cómo fueron realizadas las intervenciones y cómo los autores presentan las variables de resultado.10 Si existen diferencias en estos tres aspectos, entonces la redacción de los resultados de la revisión solo será cualitativa, es decir, el reporte final solamente se basará en la descripción de las características de cada estudio incluido, lo cual puede ser en texto o en cuadros.3
Por otro lado, cuando los estudios son muy semejantes, es decir, son homogéneos, se está en posibilidad de realizar un metaanálisis, el cual combina los datos de una o más variables de resultado de dos o más estudios. Sin embargo, es necesario que las variables hayan sido medidas de igual forma en cada estudio incluido. Si se trata de evaluar el efecto terapéutico de un fármaco para asma, no es posible hacer metaanálisis con un estudio que evaluó la eficacia por el número de disparos al día de un inhalador y otro que valoró las cifras del volumen espiratorio forzado en un segundo.
El reporte final debe ser redactado de manera objetiva y neutral, con base en los hallazgos encontrados, a fin de que los lectores tomen sus propias decisiones.8 Asimismo, no es raro que en las revisiones sistemáticas no se encuentre evidencia suficiente para llegar a conclusiones sólidas; esto ocurre por diferentes razones, las más frecuentes son la mala calidad de los estudios, el número reducido de pacientes o que los estudios disponibles no han mostrado beneficios clínicamente relevantes.
Metaanálisis
Como se señaló, un metaanálisis es la combinación de los resultados de dos o más estudios, es decir, mediante un análisis estadístico se “suman” los hallazgos de diferentes investigaciones, asumiendo que el nuevo resultado equivale a un solo estudio, pero con una muestra mucho mayor. Este nuevo resultado puede ayudar a disponer de una conclusión más confiable (mayor poder), particularmente cuando en esas investigaciones el tamaño de muestra ha sido insuficiente.8,10,13
Existen diferentes tipos de metaanálisis, que principalmente dependen de la escala de medición de los datos reportados en los estudios originales. Cuando los datos son cuantitativos, el metaanálisis podrá ser llevado a cabo por diferencia ponderada de promedios o por la diferencia estandarizada de promedios. En el caso de las variables cualitativas será mediante riesgo relativo (RR), razón de momios (RM) y diferencia de riesgos.10,14
Además, existen dos modelos de metaanálisis: de efectos fijos y de efectos aleatorios. En el primero se asume que los estudios incluidos estiman un mismo valor “verdadero” del efecto y que las diferencias entre ellos se deben al azar. Mientras que en el segundo se asume que los estudios incluidos solamente son muestras aleatorias de un “universo de estudios”, y que sus resultados están posicionados aleatoriamente alrededor un mismo valor central.
La representación gráfica de los metaanálisis ayuda a mejorar la interpretación de los resultados; el gráfico más común es la gráfica de árbol (forest plot), en el cual se presentan de manera individual los resultados de cada estudio incluido y el resultado global (Figura 2).
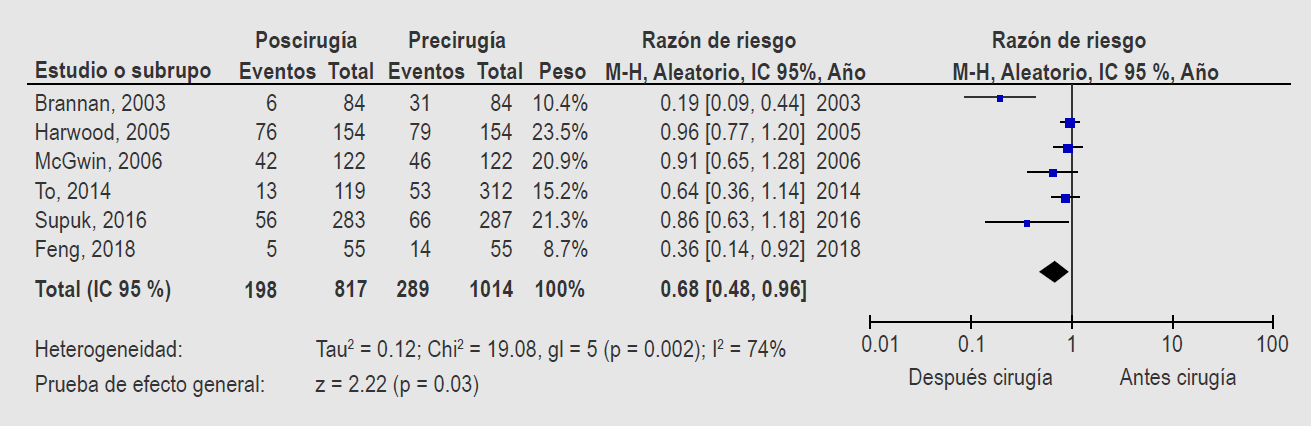
Figura 2 Gráfico de bosque (forest plot) de metaanálisis de efectos aleatorios con variables cualitativas, utilizando riesgo relativo como medida de magnitud de efecto.
Gráfico de bosque
La Figura 3 corresponde a un esquema para entender cada una de las partes de un gráfico de bosque.15,16,17 Para facilitar la lectura, es necesario correlacionar el texto descrito a continuación con los números presentados en el esquema:
Lea el título de la gráfica y busque cuál es el estimador graficado respecto a la pregunta de investigación; por ejemplo, para estudios de causalidad o pronóstico, los estimadores suelen ser RM o RR; para un estudio de prueba diagnóstica, sensibilidad, especificidad; para un metaanálisis de tratamiento con variables cuantitativas, diferencia ponderada de promedios
Reconozca la escala utilizada (aritmética, logarítmica, etcétera), ubicada en la línea de las abscisas en la parte más inferior, y cuál es el valor estadístico de nulidad o nulo (“valor 1” para RR y RM y “valor cero” para diferencias de promedios). Al calce del eje, generalmente se anota el área a favor y el área en contra de efecto estudiado (por ejemplo, si un fármaco es o no efectivo).
Analice el resultado individual de cada estudio incluido. La información se resume con una línea horizontal que señala el intervalo de confianza a 95 % (IC 95%) de la variabilidad del estimado buscado, el cual es la figura cuadrada localizada al centro del intervalo. Si el IC 95% no incluye al valor nulo (en este ejemplo, RR=1.0) al observar la gráfica, se infiere que hubo diferencia estadística significativa. Entre más alejado esté el límite del intervalo del valor nulo, el efecto será mayor. Además, al comparar los IC95% entre los diferentes estudios, el o los que se observen con los intervalos más pequeños, serán los que aporten más (tendrán más peso que el resto) al metaanálisis.
Analice la tendencia de los estudios incluidos en el metaanálisis. Cuando los estimadores y los IC95 % en la mayor parte de los estudios se dirigen hacia un mismo lado (pero lejos del valor nulo), se habla de consistencia en los resultados (conocida también como homogeneidad). Si todos están hacia un mismo lado, la homogeneidad es de 100%, pero existirá heterogeneidad cuando algunos se encuentran hacia diferentes lados. Los resultados de los metaanálisis con mayor grado de homogeneidad serán los más creíbles.
Localice en la gráfica el modelo estadístico usado para el metaanálisis. Los metaanálisis más confiables son los que tienen una buena homogeneidad (> 60%), lo cual se determina con pruebas estadísticas; I2 es una de las más usadas, pero también existen Q de Cochran y χ2. Existen diferentes razones para la falta de homogeneidad (también llamada heterogeneidad), como el número de participantes en los estudios primarios y los problemas metodológicos. Aunque hay otros fundamentos, en general los metaanálisis de efectos fijos se usan cuando hay homogeneidad y los metaanálisis de efectos aleatorios en caso de heterogeneidad.
Finalmente, analice la figura de resumen del resultado o “diamante”, localizado en la parte inferior por arriba de la línea de las abscisas (escala). Esta figura fue tomada del diamante de los naipes por tener dos ángulos centrales y dos laterales. Al unir los ángulos centrales con una línea vertical se determina el valor de resumen, es decir, la suma de todos los estudios evaluados. La unión de los ángulos laterales con una línea horizontal mostrará la variabilidad o el IC 95%. Entre más corto sea (diamante delgado), traduce un estimado muy preciso (poca variabilidad). Si el diamante en su diámetro lateral no incluye al valor nulo, se afirma que existe significación estadística. En los casos en los que el diamante esté más lejos del umbral clínico, se puede aseverar que el resultado parece muy contundente, a favor de la opción donde se encuentra el diamante. Si el diamante se localiza entre el valor nulo y el umbral, podría decirse “que, aunque el resultado es estadísticamente significativo, su impacto clínico será de poca magnitud”.
Gráfica de embudo o funnel plot
Este gráfico fue diseñado para estimar si existe sesgo de publicación; se espera que todo metaanálisis se realice con todas las investigaciones posibles respecto al tema que se está estudiando; cuando esto no sucede así, entonces puede existir este tipo de sesgo.18,19
Para facilitar la interpretación de esta gráfica, correlacione el texto descrito a continuación con los números presentados en la Figura 4:
Identifique la unidad de medición del estimado en la abscisa (en este esquema corresponde al RR); este eje puede estar graduado en escala aritmética o logarítmica.
Identifique el error típico o estándar (que puede ser en escala aritmética o logarítmica) en la ordenada de cada estudio.
Observe que cada estudio está representado con un punto localizado, según su valor estimado y error típico. Los estudios con pocos pacientes tendrán errores típicos más grandes y, por lo tanto, los puntos se encontrarán más abajo en la escala de la ordenada; en los estudios con grandes poblaciones, se localizarán más arriba. En un metaanálisis es muy frecuente que exista un mayor número de estudios con pocos participantes, por lo que habrá alta variabilidad del estimador, así como menor número de estudios con muchos pacientes y, por lo tanto, baja variabilidad del estimado.
Analice el triángulo isósceles dibujado, con una base que abarca todos los estudios con pocos pacientes; el vértice corresponde al estudio con más pacientes.
Si el triángulo es asimétrico (no isósceles), el lado donde falten puntos indicaría estudios que no fueron considerados, o bien, que no han sido publicados; si el gráfico se presenta de esta forma, entonces es posible que exista sesgo de publicación. Para determinar la simetría del triángulo se utiliza la prueba de Egger.17,19
Calidad de las revisiones sistemáticas
Como todos los procesos de la investigación, las revisiones sistemáticas pueden tener problemas durante su ejecución. Se han desarrollado instrumentos de evaluación a fin de identificar si la revisión tuvo una buena realización. Estos instrumentos pueden ser escalas, que se basan en el análisis crítico de cada fase de la elaboración de una revisión sistemática. Asimismo, en los últimos años, los autores de revisiones sistemáticas siguen pautas estándar para su publicación, como QUORUM y PRISMA.3,4,20,21 Un esquema común para presentar la selección de los estudios se presenta en la Figura 5.
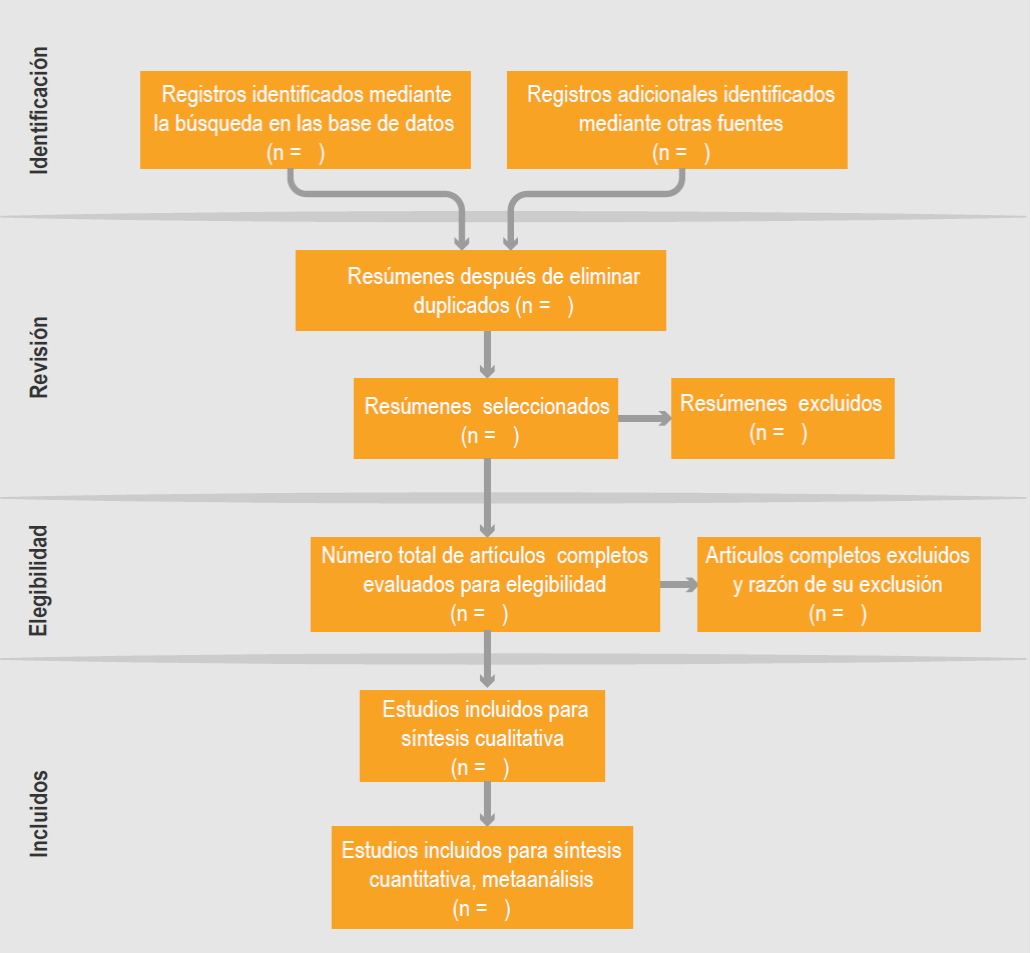
Figura 5 Esquema PRISMA para mostrar el proceso de la selección de estudios en una revisión sistemática.
Es conveniente señalar que Colaboración Cochrane es la organización más importante en cuanto a la metodología para realizar revisiones sistemáticas, ya que continuamente está evaluando los procesos para lograr que este tipo de investigación tenga la mayor calidad. De esta forma, una revisión sistemática/metaanálisis elaborada y publicada en Cochrane Library tiene la garantía de haber sido elaborada con los estándares más rigurosos. Además, debido a que es una organización sin fines de lucro, los resultados de estas investigaciones no están influidos por aspectos económicos o políticos (https://www.cochranelibrary.com).
Usos de las revisiones sistemáticas
Las revisiones sistemáticas son herramientas fundamentales de la medicina basada en evidencias (MBE).8,22,23 Como se sabe, dos de los pasos principales de la MBE se refieren a la búsqueda y la lectura crítica de los estudios que apoyarán las decisiones médicas sobre aspectos relacionados principalmente con el diagnóstico, tratamiento o pronóstico. La ventaja de leer este tipo de investigación es que los lectores en lugar de varios estudios originales sobre un mismo tema tienen la posibilidad de leer solamente uno, donde se compilan, analizan críticamente y se sintetizan los hallazgos de esas investigaciones.5
Por otro lado, desde hace tiempo las revisiones sistemáticas son imprescindibles al elaborar guías de práctica clínica basadas en evidencias. En estas guías, las recomendaciones se fundamentan en los resultados de los estudios con mejor calidad; en la jerarquía de los niveles de evidencia, las revisiones sistemáticas y metaanálisis están en el punto más alto. Otro uso de las revisiones sistemáticas/metaanálisis es en políticas de salud; por ejemplo, para adicionar nuevos fármacos para alguna enfermedad, para un hospital o sistema de salud, los directivos toman en cuenta todas alternativas terapéuticas disponibles, con base en los resultados de efectividad clínica y los costos. De esta forma, los expertos en economía de la salud seleccionarán los más costo-efectivos.5











 nueva página del texto (beta)
nueva página del texto (beta)