Antecedentes
En todas las sociedades, la carga y el costo de las enfermedades alérgicas están aumentando rápidamente y se necesitan cambios de estrategias de gestión para sustentar la transformación del sistema de atención de la salud para su atención integrada.1
Hasta el momento existen tres países hispanoparlantes (Argentina, España y México) en los que se ha implementado la app MASK-Air (actualización de Diario de Alergia) para la atención integrada de la rinitis alérgica (RA).
Argentina
Los estudios epidemiológicos evidencian que la RA es la enfermedad respiratoria crónica más frecuente. Para que dichos estudios puedan ser comparables y confiables requieren metodologías validadas, como The International Study of Asthma and Allergies in Childhood (ISAAC), del que participaron diversas ciudades argentinas (Buenos Aires, Rosario, Córdoba, Neuquén y Salta) en sus fases I y III,2,3 incluyendo los grupos etarios de seis y siete años y 13 y 14 años. Específicamente en 2002, los resultados del ISAAC fase III en el grupo de 13 y 14 años mostraron una prevalencia de síntomas de rinitis entre 22.8 y 40 %, aunque tomando síntomas asociados de rinitis y conjuntivitis, los cuales son más indicativos de RA, el rango de frecuencia varió entre 11.3 y 20.9 %. El promedio de síntomas de rinitis a nivel nacional fue de 34.9 % y de rinoconjuntivitis de 16 %, mientras que solo 12.7 % recibió diagnóstico alguna vez.3,4
Más recientemente, en 2014, se realizó una encuesta nacional (Prevalencia en Argentina de Rinitis Alérgica, PARA) utilizando una metodología diferente a ISAAC, que incluyó pacientes de cinco a 44 años entrevistados telefónicamente. La prevalencia global de síntomas de RA fue de 20.5 %. No hubo diferencias estadísticamente significativas entre los tres grupos etarios, dado que los porcentajes de prevalencia fueron de 21.1 % para el grupo de cinco a 11 años, 23.1 % para el de 12 a 19 años y 19.4 % para el de 20 a 44 años.5
En este contexto, el subdiagnóstico es posible. Además de los datos mencionados, el estudio AILA,6 que incluyó pacientes de cuatro a 60 años con diagnóstico médico de rinitis, mostró una prevalencia en Argentina de 3.6 % y, finalmente, el estudio PARA mostró que 63.8 % de los pacientes con síntomas de rinitis no tenía diagnóstico médico.5
El impacto de la rinitis en la capacidad del desempeño laboral y escolar evidenció una disminución de 33 % en los días con mayor sintomatología, similar a lo que evidencia el estudio AIM en asma bronquial.7 Además, el estudio AILA describió que la utilización de productos de venta libre en el tratamiento de la rinitis es de 42 % en adultos y de 25 % en niños.
Los datos precedentes avalan el concepto de que la rinitis es una enfermedad subestimada por los pacientes, infradiagnosticada por los médicos y, consecuentemente, subtratada.
España
Se han realizado diferentes estudios epidemiológicos para evaluar la prevalencia de la rinitis. En el estudio ISAAC, desarrollado en 1994 en 56 países, se estableció una prevalencia media de 14.9 % en niños entre seis y siete años y de 39.7 % en niños entre 13 y 14 años. En España, la prevalencia en la población pediátrica se estableció en 21.8 %.8 En una fase posterior, realizada en 2001-2004, la prevalencia de rinitis pediátrica en cualquier momento fue de 39.2 %.9 Se observó incremento de la prevalencia de la presencia de síntomas de alergia, especialmente de rinoconjuntivitis en los últimos 12 meses (RM = 1.61, IC 95 % = 1.48-1.76) al comparar ambas fases, después de ajustar por sexo, centro y variación estacional. La prevalencia de síntomas de RA fue mayor en los niños que en las niñas. Se apreciaron amplias variaciones entre centros con elevadas prevalencias en Asturias, Madrid, Cartagena y Bilbao. Las menores se observaron en Barcelona, Castellón y Pamplona.10
En 2004 se realizó un estudio en diversos países europeos (Bélgica, Francia, Alemania, Italia, España y Reino Unido), mediante 9646 encuestas telefónicas y un estudio médico en un subgrupo de 725 personas, con lo que se registró una prevalencia de rinitis de 22.7 % en la población europea general adulta y 21.5 % en España.11 En un estudio realizado en 2014 entre 2603 trabajadores españoles, la prevalencia de rinitis fue de 16.9 %.12
Alergológica 2015 es un estudio epidemiológico efectuado en los servicios de alergia españoles. La muestra fue de 2914 pacientes atendidos en centros públicos y privados de toda España. Se invitó a participar a 500 alergólogos. Los datos se compararon con los de los estudios de 1992 y 2005. La rinoconjuntivitis fue el principal motivo de consulta, que afectó a 52.5 % de pacientes adultos13 y 53.8 % de pacientes pediátricos,14 ligeramente inferior a los estudios previos. La etiología fue alérgica en 79.3 % de los casos. La causa más frecuente fue la alergia a pólenes (70.8 %), seguida de ácaros, epitelios de mascotas y hongos. Según la clasificación ARIA (Allergic Rhinitis and its Impact on Asthma) modificada,15 la rinitis fue persistente en 66 % de los casos y la intensidad fue leve en 29.9 %, moderada en 59.7 % y grave en 8.7 %. Mediante el cuestionario ESPRINT16 se evaluó la afectación de la calidad de vida: la dimensión más afectada fue la de los síntomas seguida por el sueño, por encima de las actividades diarias o aspectos psicológicos.
En la población general, según los datos del European Community Health Survey, la prevalencia de asma en España es baja, con una notable variabilidad regional (Albacete, 10 %; Barcelona, 5 %; Galdácano, 14.5 %; y Oviedo, 9.4 %).17 En Alergológica 2015, 21.2 % de los pacientes que acudían a consultas de alergia presentaba asma bronquial;13,14 fue intermitente en 38.3 % y persistente en 57.5 %. El control, según GINA, fue bueno en 35 %, parcial en 31 % y malo en 10 %. La mayoría de los pacientes con asma fueron alérgicos (82.2 %), mientras que en 16.8 % la RA fue intrínseca. Hubo predominio en mujeres.
México
Este país también participó en los estudios ISAAC. En la tercera fase de ISAAC se reportó 11.6 % de niños entre seis y siete años de edad con síntomas de rinitis y 8.4 % con síntomas de asma. Para adolescentes entre 12 y 13 años, la prevalencia fue de 15.4 y 15.6 %, respectivamente.3
En 2013, un grupo de investigadores mexicanos se dio a la tarea de diseñar un cuestionario diagnóstico para RA para estudios epidemiológicos en México, el cual fue validado18 antes de aplicarlo en diferentes estados de la república. Posteriormente se reportaron los resultados de la aplicación del cuestionario en escuelas. Fue llenado por alumnos de 12 años o mayores y por los padres en los niños menores a esa edad. En cuatro ciudades de cuatro estados diferentes del centro y sur de México se obtuvieron 8159 cuestionarios contestados. Se encontró una prevalencia promedio de rinitis alérgica de 15 % en mayores de 13 años y de 13 % en niños de 12 años o menos.19 Aproximadamente tres años después se aplicó el mismo cuestionario en 3446 niños escolares en Puebla, ciudad cerca de la Ciudad de México, encontrando una prevalencia de RA de 12 %.20
Otro grupo de investigadores aplicó recientemente el cuestionario de ISAAC acerca de síntomas de asma y de rinitis a casi 15 000 niños en cinco ciudades en el centro del país (el Bajío). La prevalencia de RA fue de 5.4 % (IC 95 % = 5.1-5.8), de rinitis más conjuntivitis de 19.2 % (IC 95 % = 18.6-19.8). Las prevalencias de asma, asma con el ejercicio y asma actual fueron de 6.1 % (IC 95 % = 5.7-6.5), 2.1 % (IC 95 % = 1.9-2.3) y 11.6 % (IC 95 % = 11.1-12.1), respectivamente.21
En este momento se está llevando a cabo el estudio GAN, que dará una visión mejor y más actualizada acerca de la prevalencia de patologías alérgicas en México.
Desde el verano de 2017, un grupo de alergólogos mexicanos se incorporó en las iniciativas de diseminación de ARIA y la aplicación móvil para pacientes con RA, lo que ayudará a mejorar el control de la enfermedad. Los médicos invitan a sus pacientes a usar la app y los ayudan a cargarla en su celular y llenar los datos iniciales. Esta estrategia ha sido exitosa. Hasta el momento, la app fue descargada por más de 1800 pacientes y más de 1500 completaron por lo menos un dato. En el futuro se espera ligar los datos obtenidos con la aplicación con referencias acerca de contaminación ambiental, especialmente en la Ciudad de México.
Vías Integradas de Atención en RA
Durante una reunión celebrada en París el 3 de diciembre de 2018, relativa al tratamiento de enfermedades crónicas, MASK (Red Celular Centinela de las Vías Aéreas) y POLLAR (Impacto de la Contaminación del Aire en el Asma y la Rinitis, del Instituto Europeo para la Innovación y Tecnología),22 profesionales y organizaciones de pacientes en el campo de las alergias y las enfermedades de las vías respiratorias recomendaron la evaluación de los ICP (Integrated Care Pathways) para la atención integral y en la vida real, con uso de medios digitales, de la rinitis y el asma con sus multimorbilidades, centrados en la persona, incluyendo la exposición ambiental.1,23
Los ICP son planes de atención multidisciplinarios estructurados que detallan los pasos clave de la atención al paciente,23,24,25 promueven la traducción de las recomendaciones de las guías en protocolos locales y su aplicación a la práctica clínica.25,26,27 Los ICP generalmente mejoran las recomendaciones combinando intervenciones reiteradas, integran el aseguramiento de la calidad y promueven la coordinación de la atención. Los ICP de las vías respiratorias26 fueron los primeros pasos para desarrollar los ICP para la multimorbilidad de la rinitis y el asma. En la RA existe una necesidad urgente de desarrollar pautas de próxima generación para la farmacoterapia y los ICP para la inmunoterapia específica con alérgenos (ITE). En este documento se presenta un resumen ejecutivo (figura 1). Lo anterior se modifica en los diferentes países o regiones para adaptar las conclusiones de los documentos al uso local y los sistemas de salud.
Guías ARIA-GRADE de nueva generación
La selección de la farmacoterapia para los pacientes con RA está destinada a controlar la enfermedad y depende de los siguientes aspectos:
Empoderamiento y preferencias del paciente.
Síntomas prominentes, su gravedad y multimorbilidad.
Eficacia y seguridad del tratamiento.28
Velocidad de inicio de acción del tratamiento.
Tratamiento actual.
Respuesta histórica al tratamiento.
Estrategias de autocontrol.
Uso de recursos.
Se diseñó un algoritmo31 y se digitalizó32 para proponer un tratamiento ascendente o descendente de la RA, pero se debe contextualizar según la disponibilidad de medicamentos y recursos en los diferentes países. Además, los algoritmos requieren pruebas utilizando ensayos controlados aleatorios (ECA) y una investigación observacional llamada “evidencia del mundo real” (RWE, real world evidence)19,20,21,22,23,24,33,34,35
La metodología GRADE (Grading of Recommendations Assessment, Development and Evaluation) considera explícitamente todos los tipos de diseños de estudios, desde ECA a informes de casos, aunque los desarrolladores de guías a menudo prefieren restringir las directrices a los ECA.36,37,38 Además de la evidencia, GRADE también considera valores y preferencias, aceptabilidad y viabilidad o transparencia de los hallazgos. Hay una tendencia creciente a utilizar RWE para informar la práctica clínica, especialmente porque los ECA a menudo están limitados por la aplicabilidad de los resultados.39
Durante la reunión de París se desarrollaron guías de próxima generación para el tratamiento farmacológico de la RA utilizando pautas basadas en GRADE para RA,30,39,40,41,42 probadas con RWE proporcionada por tecnología móvil22,41,43 y estudios de cámara de exposición a alérgenos. Estas recomendaciones se utilizaron para refinar el algoritmo MASK para el tratamiento de la RA propuesto por un grupo de consenso.31
Evidencia considerada para el desarrollo de las ICP de ARIA
Algoritmo MASK para el tratamiento farmacológico de la RA. El algoritmo MASK basado en una escala visual analógica (EVA)44 ha sido creado por el grupo de expertos de ARIA para la selección de farmacoterapia para los pacientes con RA y su escalamiento o decrecimiento dependiendo del control (figura 2a y 2b).31
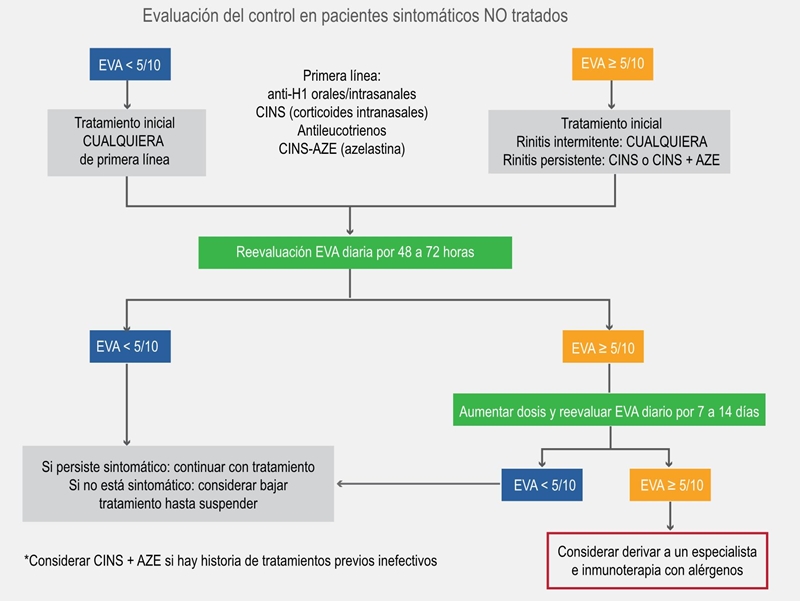
Figura 2a Algoritmo ascendente para adolescentes y adultos sin tratamiento, utilizando una escala visual análoga (EVA).32 El algoritmo propuesto considera los pasos del tratamiento y la preferencia del paciente. Niveles de escala visual análoga en proporciones. Si persisten síntomas oculares, una vez que se ha iniciado el tratamiento, incluir tratamiento tópico ocular.
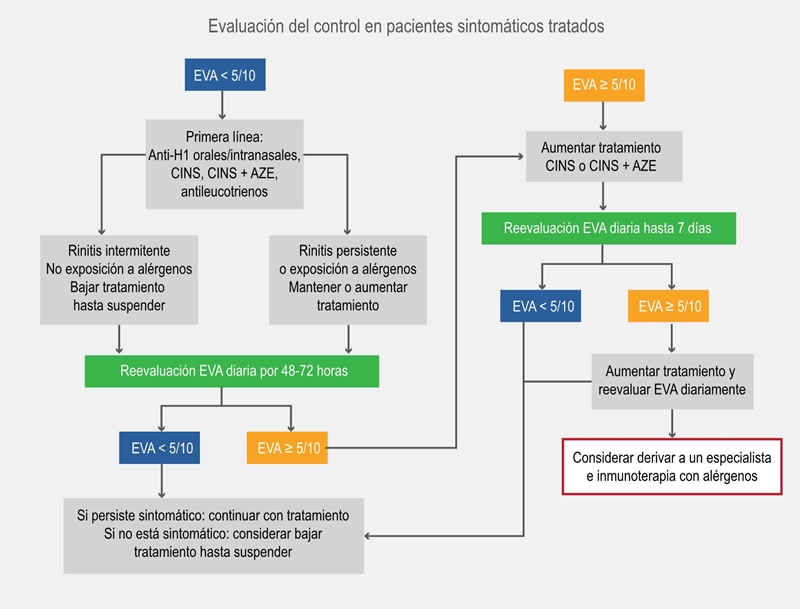
Figura 2b Algoritmo ascendente, para pacientes tratados utilizando la escala visual analógica (EVA) en adolescentes y adultos.32 El algoritmo propuesto considera los pasos del algoritmo y la preferencia el paciente. Niveles de escala visual análoga en proporciones. Si persisten síntomas oculares, incluir tratamiento tópico ocular. AZE =
ARIA 2010, revisión 2016 y Parámetros de Práctica Clínica de Rinitis Estacional 2017 de Estados Unidos. A pesar de que hay unas pocas comparaciones disponibles de los medicamentos usando ensayos aleatorizados controlados,45,46,47 la comparación de medicaciones para la RA ha sido propuesto por varias revisiones35 y guías.28,40,41,42 Una evaluación de Health Technology Assessment concluyó que la mayoría de los medicamentos para la RA tenían un efecto similar.47 De todas formas, dicho análisis utilizó un método demasiado estricto, que no permitió diferenciar entre las medicaciones. Pero en general, las guías de RA están de acuerdo con los puntos importantes (cuadro 1).28,40,41,42 La revisión ARIA 201641 y los Parámetros de Práctica Clínica de Rinitis Estacional de Estados Unidos 2017,42 desarrollados en forma independiente, usaron el mismo método de abordaje GRADE.37,38,39 Interesantemente se analizaron las mismas preguntas. Se consideraron dos objetivos principales en el tratamiento de la rinitis moderada y grave: eficacia y rapidez de acción (cuadros 2 y 3).
Cuadro 1 Recomendaciones para la farmacoterapia en rinitis alérgica
|
|
|
CINS = corticoides intranasales, MP-AzeFlu = combinación intranasal de propionato de fluticasona y azelastina, RA = rinitis alérgica.
Cuadro 2 Recomendaciones generales de ARIA41
|
|
RA = rinitis alérgica, CINS = corticoides intranasales, MP-AzeFlu = combinación intranasal de propionato de fluticasona y azelastina, Para todas estas recomendaciones el nivel de evidencia fue bajo22,23 o muy bajo.1
Cuadro 3 Consejos clínicos importantes de los Parámetros Prácticos de Rinitis Estacional de los Estados Unidos sobre el tratamiento de la rinitis alérgica estacional en su actualización 2017.42
|
Para el inicio del tratamiento de síntomas nasales de RA estacional en pacientes ≥ 12 años, los médicos de atención primaria o generalistas:
|
ARIA revisión 201642 y Parámetros Prácticos de los Estados Unidos sobre el Tratamiento de la Rinitis Alérgica Estacional en su actualización 2017,42 mayormente basados en estudios controlados y aleatorizados, aprueban el algoritmo MASK.28
RA = rinitis alérgica, CINS = corticoides intranasales
Rapidez de acción de los medicamentos. La Food and Drugs Administration ha propuesto tres tipos de estudio para medir el comienzo de la acción de los medicamentos para la RA:61,62 estudios estándar de fase 3, doble ciego controlados y aleatorizados con placebo, estudios de exposición natural en parques y estudios en cámaras de exposición a alérgenos.63 Los estudios aleatorizados y controlados son informativos, pero no proveen suficiente precisión para evaluar el inicio de la eficacia. Los estudios en cámaras con alérgenos ofrecen algunas ventajas para evaluar el inicio de la eficacia en minutos.63 Estos últimos son más consistentes que los estudios en parques.64
Varias medicaciones intranasales fueron evaluadas en las cámaras de exposición a alérgenos de Ontario58,65,66,67 y Viena.68,69,70 Los estudios en la cámara de Ontario muestran la rapidez de inicio de acción para azelastina y sus combinaciones, incluyendo MP-AzeFlu. Otros antihistamínicos intranasales tienen un inicio de acción más lento. Los corticoides intranasales (CINS) en monoterapia o con antihistaminicos orales no son efectivos antes de las dos horas. Los estudios en la cámara de exposición a alérgenos de Viena mostraron que la azelastina y la levocabastina + furoato de fluticasona son las medicaciones que actúan más rápido en comparación con los antihistamínicos orales o los CINS.
Evidencia en vida real utilizando tecnología móvil. Las guías ARIA de próxima generación evaluaron las recomendaciones basadas en GRADE frente a la evidencia de vida real, utilizando datos obtenidos por herramientas móviles de salud (mHealth) para confirmar o refinarlas y el algoritmo MASK. Si bien hay muchas herramientas móviles de salud disponibles para la RA,71 solo MASK ha proporcionado datos acerca de los medicamentos que pueden ser usados en RWE.22,72
Estudio piloto de tratamiento MASK 2017. Con un diseño transversal observacional de vida real en 2871 usuarios (17 091 días de EVA), aportó percepciones sobre el tratamiento de la RA en vida real utilizando la EVA para los síntomas alérgicos en general (EVA global) en 15 países (cuadro 4).4
Cuadro 4 Resultados de evidencias en vida real sobre el tratamiento de la RA.
RA = rinitis alérgica, MP-AzeFlu = combinación intranasal de propionato de fluticasona y azelastina, CINS = corticoides intranasales
Estudio de tratamiento MASK 2017.73 Se llevó a cabo en forma observacional transversal en el escenario de la vida real en 22 países, como complemento del estudio piloto del año 2017;43 9122 usuarios completaron 112 054 días de EVA entre 2016 y 2017. Los mismos resultados se obtuvieron en EVA global (cuadro 4). Por otra parte, se encontró la misma tendencia en la EVA para los síntomas nasales, asma, síntomas oculares y productividad laboral.
Estudio de adherencia al tratamiento MASK 2018.74 De tipo observacional transversal, se llevó a cabo con 12 143 usuarios. La adherencia fue imposible de probar directamente, ya que los usuarios no proporcionaron los datos todos los días y pudieron no informar sobre todos los medicamentos utilizados. La adherencia secundaria se evaluó usando una relación de posesión de medicación modificada y la proporción de días cubiertos. La adherencia fue inferior a 5 %.
Limitaciones de MASK
Como todos los estudios que utilizan datos de participación, los sesgos potenciales incluyen la probabilidad de sesgo en la muestra y una clasificación errónea que no puede ser evaluada, así como la disponibilidad de poca información sobre las características del paciente o días de tratamiento debido a problemas éticos. Además, los usuarios de la aplicación no son representativos de todos los pacientes con RA.
MASK utilizó los días en un análisis transversal43,75 porque no existe un patrón claro de tratamiento y no fue posible un estudio longitudinal, ya que la mayoría de los usuarios utilizó la aplicación en forma intermitente.
El diagnóstico de RA no fue confirmado por un profesional médico, pero es probable que la mayoría de los usuarios sufriera rinitis (alérgica o no).43 La caracterización precisa del paciente usando una aplicación es imposible debido a razones de privacidad. No obstante, la tecnología móvil se está convirtiendo en una herramienta importante para entender mejor y gestionar la RA y añade información que no estaba disponible con otros métodos.75,76,77,78,79,80,81 No existen otros estudios de salud con tecnología móvil que hayan evaluado la eficacia de diferentes medicamentos a gran escala.
Existe una completa desconexión entre la prescripción médica y el comportamiento del paciente frente al tratamiento de la RA inducida por polen. La mayoría de los alergólogos prescribe medicamentos para toda la temporada, recomendando al paciente su uso regular aún en los días con poca sintomatología. Algunos alergólogos prescriben un tratamiento preestacional, sin clara evidencia de su eficacia. Por otra parte, la mayoría de los pacientes utiliza su medicación a demanda cuando su RA no está bien controlada y no sigue las recomendaciones de las guías.43,82,83,84 Cuando los médicos son pacientes, se comportan como pacientes cuando tratan su propia RA y no siguen las prescripciones que ellos mismos recomiendan.
Próxima generación de guías ARIA-GRADE
El algoritmo propone un enfoque gradual para la selección de medicamentos en la RA basada en recomendaciones GRADE refinadas con RWE y estudios de provocación en cámara (cuadro 5).
Cuadro 5 Nueva generación de guías ARIA-GRADE
Recomendación GRADE |
mHealth RWE |
Estudios en cámara de exposición |
|
Los antihistamínicos orales son menos potentes que los CINS, pero muchos pacientes prefieren los medicamentos orales |
Referencia 40 No hay información sobre la preferencia del paciente |
Referencia 23 No hay información sobre la preferencia del paciente |
|
Los antihistamínicos intranasales son menos efectivos que los CINS |
Referencia 40 |
Referencia 23 |
|
Los antihistamínicos intranasales son efectivos en minutos |
Referencia 41 |
Referencias 66 y 69 |
|
Los CINS son medicamentos potentes |
Referencias 40 y 42 |
Referencias 23 y 73 |
|
El inicio de acción de los CINS es de algunas horas a unos pocos días (con excepción de la ciclesonida que es efectiva más rápidamente) |
Referencia 40 |
Referencias 67 y 84 |
|
La combinación de CINS y antihistamínicos orales no ofrece ninguna ventaja sobre los CINS |
Referencias 41 y 42 |
Referencias 43 y 73 |
|
La formulación intranasal de CINS + antihistamínico es más potente que la monoterapia |
Sí en pacientes graves.42 Con algunas limitaciones.41 |
Referencias 37 y 73 |
|
La formulación intranasal de CINS + antihistamínico es efectiva en minutos |
Referencias 58, 67 y 70 |
||
Los antagonistas de los leucotrienos son menos potentes que los CINS |
Referencias 40 y 43 |
|
CINS = corticoides intranasales
El enfoque propuesto confirma la validez de la mayoría de las recomendaciones de GRADE para la RA,85 permite alguna evidencia condicional para ser apoyada por RWE y proporciona algunas nuevas ideas:
Al inicio del tratamiento, la combinación de antihistamínicos orales y corticoides nasales no demostró ser más efectiva que los corticoides nasales en monoterapia.
La formulación intranasal de corticoides + antihistamínico demostró ser más efectiva que los corticoides nasales en monoterapia.
Los medicamentos que contienen antihistamínicos intranasales son efectivos en pocos minutos.
El algoritmo de ARIA para la RA fue probado con ensayos aleatorizados y ECA, investigación observacional RWE y estudios de campo. El algoritmo en general fue apropiado y no fue necesario ningún cambio.
Conclusiones
Este enfoque, la primera guía GRADE (para cualquier enfermedad crónica) integrando RWE y estudios adicionales (estudios en cámaras de exposición a alérgenos) podría ser un modelo para las enfermedades crónicas.
Estas guías informarán las IPC y se incluirán en el Directorate-General for Health and Food Safety (DG SANTE) habilitado digitalmente, de manera integrada y centrándose en el cuidado de los pacientes, y representa la estrategia de cambio en la fase 4 del manejo de ARIA.1,67











 nueva página del texto (beta)
nueva página del texto (beta)




