Antecedentes
La prevalencia de enfermedades respiratorias como el asma y la rinitis alérgica se ha incrementado durante las últimas décadas, tanto en niños como en adultos; es notoria la alta prevalencia de etiología alérgica corroborada por la sensibilización ante alérgenos inhalables.1,2,3
El asma es el trastorno respiratorio crónico más frecuente en el mundo. De naturaleza heterogénea, se caracteriza por inflamación crónica de las vías aéreas y limitación variable del flujo aéreo espiratorio; causa síntomas como sibilancias, dificultad respiratoria, opresión torácica y tos, que varían a lo largo del tiempo y en intensidad. Según los síntomas y uso de medicación de rescate, se consideran tres niveles de control:
La gravedad del asma se puede evaluar acorde con el tratamiento propuesto por la Global Initiative for Asthma (GINA), de modo que asma leve es aquella que se controla con el tratamiento del paso 1 o 2, es decir, con el empleo de medicación sintomática a demanda o con tratamiento de control de baja intensidad como corticosteroides inhalados (CSI), antagonistas de los leucotrienos o cromonas. El asma moderada es la que se logra controlar con tratamiento del paso 3, como CSI + LABA (betaagonistas de acción prolongada). El asma grave requiere tratamiento del paso 4 o 5, por ejemplo, dosis altas de CSI/LABA, corticosteroides orales o anticuerpos monoclonales.4,5
La rinitis alérgica es uno de los padecimientos alérgicos con mayor prevalencia en el mundo, con gran repercusión en la calidad de vida. Los síntomas cardinales conocidos como “tétrada rinítica” son rinorrea hialina anterior o posterior, obstrucción nasal, prurito nasal u ocular y estornudos en salva. En función de la duración de los síntomas, acorde con las guías ARIA 2008 se clasifica en:
Intermitente, menos de cuatro días por semana o menos de cuatro semanas consecutivas en un año.
Persistente, más de cuatro días a la semana y más de cuatro semanas consecutivas en un año.
Según la severidad de la sintomatología se clasifica en:
El abordaje diagnóstico-terapéutico del asma y la rinitis alérgica debe ser integral y multidisciplinario, abarcando tres áreas: prevención, control farmacológico de síntomas y tratamiento etiológico (inmunoterapia específica). Las medidas de control ambiental pueden ayudar a disminuir la exposición a alérgenos ambientales, mientras que la farmacoterapia con antihistamínicos, corticosteroides, broncodilatadores o antileucotrienos puede contribuir con la resolución de los síntomas, pero no alteran el curso de la enfermedad. La inmunoterapia específica (ITE) consiste en la aplicación de dosis gradualmente incrementadas de extractos alergénicos y es considerada la única medida terapéutica que tiene la capacidad de modificar el curso de la enfermedad alérgica.1,2,4,5
La era moderna de la inmunoterapia comenzó en 1911, cuando Leonard Noon describió la “vacunación contra toxinas aerogénicas”. Los síntomas de la fiebre del heno disminuían con la inoculación de extractos de pólenes, cuyo uso estaba basado en el conocimiento empírico hasta la década de 1960, momento en que el descubrimiento de la inmunoglobulina E y los avances en diversas áreas de la Inmunología dieron paso a un mejor entendimiento de la enfermedad alérgica.8,9
Investigaciones sobre las alteraciones del sistema inmune en enfermedades alérgicas han logrado grandes avances en la comprensión de los mecanismos terapéuticos de la ITE. Se sabe que en los procesos alérgicos existe disregulación entre los perfiles de citocinas Th1 y Th2, lo cual repercute en activación de distintas líneas celulares y posteriores mecanismos efectores. Por ejemplo, en el perfil Th2 predominan la interleucina (IL) 4, principal promotor del cambio de isotipo a IgE, y la IL5, principal factor responsable del crecimiento y diferenciación de eosinófilos. En tanto, en el perfil Th1 predominan la IL2, que induce la maduración y activación de linfocitos T reguladores; la IL12, que promueve el desarrollo de perfil Th1 y suprime la proliferación de linfocitos tipo Th2; y el IFNα, que detiene la producción de IgE e induce la diferenciación de los linfocitos T CD4 hacia un perfil Th1, inhibiendo el desarrollo del perfil Th2.
En este sentido, se han descrito varios cambios inmunológicos debidos al uso de la inmunoterapia subcutánea. Se ha demostrado un incremento inicial de IgE específica durante los primeros meses del tratamiento, al que sigue un descenso subsecuente y gradual. También se ha observado incremento sérico de IgG específica, particularmente de las subclases IgG1 e IgG4 desde los primeros cuatro meses de uso de inmunoterapia. Inicialmente se pensó que la función de los anticuerpos IgG era bloquear la activación de mastocitos y basófilos compitiendo con la IgE por los alérgenos, pero recientemente se ha propuesto que la IgG4 puede inhibir la presentación de antígenos alergénicos mediada por CD23 a células T. La ITE induce un estado de tolerancia alergénica alterando la memoria alérgeno-específica, así como la respuesta de linfocitos T y B hacia los alérgenos con la participación de linfocitos T reguladores (LTreg) e IL10. Se sabe que la ITE logra inducir el desarrollo y activación de LTreg CD4+CD25+ productoras de IL10 con capacidad supresora, por lo que la estimulación de LTreg es considerada el evento cardinal de la inmunoterapia. De este modo, la ITE cumple una importante función en el tratamiento de la patología alérgica, modulando al sistema inmune y reduciendo gradualmente la severidad de la respuesta.2,10,11,12
Aunque actualmente se utiliza la ITE como tratamiento de múltiples entidades alérgicas, es importante tomar en cuenta que la evidencia hasta el momento respalda su uso en tres padecimientos: asma alérgica, rinitis alérgica e hipersensibilidad a himenópteros. Por otra parte, aunque se encuentran en desarrollo diversas vías de administración de inmunoterapia como la intralinfática, epicutánea o intradérmica, las únicas validadas son la subcutánea y la sublingual; la primera se considera el estándar de oro para el tratamiento específico de los tres padecimientos mencionados.13,14
El perfil de seguridad de la ITE subcutánea ha sido evaluado en numerosos ensayos clínicos, en general se ha demostrado que este tratamiento es seguro en pacientes con rinitis alérgica y asma leve a moderada, siempre y cuando sea administrado por médicos con experiencia en inmunoterapia y capacitados para el manejo de reacciones adversas y anafilaxia.15
La ITE subcutánea ha sido evaluada de diversas maneras, utilizando instrumentos de medición clínicos como cuestionarios sobre frecuencia y severidad de los síntomas. Se ha descrito que la ITE subcutánea administrada a pacientes con rinitis alérgica o asma con sensibilización a alérgenos inhalables logra una mejoría clínica significativa, con reducción de los síntomas y del número de exacerbaciones.16,17,18
La eficacia clínica de la ITE subcutánea en pacientes con alergia respiratoria puede ser valorada con parámetros clínicos mediante el uso de cuestionarios validados, como el Control of Allergic Rhinitis and Asthma Test (CARAT), que permite cuantificar el control de los síntomas de rinitis, asma o ambos padecimientos. En estudios longitudinales, el CARAT demostró ser confiable y sensible al cambio en el control de los síntomas de rinitis o asma al paso del tiempo.19,20
En cuanto a la evaluación de la seguridad de la inmunoterapia, se ha utilizado el sistema de gradación de las reacciones adversas propuesto por la World Allergy Organization, que permite clasificar los efectos adversos que podrían atribuirse al uso de inmunoterapia subcutánea.
En una revisión reciente se reportó que la incidencia de reacciones adversas sistémicas fue menor a 0.2 %, mientras que un metaanálisis Cochrane que evaluó ITE subcutánea en asma alérgica encontró que la incidencia de reacciones sistémicas por paciente varía de 5 a 7 %, estimándose además que la probabilidad de reacciones casi fatales es de aproximadamente 1:1 000 000 aplicaciones.
Otra escala útil para valoración de efectos adversos asociados con inmunoterapia subcutánea es la propuesta por el método Portnoy, que otorga una puntuación de 0 a 6, asignando un valor numérico a las reacciones adversas locales y sistémicas acorde con su severidad. Se ha reportado asociación significativa entre la presencia de efectos locales y la posterior aparición de efectos sistémicos, pudiendo predecir manifestaciones sistémicas tanto en la fase de inducción como en el mantenimiento, por lo que se sugiere seguimiento estrecho del paciente que manifieste algún tipo de reacción adversa.15,21,22,23
En México se cuenta con la Guía Mexicana de Práctica Clínica de Inmunoterapia, que recopila la evidencia publicada hasta 2011 relativa al uso de dicho tratamiento. No obstante, son pocos los estudios que se han dado a la tarea de evaluar esquemas de inmunoterapia basados en las recomendaciones de la mencionada guía.23
Objetivo
Evaluar la eficacia y seguridad del esquema de inmunoterapia subcutánea utilizado en el Servicio de Alergia e Inmunología Clínica del Hospital Universitario de Puebla, Puebla, derivado del propuesto por la Guía Mexicana de Práctica Clínica de Inmunoterapia para alérgenos inhalables en pacientes incidentes con diagnóstico de alergia respiratoria.
Métodos
Estudio longitudinal, analítico, cuasiexperimental, prospectivo. Se incluyeron pacientes incidentes con edades entre cuatro y 65 años, de uno y otro sexos, durante un periodo de 10 meses, con diagnóstico reciente de asma o rinitis alérgica, con evidencia de sensibilización a aeroalérgenos mediante pruebas de punción cutánea o IgE sérica específica y que aceptaron iniciar tratamiento con inmunoterapia subcutánea, previo consentimiento informado.
La eficacia fue evaluada mediante parámetros clínicos (frecuencia y severidad de los síntomas) con CARAT y la seguridad de la inmunoterapia se determinó con la descripción de las reacciones adversas locales o sistémicas asociadas con su utilización, acorde con la escala de Portnoy.
Las mediciones se efectuaron al inicio del tratamiento con inmunoterapia, a los dos y cuatro meses de seguimiento, calculando comparación de promedios por t de Student, considerando un valor de p < 0.05 como estadísticamente significativo. Todos los procedimientos fueron realizados con apego a las normas éticas, Reglamento de la Ley General de Salud en Materia de Investigación para la Salud y la Declaración de Helsinki.
Resultados
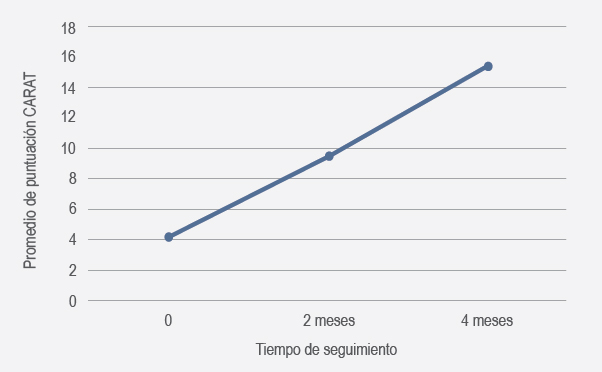
Se incluyeron 59 pacientes, de los cuales 43 (72.9 %) fueron mujeres y 16 (27.1 %), hombres. La edad promedio fue de 27.9 años, con desviación estándar de 15.9; 23.7 % de los pacientes presentó diagnóstico de rinitis alérgica y asma, mientras que 76.3 % cursó únicamente con rinitis alérgica. El promedio de puntuación del cuestionario CARAT previo al tratamiento, a los dos y a los cuatro meses de iniciada la inmunoterapia subcutánea fue de 4.22, 9.49 y 15.41, respectivamente; al comparar la puntuación inicial con la de la última medición mediante t para muestras relacionadas se obtuvo un valor estadísticamente significativo (< 0.05) (figura 1). Se reportó una incidencia global de reacciones adversas locales de 9.03 %, de las cuales 93.75 % fue grado 0 (eritema local y pápula) y 6.25 % grado 1 (pápula y eritema extendido o urticaria). El promedio de reacciones adversas locales al inicio de la inmunoterapia fue de 15.25 %, mientras que a los cuatro meses de seguimiento fue de 1.69 %. No se reportaron efectos adversos sistémicos, anafilaxia ni fatalidades.
Discusión
El asma y la rinitis alérgica son padecimientos cuya incidencia mundial ha mostrado un importante incremento en las últimas décadas; repercuten gravemente en la calidad de vida del paciente y en costos de servicios de salud.1,2,3 Hasta 80 % de los pacientes con estas patologías respiratorias presenta etiología alérgica, por lo que se ha descrito que la inmunoterapia específica es un tratamiento orientado a modificar el curso de la enfermedad, logrando importantes cambios inmunológicos y clínicos. Sin embargo, se cuenta con pocos estudios disponibles que evalúen el tratamiento en pacientes polisensibilizados, en quienes por la propia naturaleza de su sensibilización múltiple se requiere inmunoterapia con más de un antígeno. Aunque existe claridad respecto a la prescripción de inmunoterapia con un solo antígeno, hasta el presente estudio no se contaba con documentos relativos a la implementación de la Guía Mexicana de Inmunoterapia para pacientes polisensibilizados.4,10,21
De acuerdo con los resultados obtenidos, el esquema de inmunoterapia administrado en el Servicio de Alergia e Inmunología Clínica del Hospital Universitario de Puebla demostró ser eficaz en la modificación positiva de criterios clínicos, de acuerdo con un método de evaluación validado y estandarizado como el cuestionario CARAT, implementado con anterioridad en diversos estudios.13,19,20,21 Congruentemente con lo citado, la seguridad fue evaluada mediante un instrumento de medición adecuadamente caracterizado, el Portnoy, que demostró una seguridad similar a la mencionada en la literatura, en la que se ha descrito 0.6 a 30.2 % de reacciones adversas locales.24,25
Los resultados presentados son concordantes con revisiones sistemáticas previas, en las que se ha demostrado que la inmunoterapia subcutánea provee reducción importante de los datos clínicos de asma o rinitis alérgica, con cambios significativos en cuestionarios de evaluación de síntomas y con un bajo riesgo de reacciones adversas.25,26
Conclusiones
El esquema de inmunoterapia subcutánea utilizado en el Servicio de Alergia e Inmunología Clínica del Hospital Universitario de Puebla, derivado del propuesto por la Guía Mexicana de Práctica Clínica de Inmunoterapia, logra disminuir significativamente los síntomas de asma o rinitis de etiología alérgica, por lo que consideramos que es eficaz con un conveniente perfil de seguridad, como lo sugiere el nivel de evidencia y recomendación derivado del presente estudio.











 nueva página del texto (beta)
nueva página del texto (beta)