Antecedentes
La rinitis crónica es una patología inflamatoria de vía aérea superior que se caracteriza por rinorrea, prurito, obstrucción nasal y estornudos de diferente gravedad.1 La existencia o no de sensibilización a alérgenos permite la clasificación de la rinitis alérgica (RA) o no alérgica (RNA).1,2
Esta patología adquiere relevancia por el compromiso de la calidad de vida que produce en quienes la padecen1 y su alta prevalencia: entre 20 y 40 % en la población general, la mitad de naturaleza no alérgica.1,2
Existen múltiples evidencias que sustentan una estrecha relación entre la vía aérea superior e inferior. Esto ha llevado al concepto de una enfermedad común que afecta toda la vía aérea, principalmente ligada a un proceso sistémico alérgico y, secundariamente, a mecanismos no alérgicos aún no completamente dilucidados.3 Las formas de RA y RNA presentan numerosas similitudes: ambas se asocian con comorbilidades como sinusitis, conjuntivitis, dermatitis atópica y asma;4 asimismo, se conoce que el riesgo de padecer asma es similar en los niños con Ra y RNA y está aumentado respecto a la población sana.5
La determinación de la fracción exhalada de óxido nítrico (FeNO), producida endógenamente en células del aparato respiratorio como consecuencia de la oxidación de la L-arginina por la sintetasa del óxido nítrico con el estímulo de citoquinas Th2, es un método indirecto, simple y no invasivo para identificar inflamación eosinofílica de la vía aérea.6 Esta cuantificación ha sido validada en los últimos años para el diagnóstico y monitoreo terapéutico del asma alérgica y, en particular, de la respuesta a esteroides inhalados.6
Recientemente se han observado cambios inflamatorios bronquiales con predominio de eosinófilos por esputo inducido7,8 y análisis de FeNO9,10,11,12,13 en el fenotipo alérgico de rinitis. Son menos los estudios que caracterizan la inflamación de la vía aérea inferior en ARN.14 Sin embargo, la relación entre atopia, rinitis y FeNO no se ha evidenciado en todas las poblaciones y algunos autores no observaron diferencias en FeNO entre sujetos atópicos y no atópicos15 ni entre pacientes con RA y RNA puras.16
A pesar de la asociación epidemiológica entre RNA y asma, la relación entre RNA e inflamación de la vía aérea inferior no está suficientemente aclarada en individuos sin asma.
La investigación que presentamos tuvo como objetivo principal estudiar las diferencias de la FeNO en pacientes con rinitis sin asma clínica según la presencia o no de sensibilización alérgica y en relación con la función pulmonar por espirometría y la gravedad de la rinitis. Además, investigamos la correlación de FeNO con biomarcadores de atopia como eosinófilos en sangre e inmunoglobulina E (IgE) sérica total.
Método
Estudio transversal, observacional analítico, en el que se incluyeron de forma sucesiva niños y adolescentes de uno u otro sexo, entre seis y 18 años, con diagnóstico de rinitis basado en la presencia de dos o más síntomas nasales característicos (rinorrea, obstrucción nasal, prurito y estornudos).1 Los pacientes fueron categorizados con RA y RNA, de acuerdo con la presencia o no de sensibilidad a aeroalérgenos determinada por pruebas cutáneas por punción.17 Se excluyeron los pacientes con las siguientes condiciones:
Antecedente de asma o síntomas equivalentes (tos, disnea o sibilancias) por historia clínica.
Infección aguda o crónica de vías aéreas superiores e inferiores.
Alteraciones nasales anatómicas, hipertrofia adenoidea y poliposis.
Uso previo de inmunoterapia alérgeno-específica (subcutánea o sublingual.
Medicación con antihistamínicos, esteroides intranasales o sistémicos, antagonistas de leucotrienos y alfa-adrenérgicos (endonasales o sistémicos) en las últimas cuatro semanas.
Fumadores activos o expuestos al humo de cigarrillo en el medio ambiente familiar.
Se registró edad, sexo, talla, peso y duración de la rinitis. Se realizaron pruebas cutáneas con alérgenos de lectura inmediata por prueba de punción cutánea, espirometría por curva flujo-volumen, determinación de IgE sérica total y hemograma completo con medición de valores absolutos y relativos de eosinófilos en sangre. Se efectuó cuantificación de la FeNO y se clasificó la rinitis de acuerdo con los criterios de ARIA (Allergic Rhinitis and its Impacto on Asthma).
La duración de la rinitis se estableció mediante la diferencia entre edad de inicio de los síntomas y la edad del paciente al momento del diagnóstico. El porcentaje de vida afectada se obtiene con la siguiente ecuación:
[Edad de diagnóstico - edad de inicio/edad de diagnóstico] × 100
La clasificación clínica de la rinitis por grados se estableció de acuerdo con los criterios de ARIA.1 Según la frecuencia, los pacientes que presentaron síntomas menos de cuatro días a la semana por menos de cuatro semanas consecutivas fueron clasificados con rinitis intermitente; la existencia de síntomas por más de cuatro días a la semana por más de cuatro semanas consecutivas fue considerada como rinitis persistente. La gravedad de la rinitis se determinó según el compromiso de la calidad vida (limitaciones en la escolaridad, actividades diarias, sueño y existencia de síntomas molestos), en leve (ningún ítem afectado) y moderada-grave (uno o más aspectos de calidad de vida comprometidos). Por consiguiente, se clasificaron cuatro grupos clínicos de rinitis:
Pruebas cutáneas con alérgenos
Se utilizó un panel estandarizado con los siguientes alérgenos del laboratorio Alergo-Pharma® (Buenos Aires, Argentina): ácaros (Dermatophagoides pteronyssinus, Dermatophagoides farinae, Blomia tropicalis), hongos ambientales (Alternaria sp., Aspergillus sp., Cladosporium sp., Mucor sp., Rhizopus sp., Penicillum sp.), epitelio de perro, epitelio de gato y pólenes de árboles, gramíneas, compuestas y tala, solución salina fenolada (control negativo) y 1 mg/mL de histamina (control positivo). Las pruebas se efectuaron en la cara anterior del antebrazo, con una lanceta tipo Pricker (Diater Laboratorios®, Buenos Aires, Argentina), lectura a los 15 minutos con una regla milimetrada. Se consideró positiva la presencia de una pápula de 3 mm o más como promedio de la lectura de los diámetros ortogonales, respecto al control negativo.17 La positividad a uno o más alérgenos se correspondió con el fenotipo de RA; la negatividad de las pruebas cutáneas definió el fenotipo no alérgico de rinitis.
Curva flujo-volumen
Se realizó con un espirómetro Vitalograf®, modelo 2120 UK, de acuerdo con las normas internacionales de American Thoracic Society/European Respiratory Society (ATS/ERS).18 Se determinó capacidad vital forzada (CVF), volumen espiratorio forzado en el primer segundo de la CVF (FEV1), índice FEV1/CVF y flujo espiratorio forzado entre 25 y 75 % de la CVF (FEF 25-75 %), con valores directamente calculados por el programa incluido en el aparato que se utilizó, según la tabla de valores normales de Knudson.19 Se consideraron valores anormales inferiores a 80 % para los tres primeros parámetros y a 65 % para FEF 25-75 % en relación con los valores predictivos normales.18 Se valoró la respuesta broncodilatadora después de 15 minutos de la administración inhalatoria de 200 μg de salbutamol (Ventolín®, Glaxo-SmithKline) mediante una cámara espaciadora Aerocámara® de 500 mL con válvula unidireccional. Se calificó positiva una mejoría en el FEV1 ≥ a 12 % respecto al valor basal prebroncodilatador.18 Se eligió la mejor de tres determinaciones basales y tres posbroncodilatador que cumplieran con los criterios de aceptabilidad y reproducibilidad según ATS/ERS.19
IgE sérica total y eosinófilos en sangre periférica
Se utilizó la técnica de radioinmunoanálisis de doble anticuerpo (Pharmacia, Uppsala®, Suecia) para determinar la IgE sérica total. Los resultados se expresaron en unidades internacionales por mililitro (UI/mL). Se determinaron los valores numéricos absolutos de eosinófilos por milímetro cúbico (mm3) de sangre venosa periférica a partir del porcentaje relativo del total de leucocitos del hemograma, con tinción de May Grünwald-Giemsa. Se descartó previamente posibles parasitosis intestinales y otros potenciales síndromes hipereosinofílicos por historia clínica. En todos los casos se incluyeron pacientes sin antecedentes de infección bacteriana o viral aguda actual o dentro del último mes.
Medición de la fracción exhalada de óxido nítrico
La medición de FeNO se realizó usando un equipo portable NIOX Mino® (Aerocrine Co. Ltd., Suecia), con base en las guías internacionales.6 Se indicó evitar alimentos ricos en nitrógeno 12 horas antes del estudio, bebidas de cola, esfuerzos físicos y contacto con humo del tabaco.6,20
Los pacientes fueron instruidos verbalmente y por video para inspirar profundamente con boquilla adosada a su boca hasta la capacidad pulmonar total, en posición sentada o supina. Luego se realizó una espiración a flujo constante de 50 mL/segundo por un mínimo de seis segundos con lectura en el monitor del aparato del FeNO en partes por billón (ppb). La determinación fue descartada si no se logró un flujo estable por el término mínimo de seis segundos. Se repitió la maniobra hasta dos veces para evitar subvaloraciones en las determinaciones. Se consideraron normales valores < 20 ppb; intermedios entre 20 and 35 ppb y patológicos > 35 ppb.6,20 Las pruebas cutáneas con alérgenos, la determinación de la FeNO, la espirometría por curva flujo volumen y el hemograma fueron realizadas por distintos operadores sin conocimiento de las otras variables estudiadas. Para evitar variaciones circadianas, todos los estudios complementarios fueron realizados entre las 9 y 12 horas. El orden de los estudios respetó el flujograma de la figura 1.
Análisis estadístico
Las variables discretas se describieron en porcentajes, con intervalo de confianza de 95 % (IC 95 %), y las continuas en promedios con sus respectivas desviaciones estándar o mediana y rango. Se utilizó la prueba de Wilcoxon-Mann-Whitney para comparar variables cuantitativas y chi cuadrada para comparar variables cualitativas. Se realizó análisis de correlación de Spearman; una p ≤ 0.05 se consideró estadísticamente significativa. Se utilizó el programa estadístico InfoStat.21
Aspectos éticos
El trabajo de investigación fue aprobado por el Comité Institucional de Ética de la Investigación en Salud (CIEIS) de la Clínica Universitaria Reina Fabiola, Facultad de Medicina, Universidad Católica de Córdoba, Argentina; se realizó cumpliendo con la normativa de la Declaración de Helsinki y Buenas Prácticas Clínicas y de acuerdo con la Ley de la Provincia de Córdoba sobre Investigación en Seres Humanos 9694/09. Se solicitó el consentimiento informado para la realización de todas las intervenciones y para el uso de los datos; se garantizó su confidencialidad según la Ley Nacional de Protección de Datos Personales 25326/00. Los autores declararan no tener conflictos de intereses.
Resultados
Se incluyeron 40 pacientes, 28 con RA y 12 con RNA (cuadro 1). Los pacientes con RA tuvieron niveles de FeNO más elevados (mediana 36.5 ppb, rango 5-114) que los RNA (mediana 7 ppb, rango 5-24) (p = 0.0011) (figura 2). Considerando valores de FeNO de 20 ppb como punto de corte, los pacientes con FeNO en valores intermedios y patológicos tuvieron mayor probabilidad de presentar función pulmonar anormal (RM = 7.14 [IC 95 % = 1.04-49.04]) (p = 0.049). No hubo diferencias de FeNO en relación con la frecuencia de los síntomas (p = 0.576) ni la gravedad de la rinitis (p = 0.168). En pacientes con RA se comprobó correlación positiva entre los valores de FeNO y los de eosinófilos en sangre periférica (r = 0.41, p = 0.033, figura 3). No hubo correlación entre FeNO con IgE sérica total (r = 0.24, p = 0.21) en RA ni entre FeNO versus eosinófilos sangre (r = 0.02, p = 0.96) y FeNO versus IgE en el grupo con RNA (r = 0.32, p = 0.34).
Cuadro 1 Características antropométricas y demográficas de los niños y adolescentes con rinitis alérgica y no alérgica
Variable |
Rinitis alérgica (n = 28) |
Rinitis no alérgica (n = 12) |
p |
||
n |
% |
n |
% |
||
Sexo masculino |
12 |
42.8 |
6 |
50 |
0.673 |
Mediana ± DE |
Rango |
Mediana ± DE |
Rango |
||
Edad (años) |
11.66 ± 2.91 |
6.16-17.5 |
12.01 ± 3.85 |
6.08-18.25 |
0.882 |
Peso (kg) |
44.33 ± 16.65 |
18.20-83 |
41.02 ± 12.73 |
21-56 |
0.647 |
Talla (m) |
1.48 ± 0.15 |
1.13-1.68 |
1.45 ± 0.19 |
1.17-1.71 |
0.679 |
Duración de la rinitis (años) |
5.14 ± 3.63 |
1.08-16.5 |
4.72 ± 3. |
88 1.25-15.5 |
0.574 |
IgE sérica (UI/mL) |
408 ± 412 |
21-1602 |
54 ± 78.30 |
8.48-288 |
0.0001 |
Eosinófilos en sangre (células/mm3) |
569 ± 447.17 |
0-2200 |
228.58 ± 223.63 |
58-864 |
0.0046 |
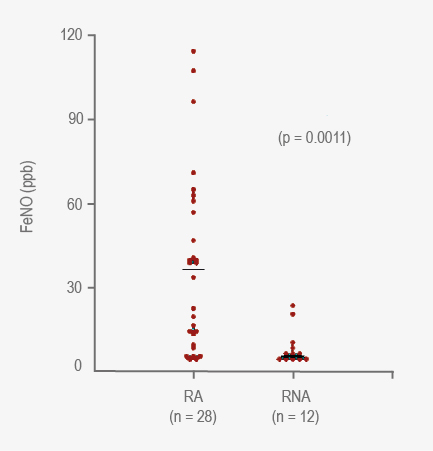
Figura 2 Distribución de los valores de la fracción exhalada de óxido nítrico entre pacientes con rinitis alérgica (RA) y no alérgica (RNA). RA = rinitis alérgica, RNA = rinitis no alérgica, ppb = partes por billón.
Discusión
En los últimos años se estudiaron las conexiones fisiológicas y patológicas entre la vía aérea superior e inferior, reconocidas como una “vía aérea única”.1,3,22 Por ello, la nariz y el pulmón se consideran órganos estrechamente relacionados que se comportan como una unidad anátomo-funcional.1,22 En los pacientes con rinitis producida por alérgenos se han comprobado signos de inflamación eosinofílica en la vía aérea inferior por esputo inducido,7,8 biopsia bronquial23 y FeNO.9,10,11,12,13 Este último es un método indirecto simple, seguro y reproducible para detectar inflamación eosinofílica bronquial, lo que le otorga mayor utilidad clínica.6 Este fenómeno inflamatorio, propio de pacientes con asma alérgica, parece también existir en quienes padecen RA, lo que indica la existencia de inflamación subclínica que podría tener implicancias pronósticas.24
Nuestro estudio demostró que los niños y adolescentes con RA, sin asma, exhiben niveles de FeNO más elevados que aquellos con RNA. Nuestros resultados coinciden con los de la mayoría de las investigaciones, que indican la ocurrencia de valores elevados de óxido nítrico exhalado en pacientes con RA comparados con RNA9,11 o individuos sanos,10,12,13 aunque las conclusiones derivadas de la bibliografía no son totalmente concordantes. En una investigación que incluyó niños con RA, RNA y controles sin rinitis,9 los primeros tuvieron los niveles más elevados de FeNO respecto a los otros grupos (15.9 ppb versus 6.8 versus 6.6 ppb). Estos valores de óxido nítrico exhalado, según los lineamientos actuales de la ATS6 no son considerados patológicos. Rolla et al.,16 en una población de niños y adultos, no demostraron diferencias significativas en FeNO entre pacientes con RA y RNA no asociadas con otros síntomas respiratorios.
En discordancia con estos últimos estudios, la mayoría de los autores coincide en sostener el papel de la atopia como determinante del aumento del óxido nítrico bronquial. Makris et al.10 comprobaron un incremento significativo de FeNO en pacientes con RA polínica durante la estación, comparado con controles sanos y con pacientes atópicos asintomáticos. Esto indica la existencia de inflamación en la vía aérea bronquial que se incrementa con la exposición polínica estacional en rinitis sin asma. Un aumento de FeNO también se observó en niños con RA con y sin hiperreactividad bronquial (HRB).13 El grupo de RA con HRB tuvo valores ligeramente superiores de FeNO que los pacientes sin HRB. En adultos con RA se demostró la coexistencia de FeNO elevado e HRB a la metacolina.12 Se determinó que el mejor umbral de FeNO para diferenciar la presencia de HRB en pacientes con RA persistente es de 27 ppb. Lo anterior evidencia una relación directa entre la inflamación y la magnitud de la HRB en RA y se especula que la existencia conjunta de ambas puede ser factor de riesgo para el futuro desarrollo de asma.12
Si bien en nuestro estudio no investigamos hiperreactividad bronquial, observamos que la FeNO anormal, en valores intermedios y patológicos se asoció con mayor riesgo de función pulmonar alterada, evento más frecuente en nuestros pacientes con RA. Esto podría indicar que la inflamación eosinofílica bronquial subclínica tiene impacto directo sobre la función pulmonar por espirometría. Como la alteración espirométrica también existió en pacientes con RNA, podemos especular que la inflamación de otras características, no eosinofílica, podría contribuir a la afectación funcional en este fenotipo de rinitis, no demostrable por determinación de FeNO.
Por otro lado, mientras que el defecto observado en FeNO es casi exclusivo del fenotipo alérgico de rinitis, la HRB y la alteración espirométrica en rinitis son independientes del estado atópico,14,24,25 lo que sugiere un nexo entre el tracto respiratorio superior e inferior más allá de la presencia de alergia.3 Las alteraciones subclínicas de la vía aérea inferior podrían ser proporcionales al grado clínico de rinitis. En un estudio previo en pacientes con rinitis sin asma se comprobaron alteraciones funcionales respiratorias, detectadas en la curva flujo-volumen, más frecuente en aquellos con mayor gravedad clínica de la rinitis.25 Del mismo modo, otros estudios demostraron HRB como defecto más prevalente en diferentes poblaciones de pacientes con rinitis persistente moderada y grave.26 Con estas observaciones, se podría inferir que la determinación de la FeNO refleja la magnitud de la inflamación de la vía aérea intratorácica en forma proporcional a la gravedad clínica de la rinitis. En una publicación reciente27 se determinaron mayores niveles de FeNO en RA persistente versus intermitente, pero no hubo diferencias en relación con la gravedad (leve versus moderada-grave) ni en las formas completas de la clasificación de ARIA.
Por otro lado, la FeNO no se correlacionó con la magnitud de los síntomas o la afectación de la calidad de vida en niños con RA con y sin asma.28 En nuestra investigación, la frecuencia ni la gravedad de la rinitis de nuestros pacientes, evaluados por separado considerando los criterios de ARIA, se asociaron con las cifras de FeNO. Pareciera que el grado de inflamación endobronquial no se expresa en función de la gravedad de la rinitis. Esto puede ocurrir como consecuencia del escaso número de pacientes incluidos en nuestro estudio, que no permitió un análisis más amplio según los cuatro grados completos establecidos en ARIA. En este estudio, además, evaluamos la relación de FeNO con variables fenotípicas relacionadas con la alergia como la IgE y el recuento absoluto de eosinófilos en sangre periférica. Si bien el grupo con RA experimentó valores de IgE y eosinófilos significativamente más elevados que en RNA, solo se observó una correlación significativa entre FeNO y el número de eosinófilos hemáticos (no obtenida en nuestros pacientes con RNA) en coincidencia con un estudio anterior.29 Ello se podría explicar con el modelo sistémico de enfermedad alérgica basado en el concepto patogénico de diseminación hemática de un evento inflamatorio eosinofílico con impacto en toda la extensión de la vía aérea, desde la nariz al bronquio.3 Así, por su correlación con la FeNO, la eosinofilia hemática podría ser un indicador indirecto, cuya determinación para inflamación bronquial mediada por eosinófilos es más simple y barata.
Las anormalidades pulmonares sin expresión clínica en individuos con rinitis podrían significar un mayor riesgo evolutivo de asma. Se ha reportado una asociación entre una FeNO > 34 ppb con respuesta positiva al broncodilatador, compatible con asma subclínica.30 Una evidencia reciente parece reforzar esa observación. Altos valores de FeNO en RA en niños podría ser un biomarcador predictivo del desarrollo de asma. Di Cara et al.31 demostraron que 21 de 109 niños con RA desarrollaron asma luego de cinco años de seguimiento. Todos exhibieron al inicio del estudio una FeNO > 35 ppb, siendo el riesgo proporcional al valor inicial de FeNO. Esta es la primera evidencia de la capacidad que tiene la determinación de FeNO de proveer información del compromiso bronquial subclínico como predictor de asma en niños con RA y realza su potencial utilidad en la práctica clínica en conjunto con la evaluación de la atopia en pacientes con rinitis.
Nuestro estudio tiene la fortaleza de demostrar, en forma clara, diferencias significativas en los valores de FeNO según el fenotipo alérgico o no alérgico de rinitis. Valorando que el esfuerzo espirométrico puede reducir los valores de FeNO, tomamos la precaución de realizar la espirometría después de la determinación de FeNO y tuvimos en consideración todas las variables que pueden afectar la medición. No obstante, deben valorarse algunas limitaciones. El tamaño muestral de cada grupo con RA y RNA fue limitado. Por lo tanto, el escaso número de pacientes percibidos de tener función pulmonar anormal (n = 5/40) hizo que la razón de momios fuera determinada incluyendo valores intermedios de FeNO. Por la misma razón, el análisis de la relación de FeNO y la gravedad de la rinitis se realizó considerando por separado frecuencia de síntomas y gravedad y no la clasificación completa en cuatro grados según ARIA. Por ello, un mayor número de pacientes permitirá un análisis más preciso en su asociación con función pulmonar alterada y los grados clínicos de rinitis.
Conclusiones
Los niños y adolescentes con RA de nuestro estudio tuvieron FeNO significativamente más elevado que los pacientes con RNA. El hallazgo se correlacionó significativamente con el recuento de eosinófilos hemáticos. La FeNO elevada estuvo asociada con función pulmonar alterada.
Utilidad potencial de los resultados
Este estudio permitió profundizar en el conocimiento de la fisiopatología de la vía aérea alta y baja como una unidad indivisible en RA y RNA y establecer el papel de la rinitis y de la condición de alergia como factores asociados con la inflamación en la vía aérea inferior. Por las potenciales implicaciones evolutivas y terapéuticas, una evaluación más rigurosa de estos pacientes permitirá la detección temprana de inflamación subclínica bronquial en individuos con rinitis.











 text new page (beta)
text new page (beta)





