Antecedentes
La naturaleza hipersensible de la tos (defensa de la vía aérea al evitar broncoaspiración, protegernos de infecciones y sustancias nocivas y alertarnos de algún problema) puede convertirse en reflejo irresistible cuando existe hipersensibilidad a estímulos ambientales triviales.1,2 Una encuesta en Europa señala que la mayoría de los individuos con tos crónica, aquella persistente por más de ocho semanas, reportó que el medicamento prescrito no le ayudaba o era prácticamente ineficaz (57 y 36 %, respectivamente).3,4 En años recientes, ha habido un avance relevante en el campo de la investigación del mecanismo de la tos.1,2,3,4,5,6,7,8
Síndrome de hipersensibilidad del reflejo de la tos
La tos crónica se entiende como una consecuencia primaria de diferentes condiciones o enfermedades crónicas tales como vía aérea reactiva (asma y bronquitis eosinofílica), rinosinusitis o reflujo gastroesofágico (ERGE).9 Sin embargo, una gran proporción de pacientes con estas condiciones no presentan tos crónica,10.11 ni pertenecen a las categorías diagnósticas de tos crónica idiopática, resistente o inexplicable. Esto ha ocasionado que se considere que la tos crónica representa una entidad clínica con diferente patofisiología.12,13 En realidad, el reflejo de la tos tiene sus propias vías neurales de regulación,14 por ello, las condiciones o enfermedades descritas pudieran estar asociadas con o actuar como precipitantes de tos, más que ser las causas directas de esta.15
Recientemente se ha propuesto un nuevo paradigma, el “síndrome de hipersensibilidad del reflejo de la tos” (SHRT) (figura 1),16 que se define como una entidad clínica caracterizada por tos como componente mayor, frecuentemente inducida por niveles bajos de exposición a estímulos térmicos, mecánicos o químicos.16 Constituye un término general que agrupa varias condiciones asociadas con la tos o a la tos inexplicable,16 sin importar las condiciones o enfermedades subyacentes.

Figura 1 Paradigmas en la tos crónica. A) Protocolo diagnóstico anatómico: la tos crónica es considerada como el resultado de enfermedades subyacentes o causales que afectan las vías anatómicas del reflejo de la tos. B) Síndrome de hipersensibilidad del reflejo de la tos: constituye un mecanismo común intrínseco del síndrome de tos. Enfermedades comúnmente asociadas constituyen factores precipitantes o moduladores de las vías anatómicas del reflejo de la tos. UACS = síndrome de tos proveniente de la vía aérea superior, ERGE = enfermedad gastroesofágica, RGSE = reflujo gastrosupraesofágico, MPCV = movimiento paradójico de cuerdas vocales.
Se ha sugerido que el mecanismo principal de esta hipersensibilidad se encuentra en las vías neurales sensoriales desreguladas y en el proceso central de la regulación de la misma tos.17,18 Esta noción de como patofisiología de la tos continúa acumulando evidencia.
Neurobiología de la tos
Desde el punto de vista clínico hay dos tipos de tos:
Tos protectora e involuntaria iniciada por aspiración.
Tos no productiva que comúnmente se asocia con tos crónica, alergia e infecciones virales.
Con métodos genéticos y microscopia electrónica se ha encontrado evidencia de que estos dos tipos de tos se regulan por diferentes subtipos de nervios.
Tos inconsciente
Las fibras Ad, conocidas como “fibras de tos”, poseen mielina, conducen los estímulos a una velocidad de > 5 m/segundo, son fibras mecanorreceptoras con umbral bajo, responden a estímulos mecánicos perturbadores al tocar el epitelio de la vía respiratoria a pesar de situarse debajo de la membrana basal. Responden también a materia particulada, al moco, a la disminución rápida en el pH de la vía respiratoria y a soluciones hipotónicas. Son insensibles a la estimulación con capsaicina y diversos mediadores inflamatorios. Aún bajo anestesia, la activación de estas fibras evoca un reflejo tusígeno. Son fenotípicamente diferentes a los receptores vagales de estiramiento (fibras RAR y SAR) y también diferentes a las fibras broncopulmonares C.2,3,4,5,6,14,15,16,17,18
Tos consciente
Las fibras C son fibras quimiorreceptoras conocidas como nociceptores, no poseen mielina, con velocidad de conducción lenta (< 1 m/segundo), son provocadas por estímulos químicos, térmicos exógenos y moléculas inflamatorias endógenas; son insensibles a la distensión pulmonar y se activan en respuesta a activación celular o inflamación. Estudios clínicos muestran que al inhalar estímulos como bradicinina y capsaicina se producen sensaciones provocadoras de tos. A bajas concentraciones, estos estímulos causan lo que conocemos como “urgencia de toser”. Estas fibras no tienen especialización morfológica en sus terminales, por ello se denominan nervios polimodales (pueden activarse por muchos y diferentes estímulos como bradicinina, capsaicina, nicotina, ATP [adenosín trifosfato], adenosina, cambios extremos de temperatura y pH bajo).
Muchos de estos estímulos emplean miembros de los receptores transitorios potenciales de canales iónicos (canales TRP, transient receptor potential) como elementos de transducción, en particular TRPV1 (transient receptor potential vanilloid 1) y TRPA1 (transient receptor potential ankyrin-1). En los sitios de inflamación, la actividad de las fibras C se encuentra aumentada. Pero, no todas las fibras C provocan tos. Algunos estudios indican que algunas fibras C en la laringe pueden inhibir la tos.2,3,4,5,6,14,15,16,17,18
Interacciones de los nervios sensoriales
Diferentes tipos de fibras sensoriales convergen en el sistema nervioso central; Mazzone et al. han demostrado que la activación de las fibras C puede provocar o sensibilizar impulsos de más fibras especializadas, incluyendo las fibras de tos en laringe y tráquea (Ad). A este fenómeno se le conoce como “sensibilización central”. Estas fibras C que sensibilizan a las fibras de tos pueden no situarse en las vías aéreas grandes, ya que las fibras C en el pulmón o aún en el esófago pueden provocar esta sensibilización central.2,14,15,16,17,18
Alérgenos y neuroplasticidad
La inflamación de la vía aérea por factores alérgenos o virales provocan mayor descarga de potenciales de acción (efecto cuantitativo), así como mayores cambios en el sistema nervioso de la vía aérea (efecto cualitativo y fenotípico). Respecto al efecto cuantitativo, se observa que el reto con alérgenos puede incrementar las descargas de potenciales de acción en las fibras C vagales, aumentando a su vez la excitabilidad eléctrica de los receptores de las tos (fibras Ad vagales).
En relación con los cambios fenotípicos, Canning et al. han reportado que el reto alergénico resulta en la transcripción y traslación de TRPV1 y TRPA1 en las fibras Ad vagales. Estas no expresan normalmente estos receptores TRP y por lo tanto no son típicamente activadas por muchos de los mediadores de inflamación. La activación de TRPV1 y TRPA1 por factores irritativos de la vía aérea y medidores endógenos de inflamación pueden provocar descargas de potenciales de acción en estas fibras Ad, por lo tanto, la inflamación alérgica o viral no solo causa un incremento inmediato en la excitabilidad eléctrica, sino que además provoca que estos cambios fenotípicos permanezcan, tengan mayor duración y se incremente el repertorio de estímulos capaces de iniciar su activación. Los mayores responsables de estos cambios fenotípicos son los llamados factores neurotróficos, como el factor de crecimiento nervioso, el factor neurotrófico derivado del cerebro y el factor neurotrófico derivado de la glía.2,3,4,5,6,14,15,16,17,18
Manifestaciones clínicas
Los pacientes con tos crónica frecuentemente reportan que su tos es causada por estímulos inocuos tales como oler perfumes, exponerse al aire frío, realizar ejercicio, sentir estrés, cantar o hablar (alotusia).1,2,3,4,5 Esta tos es frecuentemente precedida por una “urgencia por toser”, una sensación de irritación, comezón o polvillo en la garganta, llamada también parestesia laríngea. La frecuencia de alotusia o urgencia por toser varía de acuerdo con la población estudiada, pero se reporta en casi todos los pacientes.1,2,3,4,5,16
Estas características de la tos son similares a las del dolor, tales como alodinia, donde el dolor es causado por estímulos que normalmente no producen dolor.17 El desplazamiento de la curva de tos a la izquierda (hipertusia, incremento de la sensibilidad de la tos a estímulos nocivos) es otro ejemplo de esta hipersensibilidad del reflejo de la tos (HSRT). La respuesta de tos a la inhalación de capsaicina (estimulante de TRPV1) puede incrementarse después de la administración del inhibidor de la enzima convertidora de angiotensina.19
La HSRT puede observarse comúnmente en varias condiciones que se presentan con tos, tales como asma, asma con tos predominante, tos asociada con ERGE y en la tos idiopática, pero no se observa en asma sin presencia de tos.20,21 El control de estos factores asociados usualmente normaliza a HSRT.22
Activación neural sensorial en las vías aéreas
Varios factores precipitantes periféricos como los virus, alérgenos e irritantes pueden inducir cambios fenotípicos en las neuronas sensoriales y estimular la hiperrespuesta de tos en el individuo. Los virus respiratorios infectan y se replican en las células epiteliales de la vía aérea, provocando respuestas proinflamatorias en el huésped para liberarse de los invasores; las células epiteliales de la vía aérea producen factores neurotróficos solubles en respuesta a las infecciones virales.23,24 También pueden infectar neuronas sensoriales y producir cambios fenotípicos neuronales.25
Experimentos en conejillo de indias han demostrado que al provocar una infección viral intranasal con parainfluenza-3 hay incremento significativo en la expresión de TRPV1 en las neuronas Ad del ganglio nodoso traqueal. Neuronas nociceptivas con fibras C, pero no neuronas Ad, típicamente expresan TRPV1 y producen neuropéptidos, tales como sustancia P (SP) o péptido relacionado con el gen de la calcitonina (PRGC). La expresión de TRPV1 se ha usado como marcador de un cambio fenotípico en las neuronas sensoriales pulmonares.
Estos cambios fenotípicos neuronales se correlacionan con respuestas de tos a precipitantes tusígenos, tales como capsaicina y ácido cítrico, y se han asociado con incremento en la expresión de receptores neurotróficos en las neuronas.26 Cambios fenotípicos similares en neuronas sensoriales, así como el incremento de la tos se han observado en modelos animales (conejillo de indias) al provocar inflamación alérgica de la vía aérea o al estimularla con materia particulada (2.5 micras) inhalada que induce inflamación de la vía aérea.27,28 Estos cambios fenotípicos en las neuronas sensoriales periféricas provocan respuestas inflamatorias en las células inmunes, lo que llamamos inflamación neurogénica.
La liberación de neuropéptidos, tales como SP y PRGC, inducen dilatación vascular local,29 quimiotaxis, activación de células inmunes y promueven la polarización a células Th2.30 Estas interacciones neuroinmunes, particularmente en casos de estimulación sensorial repetida (virus o alérgenos), provocarán un ciclo de respuesta de hipersensibilidad.31
Esta hiperregulación de nervios sensoriales de la vía aérea se encuentra comúnmente en pacientes con tos crónica. En estudios de lavado broncoalveolar, mediadores inflamatorios tales como histamina, PRGC, cisteinil-leucotrienos y prostaglandinas E2 y D2 se encontraron incrementados en pacientes con tos crónica, sin importar las condiciones subyacentes.32,33,34,35
O´Connell et al. demostraron que el PRGC está aumentado en forma significativa en tejidos pulmonares periféricos de pacientes con tos idiopática comparado con controles sanos. La expresión de TRPV1 también se incrementó en los nervios epiteliales bronquiales de pacientes con tos crónica comparados con controles sanos.36
Recientemente, West et al.37 demostraron por primera vez características morfológicas complejas y densas en las redes neurológicas neurales de la vía aérea periférica en pacientes con tos inexplicable; para ello emplearon un abordaje posbiopsia pulmonar en humanos, con inmunofluorescencia tisular en montaje completo. Este es considerado un avance técnico considerable, ya que estudios previos con secciones tisulares delgadas habían reportado inervación subepitelial escasa (1 a 3 %).35,37 El producto del gen proteico 9.5, un marcador pan-neuronal en células epiteliales referido como células neuroendocrinas pulmonares, fue observado a través de todas las capas epiteliales, lo que sugiere la comunicación entre nervios y células epiteliales.37
Alteraciones neurales centrales en el procesamiento de la tos
En imágenes funcionales cerebrales, Mazzone et al. observaron que los procesos neurales centrales en la regulación de la tos se encuentran alterados. La sensación de irritación laríngea (urgencia por toser) posterior a la inhalación de precipitantes tusígenos normalmente acompaña la activación de diversas áreas cerebrales, sin embargo, los pacientes con HSRT mostraron mayores señales de activación en tres áreas del cerebro medio: el nucleus cuneiformis, periacueducto y el raphe dorsal, al compararlos con individuos control.21 Esas áreas del cerebro medio son conocidas como componentes del sistema modulador descendiente en dolor.38 Estos cambios en los pacientes con tos pudieran indicar un procesamiento neural central alterado.
Otro hallazgo importante fue que los pacientes con tos hipersensible mostraron menores niveles de activación en corteza prefrontal dorsomedial y cíngula medial anterior,21 implicadas en la supresión de la tos.39 La pérdida del control inhibitorio de la tos distingue también a los pacientes con tos crónica,40 la cual se ha observado en estudios funcionales al inhalar capsaicina con respuestas de tos. Se ha sugerido que agentes antitusivos centrales como la morfina41 y los antihistamínicos de primera generación, como la clorfeniramina y la difenhidramina,42 actúan a través de su actividad agonista en estas vías inhibitorias centrales. Estos efectos no se relacionan con sedación.43
Se considera que el origen de este procesamiento central anormal en la tos se debe a estímulos sensoriales periféricos y la subsecuente inflamación, sin embargo, esto necesita comprobarse. Algunos estudios en animales sugieren que esta estimulación periférica repetida induce cambios en el sistema nervioso central. En un modelo de asma alérgica con macacos rhesus, la exposición repetida al alérgeno del ácaro del polvo dio como resultado un incremento en la excitabilidad de las neuronas del núcleo del tracto solitario (NTS).44
En un modelo de ratones con asma alérgica provocada por ovalbumina, células del NTS mostraron mayor actividad en respuesta a la capsaicina versus controles.45 En otro experimento con conejillos de indias jóvenes, la exposición prolongada al humo de tabaco incrementó la transmisión sináptica de fibras aferentes sensoriales pulmonares en el NTS a través de la SP.46
Ensayos clínicos
La evidencia de ensayos clínicos demuestra este nuevo paradigma de hipersensibilidad. Medicamentos con eficacia antitusiva en pacientes con tos inexplicable, tales como opioides (morfina a través del receptor mu opioide), gabapentina, pregabalina (moduladores de canales de calcio centrales y periféricos), amitriptilina y AF-219 (antagonista de receptores purinéricos P2X3), muestran propiedades neuromoduladoras y también son útiles en el tratamiento del dolor neuropático.42,47,48,49
El receptor de neurocinina 1 (NK1) ha sido implicado en la sensibilización de sinapsis en el NTS y su antagonista aprepitant ha mostrado reducir la tos en pacientes con cáncer pulmonar.
La generación de potenciales de acción en neuronas vagales sensoriales de la vía aérea posterior a la despolarización de sus terminales por cualquier estímulo depende de una clase de canales de sodio estimulados por voltaje (Nav): Nav 1.7, Nav 1.8 y Nav 1.9; estos son enteramente responsables de la conducción eléctrica. La inhibición de Nav 1.7 ha demostrado la supresión de la tos (figura 2). La terapia no farmacológica basada en terapia de lenguaje y conductual ha mostrado también beneficio significativo en la tos crónica.50
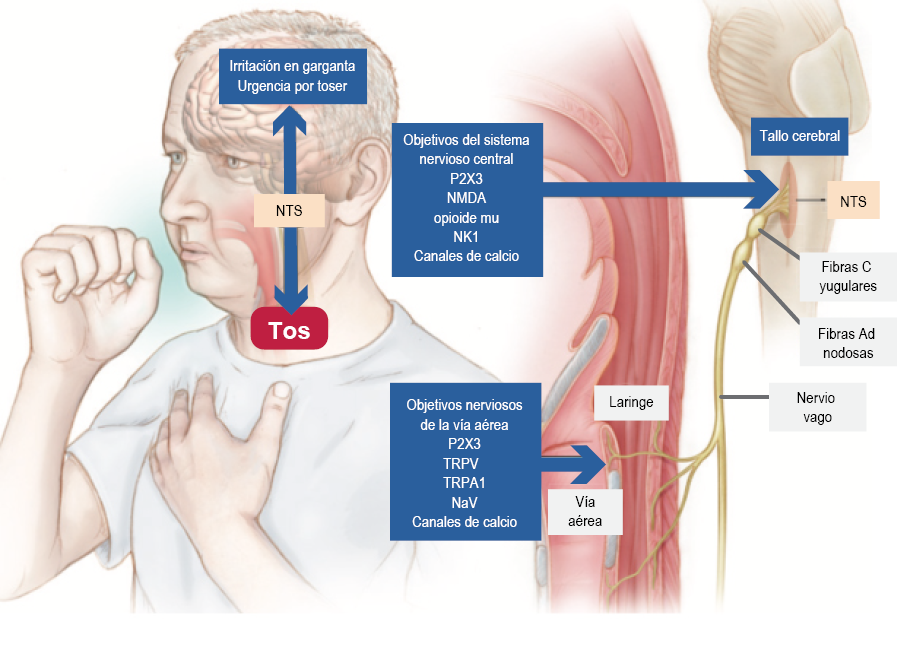
Figura 2 Vías neurales que controlan la tos y lugar de acción de los agentes antitusivos disponibles y en desarrollo. Fibras C, con cuerpos en el ganglio vagal superior (yugular) y fibras Ad, con cuerpos celulares en el ganglio vagal inferior (nodoso), son las principales fibras vagales mediadoras de la tos. Se muestran los receptores y canales de iones localizados en las terminales de los nervios vagales , aunque no intensamente, en el núcleo del tracto solitario (NTS) del tallo cerebral. El receptor potencial transitorio (TRPA1) y el receptor potencial transitorio vanilloide 1 (TRPV1) se encuentran en las terminales nerviosas y son capaces de iniciar potenciales de acción; los canales de sodio estimulados por voltaje (NaV) son responsables de la transmisión de potenciales de acción. Antagonistas de estos receptores están en desarrollo o en ensayos clínicos tempranos. En el sistema nervioso central, el receptor N-metil-D-aspartato (NMDA) es el blanco principal de dextrometorfán. La morfina se cree que posee efectos antitusivos a través del receptor opioide mu, mientras que la gabapentina y la pregabalina modulan los canales de calcio en vías centrales y periféricas. El receptor de neurocinina-1 (NK1) ha sido implicado en la sensibilización de las sinapsis en el NTS y su antagonista (aprepitant) disminuye la tos en pacientes con cáncer pulmonar.
Simpson et al.51 han reportado su experiencia con el bloqueo de la rama interna del nervio laríngeo superior en pacientes con tos crónica neurogénica, atribuida a hipersensibilidad laríngea por daño neural aparentemente posviral, logrando disminuir el índice de severidad de la tos en forma significativa, de un promedio pretratamiento de 26.8 a 14.6 postratamiento (p < 0.0001). Esta rama interna penetra la membrana tirohioidea ligeramente por arriba de la arteria laríngea superior; se divide en rama superior e inferior y proporciona sensaciones generales (dolor, tacto, temperatura) por encima de las cuerdas vocales verdaderas. La rama superior inerva a la faringe inferior, epiglotis, vallecula y vestíbulo laríngeo. La rama inferior inerva la unión ariepiglótica y las cuerdas vocales falsas. La tos típicamente es provocada al estimular la laringe, como al hablar, reír, cantar, deglutir, cambios en la temperatura, cambios de posición o estimulación externa del cuello. Los pacientes describen también una sensación de cuerpo extraño o irritación en la garganta que precede o acompaña a la tos.51
Reguladores en el síndrome de hipersensibilidad del reflejo de la tos
La capsaicina, el ingrediente activo del chile, causa dolor al contacto o al inhalarlo, sensación de quemadura y tos. Es uno de los más potentes provocadores de tos o tusígenos empleados en ensayos clínicos con reto inhalado y provocación de tos. TRPV1, el receptor sensorial para capsaicina, se expresa primariamente en fibras C nerviosas sensoriales, y su expresión se incrementa en pacientes con tos crónica.52 TRPV1 ha sido considerado un blanco para el tratamiento con nuevos agentes antitusivos (figura 2), sin embargo, el antagonista TRPV1 (SB-705498) no mostró ningún beneficio significativo en la disminución de la tos, su frecuencia o en la puntuación de calidad de vida asociada con la tos.53
TRPA1, el cual también actúa en neuronas vagales sensoriales y se encuentra frecuentemente con el TRPV1, se ha considerado otro candidato a blanco terapéutico (figura 2). TRPA1 se une a un amplio número de factores irritativos, tales como alil isotiocianato, cinamaldehído y acroleína, los cuales abundan en contaminantes y en el humo del cigarro, y ha mostrado mediar las respuestas de tos.54 TRPA1 también actúa como termosensor para temperaturas frías (< 17 °C). Ya que la tos está frecuentemente inducida por factores irritantes y exposición al aire frío, este receptor atrajo el interés científico. Un antagonista de TRPA1 no ha mostrado efectos antitusivos significativos en humanos. Estas fallas terapéuticas originan preguntas como si el bloqueo de ciertos receptores únicos en el sistema nervioso periférico era el camino a seguir.
El ATP, molécula liberada durante daño celular, es reconocido por sus receptores purinérgicos. Se han descrito dos tipos de receptores purinérgicos: los receptores P2Y, que responden principalmente a adenosina y adenosín monofosfato, y los receptores P2X, relativamente específicos para ATP. Los receptores P2X están localizados primariamente en neuronas pequeñas aferentes de la clase de fibras C.55 Anthony Ford et al. sugieren que pueden tener un papel significativo en la HSRT. Un estudio clínico controlado aleatorizado en pacientes con tos crónica resistente mostró que AF-219, un antagonista del receptor P2X3, tuvo un efecto dramático en la frecuencia de la tos.49 Estudios subsecuentes han confirmado su eficacia en pacientes con tos crónica, con normalización de la tos hasta por 12 semanas. Claramente el receptor P2X3 es un mediador importante en el SHRT (figura 2).
Los efectos de la inhalación de ATP en pacientes con tos crónica comparados con controles voluntarios sanos fueron similares a los observados con otros agentes tusígenos como capsaicina y ácido cítrico.52 Mientras que los hallazgos sugieren que los receptores P2X3 son parte integral de la vía de hipersensibilidad de la tos, la administración de ATP al árbol traqueobronquial no causa un cambio dramático en la sensibilidad de la tos, lo que sugiere que la ATP puede ser parte en la cadena más que el mediador primario de la HSRT.
La participación de la vía ATP-P2X3 está involucrada en la regulación central de la tos. ATP, un componente permanente del metabolismo intracelular liberado al espacio extracelular durante el daño celular. Esta “señal de estrés” es recogida por neuronas sensoriales a través del receptor P2X3, el cual es responsable de promover la hipersensibilidad.
En ratones knockout en los que la estimulación de TRPV4 produce despolarización de larga acción, se observó que la estimulación sucede a través de canales de pannexin, los cuales permiten que ATP se escape al espacio extracelular.56
Seguramente otros mecanismos diferentes a la liberación de ATP serán descritos, ya que potentes bloqueadores de los receptores P2X3 no son totalmente eficaces para el tratamiento de la tos crónica.49
Recientemente, Buday et al.57 han demostrado la modulación de la respuesta de la tos a través de nervios aferentes de la nariz, principalmente por la interacción del nervio trigémino. El reto nasal con mentol, un agonista del receptor transitorio potencial melanostatin 8 (TRPM8, transient receptor potential cation channel subfamily M member 8) posee efectos benéficos al suprimir la irritación de la vía aérea, incrementando el umbral de la tos e inhibiendo la respuesta de tos posterior al reto con capsaicina. El reto nasal con mentol provoca un efecto antitusivo en conejillo de indias despiertos y anestesiados. El blanco terapéutico principal son los nervios trigeminales aferentes, distribuidos ampliamente en la mucosa nasal. Más de 70 % de estos nervios expresan TRPM8. Se encuentran alrededor de los vasos sanguíneos y pueden mediar reflejos neurovasculares.
Por otro lado, el mentol puede estimular no solo terminales trigeminales sino también terminales olfatorias donde existe TRPM8 y TRPA1, y activar vías reflejas corticales voluntarias de tos. Esta acción compleja del mentol provoca sensaciones frías y refrescantes, reduciendo la percepción de disnea y esfuerzo respiratorio, así como la sensibilidad trigeminal a los factores irritativos de la vía respiratoria. La exposición de la nariz a olores no placenteros incrementa la respuesta del nervio trigémino y este mecanismo es medido por vías de señalización paracrina entre los nervios olfatorios y trigeminal.57
Hipersensibilidad del reflejo de la tos y sus implicaciones clínicas
La hipersensibilidad no solo depende de otras condiciones subyacentes; constituye un síndrome por sí misma. La relevancia de la tos en el asma, por ejemplo, donde la inflamación tipo Th2 contribuye a la hipersensibilidad del reflejo de tos, es un hallazgo frecuente en niños y adultos.
Por lo tanto, la detección de esta inflamación con estudios de esputo inducido o determinación de FeNO58 ayuda a tratar la tos crónica en estos pacientes. No obstante, la tos en el asma presenta una mayor complejidad, especialmente en los pacientes que ya reciben tratamiento.
En un estudio con 89 pacientes con asma diagnosticada, la frecuencia de la tos mostró buena correlación con el control del asma, pero no con la obstrucción de la vía aérea o la inflamación.59 En otro estudio con 262 pacientes adultos con asma severa, la puntuación de Leicester de la tos solo mostró correlación moderada con el control de asma, pero no con el porcentaje de eosinófilos en el esputo.60 En una investigación en la que se usó reto con capsaicina, la respuesta de tos fue más pronunciada en mujeres con asma no atópica, lo que sugiere que la disfunción sensorial es un rasgo importante en el asma tipo 2 bajo.61
Estos hallazgos indican que la tos es un componente importante que contribuye a la patofisiología del asma, independientemente de los factores convencionales como la función pulmonar o la inflamación. Las pruebas existentes para la valoración del control del asma como el cuestionario ACT62 y el cuestionario de control del asma ACQ63 no fueron diseñados para valorar el impacto de la tos en el asma. En futuras investigaciones será importante la utilización de pruebas de cuantificación validadas para la tos.
Experiencia en el Instituto Privado de Inmunología, Alergia y Vías Respiratorias
La tos crónica interfiere con la calidad de vida y tiene repercusiones en la vida cotidiana; puede afectar el sueño, causar dolor torácico, cefalea, dolores costales, fracturas de costillas, incontinencia urinaria o fecal y, ocasionalmente, síncope; con tratamiento adecuado puede disminuir.
Un reflejo de la tos normal es crítico para proteger la vía aérea, por ello, el objetivo del tratamiento es mitigar este estado de hipersensibilidad, ya sea tratando los factores agravantes, predisponentes o asociados que incrementan el umbral del reflejo de la tos.
En el Instituto Privado de Inmunología, Alergia y Vías Respiratorias fueron analizados 82 pacientes desde agosto 2016 a septiembre 2018, 75 del sexo femenino (edad promedio, 34 años) y siete del sexo masculino (edad promedio, 48 años). Los pacientes acudieron por tos crónica de seis meses o más de evolución, con escasa o nula respuesta al tratamiento prescrito por médicos de atención primaria, internistas, otorrinolaringólogos, neumólogos o alergólogos.
En cada caso se investigó historia clínica, antecedentes laborales, hábito tabáquico, enfermedades sistémicas o pulmonares previas y la medicación recibida. Se puso especial atención a la toma de inhibidores de la enzima convertidora de angiotensina y betabloqueadores. Se investigaron todos los factores agravantes que pudieran incrementar el reflejo de la tos y durante las primeras tres semanas de seguimiento se realizaron las pruebas necesarias para definirlos. Cada factor agravante o enfermedad diagnosticada fue tratada. La mayoría de los pacientes evaluados presentaban tos seca, no productiva, urgencia por toser debido a una sensación precipitante de tos en la garganta (sensación de polvillo, comezón o cuerpo extraño), sequedad en la garganta, que se exacerbaba al reír o al hablar. Los pacientes habían recibido medicación antirreflujo, específicamente inhibidores de la bomba de protones (IBP) a dosis estándar por dos a seis semanas, sin respuesta satisfactoria. Habían recibido también antihistamínicos, antileucotrienos, corticoides inhalados o intranasales, broncodilatadores y combinaciones de agonistas β2 adrenérgicos de larga acción y corticoides sistémicos.
A todos los pacientes se les efectuó histograma nasal, radiografía de tórax, pruebas de función pulmonar con reversibilidad a β2 agonistas, endoscopia flexible de vía respiratoria superior y laringe, tomografía de tórax de alta resolución. En 19 se realizó serie esofagogastroduodenal y en 14, pHmetría. Se efectuaron pruebas cutáneas en quienes se sospechaba alergia respiratoria y que presentaban histograma nasal positivo a células eosinofílicas o basofílicas. Se les solicitó que suspendieran todos los medicamentos que estuvieran recibiendo.
Los pacientes completaron un cuestionario de calidad de vida y de la severidad y frecuencia de la tos (escala visual analógica en porcentaje, donde 0 % normal, 25 % leve, 50 % moderado, 75 % alto, 100 % severo); la severidad y la frecuencia fueron evaluadas después del tratamiento recomendado (0 % sin cambio, 25 % leve mejoría, 50 % moderada mejoría, 75 % alta mejoría, 100 % desaparición de la tos). En los pacientes que presentaron reducción en la frecuencia y severidad de la tos, 75 y 100 % se consideraron con respuesta completa, aquellos con 25 y 50 % con respuesta parcial y los pacientes con 0 %, sin respuesta.
La mayoría de los pacientes con tos crónica asociada con patologías de la vía respiratoria superior, inflamación eosinofílica de las vías respiratorias, asma, alergias o reflujo responde a los tratamientos específicos. La falla terapéutica puede representar un mal diagnóstico, subdiagnóstico, asociación de patologías, no adherencia al tratamiento, no identificación de causas extrapulmonares o no consideración de la HSRT, entidad clínica frecuentemente inducida por exposición a estímulos térmicos, mecánicos o químicos16 y que puede agrupar varias condiciones asociadas con tos como las mencionadas o constituir la misma tos un síndrome inexplicable sin importar las condiciones o enfermedades subyacentes.16,64
De los 82 pacientes seleccionados y evaluados siguiendo el diagnóstico anatómico clásico aceptado, solo 22 % (18 pacientes) presentó respuesta completa a las ocho semanas de tratamiento; ocho presentaban asma bronquial alérgica, cinco rinosinusitis crónica sin pólipos nasales, dos ERGE y tres rinitis mixta.
A los 64 pacientes con tos persistente se les diagnosticó con fenotipo de tos crónica persistente y resistente al tratamiento habitual, grupo correspondiente a HSRT; 36 pacientes (56 %) de los pacientes con HSRT presentaban cambios hipofaríngeos y laríngeos sugestivos de reflujo gastrosupraesofágico (RGSE) o gastrolaríngeo (edema subglótico, edema ventricular, eritema/hiperemia de aritenoides, edema de cuerdas vocales, edema laríngeo difuso, hipertrofia de la comisura posterior, granuloma) sin síntomas de ERGE típico. Se ha descrito que un tercio de los pacientes con tos crónica posviral presentan RGSE.64 Murry et al.,65 en un trabajo sobre la relación de tos crónica y el movimiento paradójico de las cuerdas vocales (MPCV), conocido también como disfunción de las cuerdas vocales, encontró disminución de la sensibilidad mecánica de la mucosa laríngea en los pacientes con ERGE. Podemos pensar que existe asociación entre la tos neuropática (incremento en el reflejo de la tos) posiblemente posvirus, RGSE y tos crónica.
Veintitrés de los pacientes estudiados (36 %) presentaron MPCV, 19 con RGSE evidente por endoscopia. La pHmetría se realizó en 14 pacientes (13 del sexo femenino y uno del sexo masculino); de estos, solo siete fueron diagnosticados con esofagitis asociada con reflujo ácido asintomático con un pH < 4 %, más de 4 % de las 24 horas del registro. No conocemos el número de pacientes que pudieran presentar RGSE no ácido, alcalino o por gases. Sabemos que la tos crónica puede ocasionar RGSE por aumento de la presión intraabdominal debido a la contracción diafragmática y a la inversa: el contenido gástrico que refluye al esófago puede incrementar el HSRT. Sin embargo, existe la posibilidad de microaspiración o irritación del nervio vago y su hiperreactividad, que produce tos al liberarse taquicininas como consecuencia del reflujo.
En la laringe, la mecanosensibilidad disminuida puede provocar, paradójicamente, un estado de alteración sensorial irritativo que provoque tos como síntoma principal, así como comezón en garganta, sensación de globus, mucosidad faríngea excesiva, odinofagia e, incluso, laringoespasmo. Estos síntomas pueden agravarse por esfuerzos vocales (fonación prolongada) y por estímulos irritativos, pudiendo comprobarse al desencadenar las molestias palpando ligeramente el cricoides (área del nervio laríngeo superior y nervio vago). Treinta y ocho de nuestros pacientes (35 del sexo femenino y tres del masculino) eran profesores de tiempo completo en sus comunidades, con el consecuente uso intenso de la voz.
En pacientes con movimiento paradójico de las cuerdas vocales y tos crónica que no habían mejorado con la administración de IBP dos veces por día durante tres meses, Murry et al.65 cuantificaron la respuesta sensorial laríngea al combinar rehabilitación vocal e IBP. Se ha descrito que la irritación de la laringe causada por el RGSE disminuye la sensibilidad de la laringe, provocando una respuesta motora compensadora con hiperaducción de las cuerdas vocales durante la inspiración, con tos y disfonía.66 Esta irritación crónica de la laringe por ERGE o RGSE, una vez que se han descartado procesos alérgicos o factores irritantes inhalados, con aclaramiento laríngeo evidente, predispone a la laringe a ser más sensible a estímulos externos como humo de tabaco, aire frío, jabón, fragancia diversas, ejercicio y estrés emocional, ocasionando urgencia por toser. En estos casos, el RGSE pudiera ser la causa o un factor concomitante en la tos crónica.67
A todos los pacientes con sospecha de ERGE no típico o evidencia por endoscopia laríngea de probable RGSE y tos crónica resistente al tratamiento habitual (HSRT), con o sin MPCV, se les administró doble dosis de IBP cada 12 horas, sucralfato tres veces por día durante tres meses y se les indicó modificación de los hábitos higiénico-dietéticos, cenar ligero tres horas antes de dormir, así como cambiar su posición al dormir (cabeza levantada 30 cm).
Los pacientes con SHRT recibieron rehabilitación del uso de la voz, logopedia (estrategia para la supresión de la tos mediante la deglución y reversión del movimiento paradójico de las cuerdas vocales), así como entrenamiento en respiración adecuada (nasal, lenta y sostenida) y uso apropiado del músculo diafragmático, acompañados posteriormente de terapia de lenguaje, entrenamiento progresivo de fonación, timbre, uso adecuado de músculos inspiratorios y espiratorios, siguiendo el protocolo empleado por la División de Laringe y Voz del Hospital General de Montreal en Montreal, Canadá, implementado por las doctoras Karen Kost y Glenna Waters; así como técnicas e relajación de hombros y cuello, eliminando el comportamiento inadecuado de la voz, rehabilitando y mejorando la función vocal para lograr disminuir la urgencia de toser y los síntomas laríngeos que estimulan la producción anormal de la tos.68
Este recurso terapéutico fue implementado por el equipo de terapia respiratoria y foniatría del Instituto Privado de Inmunología, Alergia y Vías Respiratorias. A todos los pacientes se les enseñó el video de la endoscopia de la vía respiratoria y laringe, con lo que disminuyó la ansiedad que les ocasionaba la HSRT. Se efectuó entrevista/consulta y seguimiento cada tres semanas por tres ocasiones y posteriormente cada seis semanas por tres ocasiones más, tratando de que siempre estuvieran acompañados por un familiar, para fortalecer la retroalimentación de la enseñanza. En cada entrevista se valoró la ejecución y aceptación del tratamiento y la respuesta clínica mediante la escala visual analógica en los pacientes con tos crónica resistente al tratamiento habitual e HSRT. Después de las dos primeras sesiones, seis semanas, 32 de 64 pacientes (50 %) había mejorado su tos, 27 con respuesta completa y cinco con respuesta parcial. Este tipo de tratamiento disminuye eficazmente la irritación laríngea (menor urgencia por toser) e incrementa el umbral de la tos. En la literatura se ha reportado una tasa de éxito de 88 % comparada con 14 % en el grupo placebo.68
Es importante mencionar que la adherencia terapéutica fue difícil en 18 de los pacientes, quienes presentaban manifestaciones importantes de depresión y ansiedad. A 32 pacientes del resto del grupo se les propuso adicionar terapia farmacológica y continuar con la logopedia y la rehabilitación. Considerando la tos crónica como HSRT y que pudiera ser un signo de neuropatía sensorial de la laringe, como sucede con el dolor neuropático que mejora con medicamentos neurolépticos, se inició prueba terapéutica con amitriptilina o gabapentina,69,70 ya que se ha demostrado que pueden reducir la severidad de la tos.
En nuestro Instituto iniciamos con 6.25 mg de amitriptilina (un cuarto de la tableta de 25 mg), con incremento semanal de 6.25 mg hasta alcanzar una tableta al día, por la noche, dos horas antes de dormir, ajustando la dosis en quienes se observó mejoría de la tos. Tres cuartas partes del grupo toleró satisfactoriamente 12.5 mg. En los pacientes sin respuesta o intolerancia a la amitriptilina o sin aceptación de este medicamento (nueve pacientes) se les recomendó gabapentina, iniciando con una dosis de 300 mg por las noches, con incremento gradual semanal hasta llegar a 900 mg, repartidos en tres tomas, ajustando la dosis en quienes se observó mejoría. A las seis semanas de tratamiento, 72 % (23 pacientes) del grupo mejoró con amitriptilina, 17 con respuesta total y seis con respuesta parcial. La gabapentina se administró a seis pacientes con respuesta parcial a amitriptilina y a nueve pacientes que no mejoraron o no aceptaron amitriptilina. Siete pacientes mejoraron con gabapentina, cinco con respuesta total y dos con parcial; tres de los pacientes que respondieron en forma total tomaron 300 mg y dos, 600 mg; dos pacientes con respuesta parcial tomaron 900 mg. En total, 87 % respondió adecuadamente al tratamiento conjunto de rehabilitación y fármacos.
Con el objetivo de mejorar al resto de los pacientes que deseaban participar e incluso a aquellos con respuesta parcial o no perdurable, se les propuso efectuar bloqueo de la rama interna del nervio laríngeo superior siguiendo las directrices de Simpson et al.51 De los nueve participantes, en cinco mejoró el HSRT después de tres sesiones administradas con espacio de 15 días entre cada una, tres con respuesta total y dos con respuesta parcial; cuatro permanecieron sin respuesta satisfactoria.
En total, mediante la escala visual analógica observamos una mejoría de la tos crónica en 90 % de los pacientes. Si bien las dosis de los fármacos empleados fueron menores a las referidas en la literatura (hasta 75 mg de amitriptilina y 2800 mg de gabapentina), los pacientes respondieron adecuadamente y con menos efectos adversos.
La amitriptilina es un agente antidepresivo con propiedades sedantes que inhibe la recaptura de noradrenalina y serotonina en las neuronas noradrenérgicas y serotoninérgicas, respectivamente. Se cree que esta inhibición incrementa la concentración sináptica de dichos neurotransmisores en el sistema nervioso central y que la acción de su metabolito activo, la nortriptilina, es la base de la actividad antidepresiva de la amitriptilina, la cual puede tener efectos anticolinérgicos y otros menos frecuentes, como alteraciones en la conducción A-V y hepatopatía difusa. Este fármaco debe utilizarse con precaución en pacientes con hipertensión, diabetes o que cursan con embarazo. La gabapentina con frecuencia ocasiona mareos y somnolencia, por lo que es recomendable su incremento gradual para mejorar la tolerancia.
Debido a la complejidad de la tos crónica y del HSRT y la falta la adherencia al tratamiento, incluida la rehabilitación y las medidas higiénico-dietéticas en el RGSE, así como el uso excesivo de la voz (identificado en 59 % los pacientes) y la posible psicopatología en 25 % de los pacientes, la continuidad y perseverancia en la retroalimentación es fundamental en el éxito terapéutico.
Conclusiones
El reflejo de la tos es un mecanismo protector de la vía respiratoria al prevenir la broncoaspiración y alertarnos de algún peligro inminente. Se conocen parcialmente las vías neuronales de la tos. En algunas enfermedades agudas, como la infección viral de la vía respiratoria, y en otras con componente crónico prevalece un síndrome de hipersensibilidad que genera tos excesiva, la cual a su vez produce angustia y afecta la calidad de vida. Comprender la tos como un síndrome de hipersensibilidad con condiciones clínicas distintas ayudará en su tratamiento.











 nueva página del texto (beta)
nueva página del texto (beta)



