Antecedentes
Las enfermedades alérgicas son un problema de salud pública.1,2 Actualmente la prevalencia de asma y rinitis en Colombia es de 12 y 32 %, respectivamente.2 Se han propuesto diferentes factores para explicar este aumento en la prevalencia como la contaminación ambiental, cambios epigenéticos y el estilo de vida, entre otros.3,4,5 Aun se sabe poco de cómo la interacción de estos factores influye en el desarrollo de las alergias.
La reactividad cruzada entre proteínas de diferentes especies se propone como uno de los mecanismos que explicaría las reacciones de hipersensibilidad inmediata observadas en individuos expuestos por primera vez a una fuente alergénica. Aunque no se dispone de datos exactos, se sospecha que este mecanismo estaría implicado en los pacientes alérgicos al camarón con reacción de hipersensibilidad cuando consumen por primera este alimento.6,7
El alérgeno mayor del camarón es la tropomiosina (Litopenaeus vannamei, Lit v 1),8 una proteína miofibrilar presente en las células eucariotas de diferentes organismos como insectos, crustáceos, parásitos y ácaros.9,10 Esta proteína ha sido reconocida como alérgeno importante de la cucaracha (Periplaneta americana, Per a 7)11 y los ácaros del polvo Blomia tropicalis (Blo t 10), Dermathopagoides farinae (Der f) y Dermathopagoides pteronyssinus (Der p 10). Existe un alto grado de identidad en las secuencias entre las tropomiosinas de estos invertebrados y los crustáseos, superior a 80% entre la tropomiosina del camarón y la de los ácaros y cucaracha.12 La homología en las secuencias podría explicar la presencia de una inmunoglobulina E alérgeno-específica (sIgE) al camarón en los pacientes sensibilizados a los ácaros que nunca se han expuesto a esta fuente alergénica.
La principal causa de alergias en el trópico son los ácaros del polvo.13 Sánchez et al. observaron que en Medellín, Colombia, 78 % de los pacientes con alergias respiratorias o cutáneas estaban sensibilizados a los ácaros.13 Por el contrario, la sensibilización a los alimentos, como al camarón, varía según las condiciones climáticas, geográficas y hábitos dietarios propios de cada región. El consumo aparente per cápita de comida de mar en Colombia es de 3.92 kg/persona/año,14 lo que comparativamente con otras regiones es bajo, por lo que se esperaría que la sensibilización también fuera baja, sin embargo, la sensibilización a este crustáceo es alta en Medellín.15
Aunque la reactividad cruzada entre proteínas de camarón y ácaros ha sido ampliamente estudiada, existen pocos datos que muestren la frecuencia de la cosensibilización ácaros-camarón en la población con síntomas respiratorios; la mayoría de los análisis epidemiológicos no han evaluado la importancia clínica de dicha sensibilización.
Por tanto, el objetivo principal de este estudio fue determinar la prevalencia de sensibilización a camarón en pacientes con rinitis o asma sensibilizados a los ácaros del polvo. Adicionalmente se buscó lo siguiente:
Métodos
Estudio de corte transversal analítico que incluyó hombres y mujeres, sin límite de edad, con diagnóstico de asma o rinitis, que estuvieran sensibilizados a ácaros de la familia Pyroglyphidae o Echymiopodidae y que asistieron a la consulta del servicio de alergología de la IPS Universitaria en Medellín, Colombia, entre marzo de 2016 y enero de 2017.
La sensibilización IgE mediada para camarón se evaluó por medio de pruebas intraepidérmicas: Blo t, Der f y Der p, Per a, Culex pipiens (Cul p) y Solenopsis invicta (Sol i). A los pacientes con pruebas positivas a alguno de los tres ácaros se les realizó una encuesta presencial o telefónica para conocer datos sobre el consumo de camarón y, de haber presentado síntomas, las características de la reacción. Además, se clasificó la rinitis según la guía ARIA16 y el control del asma con el cuestionario ACT (Asthma Control Test).17
A los pacientes con pruebas cutáneas positivas a los ácaros y camarón, pero que nunca hubieran consumido este alimento o su consumo hubiera sido en un tiempo mayor de seis meses al momento de la encuesta y sin historia clara de reacción, se les realizó una prueba de provocación oral abierta controlada con camarón.
A los pacientes que aceptaron donar una muestra de sangre se les realizó sIgE para extracto de camarón hervido, Der p y Lit v 1, y se evaluó la prevalencia de mono y cosensibilización.
Para el análisis de los datos se realizó un análisis comparativo entre los pacientes con la sensibilización a ácaro y camarón (casos) y aquellos sensibilizados solo a ácaros (controles).
Sensibilización cutánea
La sensibilización se evaluó mediante pruebas intraepidérmicas, para lo cual se utilizaron extractos comerciales estandarizados del laboratorio Inmunotek (Madrid, España), aplicando una gota de cada extracto en la cara volar del antebrazo, con posterior escarificación con una lanceta de metal y una lectura a los 15 minutos, según las recomendaciones internacionales para las pruebas intraepidérmicas.18,19 Se consideró como resultado positivo un erupción mayor de 3 mm en relación con el control negativo. Todos los pacientes suspendieron el consumo de antihistamínicos u otros medicamentos que pudieran interferir con la reactividad de la piel.
Prueba de provocación
Las pruebas de provocación oral fueron abiertas controladas con placebo. Consistieron en la administración de 90 g de camarón en un protocolo de cuatro pasos:
Inicialmente se suministró placebo (croquetas de pollo).
Posteriormente, croquetas de camarón en tres dosis 10, 30 y 60 % de la dosis total a suministrar.
Entre cada paso hubo un intervalo de 30 minutos bajo vigilancia médica y luego de la última administración, un periodo de observación de dos horas. La prueba se realizó a todos los casos del estudio que aceptaron participar, excepto en los que tuvieran historia clara de reacción previa tras la ingesta del alimento, asma no controlada o alguna otra comorbilidad que contraindicara la provocación o consumo sin presencia de síntomas en los seis meses previos a la realización de la encuesta.
Pruebas séricas
Se evaluó la sIgE para extracto de camarón hervido, Der p, Lit v 1 mediante ELISA a los casos y a un subgrupo de controles, que se eligieron de un emparejamiento de acuerdo con la edad y de forma aleatoria. Los resultados se expresaron en densidad óptica.
Se calculó el punto de corte para cada extracto probado a partir de los resultados obtenido de cinco sujetos sanos no alérgicos, no atópicos, utilizando dos desviaciones estándar como medida de evaluación (camarón hervido 0,125, Lit v 1 0,123, Der p 0,123).
Análisis estadístico
Para el análisis descriptivo de los aspectos sociodemográficos y clínicos de la población de estudio se utilizaron distribuciones absolutas, relativas e indicadores de resumen como media aritmética, desviación estándar, cuartiles, rango intercuartílico, valores mínimos y valores máximos. Se estableció el criterio de normalidad de algunas variables clínicas mediante prueba de Kolmogorov-Smirnov, determinando la relación entre los aspectos clínicos y la sensibilización a camarón por medio de U de Mann-Whitney. De igual manera se determinó el cálculo de la probabilidad de superioridad como tamaño del efecto para U de Mann-Whitney. Este coeficiente indicó la probabilidad de que una sIgE para extracto de camarón hervido, Der p, Lit v 1 seleccionado aleatoriamente de un grupo sensibilizado a camarón, fuera superior al seleccionado de un grupo no sensibilizado a camarón.
Para establecer la relación de los aspectos sociodemográficos y clínicos con la presencia de sensibilización a camarón y ácaros se aplicó chi cuadrada de independencia de Pearson, razón de verosimilitud o prueba exacta de Fisher; de igual manera, se evaluó la fuerza de relación por medio de la razón de prevalencia (RP) con sus respectivos intervalos de confianza de 95 % (IC 95 %).
Se aplicó regresión multivariada como método exploratorio y de ajuste para evaluar la influencia de aspectos sociodemográficos y clínicos con la sensibilización a camarón y ácaros por medio de un modelo de regresión Poisson con varianza robusta; un valor p < 0.05 se consideró estadísticamente significativo.
Las variables candidatas para este análisis, de acuerdo con el criterio de Hosmer-Lemeshow y criterios de plausibilidad biológica, fueron Blo t, Der p, Der f, Per a, Aed e, Sol i, consumo de camarón, sexo y edad; estas variables se obtuvieron del análisis bivariado. Se construyó un modelo explicativo con el fin de evidenciar las variables que contribuyen con la sensibilización a camarón.
Resultados
Prevalencia de sensibilización a camarón en pacientes alérgicos sensibilizados a ácaros
Se analizaron las pruebas intraepidérmicas de 229 pacientes con rinitis o asma sensibilizados a ácaros: 48 pacientes (21 %) estuvieron sensibilizados a ácaros y camarón y 181 (79 %) solo a ácaros (figura 1). No se encontraron diferencias en las características demográficas entre los dos grupos (cuadro 1).
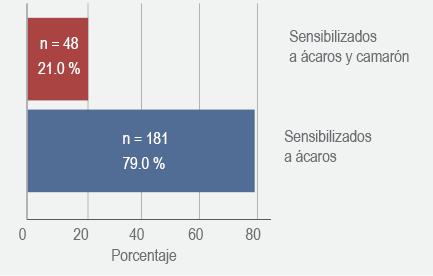
Figura 1 Porcentaje de pacientes sensibilizados ácaros y camarón versus ácaros, en pacientes atendidos en una institución de salud de Medellín, Colombia, 2017.
Cuadro 1 Aspectos sociodemográficos y clínicos relacionados con la sensibilización al camarón en pacientes con rinitis o asma atendidos en una institución de salud de Medellín, Colombia, 2017
| Sensibilización a camarón | p | RP (IC 95 %) | |||||
| Positivo | Negativo | ||||||
| n | (%) | n | (%) | ||||
| Sexo | Hombres | 25 | 52.1 | 89 | 49.2 | 0.720 | 1.09 (0.66-1.81) |
| Mujeres | 23 | 47.9 | 92 | 50.8 | |||
| Estrato económico | Bajo | 21 | 43.8 | 77 | 42.5 | 0.981 | NA |
| Medio | 25 | 52.1 | 97 | 53.6 | |||
| Alto | 2 | 4.2 | 7 | 3.9 | |||
| Asma | Sí | 19 | 39.6 | 71 | 39.2 | 0.964 | 1.01 (0.60-1.69) |
| No | 29 | 60.4 | 110 | 60.8 | |||
| Rinitis | Sí | 48 | 100.0 | 178 | 98.3 | 0.854* | NA |
| No | 0 | 0.0 | 3 | 1.7 | |||
| Consumo de camarón | Sí | 26 | 54.2 | 90 | 49.7 | 0.584 | 1.15 (0.69-1.91) |
| No | 22 | 45.8 | 91 | 50.3 | |||
| Síntomas | Sí | 9 | 34.9 | 7 | 7.8 | 0.002** | 3.31 (1.79-6.10) |
| No | 17 | 65.4 | 83 | 92.2 | |||
*Corrección por continuidad. **Prueba exacta Fisher. NA = no aplica
En el cuadro 2 se muestran los resultados del modelo multivariado para la prevalencia de sensibilización a camarón. Se encontró una relación estadísticamente significativa entre la sensibilización a Blo t y Sol i respecto a la sensibilización a camarón. De acuerdo con este modelo de interacción, es dos veces más probable que los pacientes con una prueba intraepidérmica positiva para Blo t reporten una sensibilización a camarón, respecto a aquellos que tiene prueba negativa (IC 95 % = 1.07-3.80), ajustando por las demás variables. En los pacientes con prueba de punción cutánea positiva a Sol i existió 6.19 veces más probabilidad de encontrar sensibilización positiva a camarón, en comparación con los pacientes que presentaron resultado negativo a Sol i (IC 95 % = 3.44-11.15).
Cuadro 2 Análisis multivariado de los aspectos clínicos y demográficos relacionados con la prevalencia de sensibilización a camarón en pacientes con rinitis o asma atendidos en una institución de salud de Medellín, Colombia, 2017
| p crudo | RP crudo (IC 95 %) | Valor p ajustado | RP ajustado (IC 95 %) | |
| Blo t | 0.013 | 2.29 (1.13 a 4.65) | 0.030 | 2.01 (1.07-3.79) |
| Der p | 0.084 | 4.50 (0.66 a 30.89) | 0.073 | 3.75 (0.88-15.93) |
| Per a | < 0.0001 | 3.32 (2.06 a 5.34) | 0.799 | 1.08 (0.58 a 2.02) |
| Cul p | 0.0001 | 2.68 (1.65 a 4.35) | 0.195 | 0.72 (0.43-1.18) |
| Sol i | < 0.0001 | 5.42 (3.43 a 8.55) | < 0.0001 | 6.19 (3.44-11.15) |
| Consumo camarón | 0.584 | 1.15 (0.69 a 1.91) | 0.498 | 1.17 (0.73-1.88) |
| Sexo masculino | 0.720 | 1.09 (0.66 a 1.81) | 0.595 | 1.13 (0.72-1.77) |
| Edad | 0.593 | 1.00 (0.98 a 1.02) | 0.553 | 1.01 (0.98-1.03) |
Blo t = Blomia tropicalis, Der p = Dermathopagoides pteronyssinus, Per a = Periplaneta americana, Cul p = Culex pipiens, Sol i = Solenopsis invicta.
Fuente de sensibilización proteínas de camarón: consumo versusreactividad cruzada
Al analizar la frecuencia de consumo previo de camarón, no se encontró una diferencia estadísticamente significativa en lo reportado por los pacientes sensibilizados a camarón (n = 26, 54.2 %) versus los pacientes no sensibilizados (n =90, 49.7 %), p = 0.584. Adicionalmente, se evaluó la correlación entre el tamaño de la erupción en la prueba cutánea de ácaros y de camarón, la cual fue débil pero estadísticamente significativa: mayor para Der p (figura 2).
Relevancia clínica de la sensibilización a camarón
Todos los pacientes del estudio, tanto los casos como los controles, respondieron la encuesta, lo cual permitió establecer que de los 48 pacientes con prueba intraepidérmica positiva a camarón, 33 tenía indicación para la prueba de provocación oral. En 15 pacientes no estaba indicada la prueba debido a que, por historia clínica, ocho reportaban que habían ingerido camarón anteriormente sin presentar síntomas, la última ingesta en los seis meses previos, y siete tenían historia de reacción tras el consumo, cinco casos compatibles con anafilaxia (cuadro 3).
Cuadro 3 Características de los síntoma en pacientes con rinitis o asma atendidos en una institución de salud de Medellín, Colombia, 2017
| Frecuencia absoluta (n) | Frecuencia relativa (%) | ||
| Frecuencia de los síntomas | Siempre | 11 | 68.8 |
| Casi siempre | 4 | 25 | |
| Nunca | 1 | 6.2 | |
| Ultima reacción | < 1 mes | 2 | 12.5 |
| 1- 6 meses | 0 | 0 | |
| > 6 meses | 14 | 87.5 | |
| Atención en urgencias | Sí | 6 | 37.5 |
| No | 10 | 62.5 | |
| Síntomas | Anafilaxia | 5 | 14.2 |
| Sibilancias | 1 | 2.9 | |
| Tos | 1 | 2.9 | |
| Estornudos | 1 | 2.9 | |
| Disnea | 6 | 17.2 | |
| Diarrea | 1 | 2.9 | |
| Dolor abdominal | 2 | 5.7 | |
| Vómito | 3 | 8.5 | |
| Angioedema | 9 | 25.7 | |
| Edema | 2 | 5.7 | |
| Erupciones cutáneas | 3 | 8.5 | |
| Brote micropapular | 1 | 2.9 | |
Se llevaron a cabo 17 pruebas de provocación oral, que correspondieron a 51.5 % de los pacientes con indicación para la misma. Solo un paciente fue positivo y presentó síntomas gastrointestinales tipo vómito a los pocos minutos de la cuarta dosis. Sumando los 17 pacientes con pruebas de provocación y los 15 individuos en quienes por historia clínica se logró establecer que no requerían prueba de provocación, la frecuencia de reacción a camarón observada fue de 25 % (ocho pacientes de 32). De estos ocho pacientes con relevancia clínica, cuatro (50 %) padecían asma, comparados con ocho de 24 con sensibilización sin relevancia clínica, que correspondieron a 33.33 % de los pertenecientes a este grupo.
No se realizó prueba de provocación oral en 16 pacientes (48,5 %), principalmente por temor o falta de disponibilidad de tiempo, en dos casos por falta del control del asma.
La frecuencia de los síntomas tras el consumo por autorreporte en la población general del estudio fue de 13.79 %, sin embargo, al hacer un análisis entre los grupos se encontraron diferencias estadísticamente significativas en la frecuencia de síntomas por autorreporte entre los que consumían camarón, cuando se comparaban los pacientes sensibilizados a camarón (n = 9, 34.9 %) versus los no sensibilizados [n =7, 7.8 %, p = 0.002, RP = 3-31 [1.79-6.10]).
Tropomiosina como alérgeno mayor del camarón
Se tomaron muestras de suero para medir sIgE a 31 pacientes con prueba intradérmica positiva para camarón y a 27 pacientes con prueba cutánea negativa, encontrando una tasa de sensibilización de 66.66 % para Lit v 1 entre los pacientes que tenían sensibilización relevante a camarón y, por ende, en los considerados alérgicos. Al hacer el análisis entre los dos grupos, sensibilizados versus no sensibilizados, no se encontraron diferencias estadísticamente significativas: Der p 53.8 % (28 pacientes) versus 46.2 % (24 pacientes), p = 0.999 (RP = 1.07 [0.46-2.49]); Lit v 1 53.7 % (22 pacientes) versus 46.3 % (19 pacientes), p = 0.960 (RP = 1.01 [0.59-1.72]); y extracto de camarón hervido 57.1 % (24 pacientes) versus 42.9 % (18 pacientes) p = 0.361 (RP = 1.31 [0.71-2.41]), respectivamente. Dado que desde el punto de vista de la plausibilidad biológica se esperaba encontrar diferencia entre los sensibilizados a camarón versus los no sensibilizados, en el resultado de estas IgE específicas se decidió realizar un análisis del tamaño del efecto, lo cual permitirá evaluar si la ausencia de diferencia se debía a un tamaño de la muestra insuficiente para el análisis, con el que se observaron efectos medianos, donde Der p presentó la mayor magnitud de efecto respecto a los demás sueros (cuadro 4). La sensibilización general para Der p fue de 89.7 % (52 pacientes), Lit v1 de 70.7 % (41 pacientes) y extracto de camarón hervido 72.4 % (42 pacientes).
Cuadro 4 Distribución de sIgE según sensibilización a camarón en pacientes con rinitis o asma atendidos en una institución de salud de Medellín, Colombia, 2017
| n = 58 | Camarón | p | Magnitud del efecto (probabilidad de superioridad) | |
| Positivo* (n = 31) | Negativo* (n = 27) | |||
| sIgE Der p | 0.558 (0.583) | 0.377 (0.519) | 0.513 | 0.45 |
| sIgE Lit v 1 | 0.147 (0.215) | 0.145 (0.121) | 0.440 | 0.44 |
| sIgE camarón | 0.206 (0.278) | 0.152 (0.145) | 0.212 | 0.41 |
sIgE = IgE específica, Der p = Dermathopagoides pteronyssinus, Lit v1 = tropomiosina de camarón. *Los datos se presentan en mediana (desviación estándar).
Discusión
Este es uno de los pocos estudios que ha examinado la relación de la sensibilización a camarón en pacientes con alergias respiratorias sensibilizados a los ácaros del polvo. A pesar de conocer que la alergia alimentaria ha aumentado,20 siendo el camarón uno de los alérgenos principalmente involucrados,21,22,23 poco se conoce acerca de la relevancia de otras fuentes alergénicas filogenéticamente relacionadas con la sensibilización y presentación clínica. Estudios recientes reportan frecuencias de alergia al camarón entre 1.3 y 5.2 % de la población;24 la sensibilización por vía oral es la ruta primaria de exposición. Aunque en nuestro medio no conocemos los datos exactos de esta vía de sensibilización, se cree que es baja. Mopan et al. encontraron una proporción de sensibilización a camarón de 14 % en población de alto riesgo de atopia.15 En este estudio encontramos una tasa de sensibilización de 21 % en población atópica, alta si la comparamos con la reportada por López-Rocha et al.,10 quienes identificaron 0.74 %, lo que podría explicarse, en parte, por el diseño y metodología del estudio (retrospectivo) y a que solo realizaron prueba intradérmicas a camarón cuando por clínica se tenía sospecha de sensibilización a este alérgeno.
Al observar los datos de este estudio y los comparamos con las tasas de sensibilización a camarón en la población general, también encontramos diferencias importantes. Mahesh et al.23 reportaron una tasa de sensibilización de 15.53 % en adultos de la India y Burney et al.20 de 4.79 % en diferentes países de Europa. En ambas investigaciones se usó la sIgE como método para evaluar la sensibilización. Estos hallazgos podrían reflejar el posible papel de la vía inhalada, la cual a través de la reactividad cruzada por la tropomiosina llevaría a mayor frecuencia de sensibilización a camarón entre los pacientes con asma o rinitis con prueba intradérmica positiva para ácaros si se comparan con la población general.
Asimismo, es importante resaltar que no encontramos diferencias estadísticamente significativas en el consumo de camarón entre los pacientes sensibilizados (54.2 %) versus los no sensibilizados (49.7 %), p = 0.584, lo que apoya la hipótesis de que la ingesta no es el único factor determinante en la sensibilización, como lo señalan Fernández et al.25 en una comunidad de judíos ortodoxos; demostraron sensibilización a camarón en pacientes con enfermedad atópica con prueba de punción cutánea positiva a Der f o Der p que nunca se habían expuesto al consumo de crustáceos y moluscos. Mediante prueba de inhibición confirmaron que los ácaros eran la fuente primaria de sensibilización. Sumado a esto, encontraron una correlación débil, pero estadísticamente significativa, entre los tamaños de la erupción cutánea de Der f, Der p, Blo t y camarón, lo que indica que posiblemente la sensibilización ocurrió por reactividad cruzada y no por consumo. Es importante resaltar que la reactividad cruzada también se ha planteado como el mecanismo mediante el cual algunos pacientes en inmunoterapia para ácaros posteriormente en el curso del tratamiento se sensibilizan e incluso desarrollan síntomas con el camarón.26
El factor determinante de la sensibilización a camarón es la presencia de una prueba intradérmica positiva para Blo t y Sol i, como lo demuestra el análisis multivariado. Debido al criterio de selección de este estudio, para Blo t, el segundo ácaro en prevalencia en el país, es de esperar que presente una asociación que no se observa con los más frecuentes (Der f y Der p). Esto refuerza la importancia de Blomia tropicalis en el trópico.27 En 2012, Sánchez et al.13 reportaron una tasa de sensibilización para este alérgeno de 39.7 %, que en nuestro estudio aumentó a 68.8 % (no se exhiben datos), incremento casi del doble en cuatro años, sin embargo, es importante recordar que los estudios llevados a cabo evaluando el papel de la tropomiosina y otros alérgenos en esta reactividad cruzada son principalmente con Der f y Der p.7,28,29,30,31 La similitud estructural de las proteínas de Blo t y los ácaros pertenecientes a la familia Pyroglyphidae (Der p y Der f) es de aproximadamente 50 %32 y la relación filogenética es mucho menor para Blomia tropicalis al compararla con el resto de los ácaros,33 por lo que podría plantearse la existencia de una proteína específica para este ácaro que comparte una similitud estructural con las proteínas del camarón, lo que explicaría la mayor asociación con este ácaro en el presente estudio.
También se conoce de la reactividad cruzada entre insectos y camarón, no obstante, los reportes en la literatura se realizan con cucaracha.11,34,35 Son pocos los datos sobre las proteínas de las hormigas. A la fecha, los alérgenos de Solenopsis invicta son los más estudiados. Se conocen cuatro proteínas,36 de las cuales solo se está al tanto de la función de Sol i 1. Esta es una fosfolipasa A1 que constituye entre 2 y 5 % de todo el veneno de la hormiga.37 Se desconoce si este insecto comparte proteínas con el camarón que posean una alta secuencia en su identidad.
Se ha documentado que la sensibilización a los ácaros es un factor de riesgo para alergia a camarón,38 sin embargo, poco se sabe de la relevancia clínica de la sensibilización a camarón en pacientes con alergias respiratorias a los ácaros. En este estudio encontramos que ocho pacientes (25 %) presentaron síntomas, ya sea por historia previa altamente sugestiva de reacción o prueba de provocación positiva, de los cuales 50 % padecía asma versus solo 33.33 % de pacientes con asma entre los individuos sensibilizados sin relevancia clínica, lo que parece indicar que la relevancia clínica de la sensibilización está fuertemente relacionada con la presencia de asma. Gour et al.39 identificaron un polimorfismo en pacientes asmáticos que disminuye la expresión del gen que codifica la dectina-1, receptor de reconocimiento de patrones, para el cual la tropomiosina del ácaro es el ligando que estimula la respuesta protectora de la vía aérea.
La autopercepción de síntomas con el consumo de camarón fue de 13.79 % entre los participantes en el estudio. Al comparar la frecuencia de síntomas tras el consumo de camarón con la presencia o no de sensibilización, encontramos que 34.9 % de los pacientes sensibilizados reportaba síntomas, en contraste con 7.8 % de los pacientes negativos, diferencia estadísticamente significativa que indica que la anamnesis puede ser una herramienta útil en estos pacientes. A pesar de no contar con estudios similares al nuestro, se ha evaluado previamente la frecuencia de alergia al camarón por autorreporte; las tasas de frecuencias encontradas en este estudio son más altas que las señaladas por Marrugo et al.,40 quienes encontraron una frecuencia de alergia alimentaria de 14 % en población general, siendo la comida de mar la segunda fuente alergénica involucrada, con una frecuencia de 26 %. Asimismo, Hoyos-Bachiloglu et al.41 registraron para la población pediátrica una frecuencia de alergia alimentaria de 9 %, de la cual 12 % correspondía a camarón. En ninguno de los dos estudios se realizó confirmación serológica o por prueba de punción cutánea.
De los ocho pacientes que se consideraron alérgicos al camarón por autorreporte y por la prueba de provocación positiva, se pudo realizar medición de IgE específica a seis, encontrando Lit v1 positivo en cuatro, para una tasa de sensibilización a tropomiosina de 66.67 %, lo que demostró que en nuestros pacientes alérgicos el camarón puede ser considerado como alérgeno mayor. Al evaluar la frecuencia de sIgE para Der p, Lit v 1 y camarón hervido no encontramos diferencias estadísticamente significativas al comparar los pacientes sensibilizados a camarón con los que no, sin embargo, después de realizar el análisis del tamaño del efecto y encontrar una magnitud del efecto mediano en las sIgE evaluadas respecto a la sensibilización a camarón, se determinó que había valores de probabilidad de superioridad entre 0.41 y 0.45, lo cual indica que si bien no existió diferencias entre el porcentaje de positividad de las IgE específicas entre los dos grupos, aquellos con positividad a camarón tuvieron mayor probabilidad de tener niveles más altos de la IgE específica. Sumado a este hallazgo, después de analizar el porcentaje de pacientes con Lit v 1 y camarón hervido entre los pacientes en los cuales no se encontró sensibilización por medio de la punción cutánea, los datos están a favor de la mayor rentabilidad de la las pruebas séricas para detectar sensibilización a alérgenos alimentarios, así como que la IgE específica para la tropomiosina de los crustáceos es superior a la punción cutánea y la sIgE de camarón en la detección de esta alergia alimentaria, como lo señalaron Yang et al.9
Las principales fortalezas de este estudio estriban en el tamaño de la muestra, la evaluación de la sensibilización por pruebas cutáneas y séricas, la cual no solo incluyó el extracto completo sino también alérgenos específicos como Lit v 1, lo que permitió observar el papel de la tropomiosina como alérgeno mayor en los pacientes sensibilizados a camarón, no evaluada previamente en nuestro país. También se exploraron las posibles rutas de sensibilización y se llevaron a cabo pruebas de provocación oral con el alimento para tratar de establecer la relevancia clínica.
Entre las debilidades de la investigación se encuentran la dificultad para llevar a cabo el reto oral en todos los pacientes sensibilizados a camarón con indicación, no medir la sIgE para Der p 10 y, por lo tanto, no poder realizar la prueba de inhibición, que hubiera permitido determinar la reactividad cruzada entre las tropomiosinas.
Conclusiones
Este estudio aporta nuevos datos en la frecuencia de sensibilización a camarón en los pacientes con asma o rinitis sensibilizados a los ácaros del polvo. Por estudios previos realizados en Medellín, Colombia, se sabe que los ácaros son una de las principales causas de alergia y que el camarón es el alimento que causa mayor sensibilización en pacientes con alto riesgo de atopia, sin embargo, aún no se había explorado la relación de la sensibilización entre estos invertebrados y su relevancia clínica. Encontramos una alta tasa de sensibilización a camarón en los pacientes evaluados, la cual fue relevante en 25 % de los casos, principalmente relacionada con la presencia de asma. No identificamos diferencias en el consumo de camarón en los pacientes sensibilizados y los que no lo estaban, lo que se asoció con la correlación débil, pero significativa, entre los tamaños de las erupciones y la baja frecuencia de consumo de comida de mar para el país. Podemos decir que la sensibilización a camarón en nuestro grupo de estudio no estuvo principalmente determinada por la ingesta, lo que plantea a la reactividad cruzada como una vía importante de sensibilización. Estos hallazgos requieren futuros análisis que permitan evaluar por medio de pruebas de inhibición, el papel de la tropomiosina y su reactividad cruzada.











 nueva página del texto (beta)
nueva página del texto (beta)




