Antecedentes
Las alergias conforman un grupo de enfermedades frecuentes que resultan de interacciones entre la constitución genética de cada individuo y la exposición a factores ambientales que intervienen en su desarrollo. Aunque pueden presentarse a cualquier edad, su inicio suele ser en la infancia y su prevalencia parece estar en aumento en los países en desarrollo, especialmente los ubicados en el trópico.1,2
La atopia es un factor de riesgo indispensable para el desarrollo de alergias mediadas por sensibilización a la inmunoglobulina E (IgE)3,4 y está fuertemente asociada con el asma, la rinitis y la conjuntivitis.5,6 Actualmente, la evaluación de atopia se hace utilizando extractos proteicos de las fuentes sospechosas a las que se expone el paciente, para evaluar la presencia de la IgE específica.7,8 En los países del trópico, los ácaros son la principal causa de atopia;9,10 los mayormente reportados son Dermatophagoides pteronyssinus, Dermatophagoides farinae y Blomia tropicalis.11,12,13,14
Los estudios epidemiológicos han mostrado que no todas las poblaciones están expuestas a los diferentes ácaros en la misma proporción,6,7 sin embargo, debido a la reactividad cruzada entre algunas proteínas, las personas que tienen una sensibilización IgE a proteínas que se mantienen conservadas entre diferentes especies, pueden presentar síntomas con fuentes a las que no están expuestos si estas presentan estas proteínas.15 Usualmente esto ocurre entre proteínas filogenéticamente conservadas con alta identidad que reciben el nombre de “panalérgenos” y están presentes en fuentes ancestralmente relacionadas. Estas proteínas explican porque más de 97 % de los pacientes alérgicos a Dermatophagoides pteronyssinus también lo están a Dermatophagoides farinae (y viceversa), ya que ambos pertenecen al mismo género taxonómico y sus proteínas son similares.11,12 Aunque una alta cosensiblización entre los ácaros de una misma familia es lo esperado, esto no siempre ocurre: aunque Blomia tropicalis ha sido clasificado como un ácaro de la familia Glyciphagidae, la frecuencia de sensibilización a otros ácaros de esta familia como Lepidoglyphus destructor o Glycyphagus domesticus es menor de 30 %,16 aun cuando son ácaros de amplia distribución.
El conocimiento de la reactividad cruzada entre los diferentes alérgenos puede tener importante impacto clínico, ya que permitiría definir de forma más exacta cuáles extractos se deben usar en el momento de realizar las pruebas de alergia para determinar la atopia del paciente y definir los alérgenos a utilizar si el paciente tiene indicación de inmunoterapia. Teniendo en cuenta estas observaciones y el impacto clínico que pueden tener una identificación adecuada de las fuentes de sensibilización que inducen la alergia, en el presente artículo nos propusimos evaluar la relación filogenética mediante métodos bioinformáticos entre las principales proteínas alergénicas de ácaros de acuerdo con la identidad y la homología de sus principales alérgenos.
Método
Se trabajó con ocho ácaros de los seleccionados inicialmente, por ser los más frecuentes en el trópico y de mayor importancia en las patologías alérgicas, pertenecientes a las familias Glyciphagidae, Pyroglyphidae, Chortoglyphidae y Acaridae y con base en las características morfológicas(cuadro 1). De la familia Pyroglyphidae se seleccionaron las tres especies más representativas del género Dermatophagoides: Dermatophagoides pteronyssinus, Dermatophagoides microceras y Dermatophagoides farinae. En la familia Glyciphagidae se seleccionaron dos géneros, incluyendo uno de Blomia tropicalis y Glycyphagus domesticus. Para Chortoglyphidae también se incluyeron dos especies de géneros diferentes: Euroglyphus maynei y Chortoglyphus arcuatus. Por último, para la familia Acaridae se escogieron tres especies: Acarus siro, Lepidoglyphus destructor y Tyrophagus putrescentiae.
Cuadro 1 Clasificación taxonómica clásica de los ácaros y frecuencia de sensibilización encontrada en población colombiana
| Orden | Suborden | Familia | Género | Especie |
| Acari | Astigmata | Acaridae | Acarus | Aca s (61 %) |
| Tyrophagus | Tyr p (59 %) | |||
| Glycyphagidae | Lepidoglyphus | Lep d (67 %) | ||
| Glycyphagus | Gly d (49 %) | |||
| Blomia | Blo t (46 %) | |||
| Pyroglyphidae | Dermatophagoides | Der p (73 %) Der f (76 %) Der m (67 %) | ||
| Chortoglyphidae | Euroglyphus | Eur m (69 %) | ||
| Chortoglyphus | Cho a (55 %) |
De estos ácaros se seleccionaron los alérgenos pertenecientes a los grupos 1, 2 y 5. En el grupo 1 se encuentran varios alérgenos mayores de los ácaros con una prevalencia de sensibilización entre los pacientes atópicos a los ácaros de 70 a 100 %; estos alérgenos son glicoproteínas con una masa molecular de aproximadamente 25 kDa, pertenecientes a la familia de las cisteín-proteasas, aunque se ha descrito que algunas pertenecen a las proteasas de serina. En el grupo 2 se incluyen alérgenos mayores con una prevalencia de sensibilización de 80 a 100 %, pertenecientes a la familia NPC2 (proteínas secretadas por la epidermis de unión a lípidos), con un peso molecular variable entre 14 y 26 kDa. El grupo 5 son proteínas estructurales, con un peso molecular de 15 kDa y una frecuencia de sensibilización de 20 a 50 %, aunque su función en los ácaros aún no está claramente descrita, sin embargo, en especies como Blomia tropicalis es uno de los principales alérgenos con un alto porcentaje de sensibilización.
Análisis bioinformáticos
Para los alineamientos de los alérgenos de los grupos 1, 2 y 5 de los ácaros se utilizaron secuencias de ARN y aminoácidos. Para comparar la similitud molecular con la prevalencia de sensibilización encontrada por Sánchez et al.16 se parearon todos los alérgenos encontrados en cada grupo. Se utilizaron las secuencias obtenidas a través del programa BLAST, en la base de datos del National Center for Biotechnology Information (NCBI), validadas hasta el 14 de septiembre de 2016. Solo se incluyeron las secuencias que se encontraban reportadas en la WHO/IUIS Allergen Nomenclature Sub-Committee (http://www.allergen.org) y que presentaran una secuencia completa. En las secuencias peptídicas de alineamiento pareado se utilizó el programa CRUSTAL Omega versión 1.2.3, disponible en http://www.uniprot.org, el cual implementa el algoritmo Feng y Doolittle modificado por Des Higgins. La base de datos se describe en el cuadro 2.
Cuadro 2 Base de los diferentes ácaros y sus alérgenos utilizados en los alineamientos
| Ácaros/alérgenos | Entrada Uniprot | Código | Base de ARNm (GeneBank) | Base de aminoácidos EMBL | Numero de aminoácidos |
| Pyroglyphagidae | |||||
| Dermatophagoides pteronyssinus | |||||
| Der p 1 | P08176 | PEPT1_DERPT | U11695 | AAB60215.1 | 320 |
| Der p 2 | P49278 | ALL2_DERPT | AF276239 | AAF86462.1 | 146 |
| Der p 5 | P14004 | ALL5_DERPT | S76337 | AAB32841.1 | 132 |
| Dermatophagoides farinae | |||||
| Der f 1 | P16311 | PEPT1_DERFA | X65196 | CAA46316.1 | 321 |
| Der f 2 | Q00855 | ALL2_DERFA | D10447 | BAA01239.1 | 146 |
| Der f 5 | Q3LHF8 | Q3LHF8_DERFA | AB195581 | BAE45865.1 | 132 |
| Glycyphagidae | |||||
| Blomia tropicalis | |||||
| Blo t 1 | A1KXI0 | A1KXI0_BLOTA | AY291322 | AAQ24541.1 | 333 |
| Blo t 2 | A6XEN8 | A6XEN8_BLOTA | DQ677253 | ABG76185.1 | 142 |
| Blo t 5 | O96870 | ALL5_BLOTA | U59102 | AAD10850.1 | 134 |
| Glycyphagus domesticus | |||||
| Gly d 1 | N.P. | N.P. | N.P. | N.P. | N.P. |
| Gly d 2 | Q9U5P7 | ALL21_GLYDO | AJ249864 | CAB59976.1 | 128 |
| Gly d 5 | Q1M2M7 | Q1M2M7_GLYDO | AY288675 | AAQ54605.1 | 255 |
| Acaridae | |||||
| Acarus siro | |||||
| Aca s 1 | A7UNU3 | A7UNU3_ACASI | EU092651 | ABU50820.1 | 331 |
| Aca s 2 | A7XZH1 | A7XZH1_ACASI | EU106609 | ABU97460.1 | 143 |
| Aca s 5 | N.P. | N.P. | N.P. | N.P. | N.P. |
| Lepidoglyphus destructor | |||||
| Lep d 1 | N.P. | N.P. | N.P. | N.P. | N.P. |
| Lep d 2 | P80384 | ALL2_LEPDS | X83875 | CAA58755.1 | 141 |
| Lep d 5 | Q9U5P2. | ALL5_LEPDS | AJ250278 | CAB62212.1 | 110 |
| Tyrophagus putrescentiae | |||||
| Tyr p 1 | B0KZL4 | B0KZL4_TYRPU | DQ983317 | ABM53753.1 | 336 |
| Tyr p 2 | O02380 | ALL2_TYRPU | Y12690 | CAA73221.1 | 141 |
| Tyr p 5 | B2GM93 | B2GM93_TYRPU | AY800358 | AAX34057.1 | 135 |
| Chortoglyphidae | |||||
| Euroglyphus maynei | |||||
| Eur m 1 | P25780 | PEPT1_EURMA | AF047610 | AAC82351.1 | 321 |
| Eur m 2 | Q9TZZ2 | ALL2_EURMA | AF047613 | AAC82349.1 | 145 |
| Eur m 5 | N.P. | N.P. | N.P. | N.P. | N.P. |
Se incluye el código de entrada para las secuencias de nucleótidos y aminoácidos. EMBL = European Molecular Biology Laboratory
Para la construcción de los árboles de cada alérgeno se utilizó el programa molecular Evolutionary Genetic Analysis (MEGA) versión 7, utilizando el método de reconstrucción de neighbor-joining con soporte por bootstrap con 500 replicaciones como medida de fiabilidad y robustez, asumiendo mínima evolución en la topología. Este modelo utiliza una matriz comparativa para encontrar la similitud entre nucleótidos (ARN o ADN) o aminoácidos (péptidos) de dos o más secuencias para establecer la proximidad evolutiva entre las especies. Así, entre más valores positivos de identidad se encuentre entre las secuencias, mayor su relación y más próximas en el árbol. Todos los espacios vacíos fueron eliminados (deleciones completas). A partir de la comparación global y las homologías se obtuvo la suma de longitud de las ramas que determinan la cantidad de nodos y la posición de los mismos, incluyendo los clusters de las secuencias evolutivamente más cercanas. Debido al número de secuencias utilizadas no se realizó subanálisis filogenéticos.
Resultados
Al buscar las secuencias en las diferentes bases de datos, no se encontraron datos para Chortoglyphus arcuatus y Dermatophagoides microceras, por lo que estas especies no se incluyeron en el estudio. Además, no se encontraron secuencias de Gly d 1, Aca s 5 y Eur m 5. La secuencia de Lep d 1 reportada por el NCBI es igual a la secuencia Lep d 2 y no se encuentra registrada en allergome.org, por lo tanto, esta secuencia tampoco fue incluida en el estudio.
Alineamientos de las secuencias del grupo 1
Los porcentajes de identidad del grupo 1 se muestran en el cuadro 3. Existió gran variabilidad en las secuencias (26 a 85 %). El porcentaje de identidad entre Der p 1 y Der f 1 fue de 82.8 % y al compararlas con Eur m1 se observó una identidad un poco mayor (84.4 y 85.9 %, respectivamente). La relación entre las otras familias fue menor a 40 %. Tyr p 1 en general, presentó menor identidad con las demás proteínas pertenecientes al grupo 1 con los valores más bajos entre Der p 1 y Tyr p 1 (26.3 %) y la mayor identidad con Aca s 1 (36.9 %). Blo t 1 presentó baja identidad con las proteínas de la familia Pyroglyphidae, con una identidad promedio de 32.6 %.
Cuadro 3 Alineamiento de alérgenos de ácaros del grupo 1 basado en las secuencias de aminoácidos
| Alineamiento | Posiciones | Identidad | |
| Idénticas | Similares | (%) | |
| Dermatophagoides pteronyssinus- Dermatophagoides farinae | 266 | 42 | 82.86 |
| Dermatophagoides pteronyssinus-Blomia tropicalis | 108 | 104 | 31.85 |
| Dermatophagoides pteronyssinus-Acarus siro | 100 | 101 | 29.41 |
| Dermatophagoides pteronyssinus-Euroglyphus maynei | 271 | 40 | 84.42 |
| Dermatophagoides pteronyssinus-Tyrophagus putrescentiae | 91 | 118 | 26.30 |
| Dermatophagoides farinae-Blomia tropicalis | 113 | 100 | 33.33 |
| Dermatophagoides farinae-Acarus siro | 110 | 96 | 31.88 |
| Dermatophagoides farinae-Euroglyphus maynei | 276 | 33 | 85.98 |
| Dermatophagoides farinae-Tyrophagus putrescentiae | 99 | 103 | 28.53 |
| Blomia tropicalis-Acarus siro | 136 | 109 | 39.88 |
| Blomia tropicalis-Euroglyphus maynei | 115 | 92 | 34.02 |
| Blomia tropicalis-Tyrophagus putrescentiae | 127 | 102 | 37.13 |
| Acarus siro-Euroglyphus maynei | 106 | 98 | 31.08 |
| Acarus siro-Tyrophagus putrescentiae | 126 | 117 | 36.95 |
| Euroglyphus maynei-Tyrophagus putrescentiae | 95 | 116 | 27.37 |
Alineamiento de las secuencias del grupo 2
La proporción de identidad del grupo 2 se muestra en el cuadro 4. Los alineamientos del grupo 2 fueron similares a los del grupo 1. La mayor identidad se presentó entre las especies pertenecientes a la familia Pyroglyphidae (Der p 2 y Der f 2), con 86.9 %. El alérgeno Eur m 2 presentó la mayor relación con el género Dermatophagoides spp., al encontrar una identidad bastante alta en los alineamientos de Der p 2 y Eur m 2 (84.2 %) y Der f 2 y Eur m 2 (82.1 %). La identidad de la familia Pyroglyphidae con las demás familias presentó valores que oscilaban entre 36 y 41 %. Los valores más bajos se observaron en el alineamiento entre Der p 2 y Lep d 2 (31.9 %), seguido de Gly d 2 y Eur m 2 (32.1 %). Los alérgenos de las especies de la familia Glycyphagidae, Blo t y Gly d, presentaron una identidad de 36.1 %, mientras que la identidad de Blo t 2 fue más alta con los miembros de la familia Acaridae en los alineamientos Blo t 2 y Tyr p 2 (50.7 %), Blo t 2 y Lep d 2 (51.40 %) y Blo t 2 y Aca s 2 (44 %).
Cuadro 4 Alineamiento de alérgenos de ácaros del grupo 2 basado en secuencias de aminoácidos*
| Alineamiento | Posiciones | Identidad | |
| Idénticas | Similares | (%) | |
| Dermatophagoides pteronyssinus-Dermatophagoides farinae | 127 | 14 | 86.98 |
| Dermatophagoides pteronyssinus-Blomia tropicalis | 57 | 59 | 39.04 |
| Dermatophagoides pteronyssinus-Acarus siro | 58 | 44 | 39.72 |
| Dermatophagoides pteronyssinus-Lepidoglyphus destructor | 52 | 53 | 35.61 |
| Dermatophagoides pteronyssinus-Glycyphagus domesticus | 47 | 46 | 31.97 |
| Dermatophagoides pteronyssinus-Euroglyphus maynei | 123 | 18 | 84.24 |
| Dermatophagoides pteronyssinus-Tyrophagus putrescentiae | 57 | 53 | 39.04 |
| Dermatophagoides farinae-Blomia tropicalis | 58 | 61 | 39.72 |
| Dermatophagoides farinae-Acarus siro | 60 | 44 | 41.09 |
| Dermatophagoides farinae-Lepidoglyphus destructor | 61 | 51 | 41.78 |
| Dermatophagoides farinae-Glycyphagus domesticus | 53 | 44 | 36.05 |
| Dermatophagoides farinae-Euroglyphus maynei | 120 | 20 | 82.19 |
| Dermatophagoides farinae-Tyrophagus putrescentiae | 60 | 52 | 41.09 |
| Blomia tropicalis-Acarus siro | 63 | 51 | 44.05 |
| Blomia tropicalis-Lepidoglyphus destructor | 73 | 45 | 51.40 |
| Blomia tropicalis-Glycyphagus domesticus | 52 | 50 | 36.11 |
| Blomia tropicalis-Euroglyphus maynei | 59 | 59 | 40.69 |
| Blomia tropicalis-Tyrophagus putrescentiae | 72 | 44 | 50.70 |
| Acarus siro-Lepidoglyphus destructor | 65 | 46 | 45.45 |
| Acarus siro-Glycyphagus domesticus | 53 | 44 | 36.55 |
| Acarus siro-Euroglyphus maynei | 55 | 49 | 37.93 |
| Acarus siro-Tyrophagus putrescentiae | 58 | 51 | 40.55 |
| Lepidoglyphus destructor-Glycyphagus domesticus | 70 | 38 | 48.61 |
| Lepidoglyphus destructor-Euroglyphus maynei | 56 | 50 | 38.62 |
| Lepidoglyphus destructor-Tyrophagus putrescentiae | 66 | 48 | 46.47 |
| Glycyphagus domesticus-Euroglyphus maynei | 47 | 47 | 32.19 |
| Glycyphagus domesticus-Tyrophagus putrescentiae | 56 | 46 | 39.16 |
| Euroglyphus maynei-Tyrophagus putrescentiae | 54 | 53 | 37.24 |
*Se describen posiciones idénticas, similares y porcentaje de identidad
Alineamientos de las secuencias del grupo 5
Los porcentajes de identidad de los alérgenos del grupo 5 se muestran en el cuadro 5. Para este grupo de proteínas se presentaron valores mucho más bajos en comparación con los otros dos alérgenos, oscilando entre 17 y 76 %. El alineamiento entre las especies del género Dermatophagoides fue nuevamente el que presentó identidad más alta, con 76.51 %. Los datos más bajos se presentaron en el alineamiento de esta familia con Gly d 5, donde los valores fueron de 17.89 % entre Der f 5 y Gly d 5 y de 18.43 % entre Der p 5 y Gly d 5. El otro miembro de la familia Glycyphagidae, Blomia tropicalis, presentó un valor alto al parearlo con Tyrophagus putrescentiae (51.11 %) y con las especies de la familia Pyroglyphidae (Der f 5 y Blo t 5 [44.03 %], Der p 5 y Blo t 5 [41.04 %]). Los demás apareamientos no sobrepasaron 40 % de identidad.
Cuadro 5 Alineamiento de Alérgenos de ácaros del grupo 5 basados en secuencias de aminoácidos
| Alineamiento | Posiciones | Identidad | |
| Idénticas | Similares | (%) | |
| Dermatophagoides pteronyssinus-Dermatophagoides farinae | 101 | 23 | 76.51 |
| Dermatophagoides pteronyssinus-Blomia tropicalis | 55 | 58 | 41.04 |
| Dermatophagoides pteronyssinus-Lepidoglyphus destructor | 40 | 45 | 30.07 |
| Dermatophagoides pteronyssinus-Glycyphagus domesticus | 47 | 49 | 18.43 |
| Dermatophagoides pteronyssinus-Tyrophagus putrescentiae | 49 | 48 | 36.29 |
| Dermatophagoides farinae-Blomia tropicalis | 59 | 53 | 44.03 |
| Dermatophagoides farinae-Lepidoglyphus destructor | 45 | 39 | 33.83 |
| Dermatophagoides farinae-Glycyphagus domesticus | 46 | 51 | 17.89 |
| Dermatophagoides farinae-Tyrophagus putrescentiae | 50 | 46 | 36.76 |
| Blomia tropicalis-Lepidoglyphus destructor | 53 | 35 | 39.55 |
| Blomia tropicalis-Glycyphagus domesticus | 62 | 40 | 24.21 |
| Blomia tropicalis-Tyrophagus putrescentiae | 69 | 43 | 51.11 |
| Lepidoglyphus destructor-Glycyphagus domesticus | 66 | 32 | 25.88 |
| Lepidoglyphus destructor-Tyrophagus putrescentiae | 48 | 36 | 35.55 |
| Glycyphagus domesticus-Tyrophagus putrescentiae | 57 | 51 | 22.17 |
Análisis filogenéticos de las secuencias de ARNm y aminoácidos de los alérgenos de los grupos 1, 2 y 5 de los ácaros
La historia evolutiva fue inferida utilizando el método neighbor-joining para las secuencias de ARNm y aminoácidos. El árbol filogenético se obtiene de la suma de la longitud de las ramificaciones. El porcentaje de réplicas presentadas asociadas con cada una de las agrupaciones entre las taxas en la prueba de fidelidad de bootstrap se muestra en cada ramificación. La unidad de cada ramificación es igual a las distancias evolutivas usadas para inferir la filogenética del árbol. Estas fueron computadas usando el método de corrección de Poisson. La cantidad de nucleótidos y aminoácidos evaluados varía de acuerdo con la cantidad de espacios vacíos generados por el alineamiento (gap) y nucleótidos ausentes entre cada secuencia estudiada.
Arboles de los alérgenos del grupo 1
En los árboles de los alérgenos del grupo 1 se incluyeron seis especies. La suma de las distancias de las ramificaciones para los arboles de ARNm y aminoácidos fueron de 1.72 y 2.036, respectivamente. Todos los nódulos presentaron una confidencialidad mayor a 90 % (exceptuando el nódulo de Tyrophagus putrescentiae y Acarus siro en el árbol por aminoácidos (55 %). La cantidad de monómeros evaluados fue de 600 nucleótidos y 208 aminoácidos. Ambos árboles presentaron una topología muy similar. Se observó estrecha relación entre las proteínas de la familia Pyroglyphidae y Euroglyphus maynei. Las dos especies de la familia Acaridae se encontraron en la misma ramificación, sin embargo, no presentaron una estrecha relación (distancia al nódulo, 0.39 Tyrophagus putrecentiae y 0.32 Acarus siro). Blomia tropicalis fue la especie más divergente de los ácaros estudiados (figuras 1 y 2).
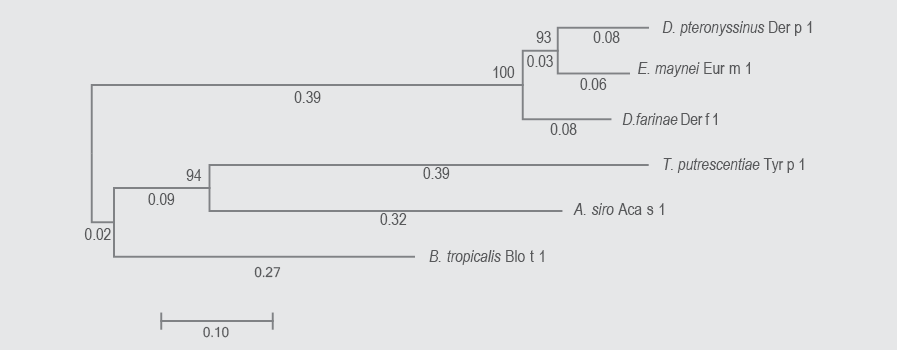
Figura 1 Árbol filogenético de alérgenos de ácaros del grupo 1 a partir de las secuencias de ácidos nucleicos, utilizando el método neighbor-joining; se muestra con la suma de la longitud de la rama = 1.72211816. El árbol está dibujado a escala, señalando al lado de las ramas las distancias evolutivas utilizadas. Hubo 600 posiciones en el conjunto de datos final.
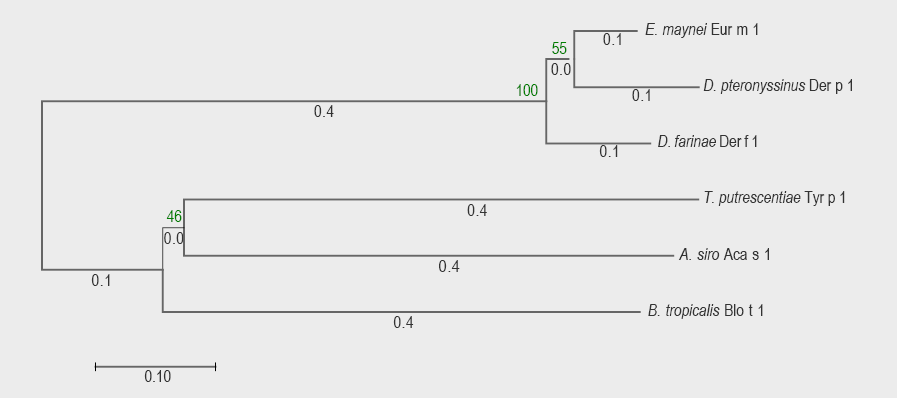
Figura 2 Árbol filogenético de alérgenos de ácaros del grupo 1 a partir de las secuencias de aminoácidos. La historia evolutiva se dedujo utilizando el método neighbor-joining. Se muestra el árbol óptimo con la suma de longitud de rama = 2.03618307. Hubo 208 posiciones en el conjunto de datos final.
Arboles de los alérgenos del grupo 2
Para el análisis del grupo 2 se incluyeron ocho especies en ambos árboles. La suma de las distancias de las ramificaciones para los arboles de ARNm y aminoácidos fueron de 2.18 y 2.49, respectivamente. La confidencialidad de los nódulos fue en todos los casos mayor a 50 %. La cantidad de monómeros evaluados fue de 379 nucleótidos y 125 aminoácidos. La familia Pyroglyphidae presentó nuevamente la relación más estrecha (distancias < 0.2). La proteína más distante fue Aca s 2 seguida de Lep 2 y, además, la proteína de Blomia tropicalis se presentó muy distante en los dos árboles, sin ninguna relación con Gly d 2, perteneciente a la misma familia. La relación entre las demás especies fue muy baja, con ramas mayores a 0.27 en ambos arboles (figuras 3 y 4).
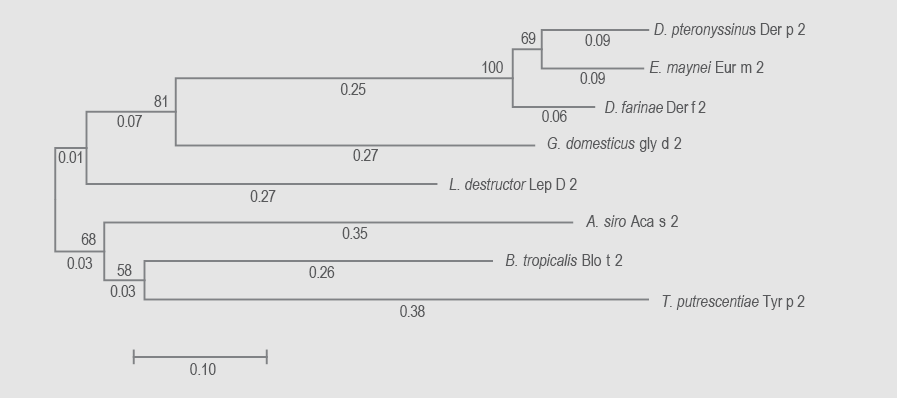
Figura 3 Árbol filogenético de alérgenos de ácaros grupo 2 a partir de las secuencias de ácidos nucleicos obtenidas mediante el método neighbor-joining. Se muestra con la suma de la longitud de la rama = 2.18019072. El árbol está dibujado a escala; al lado de las ramas se señalan las distancias evolutivas utilizadas. Hubo 379 posiciones en el conjunto de datos final.
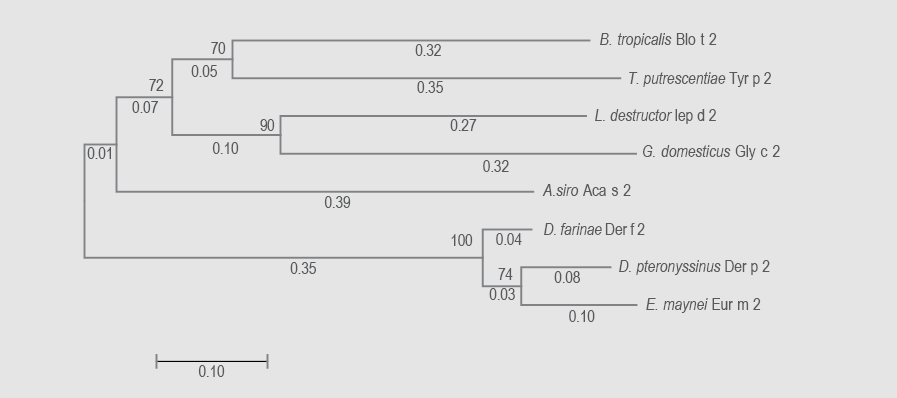
Figura 4 Árbol filogenético de alérgenos de ácaros grupo 2 a partir de las secuencias de aminoácidos. Se muestra con la suma de longitud de rama = 2.49796941. La historia evolutiva se dedujo utilizando el método neighbor-joining. Se eliminaron todas las posiciones que contenían vacíos y datos perdidos. Hubo 125 posiciones en el conjunto de datos final.
Arboles de los alérgenos del grupo 5
En los arboles filogenéticos del grupo 5 se incluyeron seis especies en ambos árboles. La sumas de las distancias de las ramificaciones para los arboles de ARNm y aminoácidos fueron de 1.90 y 2.05, respectivamente. La confidencialidad de los nódulos fue en todos los casos mayor a 70 %. La cantidad de monómeros evaluados fue de 379 nucleótidos y 109 aminoácidos. Las especies con mayor relación fueron las pertenecientes al género Dermatophagoides (< 0.15).
En el árbol filogenético basado en la secuencia de ARNm se encontró nuevamente que la especie más distante de todas, incluyendo a la otra especie de la familia, fue Blomia tropicalis. En la secuencia de aminoácidos, Blo t 5 presentó mayor relación con Tyr p 5 que en el árbol de ARNm. Nuevamente las demás proteínas fueron bastante divergentes entre sí (figuras 5 y 6).

Figura 5 Árbol filogenético de alérgenos de ácaros grupo 5 a partir de las secuencias de ácidos nucleicos. La suma de la longitud de ramificación fue de 1.90357234. La historia evolutiva se realizó a partir del método neighbor-joining. En el árbol dibujado a escala se señala al lado de las ramas las distancias evolutivas utilizadas. Hubo 327 posiciones en el conjunto de datos final
Discusión
Los ácaros son organismos de distribución cosmopolita pertenecientes al orden Astigmata, caracterizados por su cutícula poco queratinizada y su respiración cutánea. Se diferencian de los demás artrópodos por no tener un cuerpo segmentado. Estas especies son la principal fuente de sensibilización a IgE y las principales causantes de alergias en las regiones tropicales. Las familias más representativas en las alergias y con mayor distribución a nivel mundial son Acaridae, Glycyphagidae, Pyroglyphidae y Chortoglyphidae. Sin embargo, por más de cuatro décadas se ha discutido sobre su clasificación e hipótesis evolutiva. Las primeras clasificaciones basadas en las características morfológicas de las especies actualmente establecen relaciones poco consistentes con los análisis moleculares de las diferentes secuencias de ADN (genoma y mitocondrial), ARN (mensajero y ribosómico) y aminoácidos de estos ácaros, lo que ha provocado un debate sobre la clasificación de las especies en diferentes grupos taxonómicos con propuestas de clasificación diferentes a las iniciales.17
Clínicamente, esta categorización ha tomado importancia ya que diferentes grupos de proteínas de los ácaros son las principales fuentes de sensibilización y, muchas de estas tienen secuencias altamente conservadas presentando una alta homología. Entre mayor la identidad entre secuencias y exposición a los diferentes epítopes, mayor la probabilidad de presentar reactividad cruzada y, por tanto, de síntomas a un mayor número de especies de ácaros. Además, la presencia de estos ácaros y la concentración a la exposición de los alérgenos está relacionado con los niveles de IgE específico en suero y con el fenotipo del asma alérgica, con lo que se observa una relación entre el tipo de alérgeno y la familia a la que pertenece.18 A partir de lo anterior, al conocer la estructura primaria de los diferentes alérgenos y que tan conservadas se encuentran, las secuencias de epítopos específicos y las concentraciones requeridas del alérgeno para desencadenar la sensibilización, se pueden realizar combinaciones de extractos de ácaros o alérgenos para un mejor diagnóstico y tratamiento de las enfermedades alérgicas.16,19
Los alérgenos de los grupos 1 y 2 son importantes en la medicina dada su alta frecuencia de unión con la IgE y estas proteínas son usadas frecuentemente en las pruebas de diagnóstico y en la inmunoterapia alérgeno-específica.20 Por otro lado, el grupo 5 son proteínas homologas de aproximadamente 15 kD, sin una función conocida. Los tres alérgenos se encuentran principalmente en las heces de los ácaros y están frecuentemente asociados con el desarrollo de síntomas en las personas atópicas.
En los tres grupos de alérgenos estudiados, la mayor homología se presentó entre los miembros de la familia Pyroglyphidae y en algunos casos estos presentaron una alta homología con alérgenos de otras familias. Para el grupo 1 y 2, Dermatophagoides pteronyssinus y Euroglyphus maynei presentaron valores de identidad mayores a 80 %, mientras que en el grupo 5 la secuencia de Eur m 5 no está reportada en la base de datos, pero la identidad entre Der p 5 y Der f 5 fue de 76.51 %, lo que mostró alta conservación en los miembros de esta familia de proteínas y la probabilidad de que exista una reactividad cruzada entre los tres grupos de alérgenos de estos ácaros. La alta relación de esta familia se evidencia nuevamente al observar los árboles filogenéticos de los tres alérgenos, tanto de la secuencia de nucleótidos como de aminoácidos, con la relación más estrecha entre todos los organismos estudiados y ubicándolos en una rama totalmente independiente, afirmando la conservación molecular entre estas proteínas y su homología.
El género Dermatophagoides es considerado la principal fuente de alérgenos en el polvo doméstico y la especie más relevante en las enfermedades alérgicas como rinitis, asma y dermatitis en las zonas tropicales. Entre los alérgenos de este género, los grupos 1 y 2 son serodominantes respecto a los demás alérgenos. En el estudio de Sánchez et al.,16 las pruebas con los extractos de las especies de esta familia presentaron alta cosensibilización y correlación en el tamaño de la pápula, sugiriendo también una reactividad cruzada entre estas especies. Al comparar los resultados filogenéticos con la prevalencia de sensibilización en esta población encontramos que existe alta relación en los resultados, con los valores más altos en la familia Pyroglyphidae. Además, al evaluar la razón de probabilidades, encontramos que Der f y Der p fueron el principal factor de riesgo para la sensibilización a otras fuentes, aumentando más de 20 veces la probabilidad de sensibilización a otros ácaros de la familia Pyroglyphidae y más de 10 veces la sensibilización a ácaros de otras familias.16
La identidad entre las demás familias en los tres grupos es muy baja, lo que demuestra una diversificación evolutiva entre estas moléculas y una muy baja posibilidad de reactividad cruzada. Estudios que evaluaron esta reacción entre Pyroglyphidae y las demás familias presentaron resultados diversos.3,4,9,12 Se han planteado tres posibles causas:
El origen diferente de los sueros obtenidos, con características genéticas y ambientales específicas, con una respuesta particular contra los alérgenos.
En la mayoría de los casos se evalúa el extracto completo del ácaro y no los componentes moleculares.
La fuente de donde se obtienen, ya que se ha demostrado que existen variantes genéticas entre los alérgenos de los ácaros provenientes de diferentes países y que la variación de aminoácidos puede influir también en la unión de IgE con el alérgeno.
Una simple modificación de un aminoácido puede alterar la respuesta inmunológica y la producción de citocinas.20,21,22 Las implicaciones clínicas de estos hallazgos son varias: debido a la distribución cosmopolita de la familia Pyroglyphidae y su alta reactividad cruzada con otras especies de la familia Acaridae, su utilización en el diagnóstico de atopia y en el tratamiento de las alergias hace que no sea indispensable utilizar extractos de las otras dos familias, lo que ahorr tiempo y dinero tanto para el paciente como para el médico tratante. La excepción a esta utilidad práctica serían las zonas donde la frecuencia de ácaros de la familia Chortoglyphidae y Acaridae es mayor que la de los ácaros de la familia Pyroglyphidae, sin embargo, esto no suele presentarse en la región del trópico, donde imperan las especies de Dermatophagoides.
Para Blomia tropicalis, esta especie es una fuente importante de sensibilización al polvo doméstico en las regiones tropicales y subtropicales, ya que en estas zonas la humedad relativa (aproximadamente 85 %) y la temperatura (aproximadamente 28 °C) son propicias para el desarrollo de este ácaro y la sensibilización es muy frecuente en la población. A partir de sus características morfológicas, esta especie es clasificada en la familia Glyciphagidae, sin embargo, al observar los arboles filogenéticos y los alineamientos encontramos que, en su mayoría, esta especie es la que presenta una mayor diversificación evolutiva incluso con Glycyphagus domesticus, especie perteneciente a esa familia, con una identidad muy baja en los alineamientos realizados y una muy baja relación con las demás especies en los árboles filogenéticos.
Nuestros resultados concuerdan con lo propuesto en 1982 por O’Connor, quien incorpora al género Blomia en un grupo taxonómico aparte. En trabajos realizados previamente encontramos baja correlación y probabilidad de cosensibilización entre Blomia tropicalis y las demás especies estudiadas, con valores bajos en la razón de sensibilización, lo que reafirma la distancia evolutivamente marcada de esta especie respecto a las familias estudiadas. Por esto, en la clínica es recomendable evaluar independientemente la alergenicidad de esta especie, dada su baja relación con las otras especies y la poca probabilidad de reactividad cruzada.
A diferencia de las especies de la familia Pyroglyphidae, cuyas principales fuentes de sensibilización son los alérgenos de los grupos 1 y 2, el alérgeno del grupo 5 de Blomia tropicalis desempeña un papel importante en la sensibilización a esta especie, especialmente en enfermedades respiratorias como el asma. El reconocimiento de estas secuencias y la síntesis de epítopos específicos pueden ayudar a identificar posibles mecanismos de modulación de los linfocitos T e inhibir la secreción de IgE por parte de los linfocitos B.19 Además, se están reconociendo nuevos alérgenos de gran importancia provenientes de Blomia tropicalis, como Blo t 7, el cual puede inducir respuestas inmunes innatas a través de TLR2.23 Por lo tanto, es necesario realizar más estudios sobre esta especie y sus diferentes alérgenos para comprender a cabalidad el papel que desempeña en las enfermedades alérgicas.
Por otro lado, Glycyphagus domesticus presentó mayor relación filogenética con Lepidoglyphus destructor en los alérgenos de los grupos 2 y 5 en las secuencias de aminoácidos, mas no en la secuencia de nucleótidos. Probablemente la relación es visible en los árboles filogenéticos dada la organización de las secuencias y los gap no visibles en el momento del alineamiento. Dada la homología, es probable que estas especies presenten un ancestro común y puedan reorganizarse en una sola familia. Esto se observa en la diversificación entre Lepidoglyphus destructor y Acarus siro, muy distantes en el árbol filogenético de ambas fuentes y con una identidad media en los alineamientos (45.45 %). Como contraste, Acarus siro mantiene una relación con Tyrophagus putrescentiae, especialmente en el grupo 1, consistente con la clasificación morfológica descrita. Sin embargo, se necesita analizar muchos más genes para confirmar esta relación.
En conclusión, los alérgenos de los grupos 1, 2 y 5 de las especies del género Pyroglyphidae son altamente conservadas y como principales moléculas de sensibilización deben considerase y evaluar la posibilidad de reactividad cruzada entre ellas. Blomia tropicalis es un componente importante en la sensibilización en los trópicos y, por su distancia evolutiva, es importante evaluarlo independientemente de las demás. Glycyphagus domesticus y Lepidoglyphus destructor se encuentran en la misma familia y sus secuencias son altamente conservadas, por consiguiente, su evaluación como un componente individual también es necesaria, pero solo en las poblaciones donde se encuentre este ácaro.











 nueva página del texto (beta)
nueva página del texto (beta)




