Abreviaturas y siglas
FGF, factor de crecimiento de fibroblastos
GH, hormona del crecimiento
HPA, hipotálamo-pituitario-adrenal
IL, interleucina
LIF, factor inhibidor de leucemia
MHC, major histocompatibility complex
MIG, monoquina inducida por IFN-γ
MIP-2, proteína inflamatoria de macrófagos-2
MOR, sueño de movimientos oculares rápidos
NO MOR, sueño de movimientos oculares no rápidos
NT, natural killer
PCR, proteína C reactiva
PDGF-bb, factor de crecimiento derivado de plaquetas-bb
ROS, reactive oxygen species
SNS, sistema nervioso simpático
SWS, sueño de onda lenta
TNF, factor de necrosis tumoral
VEGF, factor de crecimiento endotelial vascular
Introducción
El sueño es un proceso fisiológico asociado con periodicidad circadiana, durante el cual la conciencia, la respuesta a estímulos y la tasa metabólica se reducen.
Numerosas actividades disminuyen, mientras que otras se consolidan, como se ha señalado para la respuesta inmune y la memoria.1
Durante el sueño hay restablecimiento de energía, eliminación de radicales libres, regulación endocrina y de la actividad eléctrica cortical, consolidación de la memoria y redistribución celular con aumento y activación de linfocitos T en nódulos linfáticos.
La privación, disminución o fragmentación del sueño producen alteraciones neuroinmunoendocrinas.
Sistema inmune
El sistema inmunitario contribuye a mantener la integridad del individuo eliminando elementos extraños o agentes infecciosos. Esta función la realiza mediante dos tipos de respuesta, la innata y la adaptativa.
Inmunidad innata
Constituye la primera línea de defensa del organismo contra el daño a tejidos e infecciones microbianas.2) En ella participan varios tipos de barreras: mecanismos como la fiebre y la tos, barreras anatómicas -que incluyen diversas estructuras y numerosas células como neutrófilos, macrófagos, natural killer (NK), dendríticas, endoteliales, epiteliales, etcétera- y barreras químicas y fisiológicas, que incluyen moléculas como lisozima, defensinas, complemento, proteína C reactiva.
La activación de estas células deriva en una cascada de procesos inflamatorios que ayudan a contener una infección y a promover la curación, recuperación y regreso a la homeostasis.2
Inmunidad adaptativa
En ella, los linfocitos T o B responden a estímulos inflamatorios, citocinas y principalmente a la presentación de antígenos, como consecuencia se activan, proliferan y se diferencian. Esta respuesta es regulada por numerosas citocinas, entre otras, proinflamatorias (IL-1, IL-6 y TNF), activadoras (IL-2, IFN-γ) y antiinflamatorias (IL-10, factor de crecimiento transformante beta).
Citocinas
Ambos tipos de respuesta inmune, innata y adquirida, requieren una red de moléculas de señalización denominadas citocinas, las cuales son secretadas, además de las células inmunes por la mayoría de las células, entre las cuales se encuentran las neuronas. Las citocinas son un grupo diverso de proteínas de señalización intercelular que participan en la actividad y regulación de la respuesta inmune (a nivel local y sistémico). Estas moléculas participan, además, en numerosos procesos fisiológicos y se unen a las células diana a través de receptores específicos.
Las citocinas tienen cuatro propiedades: pleiotrópicas, redundantes, sinérgicas y antagónicas. Por su importancia en la regulación del sueño se describen algunas.
IL-1. Participa importantemente en la inflamación. Activa las moléculas endoteliales de adhesión intercelular facilitando la adherencia de células inmunes al endotelio y su migración a los tejidos.3 La producen numerosos tipos de células, entre ellas las neuronas, y presenta dos formas moleculares: α y β. En 1983, Kruege et al. encontraron la relación entre esta citocina y la regulación del sueño.4 Actúa como proinflamatoria y prosomnogénica.5,6
Factor de necrosis tumoral (TNF). Igual que la IL-1 es un pirógeno endógeno, proinflamatorio y prosomnogénico. Es producido por macrófagos y otras células presentes en el entorno inflamatorio, aumenta la expresión de moléculas clase II del MHC y de las moléculas coestimuladoras CD80 (B7-1) y CD86 (B7-2) en macrófagos y células dendríticas. Cuando TNF e IL-1 se administran en animales de laboratorio en el sistema nervioso central o periférico son consistentemente somnogénicos.7,8
IFN. Al tipo I pertenecen los α y β, que pueden ser producidos por casi todas las células y participa en la respuesta innata; el tipo II (γ), producido en mayor medida por macrófagos, linfocitos NK y Th1, participa principalmente en la respuesta adquirida, estimula la maduración de las células TCD8, la diferenciación de T y B y la activación de macrófagos. El tipo III (λ) es producido principalmente por las células epiteliales, tiene gran potencial antitumoral y antiviral.8
IL-2. Induce crecimiento activación y diferenciación de T, es secretada fundamentalmente por linfocitos Th1. La producen también células presentadoras activadas, así como las células nerviosas, que la secretan principalmente en respuesta a las alteraciones emocionales.
IL-6. Participa en el desarrollo de la célula B activada. Tiene propiedades proinflamatorias, quimioatrayentes y vasoactivas, induce fiebre y puede estimular al hígado para que sintetice proteínas de respuesta de fase aguda.8 En ratas modula el sueño de movimientos oculares no-rápidos (NO MOR) y se sabe que contribuye a la somnolencia.9
IL-4, IL-10, IL-13. Citocinas tipo Th2 consideradas antiinflamatorias son antisomnogénicas.9,10
Las interacciones neuroinmunes se llevan a cabo bajo condiciones anatómicas y fisiológicas específicas: participan en forma importante células de la glia, neuronas y células del sistema inmune, las cuales expresan receptores específicos y comparten señales procedentes de hormonas, neurotransmisores y citocinas.11
Sueño
El sueño tiene un papel importante en la regulación de las respuestas innata y adaptativa; el sueño alterado induce disminución de la inmunidad adaptativa y aumento de la innata.
El sueño es un proceso importante para el individuo, en particular para su cerebro; el sueño normal se requiere para que el sistema nervioso controle las respuestas ante estímulos externos y a su vez el cerebro regula el sueño para el bienestar del organismo. Algunas funciones del sueño propuestas por Stevens son consolidación de la memoria, conservación de la energía, restauración cerebral y regulación de la función inmune.12 El sueño emerge como un importante regulador del sistema inmune.13
Fases del sueño
El sueño es un proceso que comprende diferentes ciclos de 90 minutos, a través de los cuales algunas partes del cerebro son activadas y otras desactivadas.14 Está integrado por los ciclos NO MOR y MOR.
El sueño de movimientos oculares no rápidos (NO MOR) a su vez está dividido en cuatro etapas: 1 y 2 corresponden al sueño ligero; en las etapas 3 y 4 se lleva a cabo el sueño profundo del ciclo. Investigaciones recientes han designado a las etapas 3 y 4 como sueño de onda lenta (SWS, slow-wave-sleep) debido a las dificultades para distinguir su profundidad en estas dos etapas.
El sueño de movimientos oculares rápidos (MOR), en el cual se producen los sueños, la actividad del cerebro es similar a la de las horas de vigilia y hay un tono muscular bajo.
Para tener un sueño reparador, el ciclo NO MOR-MOR de 90 minutos se debe repetir entre cinco y seis veces durante la noche (7.5 a nueve horas).15 SWS predomina en la primera parte de la noche, mientras que el sueño MOR se produce en la parte avanzada de la noche (Figura 1).

Figura 1 Principales citocinas y hormonas que participan en el sueño. En la izquierda, los elementos que disminuyen; a la derecha, los que aumentan durante el sueño.
La función del ciclo NO MOR es reparar los procesos neuronales necesarios para un desempeño mental y físico óptimo, mientras que la de MOR es la consolidación de la memoria y el desarrollo cognitivo (Cuadro 1).
Cuadro 1 Ciclo del sueño.
| No MOR | |
|---|---|
| Fase 1 | Somnolencia (4-5 minutos) |
| Fase 2 | Sueño ligero (45-50 minutos) |
| Fase 3 | Inicia el sueño profundo (3-4 minutos) |
| Fase 4 | Sueño profundo (20 minutos) |
| Fases 3 y 4 | Sueño de ondas lentas |
| MOR | |
| Fase 5 | Se presentan los sueños (20 minutos) |
Este ciclo dura aproximadamente 90 minutos y se repite a lo largo de la noche.
La calidad y cantidad de sueño está influida por mecanismos biológicos (ritmos circadianos), regulados por el hipotálamo, la glándula pineal y el núcleo supraquiasmático, los cuales a su vez son afectados por los genes, la luz solar y otros factores ambientales.
Sueño y sistema inmune
El papel que el sueño desempeña en el mantenimiento y función del sistema inmune no se ha dilucidado completamente. Algunos estudios han demostrado que la privación de sueño puede tener efectos importantes sobre la función inmune, los niveles de citocinas y de los marcadores de inflamación, disminuyendo también la función de las células NK, los linfocitos T y los monocitos.16,17 Lo anterior concuerda con evidencias acumuladas en los últimos años, las cuales muestran que el sueño aumenta la defensa inmune18 por varios mecanismos, entre otros, el incremento de la memoria inmunológica y las funciones proinflamatoria y activadora que se desarrollan durante este periodo.
En los humanos está demostrado que una noche de privación de sueño después de recibir una vacuna de hepatitis A disminuye la producción de anticuerpos, mientras que la respuesta inmune adaptativa es mejor si el individuo duerme después de la vacunación, ya que el medio proinflamatorio durante el sueño funciona como adyuvante.19 La activación inmune, la síntesis de proteínas y la proliferación celular, así como el aporte de energía y los cambios endocrinos que ocurren durante el sueño ayudan a mantener en buen estado al sistema inmune.20
En animales infectados experimentalmente se demostró que la mortalidad disminuye si tienen un sueño completo después del desafío infeccioso, mientras que su privación los conduce a septicemia o, incluso, la muerte.21,22
Por otro lado, se ha especulado que el sueño sirve para reasignar recursos energéticos de funciones relacionadas con la vigilia y los procesos que facilitan y promueven la respuesta inmune a los desafíos infecciosos.23,24 El movimiento nocturno de las células inmunes fuera del sistema circulatorio y posiblemente a los ganglios linfáticos permite que las células T y B tengan la primera exposición a antígenos extraños y se active la respuesta inmune adaptativa.23
Patel et al. demostraron que tanto la reducción como la prolongada duración del sueño se asocian con mayor riesgo de padecer infecciones severas (por ejemplo, neumonía).25
La reducción de sueño entre cuatro o cinco horas por noche tiene efectos adversos, entre los que se incluyen daño al estado neurocognitivo, al estado de ánimo y al metabolismo.26 Otros autores sugieren que el sueño reducido incrementa el riesgo de presentar aterosclerosis y enfermedades del corazón,27,28 resistencia a la insulina,29,30 obesidad31 y enfermedades cardiometabólicas,32 así como accidentes en el trabajo.33
Acorde con lo anterior se puede decir que el sueño resulta esencial para la homeostasis del organismo.
Sueño y citocinas
Como se señaló en el rubro correspondiente, las citocinas desempeñan también funciones no inmunitarias, las cuales se presentan en ausencia de estímulos al sistema inmune. Estudios de la participación entre el sistema de citocinas y la conducta sueño-vigilia lo corroboran.34 Las citocinas y sus receptores se expresan constitutivamente en células del sistema nervioso central de organismos sanos, donde interactúan con los circuitos del cerebro y los sistemas de neurotransmisores (serotoninérgico, GABAérgicos y colinérgico) que controlan el sueño.35 Lo anterior les permite participar, además de la señalización inherente al sistema inmune periférico, en funciones como la regulación del estado de ánimo y de excitación.
Al menos dos citocinas (IL-1 y TNF) participan en la regulación del sueño fisiológico normal en un contexto diferente al de la activación inmune. Numerosos datos derivados de estudios electrofisiológicos, bioquímicos y genéticos moleculares apoyan su participación en la regulación de la conducta espontánea sueño-vigilia.34 El TNF actúa dentro de una amplia red bioquímica orquestada para adaptar al sueño en la salud y enfermedad.36
Kapsimalis et al. estudiaron la participación de las citocinas en la regulación espontánea del sueño NO MOR.37 Los efectos de estas moléculas sobre el sueño están mediados por el sistema hormonal y el eje hipotálamo-pituitario-adrenal (HPA).
Las citocinas proinflamatorias IL-1, IL-6, TNF aumentan el sueño NO MOR espontáneo y las antiinflamatorias como IL-4, IL-10 e IL-13 lo disminuyen, tanto en humanos como en animales.38
El mecanismo y el sitio donde las citocinas ejercen su efecto sobre el sueño no se conocen con exactitud, los datos que existen indican que la IL-1β y el TNF-α actúan directamente sobre las neuronas del área implicada en la regulación del sueño (área preóptica hipotalámica y cerebro basal anterior).39 Cuando TNF, IFN-α o IL-1β se administran en el cerebro de ratas y conejos aumenta la duración del sueño NO MOR, este efecto se puede eliminar con el suministro de Ac anti-IL-1β, antagonistas para sus receptores (IL-1Ra) o fragmentos del receptor soluble de la IL-1.
El sueño NO MOR espontáneo se reduce en ratones con deleciones específicas de la IL-1β o de receptores para el TNF-α.39
Cuando hay exposición continua a citocinas y a moléculas de la inmunidad innata, como IFN-α, se reduce la continuidad y profundidad del sueño y se induce un patrón consistente con el insomnio y la excitación.40
La IL-1 altera directamente patrones de descarga de las neuronas hipotalámicas implicadas en la regulación de la conducta sueño-vigilia.41 Estudios en ratones sugieren que IL-6 endógena puede actuar sobre los mecanismos reguladores del sueño MOR en forma diferente a IL-1β o a TNF-α.42 En humanos, la administración de IL-6 incrementa el sueño SWS durante la segunda mitad de la noche, pero lo disminuye durante la primera mitad, esto probablemente debido a la estimulación del HPA.43
La señal que dirige el aumento nocturno de las citocinas proinflamatorias se desconoce; se especula que durante el día (periodo de vigilia) se acumulan moléculas como las especies reactivas de oxígeno (ROS, reactive oxygen species), nucleótidos y proteínas de choque térmico que actúan como estimuladores para la producción de citocinas proinflamatorias, las cuales dan inicio a la respuesta inmune adaptativa.
Esta respuesta se ve favorecida durante el sueño nocturno, por el aumento de la IL-12 y el IFN-γ, que estimulan la producción de citocinas tipo Th1: IFN-γ e IL-2, activadoras de macrófagos y linfocitos respectivamente.
El sueño puede modificar la función del sistema inmune induciendo, además, cambios en las vías del estrés, es decir, el eje hipotálamo-pituitaria-adrenal (HPA) y el sistema nervioso simpático (SNS).
Sueño e inflamación
La privación parcial de sueño repetida por varios días produce incremento en la producción de proteína C reactiva (PCR),44,45 IL-6,46,47,48 TNF,49,50 e IL-1β,45,51 el cual persiste aún después de una noche completa de recuperación del sueño. Estas moléculas activan a NF-κB, la vía de control de transcripción clave en la cascada de señalización inflamatoria.52 La alteración en el sueño, posiblemente a través de efectos sobre la inflamación, puede contribuir a desarrollar enfermedades inflamatorias crónicas.53,54 Estudios realizados en personas que duermen menos de cinco horas muestran que tienen mayor riesgo de presentar eventos cardiovasculares,55,56 con una relación lineal entre la duración del sueño y los posibles riesgos.57 Sugieren que la duración de un sueño óptimo es entre siete y ocho horas.
Yan et al. evaluaron en ratas el efecto de la privación de sueño en el perfil de diferentes citocinas y marcadores de inflamación. Para tal fin determinaron factor de crecimiento de fibroblastos (FGF)-básico, factor estimulador de colonias de macrófagos (M-CSF), factor inhibidor de leucemia (LIF), monoquina inducida por IFN-γ (MIG), proteína inflamatoria de macrófagos-2 (MIP-2), factor de crecimiento derivado de plaquetas-bb (PDGF-bb) y factor de crecimiento endotelial vascular (VEGF). De este grupo, únicamente tres elementos (FGF-básico, LIF y MIG) participaron en la respuesta inflamatoria originada por la privación total de sueño durante 48 horas.58
El periodo de sueño nocturno en los seres humanos se caracteriza por una profunda regulación sobre el HPA y el SNS, con disminución de los niveles sanguíneos de cortisol, adrenalina y noradrenalina. En contraste, mediadores que sirven para el crecimiento celular, diferenciación y restauración como la hormona del crecimiento (GH), la prolactina, la aldosterona y la melatonina aumentan en sangre durante el sueño.18
La GH aumenta en la circulación en las primeras horas de la noche, la aldosterona en las últimas horas y la prolactina toda la noche, lo cual tiene relación con el estado inmunológico y su actividad durante el sueño. En ratones se observó que la GH mejora el sueño NO MOR y, por el contrario, sus antagonistas lo reducen.59
La melatonina se produce durante la fase de oscuridad, regula ritmos circadianos y tiene propiedades antioxidantes e inmunorreguladoras.60 Aunado a esto aumenta la liberación de leptina por los adipocitos para evitar la sensación de hambre durante el sueño.61
El eje HPA incrementa su actividad durante la última parte del sueño nocturno y prepara al organismo para la actividad diaria. Así, el cortisol y las catecolaminas, que generalmente suprimen la función inmune, aumentan por la mañana, con lo cual se apaga la respuesta proinflamatoria evocada durante la noche62 (Figura 1).
En este contexto, numerosos experimentos muestran un patrón consistente de ritmos endocrinos e inmunológicos que reflejan un pico inflamatorio durante el sueño, mientras que la vigilia se asocia con actividad antiinflamatoria.63 La alteración crónica del sueño activa las vías HPA y SNS,64 que en forma conjunta inducen un estado proinflamatorio.
Ritmo circadiano, sueño y respuesta inmune
Las funciones de los sistemas biológicos se relacionan y dependen de que cada producto de sus genes sea secretado en el tiempo apropiado.
La dinámica entre las funciones de los genes, el tiempo y el ambiente está dictada en el organismo por el ritmo circadiano endógeno.65
El ritmo circadiano humano es controlado por el reloj neurológico en el núcleo supraquiasmático y los relojes periféricos ubicados en casi todas las células incluso las del sistema inmune.
El ritmo circadiano y el sueño interactúan para apoyar la respuesta inmune específica o adaptativa. Lo hacen mediante la disminución de catecolaminas y supresores como el cortisol, que baja durante el sueño nocturno, y la liberación de adyuvantes como la prolactina y la hormona del crecimiento,66 que aumentan y favorecen la redistribución de los linfocitos.
En sangre periférica hay un pico de células T vírgenes y de memoria al inicio del periodo de descanso en humanos y animales.67,68 La disminución del cortisol durante el sueño nocturno libera células T CXCR4+ de la médula ósea, las cuales, sin el impedimento del cortisol,69 penetran en nódulos linfáticos, lo que ocasiona su disminución en sangre durante el resto de la noche.68
Para ingresar a los ganglios linfáticos, los linfocitos a través de la selectina L se unen a la adresina nodal periférica de las células endoteliales altas venulares, se activan por unión de la quimiocina CXCL-12 con su receptor (CXCR4),70 se adhieren con firmeza y migran al parénquima del ganglio (Figura 2).
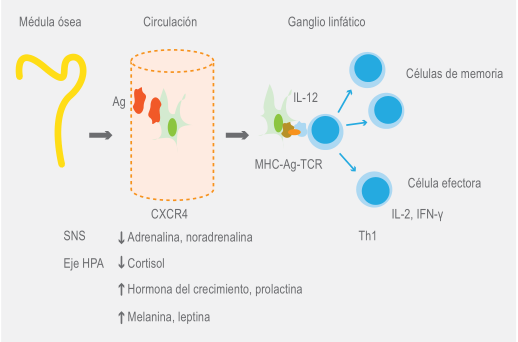
Figura 2 Durante el sueño nocturno, los linfocitos con una mayor expresión de CXCR4 migran a ganglios linfáticos donde son activados a través de la presentación del antígeno por células dendríticas. Elementos circulantes como el cortisol que disminuye y la prolactina que aumenta, favorecen la movilización celular.
En este sitio, las células dendríticas, que también migran en gran cantidad, presentan a través del MHC (major histocompatibility complex) el antígeno correspondiente a las células T vírgenes y las activan, lo que se ve favorecido por el aumento nocturno de las citocinas IL-2, IL-12 e IFN-γ.
Finalmente, en los linfocitos se expresa el receptor para esfingosina 1-fosfato, quimioatractante que abunda en sangre y permite su salida del ganglio, para que estas células puedan circular y realizar la función de patrullaje y vigilancia diurna.
A su vez, los patrones de circulación de las células madre hematopoyéticas correlacionan inversamente con el patrón circadiano que muestra la expresión de la quimiocina CXCL12 en la médula ósea.
Estos patrones son modulados por genes del reloj central a través de la secreción rítmica de hormonas adrenérgicas, las cuales son liberadas localmente en la médula ósea por neuronas del sistema nervioso simpático. El cortisol también participa modulando la expresión de CXCL12.70
Las células madre hematopoyéticas circulantes se incrementan por la mañana y disminuyen en la noche,71 pero pueden aumentar por inflamación, hipoxia, daño tisular y ejercicio. Asimismo, el reloj circadiano se puede reprogramar por elementos externos (zeitgebers), por ejemplo, luz, hormonas y corticoides. Los niveles elevados de cortisol disminuyen la proliferación de células madre en la médula ósea.
Algunos estudios en humanos muestran que las células madre de diferentes tejidos pueden diferir en su reloj circadiano.72
Conclusión
El análisis de estudios realizados hasta la fecha revela que la calidad del sueño y la respuesta inmune tienen una fuerte relación. La privación del sueño resulta en pobre función inmunológica: disminuye la producción de anticuerpos por vacunas, el número y la actividad de las células NK, así como la producción de IL-2 e induce incremento en la circulación de los marcadores proinflamatorios IL-6, TNF-α y proteína C reactiva.
El sueño insuficiente o los trastornos del sueño están relacionados directamente con enfermedades cardiovasculares, diabetes, sobrepeso, obesidad, estrés, accidentes y de manera importante con disfunción inmune y neurocognitiva.











 nueva página del texto (beta)
nueva página del texto (beta)



