Abreviaturas y siglas
5-LOX |
lipooxigenasa-5 |
AA |
ácido araquidónico |
AINE |
antiinflamatorios no esteroideos |
COX |
ciclooxigenasa |
CRTH1 |
receptor tipo 1 de prostaglandina D |
CVF |
capacidad vital forzada |
cysLT |
cisteinil leucotrienos |
EREA |
enfermedad respiratoria exacerbada por aspirina |
IgE |
inmunoglobulina E |
IL |
interleucina |
LT |
leucotrieno |
LTC4S, LTC4 |
sintetasa |
LXA4 |
lipoxina A4 |
LXB4 |
lipoxina B4 |
PCE |
proteína catiónica del eosinófilo |
PG |
prostanglandina |
PGD2M |
9α11β prostaglandina F2 |
RSC |
rinosinusitis crónica |
STAT6 |
transcripción 6 |
TC |
tomografía computarizada |
TSLP |
linfopoyetina estromal tímica |
VEF1 |
volumen espiratorio forzado al primer segundo |
Introducción
La enfermedad respiratoria exacerbada por aspirina (EREA) es una entidad crónica comúnmente caracterizada por asma bronquial, rinosinusitis crónica (RSC) con pólipos nasales y reacción de hipersensibilidad de la vía aérea a la aspirina, así como a otros inhibidores no selectivos de la enzima ciclooxigenasa (COX).1,2,3 Se encuentra dentro del amplio espectro de reacciones de hipersensibilidad inducida por los antiinflamatorios no esteroideos (AINE), como se lista en el Cuadro 1. Definida por primera vez por Widal et al.4 en 1922, no fue reconocida hasta 1968 cuando Samter y Beer5 describieron un grupo de pacientes con pólipos nasales, asma y sensibilidad a la aspirina; síntomas conocidos como la tríada de Samter.
Cuadro 1 Clasificación de las reacciones de hipersensibilidad inducida por los AINE
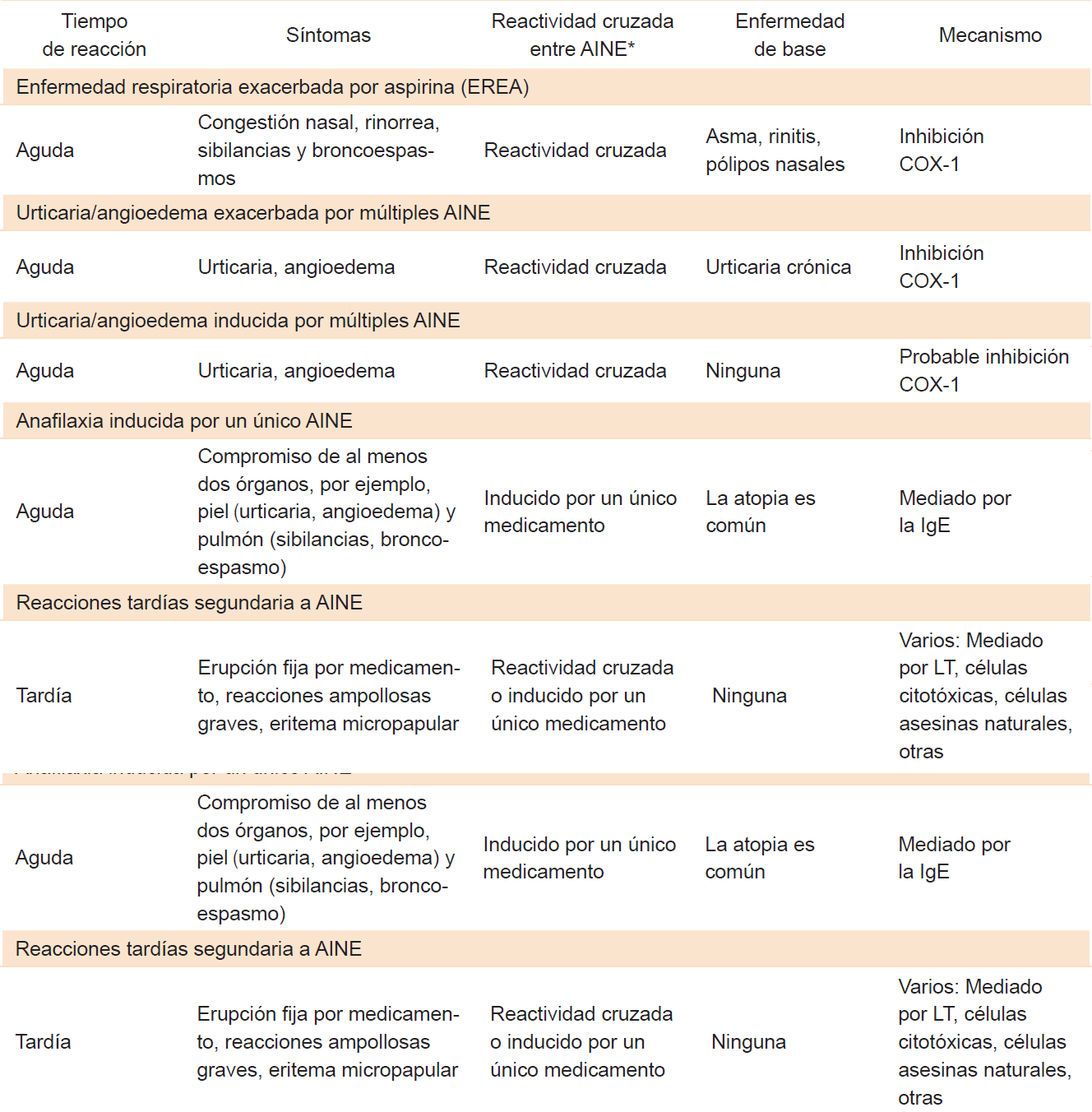
IgE = inmunoglobulina E, COX-1 = ciclooxigenasa, LT = linfocitos T. AINE de diferentes grupos según su estructura química. Tomado y traducido de Laidlaw TM, Cahill KN. current knowledge and management of hypersensitivity to aspirin and NSAIDs. J Allergy Clin Immunol Pract 2017;5(3):537-545.
El consumo de AINE en estos pacientes desencadena síntomas como rinitis, conjuntivitis, laringoespasmo y broncoespasmo en los minutos posteriores a la administración del fármaco. Se ha asociado con atopia y se pueden encontrar niveles altos de inmunoglobulina E (IgE) total,6 sin embargo, estos hallazgos no reflejan una enfermedad mediada por IgE. La fi -
siopatología no está completamente explicada: dentro de lo reportado se ha encontrado presencia de infiltración eosinofílica en la vía aérea y alteraciones en el metabolismo del ácido araquidónico.7
Descripción de casos clínicos
Caso 1
Hombre de 56 años remitido a la Unidad de Alergología Clínica de la Universidad de Antioquia por cuadro de un año de evolución consistente en rinorrea, estornudos en salva, obstrucción, cefalea frontal, dolor en maxilares y escurrimiento posterior. Al momento de la consulta se encontraba en tratamiento con esteroide nasal, antihistamínico y antibiótico oral sin mejoría clínica. Había presentado un mes atrás un episodio de broncoespasmo, con exacerbación de los síntomas nasales posterior al consumo de naproxeno (derivado del ácido propiónico). Con cuadros similares previos con ibuprofeno (derivado del ácido propiónico) y diclofenaco (derivado del ácido acético), toleraba 1 g de acetaminofén (para-aminofenol). Entre sus antecedentes se encontraba una polipectomía (dos meses atrás) y una hospitalización por síndrome de Stevens-Johnson secundario al piroxicam (oxicam, derivado del ácido enólico). Al examen físico se observó mucosa nasal eritematosa, hipertrofia de cornetes, escurrimiento posterior seroso escaso y sin evidencia de nuevos pólipos nasales. Se realizó diagnóstico de EREA, se cambió el esteroide nasal y el antihistamínico y el paciente fue integrado a un protocolo de desensibilización con aspirina (derivado del ácido acetilsalicílico) de nueve horas de duración hasta llegar a una dosis total de 650 mg de aspirina.8 Se continuó dosis de mantenimiento de 650 mg cada 12 horas y disminución gradual.
Seis años después de la desensibilización, el paciente continuaba con una dosis de 81 mg de aspirina cada 12 horas, con seguimiento clínico anual, con adecuado control de los síntomas, sin evidencia de crecimiento de nuevos pólipos ni reacciones adversas al medicamento.
Caso 2
Mujer de 30 años atendida en la Unidad de Alergología Clínica de la Universidad de Antioquia por un episodio de angioedema en párpados, labios, lengua y paladar, asociado con tos y disnea minutos después del consumo de ácido acetilsalicílico, por lo que requirió adrenalina intramuscular, con mejoría a los 30 minutos. En la anamnesis refirió eventos similares con el consumo de diclofenaco y dipirona (pirazolona, derivado del ácido enólico), así como erupciones con el consumo de naproxeno, toleraba 1 g de acetaminofén. En la revisión por sistemas describió rinorrea, obstrucción, prurito nasal, cefalea frontal, escurrimiento posterior de tres años de evolución y asma de inicio un año atrás; en tratamiento con esteroide bronquial con control parcial. Entre los antecedentes personales, enfermedad por reflujo gastroesofágico y gastritis crónica de difícil control. Al momento del examen físico presentó mucosa nasal pálida, hipertrofia bilateral de cornetes sin evidencia de pólipos y escurrimiento posterior espeso. La espirometría reveló capacidad vital forzada (CVF) de 96 %, volumen espiratorio forzado al primer segundo (VEF1) pre de 97 % y post de 97 %, cambio de 0 y relación VEF1/CVF de 102 %. La tomografía computarizada mostró sinusitis crónica y en el reporte de otorrinolaringología se consideró necesario realizar cirugía endoscópica funcional de senos paranasales. Se diagnosticó anafilaxia y EREA. Se decidió no iniciar desensibilización por contraindicación de patología gastroesofágica de difícil control. Se inició la prescripción de 300 mg de omalizumab cada mes y estudios para establecer alternativa analgésica.
Se llevó a cabo prueba de provocación oral con meloxicam (oxicam derivado del ácido enólico), la cual fue negativa. El reporte quirúrgico indicó resección de pólipo en seno maxilar izquierdo. Al momento de concluir esta investigación se encontraba en seguimiento cada seis meses, con buena respuesta clínica, asintomática y sin evidencia de crecimiento de nuevos pólipos nasales.
Caso 3
Mujer de 33 años atendida en la Unidad de Alergología Clínica de la Universidad de Antioquia, con antecedentes de rinitis crónica desde la infancia, quien indicó empeoramiento de los síntomas nasales de seis meses de evolución. Refirió rinorrea hialina abundante, prurito nasal intenso, estornudos en salva y obstrucción nasal cíclica diaria asociados con anosmia y tos nocturna diaria. Negaba tos diurna, intolerancia al ejercicio o crisis asmáticas. Además, indicó que los síntomas se exacerbaban con el consumo de ácido acetilsalicílico, ibuprofeno y 1000 mg de acetaminofén. Toleraba etoricoxib (inhibidor COX-2 selectivo) y nimesulida (sulfonanilida). Al momento del examen físico se observó mucosa nasal violácea, rinorrea abundante, hipertrofia bilateral de cornetes, sin evidencia de pólipos nasales; con la espirometría se registró CVF de 83 %, VEF1 pre de 64 %, post de 71 %, con cambio de +14 y relación VEF1/CVF de 78 %. La prueba de punción cutánea fue negativa para todos los aeroalérgenos probados. Se diagnosticó EREA, por lo que se prescribió un antihistamínico oral, un esteroide nasal y un bronquial. Posteriormente se realizó prueba de provocación con meloxicam, la cual fue negativa. En el seguimiento, la paciente refirió buen control de los síntomas, sin crisis asmáticas o evidencia de crecimiento de nuevos pólipos nasales ni desarrollo de nuevas intolerancias a algún AINE.
Epidemiologia
El consumo de AINE se ha asociado con diferentes eventos adversos como el sangrado gastrointestinal y alteraciones en la función renal si la administración del fármaco es crónica. Las reacciones de hipersensibilidad han sido reportadas con menor frecuencia, llegando a ser de aproximadamente 1.9 %.9 Para Latinoamérica, los inhibidores de la COX-1 son la primera causa de eventos adversos tipo B (no predecibles), aproximadamente de 52.5 % según Járes et al.10
Dependiendo de la metodología empleada se estima que la EREA puede afectar entre 5.5 y 12.4 % de la población general, prevalencia que aumenta a 7.5 % en pacientes con asma, (11) llegando hasta 14.8 % en asma grave. Entre los pacientes con RSC crónica con pólipos nasales se calcula que puede ser de 8.7 %.11 La prevalencia de atopia se ha reportado en 84 %, según lo encontrado por Stevens et al.12
No se conoce la prevalencia exacta de los pólipos nasales en el EREA, ya que estos pueden ser pequeños, delgados y localizarse alrededor del meato medio y su visualización puede dificultarse en presencia de cornetes edematizados en la rinoscopia anterior y la aplicación de esteroides tópicos puede contraerlos, sin embargo, se considera que es de aproximadamente 100 %.7,13 Cuando se compararon pacientes asmáticos se encontraron pólipos en 10 % de los tolerantes y aproximadamente en 60 a 70 % de los no tolerantes.14 Las polipectomías y cirugía de senos paranasales fueron dos veces más frecuentes en los pacientes con EREA, con una edad al momento de la primera cirugía de 40 años contra 43 años cuando se compararon con pacientes con RSC con pólipos nasales tolerantes a la aspirina.12 Generalmente, los síntomas iniciaron entre la tercera y cuarta décadas de la vida, con predominio en el sexo femenino, aunque fueron más graves en los hombres. El curso de la enfermedad es crónica, con síntomas de difícil manejo y resistentes al tratamiento farmacológico.7
Fisiopatología
Actualmente, la fisiopatología de la enfermedad no está completamente entendida y aunque la identificación de un desequilibrio en un único mecanismo patológico pareciera ser poco probable,15 se ha sugerido un papel importante en la alteración de la regulación del metabolismo del ácido araquidónico (AA), por lo observado en grupos de individuos con asma y reacciones de hipersensibilidad versus individuos con asma tolerantes y sin asma.16 Los pacientes con EREA muestran incremento basal en los niveles de los productos de la activación de mastocitos (histamina, triptasa y leucotrieno (LT) E4) en fluidos nasal y urinario cuando se contrastan con pacientes asmáticos tolerantes.17 Adicionalmente, la administración de aspirina o de otros AINE lleva a incremento en las diferentes aminas vasoactivas, como también en el LTE4 .18
Se conoce que la prostanglandina (PG) E2, producto de la acción enzimática de la COX-1, actúa como un inhibidor de los eosinófilos y estabiliza los mastocitos mediante su receptor (receptor 2 de la PGE2).3,6 Aunque los inhibidores de la COX lleven a depleción de esta, el factor responsable de la alteración en la activación de los mastocitos y la producción de los cisteinil leucotrienos (cysLT) en la EREA continúa siendo desconocido.
El metabolismo del AA lleva a la producción de cysLT (LTC4, LTD4, LTE4) mediante la lipooxigenasa-5 (5-LOX) en presencia de la proteína activadora de la 5-LOX (FLAP) junto con la LTC4 sintetasa (LTC4S). Su acción es contrarrestada por el efecto de las lipoxinas, en especial lipoxina A4 (LXA4) y lipoxina B4 (LXB4), mediado por 12-LOX al antagonizar el receptor de leucotrienos16 (Figura 1). La alteración en esta homeostasis, con cambio en el balance hacia los mediadores proinflamatorios, lleva a disminución de la PGE2, con incremento en la producción de leucotrienos, cysLT y PGD2, con aumento de la broncoconstricción.

Figura 1 Metabolismo del ácido araquidónico. 5-HPETE = 5-ácido hidroperoxi eicosatetraenoico, 5-LOX = 5-lipooxigenasa, 12-LOX = 12-lipooxigenasa, COX = ciclooxigenasa, cysLT = cisteinil leucotrienos.
El leucocito a través de la LCT4S, las plaquetas y las células endoteliales puede producir directamente cysLT a través de un proceso conocido como biosíntesis celular. Debido a que las plaquetas carecen de 5-LOX y FLAP, al unirse a los neutrófilos, toman el LTA4 proveniente de los leucocitos y rápidamente lo convierten a LTB4 o LTC4 mediante la LTA4 hidrolasa (LTA4H) y la LTC4S, respectivamente.16 La hidrólisis secuencial de los aminoácidos en medio extracelular transforma el LTC4 a LTD4 (un broncoconstrictor más potente que la histamina) y a LTE4 (el metabolito más estable de los cysLT).6 En los pacientes con EREA, la producción de cysLT en el tejido bronquial se ha visto cinco veces más incrementada al compararse con la de pacientes con asma tolerantes y 18 veces mayor cuando se compara con la de individuos sanos,19 similar a lo observado en orina. Christie et al.17 han reportado niveles 10 veces mayores del LTE4 urinario en pacientes con EREA respecto a los pacientes asmáticos tolerantes. Además, el grado de incremento basal del LTE4 urinario se ha asociado con el grado de disminución del VEF1 durante la provocación oral.15,20
El efecto de los cysLT, principalmente LTC4 y LTD4, se ejerce a través de la interacción con sus dos receptores, CysLT1R y CysLT2R, y recientemente se ha descrito un tercero denominado GPR99, al cual se une el LTE4.21 Se ha observado que los pacientes con EREA tienen mayor reactividad de la vía aérea a este leucotrieno y pareciera que el GPR99 tuviera un papel importante en la secreción mucosa de la vía respiratoria.22 Aún no se conoce la ubicación exacta de este receptor en el humano.16
Como se mencionó, las prostaglandinas, principalmente la PGE2, son fundamentales para mantener el balance antiinflamatorio, sin embargo, la sobreproducción de la PGD2 se ha asociado con patogénesis de la enfermedad.
La interacción de la PGD2 con los diferentes receptores puede generar vasodilatación a través del receptor tipo 1 de prostaglandina D (CRTH1) y quimiotaxis de eosinófilos, basófilos, linfocitos del sistema inmune innato tipo 2, por medio del receptor tipo 2 de prostaglandina D (CRTH2); también ocasiona broncoespasmos mediante la interacción con el receptor de prostanoides T.23 Al igual que el LTE4, los metabolitos urinarios basales de la PGD2 se encuentran aumentados en los pacientes con EREA y se incrementan hasta cuatro veces posterior a la provocación oral, cuando se comparan con controles y sujetos asmáticos tolerantes.24 Este incremento se correlaciona positivamente con la caída del VEF1 y la presencia de síntomas nasosinusales. Los niveles extremadamente altos de PGD2 también se han encontrado en el sistema cutáneo y gastrointestinal de los pacientes con síntomas después del reto oral.24 La causa de este desequilibrio no se conoce, aunque se habla de una posible alteración en la respuesta inmune innata. La interleucina (IL) 33 y la linfopoyetina estromal tímica (TSLP) pueden activar los mastocitos, dirigir la inflamación eosinofílica y la producción de IgE en ausencia de una respuesta inmune adaptativa.25,26 Buchheit et al.26 reportaron mayor activación de la TLSP en el tejido polipoide de los pacientes con EREA cuando lo compararon con el de pacientes con pólipos tolerantes a la aspirina, activación que se correlaciona fuertemente con la expresión de la PGD2 sintetasa.
Aun cuando los mastocitos son una fuente importante de producción de leucotrienos en la enfermedad, pareciera necesitarse una fuente adicional que desencadene la activación de estas células. Actualmente hay evidencia que involucra la activación plaquetaria en la patogénesis de la enfermedad. En el tejido nasal-polipoide y sanguíneo de los pacientes con EREA se ha encontrado aumento de los agregados de leucocitos-plaquetas cuando se compara con el de los individuos asmáticos tolerantes y los controles. Estos agregados se correlacionan positivamente con el nivel urinario de LTE4.27 Además, Mitsiu et al.28 han reportado aumento en la expresión de los marcadores de activación de las plaquetas de sangre periférica en estos pacientes al compararlos con los asmáticos tolerantes y los pacientes con neumonía eosinofílica crónica; tanto la P-selectina como el CD63 se correlacionan positivamente con el porcentaje de adhesión plaqueta-eosinófilo y la concentración urinaria de LTE4. En cuanto a los eosinófilos, parecieran estar más en relación con su capacidad de cambiar el perfil antiinflamatorio de las células cuando actúan en sinergismo con los mastocitos, como lo reportan Steinke et al.3 Aunque no se ha observado un papel significativo de los basófilos como prueba diagnóstica debido a su baja sensibilidad, un estudio in vitro registró activación de estos por mecanismos diferentes a la IgE.29
Manifestaciones clínicas
Los pacientes con EREA generalmente experimentan una variedad de síntomas que pueden ir desde congestión nasal, rinorrea, sibilancias y broncoespasmo, incluso síntomas cutáneos y gastrointestinales en un subgrupo de pacientes.30 Usualmente se presentan entre 30 y 60 minutos (cuando se alcanza la concentración sistémica) y hasta tres horas posterior a la ingesta de dosis terapéuticas de aspirina u AINE3 tipo ibuprofeno, naproxeno, ketorolaco o de dosis altas de acetaminofén (> 1000 mg).15 En la mayoría de los casos, los inhibidores selectivos de la enzima COX-2 son bien tolerados, no obstante, existe un riesgo teórico con los inhibidores duales tipo meloxicam, especialmente a dosis altas.5
Los síntomas nasales pueden iniciar como rinitis leve relacionada con anosmia, la cual progresa a pansinusitis persistente grave y pólipos nasales con crecimiento rápido posterior a la polipectomía.31 Los primeros síntomas nasales son la obstrucción y la rinorrea crónica, generalmente de inicio en la tercera década de la vida.1. También pueden presentar dolor facial, goteo posnasal, cefalea, rinorrea purulenta, dolor dental, sensación de presión ótica y halitosis. Por la alteración del sueño, los pacientes pueden referir además somnolencia diurna.32 Se considera una enfermedad de la vía aérea superior grave cuando no se logra un adecuado control de los síntomas a pesar de un adecuado tratamiento médico.33
Los pólipos nasales de estos pacientes pueden protruir anterior en fosas nasales o posterior a nasofarige.32 La histología generalmente reporta abundante infiltrado eosinofílico, al igual que la citología de secreción nasal, en la que además se puede encontrar productos de la activación de eosinófilo como la proteína catiónica del eosinófilo (PCE). Típicamente estos pacientes requieren múltiples intervenciones quirúrgicas.34
El asma no siempre está presente, generalmente se inicia en la vida adulta, es persistente, grave y difícil de tratar. Se manifiesta entre uno a tres años después del desarrollo de los síntomas nasales, aunque puede aparecer concomitantemente o previo a los mismos. Las exacerbaciones son frecuentes y están relacionadas con los episodios de sinusitis.34 La función pulmonar muestra aumento del volumen residual con disminución de la capacidad de difusión, producto del incremento del remodelamiento bronquial.35,36 Estos pacientes se caracterizan por mayor número de visitas a los servicios de urgencias, hospitalizaciones y uso de esteroides orales.11,34
Es importante resaltar que se ha asociado hipersensibilidad al alcohol en el EREA, donde 77 a 83 % de los pacientes reportó síntomas respiratorios de vía a aérea superior o inferior asociados con el consumo del alcohol,9 generalmente posterior al inicio de la enfermedad. Esta característica clínica puede ayudar a aumentar el índice de sospecha.37
Diagnóstico
Una historia clínica de reacción de hipersensibilidad tipo exacerbación del asma o rinitis segundaria al consumo de AINE es altamente sugestiva de EREA, especialmente si hay anosmia y pólipos nasales, que se visualizan en la rinoscopia anterior, fibronasolaringoscopia o tomografía computarizada (TC). La probabilidad de tener un reto positivo es de 42 % en pacientes con historia de asma y pólipos nasales tolerantes a la aspirina, que aumenta a 80 % cuando se asocia con reacciones de hipersensibilidad y hasta a 82 % si hay dos o más reacciones, pero puede ser hasta de 100 % si las reacciones han sido graves.38 Sin embargo, 16 % de los asmáticos puede reportar una EREA por broncoespasmo segundario a la ingesta de aspirina,38 así como 15 % de los pacientes puede no ser consciente de su intolerancia.9 Pacientes con pólipos y asma puede que nunca hayan consumido algún AINE o su consumo sea ocasional, de forma que no perciban los efectos adversos. El uso de modificadores de los leucotrienos puede inhibir por completo las manifestaciones clínicas. Además, pacientes con una enfermedad grave pueden tener dificultades para percibir un cambio agudo de la función pulmonar tras el consumo de los medicamentos.9
A la fecha no existen pruebas in vitro que permitan confirmar el diagnóstico;1,35 por lo tanto, la prueba de oro confirmatoria continúa siendo la provocación con inhibidores de la COX-1.1,2,32,35 Esta prueba de provocación se realiza principalmente con aspirina, aunque también existen protocolos con otros AINE como ketorolaco.30 La vía de administración puede ser oral, inhalación nasal, bronquial e intravenosa.34,39 La sensibilidad, especificidad, valores predictivos positivos y negativos de estas pruebas varían según el método utilizado. La provocación oral tiene una sensibilidad de 89 % y una especificidad de 93 %, con un valor predictivo negativo de 77 %.40 En la provocación nasal estos valores cambian según el medicamento usado. La sensibilidad se encuentra entre 78 y 80 %, la especificidad entre 64 y 92.5 % y el valor predictivo negativo entre 64 y 89 % (cuadro 2).30,41,42
Cuadro 2 Sensibilidad, especificidad y valores predictivos de las diferentes pruebas de provocación, según la vía utilizada

*Provocación nasal con ketorolaco.
Para el reto oral, en el método de Stevenson39 se inicia con dosis baja de aspirina (30 mg), la cual se va incrementando cada dos a tres horas por 72 horas hasta completar los 1000 mg. Actualmente existen protocolos de menor duración en los cuales se administran cuatro dosis, con incremento cada 90 minutos hasta llegar a una dosis de 325 mg.9,8 Antes de la administración de las dosis incrementales se evalúa la función pulmonar. El paciente debe presentar un adecuado control del asma, con un VEF1 mínimo de 1.5 L o > 70 % del predicho35,39 para la realización de la prueba. Debe haber suspendido los antihistamínicos y los medicamentos modificadores de los leucotrienos siete días antes. La prueba se considera positiva si hay una caída del VEF1 > 15 % con respecto al basal o aumento o presencia de al menos dos de los siguientes síntomas: congestión nasal, rinorrea, sibilancias, prurito nasal u ocular. La dosis inmediatamente por debajo de la dosis de reacción en la provocación puede ser usada como de inicio en una posterior desensibilización, si se requiere35 (Cuadro 2).
La provocación nasal con ketorolaco es otra opción diagnóstica, especialmente si hay contraindicaciones para el reto oral o bronquial,41 este último es mejor y más rápido. No debe realizarse en pacientes con obstrucción nasal grave, incluyendo poliposis significativa. Se considera el método más seguro, sin embargo, existe el riesgo de reacciones sistémicas y broncoespasmo.30,41
Manejo
El manejo de la EREA es multidisciplinario y depende del estado y la gravedad del paciente;32 incluye educar al paciente, evitar algunos AINE, tratamiento médico o quirúrgico para el control de los pólipos nasales, tratamiento farmacológico para el control del asma y desensibilización con aspirina en individuos seleccionados.1,7,32
Es importante que el paciente reconozca la naturaleza de su enfermedad. El médico debe asegurar que se comprenda la relación temporal de las exacerbaciones de la rinitis y el asma y el deterioro de la función pulmonar con el consumo de AINE, por lo cual es necesaria su evitación. Medicamentos como antigripales también deben evitarse. El asma puede tener otros exacerbantes, por lo cual se debe garantizar el uso continuo del tratamiento controlador. Además, al paciente se le debe ofrecer alternativas analgésicas seguras a través de pruebas de provocación,43 como acetaminofén (< 1000 mg), inhibidores parciales de COX (meloxicam, nimesulida) o inhibidores selectivos de la COX-27 (Cuadro 3)39,44,45,46
Cuadro 3 Clasificación de los AINE basada en el porcentaje de inhibición de las enzimas COX-1 y COX-239,44,45,46
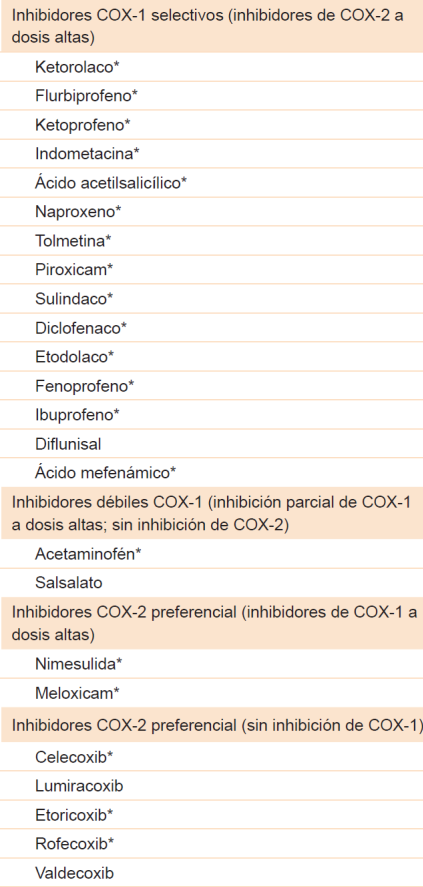
*Disponible en Colombia. Tomado y traducido de Lee RU, Stevenson DD. Aspirin-exacerbated respiratory disease: Evaluation and management. Allergy Asthma Immunol Res. 2011;3(1):3-10.
Ante de la polipectomía es necesario que el paciente haya recibido tratamiento farmacológico,32,47 que comprende lavados nasales, esteroides tópicos y en ocasiones ciclos cortos de esteroides orales. Los modificadores de los leucotrienos, por interactuar en la vía de AA, tienen impacto en el tratamiento del asma como también en la RSC con pólipos nasales.48 Tanto los antagonistas del cysLT1R (montelukast, zafirlukast y pranlukast) como los inhibidores de la 5-LOX (ziluetón) mejoran la función pulmonar, disminuyen la necesidad de medicamento de rescate, mejoran la puntuación de síntomas y de la calidad de vida.25,35 El montelukast (único disponible en Colombia) ha demostrado una mejoría de los síntomas nasales con un aumento en la escala de síntomas de 72 %,48 aunque no se ha observado mayor impacto en la reducción de los pólipos.32,49 La respuesta en la función pulmonar es similar a la encontrada en los pacientes asmáticos tolerantes.
Actualmente existen algunos reportes de casos50,51 y ensayos clínicos que han evaluado el efecto de anticuerpos monoclonales como el omalizumab en la EREA. Philips-Angles et al.52 han reportado disminución en el número de exacerbaciones, mejoría de la calidad de vida y restauración de la tolerancia a la aspirina en pacientes con asma grave de difícil control. Gevaert et al.53 encontraron mejoría de los síntomas nasales y reducción significativa en la puntuación total de pólipos nasales por endoscopia, confirmada en la tomografía mediante la puntuación de Lund-Mackay luego de 16 semanas de tratamiento, si bien la reducción evaluada en la tomografía no fue estadísticamente significativa en el grupo de asma no alérgica.
El mecanismo del efecto del omalizumab en estos pacientes no está claro. Se habla de una posible producción local policlonal de IgE desencadenada por la enterotoxina del Staphylococcus aureus en la mucosa nasal.53,54 Hayashi et al.55 han encontrado reducción urinaria del LTE4, el metabolito urinario de la PGD2, el 9α11β prostaglandina F2 (PGD2M) después de 12 meses de tratamiento, por lo que este anticuerpo monoclonal podría inhibir la activación del mastocito y la sobreproducción de leucotrienos en estos pacientes.55 Aún se requieren más estudios que confirmen estos hallazgos y respalden su uso en el EREA.
A pesar de los tratamientos mencionados, numerosos pacientes no logran el control de sus síntomas, presentan progresión de la enfermedad y requieren múltiples intervenciones quirúrgicas.31,56,57 La desensibilización con aspirina ha mostrado ser una terapia efectiva para el control a largo plazo de los pólipos nasales,58,59 hay evidencia suficiente que demuestra una mejoría en la calidad de vida, el olfato y la puntuación de síntomas nasales y bronquiales, además reduce la necesidad de uso de esteroides sistémicos, así como los episodios de sinusitis infecciosa.57,58,60 Su objetivo es inducir un estado temporal de tolerancia al medicamento, sin embargo, este debe ser administrado diariamente para conservar ese estado.56,61 La suspensión del medicamento mayor a 72 horas requiere una nueva desensibilización. El mecanismo fisiopatológico por medio del cual ejerce sus efectos aún no es entendido, pero estudios recientes han sugerido inhibición directa de la tirosina cinasa y de las señales del transductor de señal y activador de la transcripción 6 (STAT6), llevando a una inhibición de la producción de IL-4.18,62
Las indicaciones para su realización son las siguientes:7,56,57,59,61
Pacientes con RSC con pólipos nasales resistentes al tratamiento farmacológico que requieran más de una intervención quirúrgica. La evidencia es menor para el control de los síntomas bronquiales.
Pacientes con necesidad de aspirina para el manejo de la enfermedad cardiovascular.
Pacientes que requieran AINE en el tratamiento de enfermedades inflamatorias crónicas como las reumatológicas.
Idealmente, la desensibilización debe llevarse a cabo entre dos y cuatro semanas después de la polipectomía. Es un procedimiento con riesgo potencial de producir broncoespasmo, laringoespasmo, síntomas cutáneos y gastrointestinales, por lo que debe ser ejecutado por un médico especialista en el área y en un lugar adecuadamente equipado. Existen varios protocolos que se diferencian por los tiempos de intervalo entre dosis,59 generalmente se inicia con 20 a 40 mg de aspirina, la cual se va incrementando cada 90 minutos, durante un periodo de nueve horas hasta llegar a 325 mg sin que se presenten reacciones,8,39,47,56,63 dosis en la que el protocolo de desensibilización se completa como se ve en la Figura 2. La dosis óptima de mantenimiento no se ha establecido, pero debe ser individualizada en cada paciente.8,39 Se recomienda que se alcance una dosis inicial de 1300 mg de aspirina (650 mg dos veces al día) durante un mes, al término del cual si hay mejoría de los síntomas se puede comenzar un descenso. Existen diferentes esquemas de reducción progresiva: se puede disminuir a una tableta de 325 mg mensualmente, pudiendo ser 650 mg en la mañana y 350 mg en la noche o 350 mg dos veces al día. 8,39,56 Los pacientes que no toleren el descenso presentarán empeoramiento de los síntomas en las dos semanas siguientes.9 Dosis de 81 mg pueden ser suficientes para mantener el estado de tolerancia en los pacientes que requieran cardioprotección, sin embargo, es una dosis subóptima para el control de la inflamación en la vía respiratoria.8
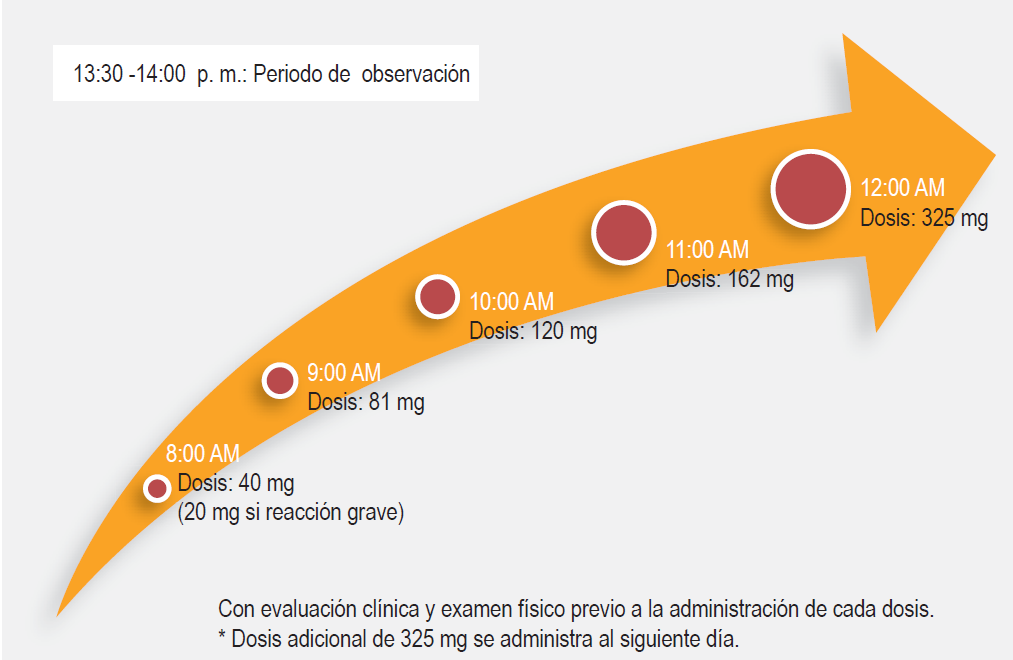
Figura 2 Protocolo de desensibilización de nuevas horas para pacientes con enfermedad respiratoria exacerbada por aspirina. Se realiza evaluación clínica y examen físico antes de la administración de cada dosis. Se administra una dosis adicional de 325 mg al siguiente día.
Los efectos secundarios de la aspirina, como la epigastralgia, el sangrado gastrointestinal, el sangrado de otro origen (epistaxis) y la urticaria constituyen las principales causas de suspensión de la dosis de mantenimiento. Se han presentado en 14 % de los pacientes que continuaron con dosis de 650 mg dos veces al día durante un año.60
Conclusiones
La EREA es una enfermedad crónica, compleja, que requiere un alto índice de sospecha para su diagnóstico, especialmente en los pacientes con asma grave resistente al tratamiento. Su fisiopatología aún no se comprende del todo, hay amplia evidencia que soporta una sobreproducción de los cysLT y la PGD2 al presentarse los síntomas. Nuevos datos señalan un papel clave de la respuesta inmune innata en el desarrollo de la enfermedad, así como la influencia celular en la persistencia de la inflamación crónica.
Los inmunomoduladores tipo omalizumab han mostrado una respuesta favorable en el control de los síntomas, con un efecto prometedor en la progresión de los pólipos nasales. Se necesitan estudios adicionales que permitan ampliar estos hallazgos y establecer nuevas opciones terapéuticas. La provocación con aspirina y otros AINE continúa siendo la prueba diagnóstica confirmatoria. La desensibilización es una herramienta útil y eficaz en el manejo de estos pacientes, sin embargo, debe ser empleada cuando ya no existan otras opciones terapéuticas y en pacientes seleccionados, debido al riesgo a largo plazo del uso crónicos de inhibidores de la COX-1.











 nueva página del texto (beta)
nueva página del texto (beta)



