Introducción
Sanz y Martoreel encontraron que la incidencia de alergia a la proteína de la leche de vaca (APLV) en el primer año de vida fue de 0.36 %, y que la probabilidad de desarrollarla en un lactante en el que existen 2 antecedentes familiares de primer grado de enfermedad atópica es de 3.8 %.1
Sánchez PM reportó que en el mundo la prevalencia de la alergia alimentaria en niños es de 1 a 3 % aproximadamente, proporción que disminuye a medida que la edad se incrementa. En el orbe, la incidencia de la APLV es de 1 a 12 % y la prevalencia en países desarrollados es de 2 a 5 %; en niños holandeses, la prevalencia es de 2.8 %; en la década de 1990 se reportó una prevalencia de 2.2 % en niños daneses durante el primer año de vida; en niños mexicanos de 5 a 7 %.
En general, la incidencia de alergias es de 12 % cuando los padres no presentan antecedentes de atopia, de 20 % cuando uno la presenta, de 32 % cuando hay antecedente de sibilancia atópica en un padre, de 43 % cuando ambos padres la presentan y de 72 % cuando ambos padres tienen igual tipo de enfermedad alérgica.2,3
En la leche se encuentran más de 25 proteínas capaces de generar reacción alérgica. De estas, las más frecuentes son las proteínas termolábiles (albúmina sérica bovina, alfalactoalbúmina, betalactoglobulina) y las termorresistentes (caseínas).4,5 La APLV es el problema alérgico dominante en el primer año de vida.6 Estudios prospectivos de varios países demuestran que aproximadamente 3.8 % de los neonatos experimentan reacciones de hipersensibilidad a las proteínas de la leche de vaca durante los primeros 12 meses de vida.3,6 Las APLV son más comunes en la infancia; su incidencia oscila entre 1.8 y 7.5 %, debido a los diferentes criterios diagnósticos usados.6
Una forma natural y efectiva de disminuir la probabilidad de reacción alérgica a la proteína de la leche de vaca (PLV) es el amamantamiento, pues la leche materna (LM) es el alimento idóneo y debería ser el único brindado hasta los 6 meses de edad debido a su composición nutricional y valor inmunológico.7 A pesar de ello, en numerosas ocasiones la LM no se brinda de manera exclusiva o no se suministra debido a diversas razones argumentadas por las madres: rechazo por parte del lactante, insuficiente producción o falta de tiempo debido a las actividades laborales; actualmente esta última es una de las principales causas debido al alto porcentaje de mujeres que trabajan y a que la legislación laboral estipula licencia de unos meses a las mujeres trabajadoras para estar con sus hijos, quienes ante la ausencia de sus madres deben ser alimentados con leches industrializadas o fórmulas infantiles (FI) o leche de vaca pasteurizada (LVP).8
En la reunión de expertos (Organización Panamericana de la Salud, Organización Mundial de la Salud y Centro de Estudios sobre Nutrición Infantil) se acordó que cuando sea imposible alimentar a un niño con LM se deben usar sucedáneos con alto valor nutritivo. La primera opción son las FI y como segunda opción, la leche de vaca fortificada.9 Sin embargo, debido al alto costo de las FI, especialmente para la población de escasos recursos, estas se preparan de manera inadecuada (sobrediluidas), por lo que no cubren todas las necesidades nutricionales del niño; en ocasiones, las familias se ven obligadas a la alimentación artificial con leche de vaca sin modificar (LVSM), es decir, con todos sus macro y micronutrientes, la cual tampoco es apta para el lactante.9
Se ha registrado que los lactantes alimentados con LVSM presentan problemas de salud, entre ellos la anemia. Esta patología se presenta en el lactante debido a que la LVP sin fortificar es deficiente en hierro,10,11,12 cuya disponibilidad es mucho menor en comparación con el de la LM.13,14 Para evitar esta deficiencia nutricional, la European Society for Paediatric Gastroenterology, Hepatology and Nutrition, la Organización Mundial de la Salud y la Asociación Americana de Pediatría recomiendan fortificar con hierro las FI y la LV. Otra potencial repercusión en los lactantes que reciben alimentos distintos a la LM es el sangrado intestinal.15,16,17,18 Según Bowman13 y Cardona,15 la LVSM puede causar deshidratación y recarga renal en los lactantes debido a su alto contenido proteínico (3 g/100 mL)19 comparado con el de la leche materna (1.2-1.9 g/100 mL),20 ya que se brinda un excesivo aporte de proteína a un organismo no preparado para procesarlo.13,15
Finalmente, otra posible patología y más trascendental es la alergia a las proteínas de la LV sin modificar,7 debido a que en los primeros 6 meses de vida los lactantes son más susceptibles a los alérgenos por inmadurez del sistema inmunológico y de la estructura gastrointestinal: mucosas permeables,21 baja producción de ácido clorhídrico (solo 10 % de la producción de un adulto), baja producción de numerosas enzimas digestivas (que afecta de manera directa el proceso digestivo y de absorción) y pancréaticas, lo que no permite la activación de cimógenos y limita la proteólisis y la lipólisis, permitiendo el paso de proteínas insuficientemente degradadas a la mucosa intestinal o disminuyendo la absorción de estas.15,22 El proceso de maduración de este sistema lleva aproximadamente 12 meses.
Algunos autores concluyen que si bien la digestión y absorción de proteínas es eficiente en los recién nacidos, la ingesta excesiva de proteínas implica un sobreesfuerzo renal con consecuencias negativas.15 En las FI se procura que el contenido y tipo de proteína sean equivalentes a las de la LM para evitar reacciones alérgicas en los lactantes, las cuales pueden repercutir en su salud y bienestar físico.
Con el objetivo de contribuir a disminuir el riesgo de déficit nutricional y los problemas inmunológicos en los lactantes, bajo la hipótesis de que la reacción alérgica del lactante está más relacionada con la cantidad de proteína que con su tipo, elaboramos una FI diluida en LV, con el aporte adecuado de nutrientes y de bajo costo, para que sea accesible a población con menores recursos económicos.
Métodos
Fase 1. Diseño nutricional del producto
El contenido nutricional de la FI se estableció tomando como base la normatividad internacional23 para alimentos de lactantes respecto a macronutrientes (proteínas, grasas y carbohidratos) y micronutrientes, específicamente aquellos que podían ser afectados con el proceso de elaboración o cuyo contenido es bajo en la LV, como el hierro.
Fase 2. Elaboración industrial del producto
Materiales: LV sin higienizar, maltodextrina, aceite de canola, micronutrientes aminoquelados (hierro y cinc), lecitina de soya y monoglicéridos, cuyas cantidades varían según la necesidad nutricional del lactante y la edad: de 0 a 5 meses 29 días y 6 a 12 meses.
Equipo: Pasteurizador de placas con capacidad de 250 L/hora, homogeneizador con capacidad de 4 m3/hora, acumulador de hielo con capacidad de 560 lb y caldera con capacidad de 3.7285 kW. La línea de proceso fue en sistema cerrado y el envasado se hizo de forma manual conforme las “buenas prácticas de manufactura”.
Procedimiento: se produjeron 200 L. Todos los ingredientes se mezclaron y posteriormente se agitaron hasta su total incorporación. La mezcla obtenida se homogeneizó a una presión de 1500 PSI, luego se pasteurizó a 75 °C por 15 segundos y se envasó a 7 °C en garrafas de PET con capacidad de 2 L, que se conservaron en refrigeración a 4 °C.
Pruebas de calidad
Microbiológicas
Las pruebas microbiológicas se realizaron conforme a las resoluciones 0616 (la cual aplica para todas las leches que se expenden en Colombia) y 11488 de 1984 (cuyo campo de aplicación es en los alimentos para lactantes). Se realizó recuento de microorganismos aerobios mesófilos, hongos, levaduras, bacterias coliformes fecales y totales, Staphylococcus aureus coagulasa positiva, Bacillus cereus y Salmonella sp/25 g.
Fase 3. Efecto de la FI en los 7 lactantes
Determinación del tamaño de la muestra
La fórmula empleada para comparación de medias en medidas repetidas fue la siguiente:
Esta fórmula se emplea para la comparación de parámetros antes y después de la realización de una intervención. El tamaño de la muestra fue de 1.5, es decir, 2 niños.
Conforme a la información obtenida en la prueba piloto se determinó hacer el cálculo del tamaño muestral para el estudio ex vivo con el software Epidata versión 4, con intervalo de confianza de 95 %, potencia de 90, desviación estándar de la diferencia de 5.4 y diferencia media entre valores basales y posteriores de 14.3. El software indicó un valor de 2.9, es decir, 3 niños.
Determinación de hemoglobina y hematócrito
Se midió hemoglobina y hematócrito a cada lactante antes y después de la administración de la FI. Se tomaron 2 mL de sangre en tubos para evitar hemólisis, los cuales fueron trasportados en forma vertical, bien tapados para evitar evaporaciones o posible contaminación en un periodo no mayor a 4 horas antes de realizar la prueba en el laboratorio clínico. Se consideraron valores de referencia para hemoglobina entre 9 y 14.6 g/dL y para hematócrito, entre 34 y 38 %.
Método para medir expresión del marcador de membrana CD63 en basófilos
A pesar de ser muy específicas y con una sensibilidad cercana a 100 %, las técnicas tradicionales para diagnosticar la hipersensibilidad tipo I o mediada por IgE no son rápidas y algunas no son seguras.24 Por el contrario, el recuento de CD63 en los basófilos es un método rápido y seguro para el diagnóstico de hipersensibilidad inmediata.25 Sin embargo, los basófilos corresponden solo a 1 % del total de los leucocitos en sangre periférica y su estudio es complejo debido a que su purificación es difícil.25 Estas células granulocíticas expresan en su membrana el receptor de alta afinidad para la IgE (FceRI).26,27 y su activación se debe al contacto de la IgE con el receptor (FcrRI).
Los estudios de la expresión del antígeno de membrana CD63 en los basófilos mediante citometría de flujo como método para su cuantificación han permitido evaluar la activación in vitro y ex vivo de los basófilos por diferentes alérgenos, lo que ha hecho posible discriminar poblaciones de pacientes alérgicos y no alérgicos.28,29 Por este motivo, la técnica es reconocida como una de las mejores para detectar población con tendencia a padecer alergias.
Se utilizó el kit Flow Cast® (Bühlmann Laboratories, Suiza), para medir mediante citometría de flujo la activación de basófilos en sangre a partir de la expresión de proteína CD63 en su membrana.
La cuantificación del porcentaje de expresión de CD63 se realizó mediante la adición de anticuerpos monoclonales para CD63 humano, marcados con isoticianato de fluorescencia (antiCD63-FITC) y para el receptor CCR3 humano, marcado con ficoeritrina (antiCCR3-PE). Debido a que el CCR3 es expresado también por los eosinófilos y los basófilos, la cuantificación de CD63 se realizó en los granulocitos.
Muestras: controles negativos (tubos con PB y background), controles positivos (tubos con antifMLP y antiFceRI), tubos con sangre de un individuo con alergia a la PLV y sangre de un individuo no alérgico; estos fueron estimulados con el nuevo producto con LV con las siguientes concentraciones: 100, 50, 25, 12.5 y 6.25 %.
Por tubo se adicionaron 50 mL de los estímulos correspondientes y posteriormente a cada tubo se adicionó 100 mL de buffer de estimulación y 50 mL de sangre del individuo y se procedió a la mezcla. Por último, se adicionaron 20 mL de reactivo de tinción y se procedió a mezclar nuevamente. Los tubos se incubaron durante 15 minutos a 37 °C mediante calentamiento indirecto por convección térmica desde medio líquido (“baño maría”).
Los eritrocitos se lisaron con el reactivo del kit y se incubaron durante 10 minutos a una temperatura de 28 ± 2 °C; posteriormente, los tubos se centrifugaron durante 5 minutos a 500 rpm, se decantó el sobrenadante, se suspendió el botón celular con 300 mL de tampón de lavado y cada tubo se volvió a mezclar. Cada tubo fue llevado al citómetro para la lectura de los datos. El procedimiento de estandarización requirió 5 repeticiones. Se determinó la activación de basófilos en cada lactante antes y después de iniciar la administración de la FI.
Adquisición de datos por citometría de flujo
Se realizó en un equipo Facs Canto II® (BD BioSciences, Estados Unidos) y se usó el programa DIVA para identificar la población de basófilos mediante la combinación del tamaño celular relativo (forward scatter, FSC) y granularidad relativa (side scatter, SSC). Una vez identificada la población de basófilos, se evaluó porcentualmente la expresión de CD63. Se consideró la variable porcentaje de expresión de CD63 en basófilos, las medias y la desviación estándar y como prueba de significación estadística se utilizó la diferencia de promedios muestrales con base en la t de Student.
Se delimitó una región P1 sobre FSC versus SSC, en el área que comparten los linfocitos y los basófilos. Los basófilos se diferenciaron de los linfocitos por la marcación específica y se delimitaron en la región P2; la activación de los basófilos se delimitó en una tercera área denominada Q2 (Figura 1).
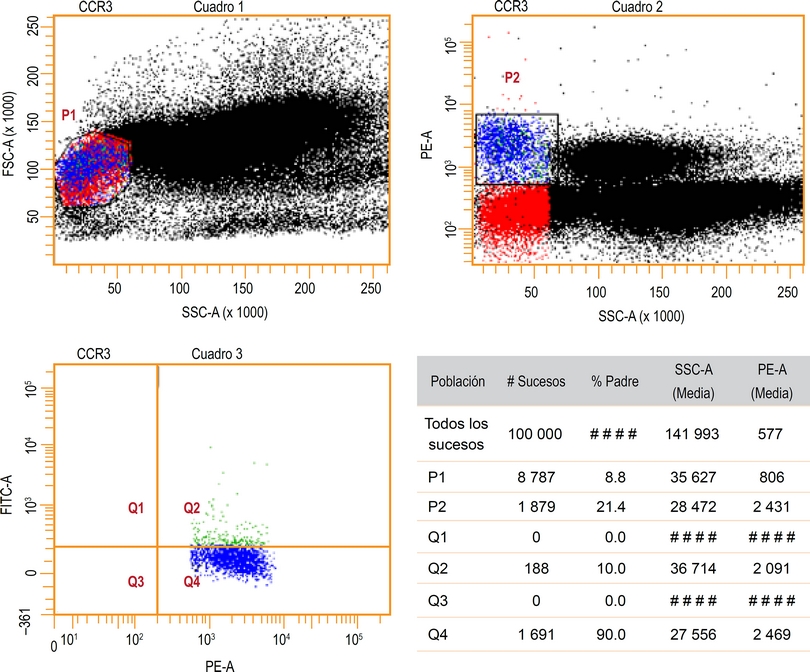
Figura 1 Reporte de una prueba de citometría de flujo para evaluar la activación de basófilos. En el Cuadro 1 se delimitó la región P1 sobre FSC (tamaño de la célula) versus SSC (granularidad de la célula) en el área que comparten los linfocitos y los basófilos. En el Cuadro 2 se ve delimitada la región P2, donde los basófilos se diferencian de los linfocitos por la marcación específica. En el Cuadro 3 se delimitó la región Q2, donde se ve la activación de los basófilos. Las muestras fueron: control negativo (basal), control positivo (con antiFce), estímulo con LV a 100 % y con la nueva FI. El punto de corte para determinar alergenicidad fue > 15 % en la expresión de CD63.
Criterios de inclusión y exclusión
Lactantes entre 1 y 10 meses, no alérgicos a la proteína de la LV, independientemente de los antecedentes heredofamiliares de atopia y patologías como infección diarreica aguda, reflujo esofágico o anemia, siempre y cuando no interfieran con el diagnóstico de APLV.
Lactantes con alimentación complementaria o suplementaria con FI comercial.
Lactantes sin patologías graves (cáncer, desnutrición grave, enfermedades respiratorias, fibrosis quística, enfermedad renal, asma, y enfermedades con tratamientos nutricionales específicos).
Lactantes que no estuvieran consumiendo proteína de leche de vaca y que no fueran atópicos.
Aprobación escrita por parte de los padres para incluir a al lactante en la investigación, previa información del objetivo, procedimiento, riesgos y beneficios.
Se vigiló el cumplimiento de la intervención con valoración del consumo del producto por medio de una bitácora, en la que se reportaban los alimentos que el lactante no consumía o los que formaban parte de su alimentación. Se consideró cumplimiento con un consumo de 80 % de lo establecido en el plan de alimentación. Se controlaron eventos adversos mediante entrevistas semanales con las madres o cuidadores de los niños. La intervención se llevó a cabo durante 2 meses.
Antes de iniciar la intervención, un pediatra inmunólogo evaluó a los niños, para descartar signos clínicos de alergenicidad como dermatitis atópica, erupciones, distensión abdominal, problemas respiratorios relacionados con la alergia causada por la PLV. Durante todo el periodo de estudio se realizó valoración clínica por parte de este profesional.
Se tuvo presente la Declaración de Helsinki 2002, la Resolución 008430 de 1993 del Ministerio Nacional de Salud, el Decreto 2378 de 2008 y la aprobación de varios comités de ética.
Se efectuó análisis descriptivo y comparativo; se empleó t de Student y U de Mann-Whitney para comparar variables cuantitativas paramétricas y no paramétricas entre dos grupos, así como chi cuadrada para diferencias estadísticamente significativas entre grupos o procedimientos. Se consideraron diferencias significativas con p < 0.05.
Resultados
Bromatológicos. El reporte se da por 100 calorías. Respecto a los macronutrientes como proteínas (2 g) y carbohidratos (7.2 g), el producto cumplió con el rango establecido por el Codex, sin embargo, la grasa (4.5 g) se encontró 0.5 g por encima del valor máximo. En relación con los micronutrientes, el hierro (0.68 mg), calcio (98.5 mg) y cinc (1.31 mg) se encontraron por encima del límite mínimo (hierro 0.3 mg, calcio 34 mg, cinc 0.34 mg), pero dado que la normatividad no especifica valores máximos para estos, se dio cumplimiento con los contenidos mínimos.
Microbiológicos. Los resultados estuvieron por debajo de las especificaciones de la norma: microorganismos aerobios mesófilos < 110 versus 1000 UFC/g, hongos y levaduras < 10 versus 300 UFC/g, bacterias coliformes totales < 3 versus 11 NMP/g, bacterias coliformes fecales < 3 versus > 3 NMP/g, Staphylococcus aureus coagulasa positiva < 100 versus > 100 UFC/g, Bacillus cereus < 100 versus 200 y Salm onella sp ausencia versus ausencia. La FI mantuvo su estabilidad microbiológica hasta el día 6, cuando se presentó aumento de los microorganismos aerobios mesófilos (2900 UFC/g), periodo semejante al tiempo de vida de anaquel de la LVP. Los datos indicaron que la FI es un producto inocuo hasta el 6 día.
Resultados ex vivo en los lactantes
Los 7 lactantes iniciaron la investigación con valores de hemoglobina dentro de los rangos de referencia (entre 9 y 14.6 g/dL), sin embargo, 3 presentaron hematócrito por debajo (entre 34 y 38 %). Después de 2 meses de consumir la nueva fórmula, la hemoglobina continuó en niveles adecuados en los 7 lactantes y solo en uno el valor del hematócrito no mejoró. En ningún lactante bajaron los niveles de hemoglobina o hematócrito mientras recibió la FI (Cuadro 1).
Cuadro 1 Hemoglobina y hematócrito en cada lactantes antes y después de finalizar la intervención con una nueva f
| Parámetro | Lactante 1 | Lactante 2 | Lactante 3 | Lactante 4 | Lactante 5 | Lactante 6 | Lactante 7 | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 1 | 2 | 1 | 2 | 1 | 2 | 1 | 2 | 1 | 2 | 1 | 2 | |
| Hemoglobina (mg/dL) | 9.9 | 11.32 | 10.72 | 11.22 | 10.12 | 10.92 | 11.8 | 11.6 | 12.2 | 12.4 | 12.1 | 12.6 | 11.5 | 11.5 |
| Hematócrito (%) | 30.92 | 34.62 | 33.12 | 34.12 | 34.12 | 34.92 | 34.5 | 34.8 | 35.1 | 35.9 | 34.7 | 36.7 | 33.9 | 33.9 |
En el Cuadro 2 se muestra que antes de iniciar el estudio, la expresión del CD63 con la nueva fórmula fue baja (< 15 %) en 57.1 % de los lactantes (4 de los 7) y alta en 42.9 % (> 15 %); al finalizar siguió baja en 57.1 % y alta en 42.9 %. Con la chi cuadrada no hubo diferencias estadísticamente significativas en la expresión del CD63 antes ni después del estudio (prueba de McNemar: significación exacta de 1.0). Ningún lactante manifestó síntomas de reacción alérgica como dermatitis atópica, erupciones, distensión abdominal o problemas respiratorios relacionados o no con la PLV.
Cuadro 2 Expresión de CD63 en lactantes antes y después de la intervención con una nueva fórmula alimenticia infantil
| Baja expresión CD63 | Alta expresión CD63 | Total | |||
|---|---|---|---|---|---|
| Baja expresión CD63 ( < 15 % ) | 2 | 50.0 | 2 | 50.0 | 4 |
| Alta expresión CD63 (> 15 %) | 2 | 66.7 | 1 | 33.3 | 3 |
| Total | 4 | 57.1 | 3 | 42.9 | 7 |
Prueba de chi cuadrada (McNemar); significación de 1.0
Discusión
La nueva FI mostró ser inocua microbiológicamente. Los análisis indicaron cumplimiento de la normatividad exigida y que la vida útil del producto es similar a la de la LVP, sin embargo, su manejo higiénico domiciliario debe ser estricto, pues una inadecuada manipulación causa contaminación y posible enfermedad en el lactante, como puede ocurrir con otras FI en polvo si no se manipulan higiénicamente.
Con la nueva FI se buscó un alimento que aportara al lactante los nutrientes necesarios para su adecuado desarrollo y crecimiento, según la normatividad internacional,23 objetivo logrado según los resultados bromatológicos.
La LM y la LV son pobres en hierro, aunque la biodisponibilidad es mayor en la primera (70 versus 30 %).20 La deficiencia de hierro es una de las principales carencias nutricionales de mayor prevalencia en los países en desarrollo y una de las causas principales de anemia en el humano. Se cree que en América Latina existen 100 millones de personas con anemia; los lactantes, niños, mujeres en edad fértil y embarazadas son los grupos más vulnerables.30
A diferencia de los niños nacidos a término alimentados hasta los 6 meses exclusivamente con LM, los lactantes cuyo alimento base es la LVSM pueden presentar mayor riesgo de padecer anemia y las consecuentes afectaciones en el adecuado desarrollo, capacidad cognoscitiva y crecimiento, ya que el contenido de hierro de esa leche es bajo y pobremente absorbido.30
Entre las políticas nutricionales mundiales está la fortificación de la LV destinada para alimentación de lactantes y niños, por esta razón y por los efectos colaterales de la deficiencia de hierro en la salud de los lactantes, la nueva FI fue fortificada con hierro para mantener o mejorar la hemoglobina y el hematócrito.
En la investigación que se presenta se buscó comprobar que la reacción alérgica en esta población depende más de la cantidad de proteínas que del tipo.
El proceso digestivo y de absorción de las proteínas en el recién nacido a término y sano comienza en el estómago y en la primera porción del duodeno por las enzimas pancreáticas, pero a menudo no es eficiente debido a inmadurez fisiológica o al exceso de proteína brindada en la alimentación, razón por la cual parte de las proteínas puede quedar subdivida en grandes partículas que atraviesan la permeable mucosa intestinal del lactante, lo que permite el paso de células inmunológicas de la LV que pueden favorecer la aparición de alergias alimentarias, desencadenando la respuesta inmune de hipersensibilidad tipo I.5,6,31
La cantidad de proteínas que contiene la nueva FI que proponemos equivale a 33 % menos de lo aportado por la LVSM y es la que se estipula en la normatividad internacional al respecto, por consiguiente, es la requerida para el adecuado desarrollo y crecimiento de los lactantes.
En la actualidad solo hay estudios que relacionan o evalúan el tipo de leche o proteína consumida y el desarrollo de alergia; los que demuestran alergenicidad a las proteínas de la LV no cuantifican la proteína brindada, aun cuando en la literatura especializada se establece que la dosis del antígeno es básica para el desarrollo de la alergia, principio que sustenta que es la cantidad de proteína la que causa la alergia y la falta de desarrollo fisiológico gastrointestinal del lactante, más que sus características fisicoquímicas.
Si bien el desarrollo de las alergias alimentarias también puede atribuirse a factores como antecedentes de atopia, baja producción de Th1, niveles de IgE en cordón umbilical al momento del nacimiento, eosinofilia en sangre periférica, proteína catiónica de los eosinófilos, determinación de IgE específica a proteínas, inicio de alimentación sólida antes del cuarto mes de vida e introducción de alimentos potencialmente antigénicos a la dieta del lactante,32 la sensibilización depende básicamente de factores genéticos, dosis y naturaleza del antígeno (solubilidad, partícula, reproducción), frecuencia de administración del mismo, edad de exposición, estado inmunológico (gastroenteropatía), manipulación dietética, con la subsecuente transmisión de potenciales antígenos vía LM.33 Por ello, si un lactante consume LVSM tiene mayor probabilidad de desarrollar alergia alimentaria a PLV debido a que está expuesto a mayor cantidad de proteínas alergénicas (caseína, alfalactoalbúmina y betalactoglobulina e inmunoglobulinas).4
Estudios como el de Lomonte V33 reportan que niños alérgicos a PLV pueden volverse toleragénicos, especialmente cuando esta es sometida a algún tratamiento térmico y sufre procesos de desnaturalización, situación que pudo suceder con la NF al ser pasteurizada, lo que favoreció la desnaturalización de las proteínas y su digestibilidad por las enzimas digestivas propias del lactante.
Conclusión
La novedad de la FI diseñada que proponemos consiste en haber empleado para su producción una materia prima (LV) y tecnología de producción de bajo costo, haciéndola más asequible a familias de escasos recursos. Además, contribuye al adecuado desarrollo nutricional y a la no activación de reacciones alérgicas.











 nueva página del texto (beta)
nueva página del texto (beta)


