Antecedentes
La acidosis tubular renal (ATR) es una acidosis metabólica hiperclorémica por disfunción tubular que altera los mecanismos de balance ácido-base; los niveles de referencia del bicarbonato sérico oscilan entre 22 y 28 mEq/L. Un nivel < 20 mEq/L en más de una ocasión sugiere ATR, la cual se confirma con gasometría, brecha aniónica, electrólitos séricos y urinarios, así como examen general de orina.1,2,3 La ATR puede ser idiopática o secundaria. Según el segmento tubular afectado puede ser distal (tipos I, III y IV) o proximal (tipo II). El tipo más frecuente en niños es el distal.1,2 Clínicamente ocasiona interrupción de la ganancia de peso y talla, vómito o reflujo gástrico, anorexia, constipación o diarrea, poliuria polidipsia, hipotonía muscular, raquitismo, nefrocalcinosis, etcétera.4 Se desconoce su frecuencia. Se calcula una probabilidad de 0.6 casos por 100 000 nacidos vivos.3 En el Instituto Nacional de Pediatría se reportó una frecuencia de 35 casos en la revisión de 10 000 expedientes;2 88 niños diagnosticados en un año representaron 1.25 % del total que acudió a consulta externa.5 Existen informes en la literatura médica de asociación de enfermedades alérgicas con ATR, pero son controversiales.6,7,8,9
El presente estudio se efectuó para conocer la prevalencia de alergia en niños con ATR secundaria, utilizando cuestionarios validados y guías diagnósticas internacionales.
Método
Estudio observacional, prospectivo, transversal, descriptivo, en el que se incluyeron niños con ATR secundaria < 18 años que fueron atendidos en la consulta externa de nefrología del Instituto Nacional de Pediatría en un periodo de 24 meses (junio de 2012 a mayo de 2014). Se consideró ATR secundaria cuando se identificó acidosis metabólica hiperclorémica, brecha aniónica normal y una causa que explicara la ATR. Se consideraron niveles séricos de bicarbonato bajos los ≤ 18 mEq/L en niños < 2 años; ≤ 19 mEq/L en niños de 2 a 5 años y ≤ 20 mEq/L en niños > 5 años.1 Previo consentimiento/asentimiento informado se aplicó el cuestionario ISAAC (International Study of Asthma and Allergy in Childhood)10 para detección de alergias respiratoria y cutánea; y los criterios de EAACI (European Academy of Allergy and Clinical Immunology)11 para diagnóstico de alergia alimentaria (AA). En quienes se sospechó alergia se realizaron pruebas cutáneas, IgE total y específica, pruebas del parche y reto a alimentos. Las pruebas cutáneas se realizaron con multitest y alérgenos Alk-Abelló y fueron consideradas positivas con erupciones ≥ 3 mm.11
Por quimioluminiscencia (QL) se determinó inmunoglobulina E (IgE) total y específica (Immunlite 2000 XPi™, Siemens).12 Los parches de alimentos se aplicaron en vaselina con cámara de Finn de 12 mm, y las lecturas se realizaron a las 48 y 72 horas.11 El diagnóstico de AA se efectuó con reto positivo a alimentos y seguimiento de 4 semanas.11 Se investigó antecedente de alergia a la proteína de la leche de vaca (APLV) en los niños incluidos; se determinó como positiva ante la presencia de cualquier signo o síntoma indicado en la guía EAACI y 4 condiciones:
Que el cuadro no cediera con tratamiento específico (antiácidos, procinéticos, etcétera).
Que persistiera después de iniciar la administración de un alcalinizante para la ATR.
Que desapareciera al suspender la leche entera y sus derivados.
Que el cuadro reapareciera al administrar lácteos.
El estudio fue aceptado por el Comité de Investigación y Ética del Instituto Nacional de Pediatría con el número 077/2012 y para la investigación se recibió financiamiento parcial de Fondos Federales (convocatoria 2013-2014).
Las causas de la ATR, así como la frecuencia de enfermedades alérgicas y los resultados de los exámenes paraclínicos se describieron en porcentajes mediante el programa SPSS versión 19.
Resultados
Se incluyeron 113 niños, cuyas edades oscilaron entre 8 y 168 meses (mediana de 73.6 meses). Se observó ATR distal en 73 niños (64.6 %), ATR proximal en 30 (26.5 %), ATR mixta en 2 (1.8 %) y ATR no determinada en 8 (7 %). Predominó el sexo masculino (53.9 %) en todos los tipos. La edad de inicio fue de 1 a 96 meses (mediana de 17.3 meses). El nivel de bicarbonato sérico al diagnóstico fue de 10.1 a 20 mEq/L (mediana de 17.2 mEq/L). Los principales motivos de consulta fueron peso o talla baja en 54.9 %, escrutinio por malformación del tracto urinario o hermano afectado en 30.1 %, datos clínicos sugestivos en 14.2 % y nefrocalcinosis en un paciente. En 5 pacientes (4.4 %) se sospecharon condiciones hereditarias por la existencia de un hermano afectado con ATR: 2 con uropatía obstructiva, 2 con síndrome de Silver-Rusell y 1 con hipoplasia renal unilateral. El Cuadro 1 muestra las patologías relacionadas con ATR secundaria.
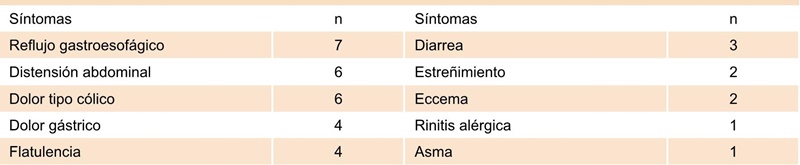
Se encontraron enfermedades alérgicas en 28 niños (24.8 %): rinitis alérgica en 21 (18.6 %), AA en 11 (9.7 %), dermatitis atópica en 9 (8 %), asma en 9 (8 %) y conjuntivitis alérgica en 7 (6.2 %); en 16 (57.1 %) coexistían más de una enfermedad alérgica. Las pruebas cutáneas de 22 pacientes fueron positivas en 16 (14.2 % de todo el grupo): 8 a alimentos, 3 a inhalantes y 5 a ambos. La IgE total en 23 niños osciló entre 6 y 650 UI/mL (mediana de 58 UI/mL) y se encontró elevada en 9. La QL realizada en 20 pacientes fue positiva en 18: 11 a alimentos, 3 a inhalantes y 4 a ambos. El reto abierto a alimentos en 18 niños fue positivo en 11. El Cuadro 2 muestra los síntomas ante el reto, los cuales remitieron al suspender el alimento implicado. Se observó en promedio 3.2 síntomas por niño.
Ocho niños presentaron síntomas después de 3 semanas de iniciado el reto. Los parches se aplicaron a 12 niños, de los cuales solo 6 acudieron a las 2 lecturas: 4 fueron positivos (2 a leche, 2 a clara, 2 a trigo y 1 a soya). Al rastrear la “marcha alérgica” se investigó la evolución en el tiempo de 29 niños con antecedente de APLV: se identificó remisión de síntomas de APLV en 18 (62 %) entre los 12 y 72 meses de vida (mediana 26.5) y persistencia de APLV en 11. En la Figura 1 se muestra la progresión hacia enfermedad alérgica en relación con el antecedente de APLV.
La totalidad de los niños con APLV sin remisión desarrollaron alergia. De los niños con APLV y remisión, 55.6 % desarrolló alergia. En los niños sin APLV, el desarrollo de alergias fue de 8.3 %.
Discusión
En México no se conoce la frecuencia de ATR8 El presente estudio se realizó en el Instituto Nacional de Pediatría, Secretaría de Salud, centro de referencia nacional de tercer nivel con un área de influencia aproximada de 18 millones,13 lo que explica la inclusión de 113 niños. La ATR se puede manifestar desde el nacimiento.3,4 Se ha descrito mayor incidencia de ATR proximal en hombres y distal en mujeres.5 En el presente estudio predominó en el sexo masculino (53.9 %) en todos los tipos.
Un nivel bajo de bicarbonato sérico por gasometría en más de una determinación es el signo más importante para sospechar ATR.1,2,3,4 El bicarbonato sérico al diagnóstico fluctuó entre 10.1 y 20 mEq/L (mediana 17.2 mEq/L). La ATR se confirmó con gasometrías subsecuentes, brecha aniónica, electrólitos séricos/urinarios y examen general de orina.1,5
La ATR puede afectar la reabsorción o secreción de iones, puede ser distal (tipos I, III y IV) o proximal (tipo II) según el segmento tubular donde se localiza el defecto.1,2,3,4 En el grupo encontramos mayor frecuencia de ATR distal (64.6 %), lo cual ya ha sido descrito en niños,1 seguida de ATR proximal (26.5 %) no determinada (7 %) y mixta (1.7 %). En este último grupo se inició el tratamiento antes de clasificarlos y por cuestiones éticas no se suspendió el tratamiento alcalinizante para completar su tipificación.
Entre las manifestaciones frecuentes de ATR se encuentra retraso en el crecimiento.1,2,3,4 En el grupo incluido se sospechó ATR por peso o talla baja en 54.9 %; en 30.1 % por prueba de escrutinio debido al diagnóstico de ATR en un hermano o por malformaciones renales. Otros datos clínicos de acidosis se encontraron en 14.2 %. En un estudio del Instituto Nacional de Pediatría, en niños con ATR se encontró que 93 % acudió por peso bajo, 86 % por desaceleración del crecimiento y 88.3 % por hiporexia.6
Por su origen, la ATR puede ser primaria o secundaria. Los casos idiopáticos se deben a defectos genéticos en el transporte de iones.1 En 5 pacientes con ATR secundaria (4.4 %) se sospechó un factor hereditario, por tener un hermano afectado.
La ATR secundaria se encontró en 113 niños, y de ellos 66 (58.4 %) tenían uropatía obstructiva. Este rubro incluyó obstrucción o reflujo primario o asociado a malformaciones urinarias o vejiga neurogénica. La ATR afecta a 58 % de los pacientes con hidronefrosis uni o bilateral.14 La ATR ocurre en 46 % de niños con síndrome de Silver-Russell.15 Encontramos este síndrome en 8.8 %, todos con ATR proximal. Otra causa es la hiperplasia suprarrenal congénita que se asocia a ATR tipo IV,5 la cual se identificó en 10 niños. La ATR secundaria a cardiopatías congénitas cianógenas (6 niños) está ocasionada por expansión del volumen extracelular de los túbulos, dado por hematócrito elevado y puede corregirse con cirugía cardiaca.16 La citopatía mitocondrial (5 casos) es un defecto en la fosforilación oxidativa que afecta diversos órganos que dependen de la energía mitocondrial, originando diferentes nefropatías, entre ellas la más frecuente es la ATR proximal.17 La púrpura de Henoch Schonlein (4 niños) es la vasculitis más frecuente en la infancia y ocasiona nefritis en 40 %,18 pudiendo dejar como secuela ATR.
La nefrotoxicidad de la quimioterapia está determinada por tipo de medicamento, tipo de neoplasia, factores individuales y función renal. Puede comprometer el glomérulo, los túbulos, el intersticio o la microvasculatura, dejando como secuela la ATR.19 Encontramos ATR asociada a neoplasias en 7 pacientes: leucemia linfoblástica en 3, tumor de Willms en 2, linfoma no Hodking en 1 y leucemia mielocítica crónica en 1. La esclerosis tuberosa es una enfermedad familiar rara (herencia autosómica dominante), en la que existe defecto en el desarrollo de las estructuras ectodérmicas. El 80 % de casos es de tipo esporádico, por nuevas mutaciones. La tríada característica consiste en deficiencia mental, epilepsia y adenoma sebáceo facial.20 En los 3 niños con esta entidad, la ATR pudo deberse a angiomiolipomas renales o ser consecuencia del tratamiento anticonvulsivo.
La hipoplasia renal (3 pacientes) se asocia frecuentemente a reflujo vesicoureteral grados III y IV, causando ATR.21 La hipercalciuria familiar (2 pacientes) origina ATR y nefrocalcinosis.22 Tanto la esferocitosis (1 niño), como la drepanocitosis (1 paciente) se relacionan con ATR. Las mutaciones que afectan el intercambio de aniones originan ATD o anormalidades en los eritrocitos como ovalocitosis, esferocitosis o hemoglobinopatías (drepanocitosis y talasemias).23,24 El síndrome de Ehrles Danlos se asocia con riñón de médula en esponja que se caracteriza por dilatación en los túbulos colectores que origina defectos en la acidificación.25 El síndrome fue encontrado en un niño, en quien se demostró la malformación.
La prevalencia de las enfermedades alérgicas está aumentando globalmente. Se calcula que entre 30 y 40 % de la población del orbe padece alguna alergia.26 Las enfermedades alérgicas se encontraron en 28 niños (24.8 %), lo cual se acerca a las cifras sugeridas por la Organización Mundial de la Salud.26
Una fortaleza de este estudio es que la prevalencia de enfermedades alérgicas fue estimada por cuestionarios validados internacionalmente y basados en síntomas (ISAAC).10 En el Cuadro 3 se compara la prevalencia encontrada en niños mexicanos con método ISSAC27 y en población abierta mexicana.28 Para la AA se utilizó como parámetro la prevalencia mundial, que va de 3 a 18 %, con una media de 10 %.29
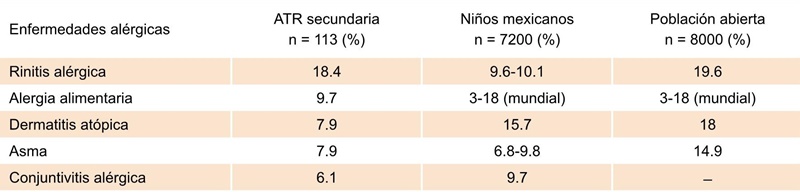
Comparación con reportes en pacientes mexicanos. Referencias 27 y 28. Para alergia alimentaria se usó la prevalencia mundial. Referencia 29.
Cuadro 3 Prevalencia de enfermedades alérgicas en niños con ATR secundaria c
La alergia más frecuente fue la rinitis alérgica (18.4 %), con cifra cercana a la de la población abierta28 y superior a la de ISAAC México.27 La estimación de prevalencia de AA es difícil por diferentes definiciones, metodologías y variaciones poblacionales y geográficas, por lo que no existen cuestionarios validados internacionalmente.11,29 Encontramos AA en 9.7 %. Un grupo del Instituto Nacional de Pediatría reportó APLV en 32 % de los lactantes con ATR en dos estudios diferentes.8,9 en otro estudio mexicano se encontró a 30 niños con ATR y AA confirmada con prueba de reto oral.7 Lo anterior demuestra que la percepción de AA en la comunidad (12 a 25 %) es superior a la prevalencia real y pudiera deberse a intolerancia alimentaria.30 La dermatitis atópica (DA), se encontró en 8 % de los niños, cifra inferior a la registrada en población abierta (18.7 %),28 y en escolares (15.7 %).31 El asma se encontró en 8 %, prevalencia similar a la descrita en niños mexicanos.27 La prevalencia de conjuntivitis alérgica en ATR secundaria fue de 6.1 %, similar a la encontrada en una investigación previa en niños con ATR primaria del Instituto Nacional de Pediatría (7 %).6
Se ha demostrado la coexistencia de enfermedades alérgicas en individuos atópicos.26 En los niños con ATR alérgicos encontramos coexistencia de más de una enfermedad alérgica en 57.1 % (16).
Las pruebas cutáneas realizadas en 22 niños, fueron positivas en 16 (14.2 % de todo el grupo). Para alergia inhalatoria tienen una especificidad de 70 a 95 % y una sensibilidad de 80 a 97 %. La sensibilidad y especificidad para alimentos es menor: 30 a 90 % y 20 a 60 %, respectivamente.11 En niños con ATR primaria del Instituto Nacional de Pediatría, las pruebas cutáneas fueron positivas en 27.9 %.6
La IgE total se encontró elevada en 9 de 22 pacientes. La sensibilidad de la IgE total es muy baja (20 a 32 %) y su especificidad adecuada (90 a 95 %), puede elevarse por activación policlonal por superantígenos y por helmintos. De 20 a 30 % de los pacientes alérgicos tienen IgE normal.12
La IgE específica refleja la exposición de un individuo a un alérgeno, pero no correlaciona con la clínica.32 La quimioluminiscencia (QL) se realizó en 20 niños; resultó positiva en 18. La QL tiene una sensibilidad de 88 a 90 % y especificidad de 58 %.12 En un estudio en niños con ATR y alergia se encontró QL positiva en 25.6 %.6
El diagnóstico de AA se sospechó con cualquier signo o síntoma de la guía EAACI y se estableció con prueba de supresión y reto abierto positivo.11 La prueba de reto doble ciego placebo controlado (DCPC), considerada el estándar de oro, es útil en hipersensibilidad inmediata, pero no en hipersensibilidad tardía.33 El reto abierto se realiza fácilmente y se sugiere en pacientes con antecedente dudoso de AA.30 Dado que trabajamos en un tercer nivel con pacientes foráneos, se realizó el reto abierto extrahospitalario con el alimento sospechoso, llevando el registro diario detallado de alimentos y síntomas. Se solicitó a los padres disimular el procedimiento a los niños, para evitar influencia psicológica en los síntomas. El resultado fue definitivo si el reto fue negativo, pero en pacientes con síntomas subjetivos −como distensión o dolor abdominal− los resultados positivos son difíciles de interpretar.33 El reto abierto se realizó en 18 niños y fue positivo en 11. Ante el reto predominaron síntomas gastrointestinales, con un promedio de 3.3 síntomas por niño; 72.7 %, presentó hipersensibilidad tardía. Otros autores ya han registrado que la hipersensibilidad tardía se observa con mayor frecuencia que la inmediata.8,9
La prueba de parche tiene sensibilidad de 90 % para hipersensibilidad retardada.11 Se realizó en 12 niños, pero solo 6 acudieron a las dos lecturas y fue positiva en 4. Se investigó el antecedente de APLV, porque suele ser el primer paso de “la marcha alérgica”.34 Encontramos el antecedente de APLV en 25.7 %, aunque se describe en 5 a 7 % de los recién nacidos.34 Esta cifra alta pudiera deberse a que algunas mutaciones en los transportadores de cloro en ATD disminuyen la secreción de ácido gástrico,35 y la hipoacidez es un factor de riesgo para el desarrollo de AA, al impedir la digestión de proteínas alergénicas, con lo que se favorece la sensibilización a través del epitelio intestinal.36 Estudios de cohortes refieren que la APLV remite en 51 % de los pacientes a los 2 años y en 80 % a los 4 años.34 La remisión en nuestro grupo se evaluó a los 2 años y fue similar a la descrita (62 %). Los 11 niños en quienes la APLV no remitió desarrollaron enfermedades alérgicas, mientras que 55.6 % del grupo con remisión desarrolló alergias. En los niños sin antecedentes de APLV, el desarrollo de alergia fue de 8.2 %. Estos hallazgos resaltan la importancia del antecedente de APLV en el desarrollo de alergia.
Por lo anterior podemos concluir que aunque la ATR secundaria es frecuente en niños con condiciones diversas que acuden a hospitales de tercer nivel, la prevalencia de enfermedades alérgicas en estos niños es similar a la descrita en la población general.











 nueva página del texto (beta)
nueva página del texto (beta)